P-DCB和Cd2+聯合污染對草魚肝胰臟和腎臟SOD和POD酶活的影響
王桂燕, 吳沁霏, 張 平, 倪 倩, 張 馳, 遲艷玲, 肖 月
(沈陽藥科大學 制藥工程學院, 遼寧 沈陽 110016)
對二氯苯(1,4-dichlorobenze,P-DCB)是重要的有機化工原料,質量好的P-DCB在各項新的工業和經濟生活領域中有著廣闊的應用和發展前途.P-DCB具有高度的脂溶性,能夠穿過包括胎盤屏障和血腦屏障在內的各種生物膜,1987年它被國際癌癥研究機構(IARC)確定為可能的人類致癌物,在水生生物中可發生生物蓄積. 重金屬鎘(Cd2+)被廣泛應用于各種工農業生產中,由此產生的大量含鎘離子的廢水給土壤和水資源帶來嚴重污染[1-2].現在有多種污染物共同存在于環境中[3-4].因此,多種污染物之間的復合污染應該更加受到人們的關注.在生活中廣泛使用的P-DCB和重金屬Cd2+常常同時存在于水環境中且易構成復合污染.對于二者復合污染脅迫魚類導致對其抗氧化酶系統的影響至今尚未見有報道.因此,我們用草魚作研究對象,考察草魚肝胰臟和腎臟組織的超氧化物歧化酶(SOD)和過氧化物酶(POD)在P-DCB 和Cd2+的聯合脅迫下的變化情況,并詳細探討了用SOD和POD的酶活變化來作為P-DCB和Cd2+聯合污染生物指標的可能性,為防治水環境的污染、保護水生生物的正常生長提供科學依據.
1 實驗部分
1.1 試驗材料、試劑和儀器
試驗魚苗選購于沈陽北市花鳥批發市場.挑選鱗片無缺口、行動敏捷、大小相近的魚,體長不大于5 cm,體重在 4.5 g左右.購回后投入大水族缸里,全天曝氣,馴養7 d(在此時間段死亡率不能超過5%).
對二氯苯,純度>97%,購于山東西亞化學工業有限公司,氯化鎘(CdCl2·2.5 H2O)、硝基藍四氮唑(NBT)、愈創木酚、L-甲硫氨酸、乙二胺四乙酸(EDTA)、核黃素、磷酸二氫鈉和磷酸氫鈉等都是分析純試劑,購于沈陽禹王化學試劑公司.
CR-GIII離心機(HITACHI),UV1902PC分光光度計(上海奧析科學儀器有限公司),HM-330培養箱(上海一恒科技有限公司),Seven2Go便攜式溶解氧儀(METTLER TOLEDO),空氣壓縮機.
1.2 實驗步驟與方法
采用靜態試驗法[5].實驗用水是已曝氣3 d的自來水.水溫為18 ℃左右,pH值為6.6±0.1,溶解氧質量濃度(ρ)大于5.0 mg·L-1.試驗使用大小為25 cm×18 cm×25 cm的水族缸.試驗過程中定期測試溶液的溫度(T)、pH值、ρ等.在試驗期間一直曝氣,整個試驗期間和試驗的前一天都不投食.
1) 試驗質量濃度設計.在P-DCB和Cd2+聯合污染試驗基礎上,得到的聯合毒性各污染物96 h的LC50值作為一個毒性單位(TU)[6],然后以毒性1∶1進行復合毒性試驗,設置0.5 TU、0.25 TU、0.125 TU和0.062 5 TU 4個質量濃度組,各質量濃度分別設3個平行組和1個空白對照組,每組隨機投入10尾魚.

表1 P-DCB和Cd2+ 復合毒性試驗質量濃度水平的設定
2) 酶活性測定.P-DCB和Cd2+聯合污染試驗每隔1 d更換1次新制的試驗液.在試驗后的第1、2、3、4、5、6和7 d分別從染毒組和空白組中隨機取出3條草魚,迅速解剖,取出草魚的肝胰臟和腎臟,然后在含有0.1 mmol·L-1的EDTA、pH值為7.8的提前冷藏的磷酸鹽緩沖溶液(50 mmol·L-1)里勻漿,再把得到的勻漿液離心30 min(4 ℃、15 000 r·min-1),離心后的上清液就是酶提取液,在4 ℃下保存以備用.采用氮藍四唑(NBT)法測定SOD活性[7],引起3.0 mL反應液達到50%抑制時所需要的酶量定義為1個酶活性單位(U),1 U=16.67nkatal.用U·g-1表示SOD酶活性,采用愈創木酚法測定POD活性[8],吸光度在470 nm處變化0.01表示1個酶活力單位(IU),用IU·(g·min)-1表示POD酶活性,組織的質量都是鮮重.
1.3 數據處理
試驗數據用SPSS 22.0軟件進行單因素分析,數據用平均值±標準差(Mean±SD)表示,用LSD多重比較來分析試驗結果的差異顯著性,p<0.05表示顯著性差異.
2 實驗結果與討論
2.1 P-DCB和Cd2+聯合污染對草魚肝胰臟超氧化物歧化酶的影響
如圖1所示,24 h內各污染質量濃度草魚肝胰臟超氧化物歧化酶活性抑制現象均很顯著(p<0.05);當污染暴露達到48 h時,0.062 5 TU和0.125 TU組肝胰臟的SOD被明顯誘導(p<0.05);隨著暴露時間的繼續增加,高質量濃度組草魚肝胰臟的SOD活性被明顯誘導(p<0.05);當暴露時間達到120 h,肝胰臟的SOD活性在各污染質量濃度組中均被明顯誘導(p<0.05);當暴露144 h時,肝胰臟的SOD活性在各污染質量濃度組中都有所下降,但只有在0.25 TU組的草魚肝胰臟SOD酶活明顯低于對照(p<0.05),其他組SOD酶活仍明顯高于空白對照組(p<0.05);污染暴露時間增加到168 h,各質量濃度組的SOD活性抑制現象均比較明顯(p<0.05).各質量濃度組中草魚肝胰臟組織的SOD酶活隨著 P-DCB和Cd2+聯合污染時間的延長呈現出先降再升又降的趨勢.

圖1 P-DCB和Cd2+聯合污染對草魚肝胰臟SOD酶活的影響Fig.1 Effects of P-DCB and Cd2+ on the SOD activity in liver pancreas tissues of grass carp
注: 不同大寫字母表示同一質量濃度不同暴露時間之間存在顯著性差異(P<0.05),不同小寫字母表示同一暴露時間不同質量濃度之間存在顯著性差異(P<0.05).下同
2.2 P-DCB和Cd2+聯合污染對草魚腎臟超氧化物歧化酶的影響
如圖2所示,草魚腎臟組織的SOD酶活在暴露24 h內被明顯抑制(p<0.05);較低質量濃度組腎臟組織SOD活性在污染48 h被明顯誘導(p<0.05);各污染暴露的質量濃度在暴露72 h時,草魚腎臟SOD活性都被明顯抑制(p<0.05);當P-DCB和Cd2+聯合污染時間達到96 h,除了最低質量濃度組的SOD酶活抑制現象比較明顯(p<0.05)以外,其他質量濃度組的SOD酶活均被明顯誘導(p<0.05);草魚腎臟組織SOD酶活隨著P-DCB和Cd2+聯合污染時間的繼續延長,低質量濃度組被誘導顯著(p<0.05),而高質量濃度組被明顯抑制(p<0.05);當污染達到168 h,各暴露質量濃度組的草魚腎臟SOD酶活都被明顯被抑制(p<0.05).
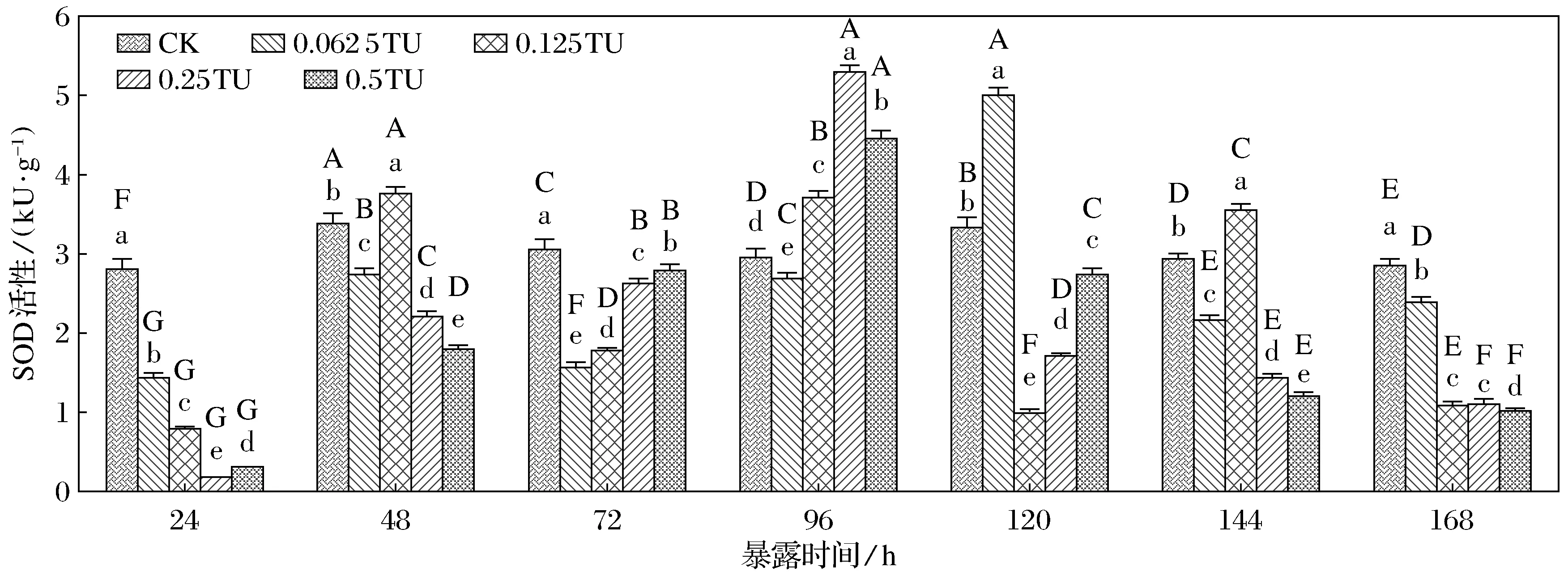
圖2 P-DCB和Cd2+聯合污染對草魚腎臟SOD酶活的影響
2.3 P-DCB和Cd2+聯合污染對草魚肝胰臟POD酶活的影響
如圖3所示,草魚肝胰臟POD酶活在24 h內各污染的質量濃度組抑制現象明顯(p<0.05);在污染48 h時, 0.25 TU組肝胰臟POD活性被明顯誘導(p<0.05),而其他污染質量濃度組POD活性則被抑制比較明顯(p<0.05);0.062 5 TU組肝胰臟POD活性在污染72 h時被誘導比較顯著(p<0.05),其他污染質量濃度組POD活性則被抑制比較顯著(p<0.05);當暴露時間達到96 h以上時,各暴露質量濃度組中草魚肝胰臟POD活性抑制現象均非常顯著(p<0.05).
2.4 P-DCB和Cd2+聯合污染對草魚腎臟POD酶活的影響
如圖4所示,較低質量濃度組草魚腎臟POD活性在24 h內被明顯誘導(p<0.05),而高質量濃度組POD活性則被明顯抑制,其值顯著低于對照組(p<0.05);當污染時間達到48 h時,0.5 TU組的POD活性被明顯誘導(p<0.05);污染暴露達到72 h時,0.5 TU組的POD活性與對照組沒有明顯差異(p>0.05),而其他質量濃度組腎臟POD活性均被明顯誘導(p<0.05);當P-DCB和Cd2+聯合污染到96 h時,0.5 TU質量濃度組的腎臟POD活性抑制現象比較明顯(p<0.05);污染暴露到120 h時,較低質量濃度組草魚腎臟POD活性被誘導比較顯著(p<0.05),而最高濃度組POD活性則出現顯著的抑制現象(p<0.05);污染達到144 h以上時,各污染質量濃度組草魚腎臟POD活性均明顯低于空白對照組(p<0.05).
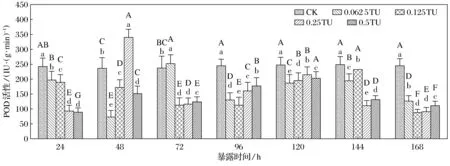
圖3 P-DCB和Cd2+聯合污染對草魚肝胰臟POD酶活的影響

圖4 P-DCB和Cd2+復合污染對草魚腎臟POD酶活的影響Fig.4 Effects of combined exposure of P-DCB and Cd2+ on POD enzyme activity in kidney tissues of grass carp
3 結 論
1) P-DCB和Cd2+復合污染對草魚肝胰臟和腎臟組織的酶活影響顯著.在P-DCB和Cd2+聯合作用下,草魚肝胰臟和腎臟組織的POD和SOD酶活均變化比較明顯,隨著污染時間的增加都呈現出“降-升-降”的趨勢.當污染時間增加到168 h,各質量濃度組的肝胰臟SOD均明顯低于空白對照組(p<0.05);當污染時間增加到120 h以上,0.25 TU和0.5 TU組的草魚腎臟SOD酶活明顯低于對照組(p<0.05);草魚肝胰臟POD只有在0.062 5 TU和0.25 TU組分別在暴露72 h 和48 h時明顯高于對照組(p<0.05),其他情況下始終顯著低于對照組(p<0.05);當污染暴露時間達到144 h以上,各質量濃度組腎臟組織的POD酶活均明顯低于對照組(P<0.05).

3) 草魚肝胰臟和腎臟組織SOD活性不穩定有待深入研究.在P-DCB和Cd2+復合污染對草魚肝胰臟SOD活性的影響中,0.125 TU組和0.25 TU組SOD酶活性分別在72 h和96 h出現波動,另外腎臟組織SOD酶活在0.062 5 TU組和0.125 TU組在暴露48 h也有波動,其原因都有待繼續深入研究.另外在P-DCB和Cd2+復合污染對草魚腎臟POD活性的影響中,0.062 5 TU組也出現波動,這些不穩定的原因也需要進一步深入研究.

