緊穗野生稻幼胚愈傷誘導、分化及生根苗的體系建立
王玲仙,王 波,付 堅,邢佳鑫,肖素勤,張敦宇,鐘巧芳,柯 學,陳 玲,殷富有,蔣 聰,程在全
(云南省農業科學院 生物技術與種質資源研究所/云南省農業生物技術重點實驗室/農業農村部 西南作物基因資源與種質創制重點實驗室,云南 昆明 650205)
野生稻資源是現代水稻育種中新基因的一個重要來源。特別是非AA染色體組野生稻這一次級基因庫中有利基因的利用前景更為誘人,并已有成功的報道[1]。野生稻長期處于野生狀態,經受各種病蟲害和不利環境的自然選擇,具有豐富的遺傳多樣性,是天然的基因庫。在目前還不能大規模人工創造新基因的條件下,天然的野生稻資源在水稻育種中,特別是在抗病蟲、抗逆性育種中具有巨大的利用價值[2]。同時野生稻還具有優質蛋白質含量高、功能葉片耐衰老、特強的再生性、良好的茂盛性及生長優勢,這些優良特性已被廣泛用于水稻常規育種和雜交育種中,并取得了巨大的社會效益和經濟效益[3]。
緊穗野生稻Oryzaeichingeri經查證,認為O.eichingeri實際上是二倍體稻種, 有學者將其染色體組定為CC。它與栽培稻親緣關系較遠,同樣具有許多優良特性,但緊穗野生稻結實率不高,種子落粒性強,萌發率低,基本不能用種子進行繁殖,嚴重妨礙了緊穗野生稻的保存保護、繁殖和利用。目前,緊穗野生稻的繁殖手段主要是莖稈扦插和分根移栽,其繁殖率低、繁殖時間長。研究中發現,緊穗野生稻種子種皮堅硬,有一層釉質包裹,種子極難吸水膨脹,造成種子萌發率極低,利用常規的浸泡和高溫催芽處理也很難提高緊穗野生稻種子的發芽率,利用種子誘導愈傷效率和成苗率也極低。本研究利用緊穗野生稻的幼胚活力強的特點,應用不同植物激素組合和培養條件變化對其進行誘導分化,成功地誘導出了緊穗野生稻幼胚愈傷組織,并得到分化生根苗,為今后野生稻的資源保存、利用和雜交育種提供了技術支持和充分保障。
1 材料和方法
1.1 實驗材料
緊穗野生稻種質材料從斯里蘭卡引進。
1.2 實驗試劑
2,4-D、6-BA、NAA、IAA、KT、ZT、TDZ與各類組織培養所用化學試劑均為國產分析純。
1.3 實驗方法
1.3.1 幼胚采集 田間采集緊穗野生稻幼胚,用紙袋裝好,曬干,儲存于干燥通風的地方。
1.3.2 幼胚處理 將曬干幼胚剝去殼,置于滅菌的小錐形瓶內,在超凈工作臺內用蒸餾水清洗,再用75%的酒精表面滅菌1 min,加入0.1%的氯化汞分別處理15、10 min,用無菌水清洗4~5遍,將種子用濾紙吸干水分,待用。
1.3.3 胚性愈傷誘導 將待用幼胚接入不同的誘導培養基上,置于人工氣候箱28 ℃暗培養,35 d后,長出帶有粘液的胚性愈傷,換培養基一次,繼續培養10~16 d,使愈傷長至直徑0.2 cm時,N6和MS愈傷誘導培養基為:N6和MS+2,4-D 3.0~15.0 mg/L+植物凝膠2.8 g/L+蔗糖30%, pH值6.0。
1.3.4 胚性愈傷繼代培養 將直徑0.2 cm的胚性愈傷從胚上分離下來,接入繼代培養基中,置于人工氣候箱中28 ℃暗培養,每20 d換培養基一次,繼代2~3次后愈傷組織由白色變成淡黃色的緊實顆粒。愈傷繼代培養基為:N6+2,4-D 3.0 mg/L+植物凝膠2.8 g/L+蔗糖30%, pH值6.0。
1.3.5 胚性愈傷增殖培養 挑選直徑為0.2~0.5 cm的淡黃色緊實顆粒狀愈傷組織進行增殖,每瓶接入20個愈傷,置于溫度為28 ℃、光照為2000 lx的培養箱中進行弱光培養,每7 d更換一次培養基;21~28 d后;愈傷組織大量增殖覆蓋整個培養基表面,并呈現黃綠色。愈傷增殖培養基為:N6+2,4-D 6.0 mg/L+植物凝膠2.8 g/L+蔗糖30%,pH值6.0。
1.3.6 胚性愈傷組織分化和繼代培養 將黃綠色緊實顆粒狀的愈傷組織分別接入不同分化培養基中,每瓶10~15個,置于溫度為28 ℃、光照為4000 lx的培養箱中進行光照培養,10~12 d后,愈傷組織變為淡綠、深綠色相間,換繼代培養基一次,繼續培養20~25 d,換增殖培養基一次,25~30 d后,愈傷分化出小苗,待小苗長至2~3 cm長時,進行壯苗培養。分化、繼代、增殖培養基為:N6+6-BA 2.0~12.0 mg/L+NAA 0.3 mg/L+KT 2.0 mg/L+ ZT 2.0 mg/L+植物凝膠2.8 g/L+蔗糖30%,pH值6.0。
1.3.7 壯苗培養 將2~3 cm長的小苗從培養瓶中取出,接入壯苗培養基中,置于28 ℃、4000 lx的光照培養箱中培養20~27 d,小苗莖稈增粗并長至4~5 cm時,進行生根培養。壯苗培養基為:N6+6-BA 2.0 mg/L+NAA 0.3 mg/L+TDZ 2.0 mg/L+植物凝膠2.8 g/L+蔗糖30%,pH值6.0。
1.3.8 生根培養 將4~5 cm的健壯無根苗分別接入裝有N6與NAA和IAA的生根培養基試管中,每根試管接入6~8株,置于28 ℃、2000 lx的弱光照培養箱中進行生根培養,3 d后根芽露白,培養20~25 d后,根長至5~7 cm,苗長至10~12 cm后進行煉苗;生根培養基分別為:N6+NAA和IAA 0.1~1.2 mg/L+植物凝膠2.8 g/L+蔗糖15 g/L,pH值6.0。
1.3.9 煉苗與栽種 將長至10~12 cm的生根苗揭掉試管膜,培養2 d后,用自來水將苗根部的培養基沖洗干凈,放入試管中,加水淹沒根部,置于28 ℃、2000 lx的光照培養箱中進行苗鍛煉,5 d后,將苗從光照培養箱中移出,定植到購于市場的營養基質中,置于溫室進行培養,12 d后,葉片完全展開、新根長出,再移栽至大田,在生長中期注意水、肥管理,后期注意追施一次肥,直至種子成熟。
2 結果與分析
2.1 不同誘導培養基對緊穗野生稻幼胚誘導愈傷情況的比較
以N6為基本培養基,設置不同的2,4-D濃度梯度,緊穗野生稻幼胚誘導愈傷情況如圖1、表1所示。N6基本培養基在不加2,4-D的情況下(對照),緊穗野生稻幼胚沒有產生胚性愈傷。加入不同濃度2,4-D后,能夠誘導出幼胚愈傷,當2,4-D濃度為5.0 mg/L時,對胚性愈傷誘導率最強,出愈率達到100%(圖2)。此時愈傷顆粒緊實,淺綠,胚性愈傷生長情況最好。當2,4-D濃度為6.0 mg/L時,出愈率達到90%,愈傷顆粒緊實,淡黃、淡綠,胚性愈傷生長情況次之。當2,4-D濃度為15.0 mg/L,出愈率最低,只有26%,愈傷透明,粘性愈傷增多,品質下降。結果說明:2,4-D在一定濃度范圍內誘導并促進了緊穗野生稻胚性愈傷組織的生長,但超過一定濃度之后,隨著2,4-D濃度的不斷增高,抑制了胚性愈傷生長,說明較低濃度和高濃度的 2,4-D不利于緊穗野生稻幼胚的愈傷組織誘導。
以MS為基本培養基,設置不同的2,4-D濃度梯度,緊穗野生稻幼胚誘導愈傷情況如圖1、表1所示。MS培養基在不加2,4-D的情況下(對照),幼胚沒有產生胚性愈傷。當加入不同濃度2,4-D后,MS培養基與2,4-D的組合也能夠誘導出幼胚愈傷,當2,4-D濃度為 7.0 mg/L時,胚性愈傷出愈率最高,達到30%,愈傷成顆粒狀,淡黃淡綠相間;當2,4-D濃度為 15.0 mg/L時,胚性愈傷出愈率最低,只有10%,愈傷透明,粘性增多,說明當2,4-D濃度高時,在MS培養基中同樣抑制了胚性愈傷形成。MS基本培養基與2,4-D配比整體來看,出愈率普遍偏低,愈傷粘性較多,不適合作為胚性愈傷的誘導培養基。
以上結果說明N6培養基比MS培養基更適合誘導緊穗野生稻的胚性愈傷,N6培養基+2,4-D濃度為5.0 mg/L時,愈傷誘導率最高,出愈率達到100%,此時愈傷顆粒緊實,淺綠,胚性愈傷生長情況最好。

圖1 不同誘導培養基下緊穗野生稻幼胚愈傷組織誘導情況

圖2 緊穗野生稻幼胚愈傷組織誘導培養

表1 緊穗野生稻在不同培養基中胚性愈傷的生長情況
2.2 不同激素配比分化培養基對緊穗野生稻幼胚分化影響比較
不同激素配比分化培養基對緊穗野生稻幼胚分化的影響如圖3、表2所示。以N6為培養基,添加NAA 0.3 mg/L、KT 2.0 mg/L和ZT 2.0 mg/L情況下,設置不同的6-BA濃度梯度,均能夠分化出苗。當6-BA濃度為4.0 mg/L時,愈傷分化率最高,達到88%(圖4);綠色凸起愈傷分化苗最多,苗油綠,莖稈粗,叢生苗多,長出新愈傷。當6-BA濃度為2.0 mg/L時,愈傷分化凸起增殖減慢,分化苗生長緩慢,用于分化繼代培養較好。當6-BA濃度為2.0 mg/L時,添加NAA 0.3 mg/L、TDZ 2.0 mg/L,作為壯苗培養基最適合,壯苗后,苗油綠,葉片硬扎,莖稈粗壯,植株矮壯。當6-BA濃度為6.0 mg/L時,愈傷分化漸降,苗綠,而新愈傷和芽增多,作為分化增殖培養最理想;當6-BA濃度為12.0 mg/L時,愈傷分化率最低,只有2%,極少有分化苗,苗色黃綠,莖稈纖細,未見叢生苗和新愈傷長出,愈傷褐化,分化最差,不適合用于分化培養。
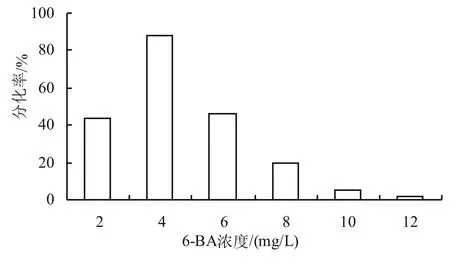
圖3 不同激素配比分化培養基下緊穗野生稻幼胚分化情況
2.3 不同培養基對緊穗野生稻幼胚生根影響的比較
不同培養基對緊穗野生稻幼胚生根的影響如圖5、表3所示,以N6為基本培養基,設置不同的NAA和IAA濃度梯度,均能夠使緊穗野生稻幼胚分化苗生根。N6培養基與IAA的組合搭配,以IAA濃度為0.3 mg/L時,幼胚生根率最高,達到96%;3 d時根芽露白,根芽露白早,主根吸收養分充足,主根、須根生長快,根多、粗壯,用于生根最好(圖6)。以IAA濃度為0.4 mg/L時,幼胚生根率次之,達到82%;3 d時根芽露白,主根粗、生長快,主須根分生次之。以IAA濃度為1.2 mg/L時,生根率最低,只達到15%;9 d以后根芽露白,主根生根減少,須根絨根曲卷,很難利用根系吸收足夠的養分和水分來滿足生根苗的生長需要。也就是說:當IAA濃度為 0.1~0.3 mg/L時,生根率隨著激素濃度的提高而逐漸增高;當IAA濃度為0.3~1.2 mg/L時,生根率隨著激素濃度提高而降低;當IAA濃度為1.0~1.2 mg/L時,由于激素濃度偏高,苗根基部嚴重褐化。

圖4 緊穗野生稻幼胚分化培養

表2 不同6-BA濃度對分化培養基中愈傷分化的影響
N6培養基與NAA的組合搭配,當NAA濃度為0.3 mg/L時,5 d時幼胚根芽露白,主、須根出根增多,主根短,生根率最高,達到82%。當NAA濃度為0.4 mg/L時,7 d后幼胚主根長出,主根短、粗,須根長出、偏少,生根率次之,達到77%。當NAA濃度為1.2 mg/L時,9 d后根芽露白,主根生根減少,須根絨根曲卷,曲卷的須根不利養分和水分的吸收,因而滿足不了根的生長需要,生根率最低,只達到23%。也就是說:當NAA濃度為0.1~0.3 mg/L時,生根率隨著激素濃度的提高而逐漸增高;當NAA濃度為0.4~1.2 mg/L時,生根率隨著激素濃度的增高而逐漸降低;當IAA濃度為1.2 mg/L時,苗根基部同樣出現嚴重褐化。說明以N6為基本培養基時,設置不同的NAA和IAA的濃度配比,都能使緊穗野生稻幼胚分化苗生根。但是,IAA 較NAA更適合用于緊穗野生稻幼胚生根培養基。
2.4 煉苗、栽種與成活率
生根苗揭膜后,在培養箱中培養2 d,用自來水沖洗掉生根苗根部培養基,加水將根基部淹沒,進行苗鍛煉5 d,定植到營養基質中,在溫室培養12 d,待葉片完全展開、新根長出,再移栽至大田生長20 d,統計苗的成活率。苗經過煉苗和栽種,組培苗和自然生長苗存在著很多差異,由室內環境過渡到室外,生長環境由無菌狀態變成有菌狀態,培養溫度和光照條件發生了改變,整個煉苗和栽種,必須是一個逐步適應過程,這樣有利于提高生根苗在田間的成活率。

圖5 不同培養基下緊穗野生稻幼胚生根情況
3 結論
3.1 培養基的選擇對緊穗野生稻幼胚愈傷組織誘導的影響
不同的培養基有不同的作用,分別可以誘導細胞分裂、控制愈傷組織生長和分化生根,選擇適合的培養基是組織培養中最主要的因素。目前各種培養基無機鹽的含量一般都比較高,對植物組織和細胞的離體培養適用性更好,由Murashige和Skoog設計的MS培養基各元素比例合理,對雙子葉、單子葉、木本和草本的器官、組織、細胞及原生質體培養有良好效果。而N6培養基銨離子濃度較低,銨態氮和硝態氮比例合理,適合禾谷類的組織培養[4]。本研究中,通過N6和MS兩種培養基篩選,確定了緊穗野生稻幼胚愈傷組織誘導以N6為基本培養基效果較好,出愈率高,愈傷顆粒緊實。這與張智奇等認為N6培養基比MS培養基更有效地促進水稻幼穗的愈傷組織誘導及植株再生的結果一致[5]。張堯忠等的研究結果也表明,愈傷組織在N6分化培養基的再生綠苗率高于MS培養基[6]。

圖6 緊穗野生稻幼胚生根培養

表3 不同NAA和IAA濃度下緊穗野生稻幼胚生根苗的生長情況
3.2 激素對緊穗野生稻幼胚誘導愈傷組織產生的影響
植物生長調節劑是影響水稻胚性愈傷組織誘導和形成的關鍵因素之一,其中2,4-D是誘導水稻愈傷組織不可缺少的關鍵激素。不同植物外植體對2,4-D的濃度要求不同[7-8]。通過對7組不同濃度梯度的2,4-D比對發現,5.0 mg/L對緊穗野生稻胚性愈傷誘導最強,出愈率最高達到100 %。以2,4-D濃度為3.0 mg/L時用于愈傷繼代培養較好。以2,4-D濃度為6.0 mg/L時用于愈傷增殖培養較好。2,4-D濃度過低和過高對胚芽啟動效果很差,選擇適宜的濃度比才是突破胚芽萌發的關鍵。
3.3 激素對緊穗野生稻幼胚分化成苗產生的影響
植物生長調節劑是影響愈傷組織再分化的關鍵性因素之一,細胞分裂素在組織培養中促進細胞分裂和分化,可促進植物細胞的分裂和不定芽的形成,打破頂端優勢形成叢生芽,有利于芽的增殖和繼代培養[9-11]。6-BA是誘導水稻愈傷組織再生植株時常用的細胞分裂素[12]。周玲艷等認為,6-BA有利于水稻愈傷組織的分化[13]。本實驗結果表明:添加6-BA 4.0 mg/L,愈傷綠色凸起最多、分化最繁盛。選擇生長素NAA與一定比例的細胞分裂素誘導腋芽及不定芽的產生,也是相符合的[14]。王力等[15]研究表明:6-BA促進分化而不利于成苗,添加KT、ZT促進成苗而不利于分化。本文通過實驗證明:選擇6-BA、NAA、KT、ZT多激素搭配和最適合的濃度配比,不僅愈傷綠色凸起增多、分化繁盛 ,而且苗油綠,莖稈粗,叢生芽、叢生苗增多,新愈傷長出。實驗得出:利用生長素和幾種細胞分裂素進行最適合的比例配合使用,用來作為緊穗野生稻幼胚分化改良培養基,成功將幼胚愈傷分化出健壯油綠的再生苗和叢生苗,并使分化率得到大幅提高。不同的品種材料在選擇基本培養基及激素搭配和比例配比時,必須對癥下藥,方可見效,以免適得其反。
3.4 激素對緊穗野生稻幼胚生根苗產生的影響
眾所周知,作為生長素的NAA和IAA,其主要作用是誘導愈傷組織的形成、胚狀體的產生以及試管苗的生根,本實驗對NAA和IAA各設置了9組梯度濃度比較,實驗結果得出:以IAA 0.3 mg/L對根芽啟動效果最好,對促進主根根粗、主根生長、須根出根率、須根長具有顯著效果。
3.5 煉苗與栽種及田間管理
實驗結果表明:生根苗從揭膜、定植、煉苗到栽種,經歷39 d,由組培苗過渡到自然生長苗,從無菌狀態變成有菌狀態,這樣一個循序漸進的過程,苗的田間成活率達到98%。苗在田間的生長過程中,注意水、肥管理及病蟲害防治,后期追施一次肥,直至種子成熟。在本研究中,通過對緊穗野生稻幼胚愈傷誘導培養,篩選出最適合的N6基本培養基,選擇最適宜的激素組合,根據不同生長時期的要求來確定激素配比和培養基配方,成功地建立起一套高效高質量的緊穗野生稻幼胚愈傷誘導、分化、生根培養基的再生體系,并將改良后的培養基在實踐中得到充分應用,取得較好效果;突破了野生稻離體保存的關鍵技術,為野生稻的培育奠定了扎實基礎。

