鋰離子全電池研究綜述
孫嘉遙 黃超 郭雙桃
第二次工業革命以后社會發展迅猛,傳統化石能源燃燒的粗放式使用,不僅帶來了嚴重的環境污染,也造成了極大的能源危機。太陽能、風能、氫能等新能源的使用能夠有效緩解這一問題,這些新型能源得到了各國的大力支持。雖然這些能源儲量豐富、可清潔再生,但是其大規模應用仍然存在著能量轉化、運輸、存儲等問題,因此新能源儲能技術得到了廣泛關注,高效安全的儲能器件成為關鍵。鋰離子二次電池以其儲能穩定、高效安全、周期壽命長、攜帶方便、成本較低而備受青睞;在電網儲能,汽車航空,消費類電子產品等領域得到廣泛應用[1]。
正極材料是組成鋰離子電池的關鍵。其成本占全電池成本的1/3以上,且作為全電池鋰源,對電池的能量密度和功率密度影響極大,故從正極材料角度研究鋰離子全電池具有很大的理論意義和現實價值。然而目前科研院所對鋰離子電池電極材料的改性研究主要以扣式半電池為主,未考慮到全電池和半電池的差異,與鋰離子電池實際應用有一定的差距。很多電芯生產企業研究力量不足也缺乏對全電池體系的深入研究,造成電池體系或系統存在的問題得不到解決,這顯然不利于電池產業的可快速發展和電池性能的提高。本文分析了鋰離子全電池和半電池的差異,綜述了橄欖石體系、巖鹽層狀體系、尖晶石體系全電池的研究進展,分析了全電池體系的技術難題,展望了鋰離子全電池的研究趨勢與應用前景。
1 全電池與半電池差異
實驗室研究多針對電池某一部分,一般以扣式半電池為主;而商業化應用都是全電池,以軟包和圓柱形電池為主。在用負極活性物質取代金屬鋰片過程中,電池的電化學性質和研究側重點有所不同,主要表現在以下幾個方面。
1.1 鋰離子供體差異
一般地,在半電池研究中,負極采用金屬鋰片作為鋰源,可以補充SEI膜形成和電解液分解等副反應消耗的鋰離子(Li+);而在全電池中只有正極提供Li+,因此全電池性能受不可逆反應影響非常大。這一差異是全電池和半電池之間最大的區別,具體例如:①在半電池測試中性能良好的負極如石墨烯,由于SEI膜形成過程中消耗Li+太多,很難應用于全電池[2];②全電池循環過程中的容量衰減比半電池嚴重得多[3]。
針對全電池在循環過程中發生的容量衰減現場,文獻中共提出4種衰減機制[4-7]:①負極表面SEI膜生成以及電解液氧化等引起的鋰損失;②活性物質中金屬離子溶解以及循環過程中活性物質從集流體表面剝離等引起的活性材料損失;③SEI膜以及電解液副產物引起的電極表面阻抗增加;④脫嵌鋰過程中活性物質結晶度降低,發生結構破壞甚至崩塌,阻礙鋰離子脫嵌。研究表明:全電池循環過程中的容量衰減主要是由于正極材料的鋰損失,而這通常是SEI膜生成中的消耗和電解液氧化分解引起的。2012年,Zheng等[8]以磷酸鐵鋰(LFP)為正極,中間相碳微球(MCMB)為負極,組成全電池,室溫循環1 000圈后在滿放狀態下拆開,重新組裝成LFP/Li、MCMB/Li半電池。通過恒流充放電后發現:LFP/Li半電池的首次充電容量僅為0.22 mAh·cm2,與全電池的初始容量0.58 mAh·cm2差別很大,與全電池循環1 000圈后的可逆容量0.23 mAh·cm2十分接近。全電池循環過程中的容量衰減主要來自鋰的損失已成為共識。為此研究者們在設計全電池時,針對性提出了3種改性方法:①正極過量;②加入鋰添加劑或加入“補償性”鋰鹽;③對負極預鋰化。
1.2 正負極質容量匹配
全電池充放電過程中,Li+在正負極之間來回遷移,理論上為保證Li+利用率的最大化,正負極之間的質容量關系應該滿足下述關系式: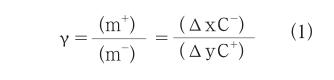
γ代表正負極質量比例系數,m+、m-分別代表正、負極活性物質質量;Δx、Δy分別代表嵌入到負、正極中的鋰離子摩爾數;C+、C-分別代表正負極活性物質的理論質量比容量。而對于實際比容量和理論值差別很大的體系,C+、C-有時也會以實際比容量代替。
研究表明:正負極之間的質容量匹配對全電池的電化學性能尤其是循環性能影響很大。2016年Y a n等[9]以L i M n2O4( L M O )正極,LTO負極組成的全電池為研究對象,對比研究了正負極質量比例系數γ(=0.5,1.0,1.5,1.7,2.5,3.0)對其電化學性能的影響。結果顯示:在25℃、0.2C、1.5~2.8 V下循環,γ等于1.5的全電池綜合性能最佳,可逆放電容量約為130 mAh/g,100圈循環幾乎沒有發生容量和電壓衰減,1C放電接近90 mAh/g(以LTO負極質量為準)。進一步研究發現,γ等于1.5時剛好對應負極(161 mAh/g)和正極(111 mAh/g)的可逆實際容量之比,證實了式(1)的正確性。
現實中,由于截止電壓,電流密度等有關因素波動較大。此外考慮到電池材料的不一致性,所以實際中往往選擇以某一電極總容量過量來保證全電池綜合性能。研究發現:如果全電池以碳類材料為負極,正極容量限制的全電池性能更佳。而在以鈦類材料為負極的全電池中,負極容量限制的全電池性能更佳。
1.3 電極之間相互作用
相比半電池而言,全電池中正、負極之間相互作用強烈。研究表明:全電池在循環過程中會發生過渡金屬離子溶解,后在負極表面析出金屬鹽,催化負極與電解液的界面反應;而半電池中由于是金屬鋰片,過渡金屬鹽析出對其影響較小。
2012年,Z h e n g等[10]發現LiNi1/3Co1/3Mn1/3O2/MCMB體系全電池在30℃、C/24、3.0~4.5 V下循環150圈后,MCMB負極表面沉積了大量過渡金屬氧化物顆粒,其源于循環過程中金屬離子在電解液中溶解后,遷移至負極表面析出。金屬鹽在負極的存在不僅會催化負極與電解液的界面副反應消耗大量的Li+,而且會增加負極表面SEI膜阻抗。雖然鈦類負極沒有SEI膜,但是正極材料對其影響也很明顯。
1.4 評價指標不同
半電池研究只針對電池某一組成,注重其本征特性;而全電池注重綜合性能,需要考慮的因素很多。評價全電池品質的優劣,主要有成本、性能、安全、壽命4個指標。①成本:電池價格影響其供求關系,低成本有助于電池應用推廣;②性能:全電池需要考慮電池能量密度、功率密度、荷電恢復能力、高低溫特性等;③安全:全電池在實用過程中,安全性測試必不可少,而扣式半電池并不考慮安全性問題;④壽命:電池的循環壽命決定了電池的使用周期,影響電池回收成本。
此外相比半電池而言,全電池還需要考慮電荷轉移問題、外殼質量、氣密性封裝等問題。下面將商業化的鋰離子全電池正極材料的類型分為橄欖石結構、巖鹽層狀結構和尖晶石結構,分別介紹相關的全電池研究。
2 橄欖石類正極全電池
橄欖石類正極的結構式為LiMPO4(M=Ni,Co,Mn,Fe),以磷酸鐵鋰(LiFePO4,LFP)應用最廣。LFP的電壓平臺在3.4 V左右,理論比容量170 mAh/g,成本低廉、無毒性、合成工藝成熟、體積穩定性好(LFP中強的共價鍵P—O能夠抑制O流失),安全性極佳,在動力電池中應用很廣[11]。已報道的文獻中與LFP搭配組成全電池的負極按照反應機制可分為3種[12]:
①脫嵌機制,Li+在負極材料晶體空隙中遷移脫嵌,如石墨、鈦酸鋰等;②合金機制,負極材料與鋰形成合金且該過程可逆,如硅、錫等;③轉換機制,將Li+與O2-反應轉換成Li2O形式存儲,部分過渡金屬氧化物和碳酸鹽。
2.1 LFP與碳類負極
以LFP為正極的鋰離子全電池,負極多為碳類材料,尤以石墨(Gra)負極最多。石墨負極不僅價格低廉、工藝簡單、性能穩定、且理論容量高(約372 mAh/g)、電壓平臺低(約0.2 V),可與LFP正極組裝成工作電壓3.2 V左右的全電池,其在脫嵌鋰過程中的化學反應式如下[13]:LiFePO4→←xLi++Li1-xFePO4+xe- (2) 6C+xLi+→←LixC6-xe- (3)
正如1.4部分所述,全電池評價參數有4個:成本、壽命、安全、性能。由于LFP/Gra體系全電池的成本較低、安全系數高、實際容量幾乎接近理論容量,故針對該體系的全電池研究主要集中在循環壽命上,對其循環過程中容量衰減的影響因素及循環性能改性研究較多。
2003年,Shim和Striebel等[14]研究LFP與天然石墨體系軟包電池的電化學性能,結果表明,該全電池體系工作電壓約為3.4 V,在25℃、2.5~4.0 V條件下循環100圈,C/2和C/25容量保持率分別為80%和60%。滿放狀態下拆分成半電池后發現LFP正極鋰損失接近50%。2005年,Striebel和Shim等[15]針對2003年的實驗做了2點改性:①采用碳包覆鋁集流體以降低全電池正極局部阻抗和抑制過渡金屬離子Fe2+在電解液中溶解,發現循環壽命提高了2.5倍;②用二草酸硼酸鋰(LiBOB)替代原電解液中的LiPF6避免HF對活性材料和集流體的腐蝕,發現同樣條件下,前者容量衰減速率比在LiPF6中慢了近1/2。總而言之,LFP/Gra體系的全電池容量衰減受較多因素影響,容量衰減多與SEI膜形成和電解液副反應引起的鋰損失和石墨負極表面阻抗增加有關。
2.2 LFP與鈦基負極
石墨等碳類負極在Li+嵌入后體積膨脹較大,不僅會引起表面SEI膜破損,而且會降低負極與集流體的粘著力,甚至導致活性材料從集流體上剝離。此外,碳類負極放電平臺低,接近析鋰電位,易形成鋰枝晶刺穿電池隔膜,存在安全隱患;而且碳類負極表面形成SEI膜時消耗大量鋰,全電池容量衰減嚴重。正是上述缺點限制了石墨等碳負極在鋰離子電池上大規模的應用[16]。
鈦類負極是另一個備受關注的體系,近幾年得到了很大發展。已報道可作為鋰電池負極的鈦基氧化物主要有:TiO2、Li4Ti5O12、TiNb2O7,LiCrTiO4,其中以鈦酸鋰(LTO)和二氧化鈦(TiO2)最受青睞。
LTO負極具有價格低廉、體積穩定,無毒環保、平臺一致等優點,此外LTO還因2點備受推崇[17]:①在脫嵌鋰過程中體積變化小于1%,被稱為“零應變”材料,循環性能優異;②電壓平臺約為1.55V,遠高于普通電解液的分解電壓(約0.8 V)和析鋰電位,在負極表面幾乎不形成SEI膜,排除了表面析鋰的可能性。LTO電極在脫嵌鋰過程中的化學方程式如下:Li4Ti5O12+3Li++3e-→←Li7Ti5O12 (4)
LTO作為負極電壓較高,組成的全電池整體電壓很低(<2 V);此外由于理論容量偏低,所以LFP/LTO體系全電池的能量密度較低。但是L F P / L T O體系全電池循環壽命長、安全性能好、且實際容量幾乎接近理論容量。由于能量密度提高空間有限,且LFP和LTO電極的電子電導率都很低,故該體系全電池改性研究主要集中在倍率性能上。
2009年Jaiswal等[18]結合碳包覆和納米化手段組成功率型LFP/LTO全電池,在25℃,0.3~3.2 V之間恒流充放電。結果顯示,全電池電壓平臺在1.85 V左右,C/5、1C、5C下放電比容量分別是150、145、122 mAh/g(以LTO負極質量為準);5C下循環100圈后容量保持率高達99.4%,每圈容量損失率僅在0.003%。
TiO2幾乎具有LTO所有優點:成本低廉,電壓平臺接近1.7 V,脫嵌鋰過程中體積變化率小于4.0%。此外TiO2理論容量(335 mAh/g)比LTO(175 mAh/g)高,且在Li+嵌入過程中由于Ti3+的存在能夠提高電極的整體電導率比LTO(<10-13S/m)高幾個數量級[19]。所以TiO2應用在鋰離子電池負極上優勢明顯,其脫嵌鋰過程中的反應式如下:
TiO2+xLi++xe-→←LixTiO2 (5)
2010年,Choi等[20]以石墨烯復合對TiO2進行改性,后與LFP組成全電池,25℃、1.0~2.5V、1C下恒流充放電,放電平臺約為1.5 V,可逆容量接近110 mAh/g,循環700圈容量幾乎沒有衰減。
正如上述研究結果顯示,LFP正極與鈦類負極組成的全電池電壓較低,為了解決這個問題,部分研究者們通過元素取代Fe2+來提高正極的電壓。
2.3 LFP與其他負極
脫嵌機制負極電壓平臺穩定、體積穩定性也比較好,但由于材料內部Li+嵌入活性位點有限,其理論容量普遍不如合金機制和轉換機制負極。轉換機制負極具有容量高的優點,但是存在如首次庫倫效率低、不可逆容量大、幾乎沒有放電平臺等問題。其研究尚處起步階段,對其全電池研究很少,已報道可作鋰離子電池用轉換機制負極主要是部分金屬氧化物和氮化物,分別以Li2O和Li3N方式儲鋰[21,22]。
相比轉換機制,合金負極研究已具有一定的系統性,以硅(Si)和錫(Sn)負極最受研究者青睞。
Si負極不僅成本低廉、無毒環保、平臺較低(0.1~0.2V)且理論容量極高(約4200 mAh/g),在鋰電池中應用潛力很大。但Si負極與Li形成合金過程中(見式6)體積膨脹近300%,易造成活性物質從集流體剝落甚至粉化、電極表面SEI膜撕裂和容量的急劇衰減[23,24]。
4.4Li+Si→←Li4.4Si (6)
鑒于此,LFP與Si負極全電池的核心在于緩解Si-Li合金化過程中的體積膨脹,針對這一點學者們做了大量的研究工作。2014年,Kim等[25]為保證Si負極合金化過程中體積膨脹一致,緩解局部膨脹壓力,采用無定形Si薄膜作為負極與LFP正極組成全電池,在25℃、2.5~4.4V下進行電化學測試,結果顯示在0.5C、1C下全電池首次放電容量分別為143.9 mAh/g、132.7 mAh/g,循環100圈后放電容量還能保持在107.1 mAh/g和100.2 mAh/g,容量保持率分別是在74%和76%。
相比Si負極而言,Sn不僅電導率更高而且理論容量也很高(994 mAh/g)是另一種研究較多的合金負極。純Sn很少作為電池負極,一般與碳材料復合組成Sn—C負極。Sn—C合金化過程中的反應式如下:
4.4Li+Sn—C→←Li4.4Sn+C (7)
2012年Brutti等[26]以高比例的Sn-C負極(Sn:C質量比2:3)與LFP組成全電池在25℃、1.8~3.5V、3C下恒流充放電:電壓平臺接近2.8V,100圈可逆容量約為120 mAh/g,全電池能量密度約為350 Wh/kg,功率密度達到2.4 kW/kg。
3 巖鹽層狀正極全電池
巖鹽層狀正極材料主要有2大類:一元LiMO2(M=Ni,Co,Mn)體系和三元LiNixCoyMO2(M=Mn,Al)體系。一元體系中,由于純相的LiNiO2和LiMnO2制備困難,難以產業化,因此以LiCoO2的全電池研究為主。
3.1 LiCoO2正極全電池
LiCoO2(LCO)從1991年鋰電池商業化以來,一直活躍在鋰電正極市場。相比LFP而言,巖鹽層狀正極無論是在Li+擴散系數(具有二維鋰離子擴散通道)、電壓平臺(約4.0V)還是理論容量(275 mAh/g)方面都很有優勢。但是LCO2也存在不足:循環壽命和安全性欠佳。由于層狀正極電壓、容量都比較高,因此相比橄欖石正極和尖晶石正極而言,可與層狀正極搭配組成的全電池的負極種類很多。
Ethan C等[27]以靜電紡絲合成高能量密度LCO—C全電池,在25℃、2.5~4.2V、0.1C下恒流充放電,能量密度能夠達到144Wh/kg;Li等[28]用LCO正極與Ge—C納米負極組成全電池,提前將負極組裝成半電池預鋰化減少電池首次不可逆容量,在25℃、1C、2.7~4.4V下循環300圈后能量密度還能維持在370Wh/kg。
在眾多體系中LCO—Gra最為成熟。研究發現石墨負極SEI膜的相關特性對該全電池體系電化學性能影響很大。2011年,He等[29]對比研究了電流密度對LCO/Gra體系全電池電極表面SEI膜形成的影響。在實驗中,作者選取了4種電流密度不同的方式對041428型全電池進行化成。EIS測試結果表明,該體系全電池在4種不同電流密度下化成形成的SEI膜阻抗差別很大,大電流密度下形成的SEI膜多孔疏松且附著力弱。此外研究也發現正極形成的SEI膜阻抗比石墨負極大很多。這是因為正極SEI膜不穩定且附著力低,在放電過程中容易脫落。
3.2 三元正極全電池
Ni、Mn摻入LCO后,不僅可以降低正極成本,而且Ni2+能提高電池實際容量,Mn4+可以穩定電池結構,利用3種元素的協同作用可以進一步提高電池的綜合性能。
2 0 1 2年,J i等[ 3 0 ]以三元LiNi1/3Co1/3Mn1/3O2為正極與多層結構硅—石墨烯負極組成全電池,3.0~4.3V、C/15下電池首次放電容量達到137mAh/g(以正極質量為準)。2013年,Takami等[31]以三元LiNi0.5Co0.2Mn0.3O2為正極,與固相法合成的LTO負極組成額定容量20Ah級的方型全電池。在1.5~2.7V、3C下循環6 000圈后容量保持率為86%,10 000圈容量保持率高達80%,能量密度為90Wh/kg,50%SOC狀態下功率密度達到2 200W/kg。
除傳統三元以外,近幾年富鋰體系也獲得了很大關注。三元富鋰正極放電容量高(>250mAh/g),能夠大幅度提高正極的能量密度,但是富鋰體系在循環過程中存在尖晶石轉變、電壓衰減等問題,所以針對該正極全電池體系主要集中在改善循環性能的研究上。
4 尖晶石正極全電池
尖晶石正極材料具有工作電壓高、熱穩定性好、安全性絕佳、合成容易、成本低廉、無毒環保等優勢在鋰電池中應用頗具潛力,其代表性物質有2種:LiMn2O4和LiNi0.5Mn1.5O4。
4.1 LiMn2O4正極全電池
雖然LiMn2O4(LMO)正極理論容量較低(148mAh/g),但是其電壓平臺高(4.0/4.1V),鋰離子擴散系數大(10-8~10-10cm2/s),在動力電池上應用很具優勢。然而LMO正極循環性能很差,限制了其大規模應用,其原因主要來自2方面:①由于Mn2+易溶解進入電解液后沉積到負極表面,催化活性材料與電解液發生界面反應,不僅造成活性物質流失且鈍化電極表面,增大電化學阻抗;③在材料內部,Mn3+的高自旋誘發JahnTeller結構畸變,引起晶體塌陷[32]。
與LMO搭配的全電池負極主要是鈦基材料。這是由于石墨等碳類與LMO正極組成全電池的效果很不理想。LMO正極在循環過程中存在部分Mn2+溶解進入電解液,后遷移到石墨負極表面,發生過渡金屬氧化物沉積。過渡金屬鹽會破壞SEI膜,而SEI膜反復破裂重組會消耗Li+。而鈦基材料電壓平臺較高在氧化還原過程中不產生SEI膜,能夠避免SEI膜消耗引起的容量衰減,有研究表明用LTO替代石墨能夠提高全電池的循環性能和安全性能。由于LMO的循環性能較差,所以針對該體系的全電池研究主要集中在正極的循環改性上,改性方法主要有納米化、包覆、摻雜、復合這4種。
2012年,Wang等[33]對比研究了碳源和包碳量對LMO/LTO全電池性能的影響,發現如果LTO同時包覆蔗糖和導電石墨KS-6的話,全電池倍率和循環性能最好,0.2C下首次可逆容量在152.5 mAh/ g,1C下1 000圈循環后放電容量還能維持在145.1 mAh/g,容量保持率為96.8%,10C下放電容量是1C的83.0%倍率性能極佳。此外該體系全電池循環性能、高溫性能和安全性能都很好,能夠通過5C,20V的短路、過充和針刺測試。2014年,Wang等[34]對比研究了Zr摻雜LTO對LMO/LTO全電池的性能的影響,發現Zr摻雜能夠顯著提高電池的倍率性能,對電池的循環性能也有改善。摻Zr后的全電池在1.0~2.8V下恒流充放,0.1C、1C下首次放電容量分別是97.4 mAh/g和91.8 mAh/g,1C下循環200圈容量幾乎沒有衰減。
4.2 LiNi0.5Mn1.5O4正極全電池
由于LMO存在諸多不足,其深度應用需要進一步改性。其中摻雜是有效且常用的手段,研究報道的摻雜元素有:Ni、Mg、Cu、Fe、Co、Cr、Al,以Ni摻雜LMO最成功。相比LMO而言,Ni摻雜得到的LiNi0.5Mn1.5O4(LNM)多了2點優勢:①電壓平臺更高,在4.7V左右;②理論上沒有Mn3+的存在,避免了Mn3+的歧化反應和Jahn—Teller效應。很多研究表明LNM綜合性能比LMO好得多[35]。
一方面來說,高達4.7V的電壓平臺是LNM的一大優勢,使之無論是與Gra、LTO等脫嵌負極、Si、Sn等合金負極還是Fe2O3、CuO等轉換負極組成的全電池都具有較高的工作電壓。
Zhang等[36]用多級結構LNM正極與納米棒CuO負極組成全電池,在0.1C、1.7~4.75V下循環5圈后可逆容量為660mAh/g(以負極質量為準),能量密度達217Wh/kg。2009年,Fang等[37]以改良的溶膠-凝膠法合成具有高(111)暴露面的P432型 LNM正極,與商業化Gra負極組成的全電池具有高達4.55V的放電平臺,0.2C、3.3~4.8V時首次放電容量為130.2mAh/g,能量密度達到576.2Wh/kg。
從另一方面來講,高達4.7V的電壓平臺也會給LNM帶來一些問題:高電壓下,電極與電解液之間的副反應增多引起容量衰減。鈦類材料的存在,很大程度上緩解了負極材料由于SEI膜反復破裂后重組造成的活性鋰消耗以及電化學阻抗增加的問題,因此與LNM正極材料搭配效果良好。同時由于高電壓下的過充會帶來很大的安全隱患,為解決該問題,LNM-LTO體系全電池都采用LTO負極容量限制。
2014年,Kim等[38]對比研究了LNM/Gra、LNM/LTO全電池的電化學性能,結果顯示LNM/Gra體系全電池,C/5、3.4~4.8V下循環100圈后,30℃、45℃下的容量保持率分別為72.0%和38.9%。而LNM/LTO體系全電池,C/5、2.0~3.3V循環100圈后,30℃、45℃下的容量保持率分別接近100.0%和58.0%,相比LNM/Gra而言,循環性能明顯要好得多。
5 結語
相比半電池而言,全電池不僅需要了解某一電極材料的本征電化學性質,而且更要考慮到正極、負極、電解液之間的匹配。兩者無論是在電化學組成、正負極之間反應還是在性能指標、應用環境等方面都有很大差異。深入了解這些差異,不僅能夠幫助設計綜合性能優良的全電池,而且有助于新材料的開發和改性研究,具有很高的理論指導和應用價值。
參考文獻
[1] SUN Yangkook,MYUNG S T,PARK B C,et al.Highenergy cathode material for long—life and safe lithium batteries[J]. Nature Material,2009,8(4):320.
[2] SCAR Vargas,áLVARO Caballero,MORALES J,et al.Contribution to the Understanding of Capacity Fading in Graphene Nanosheets Acting as an Anode in Full Li—Ion Batteries[J].Acs Applied Materials & Interfaces,2014,6(5):3290.
[3] ZIV B,BORGEL V,AURBACH D,et al.Investigation of the Reasons for Capacity Fading in Li—Ion Battery Cells[J].Journal of the Electrochemical Society,2014,161(10):A1672—A1680.
[4] CHANG Haohsun,WU Hungchun,WU N.Enhanced high—temperature cycle performance of LiFePO4/carbon batteries by an ion—sieving metal coating on negative electrode[J].Electrochemistry Communications,2008,10(12):1823—1826.
[5] DUPRE N,MARTIN J F,DEGRYSE J,et al.Aging of the LiFePO4,positive electrode interface in electrolyte[J].Journal of Power Sources,2010,195(21):7415—7425.
[6] DUBARRY M,LIAW B Y.Identify capacity fading mechanism in a commercial LiFePO4 cell[J].Journal of Power Sources, 2009,194(1):541—549.
[7] ZHANG Yancheng,WANG Chaoyang,TANG Xidong.Cycling degradation of an automotive LiFePO4,lithium—ion battery[J]. Journal of Power Sources,2011,196(3):1513—1520.
[8] ZHENG Honghe,CHAI Lili,SONG Xiangyun,et al.Electrochemical cycling behavior of LiFePO4,cathode charged with different upper voltage limits[J].Electrochimica Acta,2012,62:256—262.
[9] YAN Hui,ZHANG Ding,GUO Guibao,et al.Hydrothermal synthesis of spherical Li4Ti5O12 material for a novel durable Li4Ti5O12/LiMn2O4 full lithium ion battery[J].Ceramics International.2016(42):14855—14861.
[10] ZHENG Honghe,SUN Qingna,GAO Liu,et al.Correlation between dissolution behavior and electrochemical cycling performance for LiNi1/3Co1/3Mn1/3O2—based cells[J].Journal of Power Sources,2012,207(6):134—140.
[11] TALEBIE M,ROUSSELOT S,GAUTHIER M,et al.Control of the LiFePO4 electrochemical properties using low—cost iron precursor in a melt process[J].Journal of Solid State Electrochemistry,2016:1—10.
[12] BALOGUN M S,QIU W,LUO Y,et al.A review of the development of full cell lithium—ion batteries:The impact of nanostructured anode materials[J].Nano Research,2016(10):1—29.
[13] KLETT M,ZAVALIS T G,KJELL M H,et al.Altered electrode degradation with temperature in LiFePO4/mesocarbon microbead graphite cells diagnosed with impedance spectroscopy[J].Electrochimica Acta,2014,141(28):173—181.
[14] SHIM J,STRIEBEL K A.Cycling performance of low—cost lithium ion batteries with natural graphite and LiFePO4[J]. Journal of Power Sources,2003,119—121(2):955—958.
[15] STRIEBEL K,SHIM J,SIERRA A,et al.The development of low cost LiFePO4—based high power lithium—ion batteries[J]. Journal of Power Sources,2005,146(1—2):33—38.
[16] INABA M.Secondary Batteries—Lithium Rechargeable Systems—Lithium—ion/Negative Electrodes:Graphite[J]. Encyclopedia of Electrochemical Power Sources,2009:198—208.
[17] LIU G Y,WANG H Y,LIU G Q,et al.Facile synthesis of nanocrystalline Li4Ti5O12,by microemulsion and its application as anode material for Li—ion batteries[J].Journal of Power Sources,2012,220(220):84—88.
[18] JAISWAL A,HORNE C R,CHANG O,et al.Nanoscale LiFePO4 and Li4Ti5O12 for high rate Li—Ion batteries[J].Journal of the Electrochemical Society,2009,156(12):A1041—A1046.
[19] WANG Ping,ZHANG Geng,CHENG Jian,et al.Facile Synthesis of Carbon—Coated Spinel Li4Ti5O12/Rutile—TiO2 Composites as an Improved Anode Material in Full Lithium—Ion Batteries with LiFePO4@N—Doped Carbon Cathode [J].Acs Applied Materials & Interfaces,2017,9:6138—6143.
[20] CHOI D,WANG Donghai,VISWANATHAN V V,et al.Li—ion batteries from LiFePO4 cathode and anatase/graphene composite anode for stationary energy storage[J].Electrochemistry Communications,2009,12(3):378—381.
[21] XU Guiliang,XU Yuefeng,FANG Junchuan,et al.Facile Synthesis of Hierarchical Micro/Nanostructured MnO Material and Its Excellent Lithium Storage Property and High Performance as Anode in a MnO/LiNi0.5Mn1.5O4—δ Lithium Ion Battery[J].Acs Applied Materials & Interfaces,2013,5(13):6316—6323.
[22] REDDY M V,PRITHVI G,LOH K P,et al.Li storage and impedance spectroscopy studies on Co3O4,CoO,and CoN for Li—ion batteries.[J].Acs Applied Materials & Interfaces,2014,6(1):680—690.
[23] HASSOUN J,PANERO S,REALE P,et al.A New,Safe,High—Rate and High—Energy Polymer Lithium—Ion Battery[M]. Advanced Materials.2009:4807—4810.
[24] JI Liwen,ZHANG Xiangwu.Evaluation of Si/carbon composite nanofiber—based insertion anodes for new—generation rechargeable lithium—ion batteries[J].Energy & Environmental Science, 2010,3(1):124—129.
[25] KIM J K,CHO G B,RYU H S,et al.Electrochemical properties of a full cell of lithium iron phosphate cathode using thin amorphous silicon anode[J].Solid State Ionics,2014,268:256—260.
[26] BRUTTI S,HASSOUN J,SCROSATI B,et al.A high power Sn—C/C—LiFePO4,lithium ion battery[J].Journal of Power Sources,2012,217(11):72—76.
[27] SELF E C,MCREN E C,WYCISK R,et al.LiCoO2—Based Fiber Cathodes for Electrospun Full Cell Li—ion Batteries[J]. Electrochimica Acta,2016,214:139—146.
[28] LI Xiaona,LIANG Jianwen,HOU Zhiguo,et al.The design of a high—energy Li—ion battery using germanium—based anode and LiCoO2,cathode[J].Journal of Power Sources,2015,293:868—875.
[29] HE Yanbing,LI Baohua,YANG Quanhong,et al.Effects of current densities on the formation of LiCoO2/graphite lithium ion battery[J].Journal of Solid State Electrochemistry,2011,15(9):1977—1985.
[30] JI Liwen,ZHENG Honghe,IISMACH A,et al.Graphene/Si multilayer structure anodes for advanced half and full lithium—ion cells[J].Nano Energy,2012,1(1):164—171.
[31] TAKAMI N,INAGAKI H,TATEBAYASHI Y,et al.High—power and long—life lithium—ion batteries using lithium titanium oxide anode for automotive and stationary power applications[J].Journal of Power Sources,2013,244(4):469—475.
[32] HU D H,ZHAO S X,DENG Y F,et al.Synthesis and electrochemical performance of rod—like spinel LiMn2O4 coated by Li—Al—Si—O solid electrolyte[J].Journal of Materials Chemistry A,2013,1(46):14729—14735.
[33] WANG Ruying,WANG Juan,TIAN Qiu,et al.Effects of different carbon sources on the electrochemical properties of Li4Ti5O12/C composites[J].Electrochimica Acta,2012,70(6):84—90.
[34] WANG Z,WANG Z,PENG W,et al.An improved solid—state reaction to synthesize Zr—doped Li4Ti5O12 anode material and its application in LiMn2O4/Li4Ti5O12 full—cell[J].Ceramics International,2014,40(7):10053—10059.
[35] KRAYTSBERG A,EI Y.Higher,Stronger,Better A Review of 5 Volt Cathode Materials for Advanced Lithium—Ion Batteries[J].Advanced Energy Materials,2012,2(8):922—939.
[36] ZHANG Weixin,GUO Ma,GU Heyun,et al.A new lithium—ion battery:CuO nanorod array anode versus spinel LiNi 0.5Mn1.5O4,cathode[J]. Journal of Power Sources,2015,273(273):561—565.
[37] FANG Junchuan,XU Y,XU Guiliang,et al.Fabrication of densely packed LiNi0.5Mn1.5O4,cathode material with excellent long—term cycleability for high—voltage lithium ion batteries[J].Journal of Power Sources,2016,304:15—23.
[38] KIM J,PIECZONKA N P W,SUN Y,et al.Improved lithium—ion battery performance of LiNi0.5Mn1.5—xTixO4 high voltage spinel in full—cells paired with graphite and Li4Ti5O12 negative electrodes[J].Journal of Power Sources, 2014,62(9):62—71.

