煤熱解過程中H2與CO變化規律的試驗研究
鄒凱


摘 要:通過對中天合創煤炭分公司葫蘆素煤礦2-1煤樣的氧化升溫實驗,研究了煤升溫過程中H2與CO的產生、變化規律及相關性。認為煤升溫氧化過程中,CO濃度變化基本服從指數曲線變化趨勢,H2濃度變化趨勢基本符合6階多項式分布。170℃以后,CO和H2產生量開始急劇增加,均呈指數規律變化,且H2溫升率(△ppm/△T)為CO的168倍左右,H2變化速率對現場實際滅火中判斷火勢發展具有重要意義。
關鍵詞:熱解;H2;變化趨勢;相關性
CO作為煤自燃預測預報的主要且最為關鍵指標性氣體,在現場實際應用中受到一定的局限性,通常輔以C2H4、CO/⊿O2等來判斷煤炭的自燃程度。由于煤燃燒過程中,H2常常伴隨CO有規律的產生、變化,H2的變化趨勢、變化量會一定程度地反映CO的變化情況,研究煤自燃過程中H2與CO的變化規律及相關性具有重要意義。
1 煤氧化熱解實驗
1.1 實驗目的
研究煤樣氧化熱解過程中解析出的CO與H2隨煤樣溫度變化情況,尋找煤自燃過程中CO與H2變化的規律及相關性。
1.2 實驗設備
氧化熱解實驗系統主要包括氣體質量流量控制器、程序控溫箱、銅質煤樣罐、氣相色譜儀、溫度控制系統、預熱氣路等。
1.3 實驗過程
1.3.1 選取煤樣
選取中天合創葫蘆素煤礦2-1煤層煤樣,去除煤樣表面氧化層,然后用煤樣破碎機進行破碎并篩分出粒度為80目的顆粒作為實驗煤樣。
1.3.2 實驗過程
①選取粒度為80目的煤樣50g,置于銅質煤樣罐內;
②連接好進氣氣路、出氣氣路和溫度探頭(探頭置于煤樣罐的幾何中心),并檢查氣路的氣密性,確保氣路不漏氣;
③將煤樣罐置于程序控溫箱內,向煤樣罐內通入80ml/min的干空氣,空氣壓力為0.04Mpa;
④設置程序控溫箱的初始恒溫狀態為30℃,當達到初始恒溫狀態時,在程序控溫箱控制下對煤樣進行加熱,從30℃至300℃,每上升10℃采集氣樣,用氣相色譜儀進行氣體化驗分析。
1.4 實驗結果及分析
1.4.1 氧化熱解過程中CO的變化規律
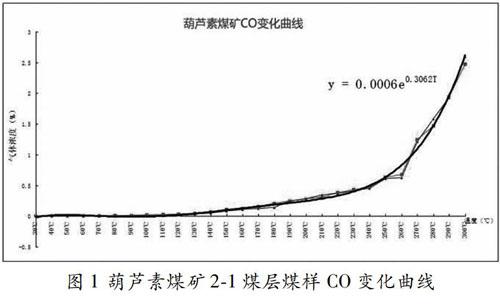
煤樣升溫中,CO 在30℃時就開始出現,30℃-120℃階段為低溫氧化階段,煤中各基團的化學反應較弱,CO生成量較小;120℃-240℃為蓄熱階段,CO濃度逐步上升;當溫度超過240℃后,煤開始迅速氧化燃燒,CO溫升率急劇增加。
從圖1及擬合曲線(y = 0.0006e0.3062T)中我們可以看出,煤樣從30℃至300℃的升溫過程中CO濃度基本服從指數曲線變化趨勢。
1.4.2 氧化熱解過程中H2的變化規律
圖2中可以看出,葫蘆素煤礦2-1煤層煤樣從30℃-170℃氧化熱解過程中H2濃度先增大后減小,170℃以后H2濃度開始急劇上升,變化趨勢基本符合6階多項式分布。
由于煤中吸附有H2,在170℃以前為干燥脫氣階段,[1]升溫過程中可解析出H2。實驗中,30℃-170℃階段主要解析出煤中吸附的H2及游離態H2,[2]含量較小,當煤中吸附或游離態的H2釋放完畢后,H2濃度又逐漸減小。
170℃以后,裂解反應開始占據主導地位,此時反應產物主要以H2和CO為主,H2產生量開始急劇增加。
1.4.3 熱解過程中CO和H2的相關性
在煤樣升溫過程中,170℃以前,由于氧化熱解過程中物理及化學反應綜合作用,CO和H2無明顯相關規律,170℃以后,熱解反應開始活躍,并逐漸占據主導地位。圖3中可知,170℃后,CO和H2的變化趨勢基本相同,且都呈指數規律變化:H2按y1= 17.1677e0.2135T變化,CO按y2= 0.102e0.218T變化。
但隨著溫度的上升,H2上漲的趨勢明顯較CO快。同一溫度下,我們對上述兩個公式求導:
可以看出,170℃以后H2溫升率(△ppm/△T)較大,為CO產生速率的168倍左右。
2 結論
(1)2-1煤層煤樣升溫氧化熱解過程中CO濃度變化基本服從指數曲線變化趨勢,H2濃度變化趨勢基本符合6階多項式分布。
(2)煤中吸附有H2,升溫過程中可解析出H2,不同煤種干燥脫氣階段和裂解反應階段溫度各不相同。實驗中,30℃-170℃階段為煤樣干燥脫氣階段(解析出煤中吸附或游離態的H2),H2含量較小,H2變化趨勢呈現先增大后減小的趨勢。
(3)170℃以后,煤樣物理解析等作用減弱,化學反應開始逐漸增強,裂解反應開始占據主導地位,此時反應產物主要以H2和CO為主,CO、H2產生量開始急劇增加,且變化趨勢基本相同。
(4)170℃以后,隨溫度上升,H2和CO均按指數規律變化,H2上漲趨勢明顯較CO快,H2溫升率(△ppm/△T)為CO的168倍左右,現場實際滅火中根據H2變化速率來判斷火勢發展情況。

