高溫生物酶雙元破膠性能與現場應用*
劉 彝,羅 成,李良川,吳 均,吳佐浩,顏 菲,但佳敏
(1.中國石油冀東油田公司鉆采工藝研究院,河北唐山063002;2.中國石油天然氣集團公司油田化學重點實驗室,北京100083)
高尚堡油田是典型的低孔(10%數15%)、低滲油藏(3×10-3數 20×10-3μm2),埋藏深(3500數 4000 m),溫度90數120℃,自然產量低。目前選用的壓裂液體系為高攜砂、延遲交聯、易返排的低濃度胍膠壓裂液。部分壓裂液破膠不均勻、不徹底,返排率(30%數40%)較低,需進一步降低支撐劑填充層的胍膠殘渣,提高裂縫清潔程度。目前壓裂用破膠劑主要為氧化型破膠劑過硫酸銨,其價格低、使用方便,但破膠程度取決于破膠劑的用量,且膠囊破膠劑破碎后釋放出的過硫酸銨擴散不均勻、活性輻射半徑小,造成胍膠鏈不能完全降解。郭建春等[1]發現氧化類破膠劑雖然能有效降低壓裂液黏度,但對胍膠分子尺寸以及分子量的有效降解能力較差。
苷露聚糖酶是一種特異性水解酶,專一作用于多糖聚合物的β-1,4-鍵苷鍵。酶本身在多糖聚合物降解前后不變,只是參與反應,具有長效性、不易被消耗、無毒無害、活性高、專一性的特點。與傳統破膠劑相比有特殊優勢,但也容易受到溫度、pH 值及其他壓裂液添加劑的影響而失活,因此與傳統氧化劑使用能揚長避短[2-5]。然而,目前報導的生物酶破膠劑只能在90℃以內使用[6]。與普通生物酶相比,高溫生物酶在增強疏水相互作用、增強鹽橋作用、穩定α-螺旋結構、增強芳香環相互作用方面更強,結構更穩定。筆者通過凝膠色譜法和電噴霧離子化質譜分析了過硫酸鹽破膠與生物酶破膠機理的差別,通過DNS 法[7]測定酶活力,優選得到了一種耐溫120℃、耐受pH值10.5的從海棲熱袍嗜熱菌中提取β-苷露聚糖酶的基因片斷,從而形成了90數120℃高溫生物酶雙效降解壓裂液配方、現場破膠劑加入剖面和現場注入工藝。
1 實驗部分
1.1 材料與儀器
胍膠(HPG),生物純,Sigma 公司;β-苷露聚糖酶140、3,5-二硝基水楊酸(DNS),自制;β-苷露聚糖酶180,生物純,大連百奧泰有限公司;氫氧化鈉、四水合酒石酸鉀鈉、苯酚、無水亞硫酸鈉、過硫酸銨(APS)、甲醇、檸檬酸,分析純,國藥集團化學試劑有限公司;多頭硼酸交聯劑、調理劑(氫氧化鈉溶液)、殺菌劑(烷基銨)、助排劑(烷基磺酸鹽)、防膨劑(聚烷基銨),工業品,冀東瑞豐化工公司;膠囊破膠劑,工業品,廣漢華星有限公司;蒸餾水。
RS6000高溫高壓流變儀,德國ThermoFisher公司;XEVOG2 TOF 質譜儀,美國 Waters 公司;Elite P230 凝膠滲透色譜儀,美國沃特斯公司;電噴霧飛行時間質譜儀(ESI-TOF-MS),美國 Waters 公司XEVOG2.TOF 質譜儀,電噴霧離子源(ESI)為ESCi復合源,正離子檢測模式,針孔電壓3.0 kV,錐孔電壓30 數 60 V,離子源溫度100℃,洗脫氣溫度300℃,掃描質譜范圍m/z 為100數 4000,分辨率22500(FWHM)。
1.2 實驗方法
(1)DNS 溶液的配制。稱取3.15 g DNS,加水500 mL,攪拌后放入45℃水浴,在攪拌下緩慢加入100 mL 5 mol/L 氫氧化鈉溶液,直到溶液清澈透明(在加入氫氧化鈉的過程中,溶液溫度≤48℃);再依次加入91 g四水合酒石酸鉀鈉、2.5 g苯酚和2.5 g無水亞硫酸鈉,45℃水浴繼續加熱,同時補水300 mL,不斷攪拌,直到加入的物質完全溶解,停止加熱,冷卻至室溫后,用水定容至1000 mL,過濾后儲存在棕色瓶中,避光保存,室溫下存放7 d后即可使用,有效期為6個月。
(2)破膠液分子量的測定。將酶降解前后的樣品經真空冷凍干燥得到固體樣品,用超純水配成一定濃度的溶液,經0.22 μm水相濾膜過濾后,用凝膠滲透色譜儀測定分子量。
(3)破膠液中低聚物的測定。配制1.4%胍膠,分別加入酶和過硫酸銨,于一定溫度處理3數48 h,并以不加酶及過硫酸銨、不處理及處理48 h 做參照,取處理前、后的樣品0.5 mL,冷凍干燥,加入1 mL甲醇水(體積比1∶1)分級,離心,取上清液適當稀釋后,采用電噴霧飛行時間質譜儀(ESI-TOF-MS)測定質荷比。
(4)DNS法測定酶活力。甘露聚糖酶可促進甘露聚糖的水解,降低甘露聚糖的分子量,同時降低黏度和增加還原糖的數量。通過測定單位時間和單位酶量作用下還原糖數量的增加,可以衡量酶的活性大小。DNS 法是甘露糖等還原性糖在堿性條件下與DNS反應,將DNS中的硝基還原成氨基,使吸收波長變長,最大吸收波長增至540 nm,在其他試劑濃度和反應條件一定的情況下,吸光度與還原糖的濃度成正比,據此可以定量測定還原糖的含量。具體步驟為:取樣稀釋一定倍數,配制一定濃度的胍膠溶液,置于不同溫度水浴和烘箱中穩定20 min,加入稀釋后的酶液0.1 mL,迅速混勻,保溫不同時間(10數180 min)后,分別取出2 mL 于含有2 mL DNS 溶液的25 mL 比色管中,一定溫度下加熱10 min后取出冷卻,加水定容至25 mL混勻,用分光光度計測定540 nm 處的吸光度。用相同的方法測定空白樣品的吸光度,樣品的吸光度扣除空白后,通過不同還原糖含量下吸光度標準工作曲線得到線性回歸方程,計算還原糖的含量,從而得到酶活大小及酶活保持時間。
(5)壓裂液表觀黏度的測定。配制不同配方的壓裂液樣品,裝入高溫高壓流變儀的密閉容器中,在實驗溫度、170 s-1的剪切速率下測定壓裂液表觀黏度。
(6)壓裂液殘渣降解性能。在壓裂液中加入APS 和生物酶,置于95℃水浴中2 h,將徹底破膠的破膠液移入已烘干恒量的離心管中,在3000±150 r/min 的轉速下離心30 min,然后緩慢傾倒上層清液,將離心管放入恒溫電熱干燥箱中烘烤,在105℃下烘干至質量恒定(m)。按式(1)計算壓裂液殘渣含量(η)。

其中,m—殘渣質量,mg;V0—壓裂液用量,mL。
濾餅的降解:收集壓裂液濾餅,加入不同濃度的β-苷露聚糖酶,在不同溫度不同時間下浸泡后觀察并測定體積。
2 結果與討論
2.1 破膠液平均分子量
80℃下,不同破膠條件下加熱0、3 h 后胍膠水解產物的平均分子量見表1。加入破膠劑后,胍膠平均分子量快速下降,且復合破膠所得破膠液的平均分子量小于化學破膠,得到的分子量更集中,說明復合破膠更徹底,專一性更強。

表1 不同破膠方式下胍膠水解產物的平均分子量*
2.2 破膠液低聚物與單糖的識別
利用電噴霧離子化質譜(ESI-MS)半定量方法測定樣品中低聚糖的質荷比(m/z),對應質荷比的相對強度進行簡單的定量分析。將識別到的糖的質荷比峰高作為濃度的反映。為了減少不同樣品間的差異,將每個樣品的總峰高進行歸一化處理,獲得每個樣品中各糖的相對比例。酶作用胍膠溶液不同時間下各低聚糖的相對比例見表2。產物中單糖均較少,酶在40、80℃下均有二糖產生;80℃下隨時間增加,二糖、三糖呈增加趨勢,五糖、六糖、七糖、八糖呈降低趨勢,四糖變化較小,九糖、十糖量少。單糖、二糖數十糖的低聚糖分子質荷比(m/z)主要為:203.1、365.1、527.2、689.3、851.4、1013.5、1175.6、1337.7、1499.8、1661.9。由80℃下APS 處理12 h 后胍膠溶液的質譜圖(圖1)可見,破膠液未顯示低聚糖分子質荷比。說明APS 的破膠原理與生物酶不同。苷露聚糖酶為內切酶,通過內切作用大幅降低胍膠黏度和分子量,直接作用于糖苷鍵,主要產生二糖數六糖,單糖極少。而APS較易斷裂糖環上的C—C 鍵,氧化降解產物結構復雜目前無法解析。
2.3 酶活力
在不同溫度、不同pH值條件下,用DNS法測定兩種β-苷露聚糖水解酶(140、180)的酶活力,結果見圖 2數 5。由圖 2、圖 3 可知,酶 140 的活性在 40數80℃隨溫度升高迅速增加,80℃后迅速降低,最佳溫度為80℃,最適作用范圍為60數85℃;耐溫90℃,在90℃下活性保持時間為60 min。由圖4、圖5 可知,酶180 的最適宜溫度為70℃,在120℃下的活性能保持50 min 以上,90℃下的活性能保持180 min 以上;堿性條件下,適宜的pH 范圍為8數10.5,最適pH值為9.0。因此,選擇β-苷露聚糖水解酶180作為壓裂用生物酶。由于現場作業環境較差,易產生有機副產物,選擇天冬氨酸和谷氨酸作為保護劑。兩種氨基酸一方面可以調節壓裂液pH 值,為酶提供適宜且較穩定的溶液pH 值緩沖環境;另一方面酶催化中心主要由天冬氨酸和谷氨酸殘基構成,對酶催化中心起到保護作用,且天冬氨酸對后續的注入水具有阻垢作用。

表2 酶作用不同時間下各低聚糖的相對比例

圖1 80℃APS處理12 h后胍膠溶液的質譜圖

圖2 酶140的相對酶活隨溫度的變化

圖3 酶140在不同溫度下的相對酶活隨時間的變化
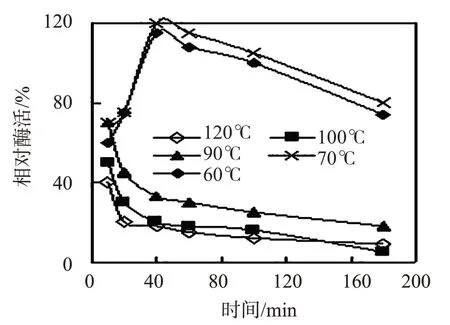
圖4 酶180的相對酶活隨時間和溫度的變化

圖5 70℃下pH值對酶180相對酶活的影響
2.4 生物酶壓裂液配方
由圖6數8可見,壓裂液配方中,隨著酶加量的增加,壓裂液的流變性能逐漸降低。酶具有快速降低壓裂液黏度的功能,因此,確定泵注過程中酶的加量是保證壓裂施工成功的關鍵。
由于壓裂液的注入過程是一個降溫過程,當儲層溫度為120℃時,將前置液、攜砂液階段儲層假設為120、90、80、65℃,通過流變實驗,優化每個階段酶的用量。由圖6數 9 可見,當溫度為120、90、80、65℃時,適宜的酶加量分別為 5、10、20、40 mg/L。因此,根據不同溫度下不同濃度生物酶對壓裂液黏度和復合破膠實驗(表3)的影響,綜合得到90數120℃雙元破膠壓裂液配方及每個階段加入破膠劑(生物酶和膠囊破膠劑)的量。90數120℃壓裂液配方為:0.3%數0.4% HPG+0.12% Na2CO3+0.1%殺菌劑+0.25%數0.4%調理劑+0.8%交聯劑+0.025%檸檬酸+5數40 mg/L高溫生物酶(β-苷露聚糖酶180)+30數100 mg/L 膠囊破膠劑;90℃儲層破膠劑加量為:前置液階段:10 mg/L酶+30 mg/L膠囊破膠劑,攜砂液階段:20數 60 mg/L 酶+50數 100 mg/L 膠囊破膠劑,頂替階段:200 mg/L酶+0.1%過硫酸銨。施工過程中,需要根據具體的井況、現場施工條件調整破膠劑的加入速度。
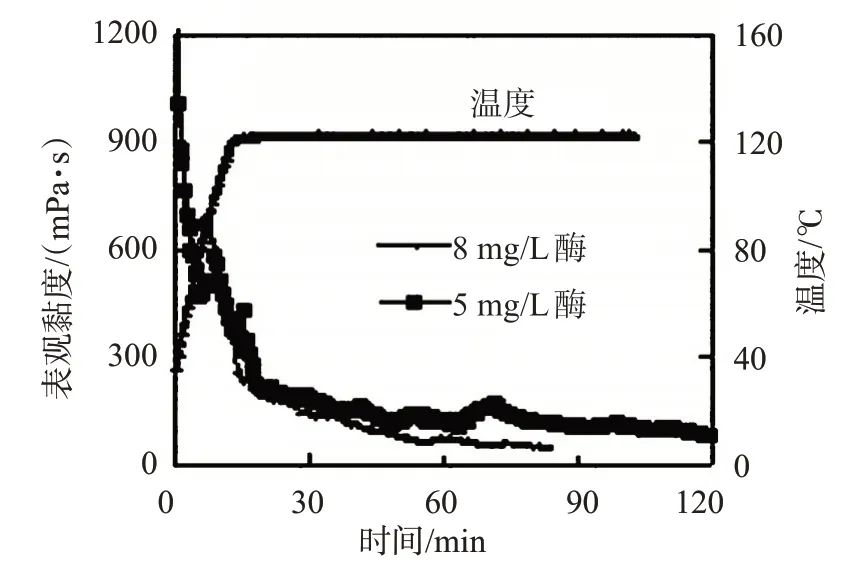
圖6 前置液1生物酶用量優化

圖7 前置液2生物酶用量優化
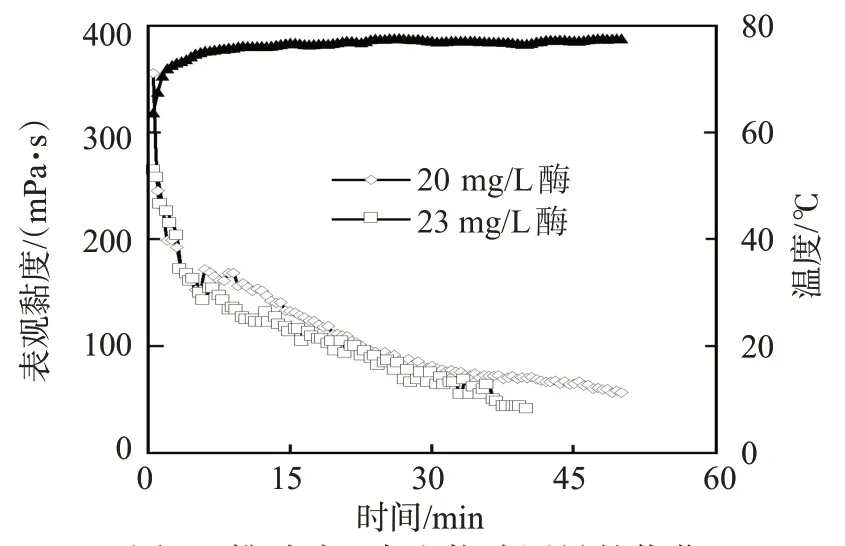
圖8 攜砂液1中生物酶用量的優化

圖9 含40 mg/L酶攜砂液2的黏度變化
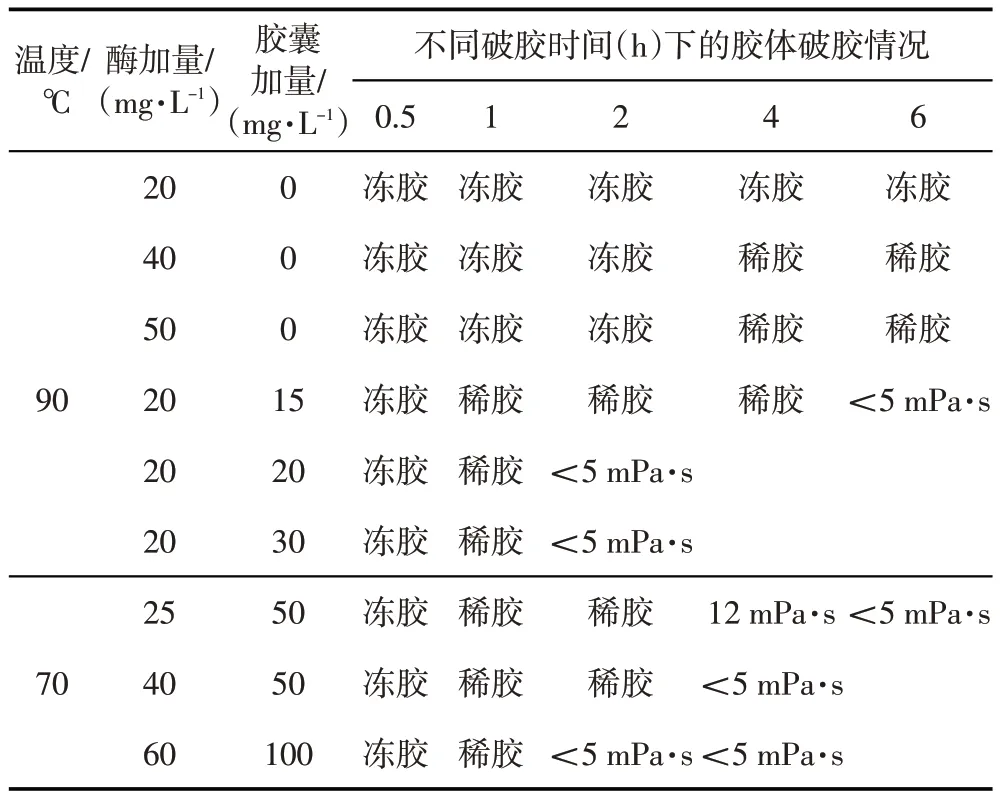
表3 不同溫度不同破膠劑加量下的膠體破膠情況
2.5 酶對壓裂液殘渣降解性能的影響
由表4、表5可知,β-苷露聚糖酶加量為0.1%時,老化2 h 可降解40%以上的濾餅,且濾餅粒徑中值由60數90μm降至9數15μm,粒徑明顯變小;伴注生物酶可降低殘渣含量22%數45%。

表4 β-苷露聚糖酶對濾餅的降解實驗

表5 不同破膠劑用量下的殘渣含量
2.6 現場應用
2.6.1 施工工藝
(1)伴注工藝:由于生物酶原液濃度高,活性強,在低溫條件下活性也較強,因此采用專門的加料器控制流速。根據酶破膠劑加量、施工排量、加入裝置的流量極限,當施工排量為4 m3/min時,確定酶的質量分數為8%,前置液按0數1 L/min加入,中低砂比按1數1.2 L/min加入,高砂比按2.5 L/min加入,頂替液按10.0 L/min 加入。可根據具體的井況和現場液體交聯情況等調整生物酶的注入速度。
(2)尾追工藝:頂替后關井,具體關井時間根據地層壓力擴散情況而定(高66x1 斷塊為40數60 min)。待裂縫完全閉合,壓力降至該區塊的閉合應力,重新啟泵,低排量擠注0.1%高溫生物酶溶液,避免裂縫重新張開,施工排量0.8數1.2 m3/min。一方面快速將壓裂液徹底破膠和降低濾液分子量;另一方面降解裂縫壁面濾餅,盡量使酶溶液接觸遠端的壓裂液濾餅,減少胍膠濾餅的面積。生物酶注入量為裂縫體積的1.2數1.5 倍。施工完畢后,關井2 h后放噴。
2.6.2 施工參數及效果分析
該技術在高尚堡深層水井壓裂增注現場應用9井次,施工井段為3200數3770 m,儲層溫度為90數120℃。由表6數據可見,通過生物酶與氧化還原復合破膠及壓后高濃度生物酶降低濾餅等措施綜合降低壓裂液殘渣傷害,在注水井壓裂增注應用中取得了良好的效果。伴注生物酶過程中,施工壓力平穩,液體攜砂能力強,最高砂比40%,平均砂比18%,4口井已開井,初期注水壓力平均下降約13 MPa,平均單井累計增注1.2×104m3,有效期290 d。

表6 壓裂施工參數及效果
3 結論
從海棲熱袍嗜熱菌中提取的β-苷露聚糖酶基因片斷,耐溫120℃、耐受pH值4數10.5。該酶最適宜溫度為70℃,pH 值為6數7,在120℃下的活性可保持50 min,90℃下的活性可保持180 min。與APS破膠原理不同,苷露聚糖酶為內切酶,通過內切作用降低胍膠黏度與分子量,直接作用于糖苷鍵,主要產生二數六低聚糖,單糖極少;而APS 較易斷裂糖環上的C—C鍵。在壓裂液中同時加入APS和生物酶破膠,可降低殘渣含量22%數45%。用胍膠、生物酶和膠囊破膠劑及其他添加劑配制壓裂液,根據現場施工條件選擇酶破膠劑的質量分數為8%,在水井壓裂增注現場應用9 井次,初期注水壓力平均下降約13 MPa,平均單井累計增注1.2×104m3,有效期290 d。

