苦蕎GIS基因家族生物信息學分析
時小東,吳 琪,向達兵,萬 燕,趙 鋼*
(1.成都大學農業部雜糧加工重點實驗室, 四川 成都 610106; 2. 成都大學藥學與生物工程學院, 四川 成都 610106)
【研究意義】苦蕎(Fagopyrumtataricum)為蓼科蕎麥屬一年生植物,營養豐富,富含黃酮類化合物等營養物質,是一種藥食同源的雜糧作物[1-2]。此外,苦蕎品種多樣,抗逆性強,能夠適應干旱、低溫、紫外輻射、鋁脅迫等惡劣環境[3-5],在我國主要分布在四川、云南、貴州等干旱高海拔地區生長。表皮毛作為植物表面凸起,能夠增加植物表皮組織的厚度,形成一道天然屏障,保護植物抵御機械損傷、惡劣天氣、紫外輻射、病蟲害等脅迫[6-7]。具有腺體的表皮毛能夠分泌多種次生代謝產物,如生物堿、類黃酮、萜類等,這些物質不僅能夠產生經濟效益,還能夠起到驅逐昆蟲的生物防御和抵抗非生物脅迫的作用[8]。因此,對苦蕎表皮毛的形成及調控機理研究具有重要的理論意義和潛在的應用價值。【前人研究進展】表皮毛是一種覆蓋于植物表面的特化細胞,是表皮細胞向外延伸形成的表皮附屬結構[9]。植物表皮毛形態多樣,可分為多種類型,如單細胞和多細胞、腺毛和非腺毛,以及分枝和不分枝,如擬南芥的表皮毛為典型的單細胞、分枝和非腺毛結構[10]。植物表皮毛對細胞分化機制研究、脅迫防御和經濟效益具有重要意義。由于植物缺失表皮毛仍能正常生長,試驗操作簡單,表皮毛已經成為重要的細胞發育和分化機制研究的重要模型[6,11]。植物表皮毛發育相關基因的研究較多,尤其是在植物模式植物擬南芥。在擬南芥中GL1-GL3/EGL3-TTG1形成核心調控復合體,調控擬南芥單細胞表皮毛的發育[12]。同時,擬南芥表皮毛的形成、分枝和延伸等過程受到多種植物激素和轉錄因子的協同調控[13]。在擬南芥中已經挖掘得到多個轉錄因子對擬南芥單細胞表皮毛形成起著正調控的作用,如C2H2型鋅指蛋白基因GIS家族(如GIS、GIS3、ZFP6、ZFP8等)[14-15]。同時,研究表明擬南芥表皮毛發育相關的GIS基因能夠引起煙草多細胞表皮毛的增加,并促進腺毛代謝產物的生成[16]。Shi等研究也表明鋅指蛋白基因JcZFP8(GIS家族基因)能夠促進煙草多細胞表皮毛的形成[17]。在多細胞表皮毛植物番茄中,C2H2鋅指蛋白基因能夠調控番茄和煙草表皮毛的形成[18]。上述結果表明,GIS家族基因在不同類型表皮毛形成中均發揮這重要的作用,可能是所有植物表皮毛發育的關鍵保守基因。但已有的GIS家族基因調控表皮毛發育機制研究僅集中在擬南芥、番茄和煙草等少數植物,在其他植物中研究調控機制還不清楚。慕勤國對苦蕎營養器官進行解剖學研究表明,苦蕎葉柄有明顯表皮毛,且葉片上下表皮細胞均有腺毛的表皮毛[19]。游亞麗等對金蕎麥和蕎麥形態結構研究也表明其莖葉等部位均具有表皮毛,對其干旱適應性起到促進作用[20]。【本研究切入點】苦蕎表皮毛發育的調控機理研究還不深入。因而,開展苦蕎表皮毛發育機制研究對于深入分析其抗逆性和高含量活性成分等具有重要意義。【擬解決的關鍵問題】本研究根據苦蕎基因組數據,對GIS家族基因進行挖掘,并采用生物信息學方法對其理化性質、染色體定位、保守結構域,以及逆境下表達情況等進行分析,為苦蕎基因組數據的深入挖掘及皮毛發育機理研究奠定了基礎。
1 材料與方法
1.1 數據材料來源
通過NCBI(https://www.ncbi.nlm.nih.gov/)下載苦蕎基因組數據和結構文件;擬南芥GIS家族基因序列下載于TAIR(https://www.arabidopsis.org/)。
1.2 苦蕎基因組中GIS家族基因序列獲得及分析
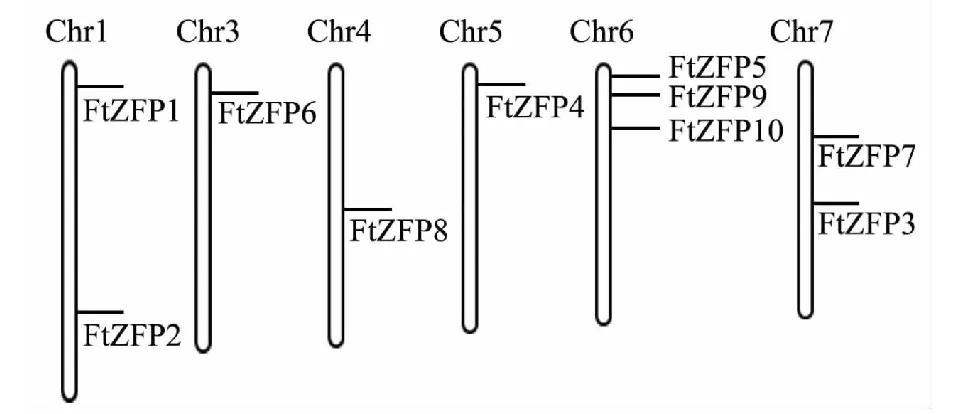
以提取的擬南芥GIS家族基因的蛋白序列作為查詢序列信息,利用BLAST軟件對苦蕎全基因組數據進行同源搜索,篩選參數為E-value 使用ExPaSy(https://web.expasy.org/protparam/)對篩選序列進行氨基酸數目、分子量、理論等電點等信息進行預測;使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/)對α螺旋、延伸鏈和β轉角等二級結構進行預測。利用ProtComp(http://linux1.softberry.com/berry.phtml?group=programs & subgroup=proloc & topic=protcompan)和SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)進行亞細胞定位和信號肽分析。參數設置為默認值。利用SWISS-MODEL進行蛋白三維結構分析,選擇最適三維結構模板。 使用ClustalX 2.1和MEGA 7.0進行系統進化樹構建,采用鄰接法(Neighbor-Joining,NJ),bootstrap值為1000。利用DNAMAN 5.0 對FtZFP蛋白序列進行多序列比對,用MEME(http://meme-suite.org/tools/meme)進行保守基序分析。 根據Wu等報道的苦蕎鹽脅迫的轉錄組數據[21]和Zhuang等報道的鋁脅迫的轉錄組數據[22],利用FPKM值,對挖掘得到的FtZFP基因的表達模式進行分析。 利用已報道的擬南芥中GIS家族基因的蛋白序列,BLAST對比結果顯示,從苦蕎基因組中對比得到了10個同源序列,分布于6條染色體上(圖1)。FtZFP分布涉及染色體1、3、4、5、6和7,染色體2和8上沒有分布。其中,定位于6號染色體上序列最多,為3條,且基因在染色體上的位置相對集中;其次是染色體7號,存在2條基因分布;其余染色體上分布數目各為1條,涉及染色體1、3、4和5。 圖1 苦蕎FtZFP基因染色體定位Fig.1 Chromosome mapping of F. tataricum FtZFP proteins 對10個FtZFP基因結構分析結果顯示,發現10條基因序列中8條僅含有1個外顯子,占總個數的80 %;FtZFP10含有外顯子數目最多,為5個;FtZFP8含有外顯子數目為2個(表1)。結果表明,苦蕎GIS家族基因結構具有高度相似性。 利用生物信息學軟件對得到的FtZFP序列的理化特性進行分析。由表1可知,10個FtZFP基因編碼氨基酸數目介于115~270,FtZFP3編碼氨基酸數目最少,FtZFP10編碼氨基酸數目最多;其中氨基酸數目大于200和小于200的蛋白數量各為5個,FtZFP氨基酸跨度相對較小。蛋白質分子量介于12 750.14~28 977.52 kDa,蛋白質分子量與氨基酸數目相一致。理論等電點分析表明,其中FtZFP3編碼蛋白的等電點最小,為5.77,表現為酸性;FtZFP5編碼蛋白的等電點最大,為9.22,表現為堿性。在堿性和堿性范圍內蛋白各為5個,說明苦蕎FtZFP編碼蛋白含有基本一致的堿性氨基酸和酸性氨基酸。 對FtZFP蛋白不穩定指數分析表明,10個蛋白的不穩定指數介于42.05~70.14,均大于40.0。從不穩定指數結果可知,苦蕎基因組中挖掘得到的FtZFP均表現為不穩定蛋白。對脂肪指數和疏水性進行分析,FtZFP蛋白脂肪指數介于35.07~71.91,均小于100。氨基酸的疏水性數值介于(-1.063)~(-0.456),均為負值,說明得到的苦蕎FtZFP均表現為疏水性。 蛋白質二級結構是衡量蛋白質穩定性的重要因素,α螺旋和β轉角結構具有高度穩定性,為蛋白質的有序結構;而無規則卷曲為蛋白質的無序結構。對10個苦蕎FtZFP編碼蛋白的二級結構進行預測分析結果表明,FtZFP蛋白二級結構主要以無規則卷曲為主,其次是α螺旋,β轉角二級結構最少(表2)。蛋白二級結構分析表明,苦蕎中GIS家族基因的蛋白二級結構整體表現為不穩定性,這一結果與蛋白不穩定指數預測結果相一致。 對蛋白序列進行信號肽分析,10個FtZFP蛋白未發現信號肽序列。對10個FtZFP蛋白進行亞細胞定位分析,10個基因編碼蛋白均定位于細胞核,符合作為轉錄因子的亞細胞定位特征,這為其發揮生物學功能奠定基礎。 利用MEME在線軟件對蛋白序列進行保守基序繪制,得到1個高度保守的結構域,該結構域含有40個氨基酸序列,存在C2H2結構域(圖2)。同時,該保守序列結構在10個FtZFP均有分布,有且僅有1個,表明苦蕎10個FtZFP均為單一C2H2鋅指結構。通過多序列對比發現,10個FtZFP蛋白都含有C-X2-C-X12-H-X3-H,即C2H2結構區域,這與MeMe分析結果相一致。8個FtZFP蛋白結構域中均含有QALGGH,該結構為植物所特有,此類鋅指蛋白稱為Q型。FtZFP1中第4為G變為D,FtZFP4中第3位L變為Y。前人研究表明,QALGGH結構與鋅指蛋白結合DNA能力相關,任何一個氨基酸的突變都會導致DNA能力的降低或失去,表明FtZFP1和FtZFP4可能在進化過程中發生突變而失去相應功能。 表1 苦蕎FtZFP外顯子數目和蛋白一級結構 表2 苦蕎FtZFP蛋白二級結構和亞細胞定位預測 FtZFP蛋白結構域中具有保守性的C2H2,中心位置Zn2+能夠與2個His和Cys結合形成緊密的空間結構維持整個蛋白的穩定性(圖2)。同時,FtZFP還含有QALGGH和其他保守氨基酸殘基,能夠更好地維持FtZFP的結構,從而與DNA分子進行結合而發揮功能。 為揭示苦蕎GIS家族基因成員之間的進化關系,基于氨基酸序列對10個FtZFP進行系統進化樹構建(圖3)。根據進化樹分枝情況,可以將苦蕎FtZFP蛋白成員分為2類家族,除FtZFP10單獨為1類,其他9個FtZFP聚類為1類家族。FtZFP10基因含有5個外顯子序列,其他9個FtZFP含有1-2個外顯子序列。第1類家族進一步分為3個亞家族,第I亞家族含有5個成員,數量最多;第II和III亞家族含有成員數量相同,均為2個成員。利用MEME對苦蕎FtZFP鋅指蛋白進行結構域分析和繪制圖譜,結果顯示所有基因家族成員都含有1個C2H2鋅指結構,多位于肽鏈的N端,在數量和分布上均具有一致性。 圖2 苦蕎FtZFP氨基酸序列對比和保守序列結構Fig.2 Amino acid alignments and conserved motif structure of F.tataricum FtZFP proteins 圖3 苦蕎FtZFP系統進化樹和C2H2結構分布Fig.3 The phylogenetic analysis and C2H2 motif distribution of F.tataricum FtZFP proteins 基于已報道苦蕎鹽脅迫和鋁脅迫的RNA-seq測序數據,篩選涉及FtZFP的FPKM值。結果表明,在苦蕎鹽脅迫中,FtZFP8表現為上調表達,而FtZFP3表現為下調表達;在苦蕎鋁脅迫下,FtZFP7表現為上調表達,推測與其生物學作用具有一定的關聯。 隨著高通量測序技術的發展,特別是三代測序技術的誕生,為植物全基因組數據的獲得提供了基礎。植物基因組測序工作的完成,為基因家族的挖掘和關鍵基因的深入分析提供了基礎。楊明磊等運用BLASTp對普通煙草(Nicotianatabacum)基因組數據中C2H2鋅指蛋白轉錄因子家族序列進行鑒定,最終獲得了118條序列[23]。Muthamilarasan等在谷子(Setariaitalica)基因組中鑒定得到124個C2H2鋅指蛋白基因,并對其非生物脅迫響應進行分析[24],表明基于基因組進行C2H2鋅指蛋白基因家族深入挖掘的可行性。2017年,Zhang等運用二代、三代測序平臺,并結合光學圖譜和Hi-C技術,完成了苦蕎基因組測序工作,獲得了489.3 Mb的高質量染色體水平的參考基因組,預測得到了33 366個基因[22]。苦蕎基因組測序工作的完成,為其功能基因的挖掘和途徑分析提供了基礎,有助于推動苦蕎成為抗逆研究的模式植物。本研究基于報道的苦蕎基因組數據,運用生物信息學手段,對苦蕎關鍵基因家族進行挖掘。 表皮毛與植物生物脅迫和非生物脅迫等密切相關,GIS家族基因在表皮毛發育調控中起著重要的作用。從苦蕎基因組數據中,挖掘得到了10條GIS家族基因序列。對10條FtZFP染色體定位分析發現,其分散定位于6條不同染色體上,這與其他C2H2基因家族成員染色體定位結果具有一致性[25],說明C2H2基因家族成員分布廣泛,并可能存在功能互補性。亞細胞定位預測,10個FtZFP蛋白均定位于細胞核,這與其他表皮毛相關的C2H2鋅指蛋白研究結果相同[26],符合其作為轉錄因子發揮調控功能的亞細胞定位特征。 在結構上,10個FtZFP均含有一個保守的C2H2結構域,這與擬南芥和番茄等植物中毛發育相關的C2H2鋅指蛋白家族基因相一致[14-18],表明在植物中參與表皮毛發育調控的鋅指蛋白基因均為單鋅指結構。在C2H2結構域中存在QALGGH基序,為植物鋅指蛋白所特有,對C2H2型鋅指蛋白轉錄因子結合到特定的DNA序列具有重要的作用[27],說明FtZFP蛋白家族可能通過與其他因子相互作用從而調控植物表皮毛的發育。 基于報道的苦蕎脅迫轉錄組數據,大部分FtZFP基因在鹽脅迫和鋁脅迫過程中表現為上調表達,說明FtZFP可能通過增加表皮毛的密度或形態,從而通過表皮毛物理防御或次生產物代謝形成增加苦蕎的抗性。目前,對擬南芥調控表皮毛發育相關基因的研究較多,在番茄、煙草、水稻、黃瓜等植物中已經開展了部分研究[28]。苦蕎作為高海拔作物,能夠抵抗干旱、低溫、紫外等惡劣環境,且富含黃酮類等次生代謝物質,其逆境適應性和高生物活性物質是否與苦蕎表皮毛有關仍有待進行深入研究。 從苦蕎全基因組中共鑒定得到了10條GIS家族基因序列,序列分析和保守結構域等分析結果表明,所有序列均含有保守的單一C2H2結構域。與其他植物一樣,多數苦蕎FtZFP含有植物C2H2鋅指蛋白特有的QALGGH基序。對苦蕎基因組中GIS家族基因進行挖掘將對苦蕎抗逆性研究和資源開發具有實際意義和應用價值。1.3 FtZFP序列的基本性質分析
1.4 FtZFP序列保守結構域和進化分析
1.5 逆境脅迫下FtZFP的表達分析
2 結果與分析
2.1 苦蕎基因組中GIS家族基因信息
2.2 FtZFP蛋白一級結構分析
2.3 FtZFP蛋白二級結構和亞細胞定位預測分析
2.4 FtZFP保守結構域分析


2.5 FtZFP系統進化樹分析


2.6 FtZFP脅迫下表達分析
3 討 論
4 結 論

