光裸方格星蟲生物擾動對沉積物氮磷物質釋放的影響
李俊偉, 胡瑞萍, 郭永堅, 陳素文, 朱長波,*, 頡曉勇, 張文文, 陳振國
光裸方格星蟲生物擾動對沉積物氮磷物質釋放的影響
李俊偉1, 胡瑞萍2, 郭永堅1, 陳素文1, 朱長波1,*, 頡曉勇1, 張文文1, 陳振國3
1. 中國水產科學研究院南海水產研究所, 廣東省漁業生態環境重點實驗室, 農業農村部南海漁業資源開發利用重點實驗室, 廣州 510300 2. 廣州市海威水產科技有限公司, 廣州 510300 3. 湛江市碧海灣水產科技有限公司, 湛江 524000
通過測定養殖箱內(24 cm×17 cm×16 cm))的沉積物管道數量和水體氮磷指標, 研究方格星蟲生物擾動對沉積物氮磷物質釋放和表層物質遷移的影響。養殖箱底部鋪設粗沙(3200 g, 有機質含量27.6 mg·g–1), 上層為細沙(2200 g, 有機質含量11.0 mg·g–1), 星蟲密度分別為0條·箱–1(T0))、1條·箱–1(T1))、2條·箱–1(T2))和4條·箱–1(T4)), 各組均設4個重復, 實驗時間為11 d。數據顯示: 1)方格星蟲組沉積物側面和底部的管道數量增加, 并且表層細沙向下遷移, 方格星蟲密度越大, 管道數量越多。實驗期間水體懸浮顆粒物無明顯變化(>0.05)), 且處理組之間亦無顯著差異(>0.05)), 表明方格星蟲擾動對表層沉積物的再懸浮作用無明顯影響。2)實驗前3天水體中的亞硝態氮、硝態氮、氨氮和總無機氮均無明顯增加, 而在第4天亞硝態氮、硝態氮、總無機氮表現增加趨勢, 并且星蟲密度越大含量越高(<0.05))。實驗期間, 各組活性磷含量呈現下降趨勢, 并且T0組平均含量低于其他三組。結果表明, 底層有機質含量高于表層時, 方格星蟲生物擾動可以促進底層含氮物質的釋放, 并且密度越大促氮釋放作用越明顯; 方格星蟲對沉積物含磷物質的釋放影響較小, 可能與其含量較低和轉化過程有關。
光裸方格星蟲; 生物擾動; 沉積物; 營養鹽釋放
0 前言
底棲動物的生物擾動行為(筑穴、爬行、避敵; 攝食、排泄、分泌和呼吸等)會對沉積物初級結構產生影響, 進而影響灘涂沉積物的理化性質與生物特征[1-6]。底棲動物的生物擾動可以改變有機質或污染物在沉積物中的垂直分布和粒徑分布[7], 其表層攝食和底部排泄行為也會加速表層有機質的遷移或封埋, 進而影響沉積物中氮磷物質釋放和轉化[8-9]。底棲動物對沉積物的搬運和混合作用也會加速間隙水與上覆水之間的營養物質遷移, 從而影響沉積物-水界面的營養鹽通量[10]。海參、蟹類、多毛類等動物由于棲息、攝食習性不同, 其生物擾動對灘涂有機質遷移的影響具有顯著區別, 多數海參底表攝食和排泄, 對有機物質水平遷移較明顯; 蟹類和多毛類為筑穴類動物, 頻繁活動加速有機物質向上或向下垂直遷移[8,11-13]。星蟲類動物依靠吻部伸展和收縮無選擇地攝食表層顆粒有機物質, 在洞穴內排泄積累, 表現出對有機物質較強的向下遷移作用[14]。
光裸方格星蟲()又稱方格星蟲、沙蟲, 是一種穴居底棲動物, 在灘涂中的筑穴深度可達50 cm[15-17]。方格星蟲廣泛分布于我國近海沿岸, 北至渤海灣、南至海南均有發現, 以廣東、廣西、福建和海南沿海資源較為豐富。方格星蟲攝食表層沉積物中的營養物質, 并在洞穴深處排泄, 實現表層沉積物質向底層的搬運和封埋[18]。一般認為星蟲類動物對表層沉積物及重金屬具有明顯的封埋和遷移效果, 在生態系統的地球化學過程中發揮著重要作用[19-20]。近年來, 隨著方格星蟲繁育技術的逐漸成熟, 每年在沿海灘涂投放上億條的幼苗進行增養殖, 該生產活動對灘涂沉積物的影響較為明顯。以往研究了方格星蟲生物擾動對混養系統沉積物及間隙水中營養物質的影響, 表明方格星蟲生物擾動在一定程度上可以促進沉積物表層的有機質向底層轉移[14]。方格星蟲對營養物質具有向下遷移和擾動釋放的雙重作用, 關于方格星蟲的擾動釋放能力的相關研究較少, 需要就其氮磷物質擾動釋放的影響機理需要進一步研究。
本研究通過在室內設置不同密度的方格星蟲生物擾動實驗, 研究方格星蟲生物擾動對于水體中氮、磷濃度變化的影響, 確定方格星蟲的生物擾動對沉積物底層氮磷物質釋放的效果, 為沿海灘涂科學增養殖方格星蟲提供理論依據。
1 材料與方法
1.1 實驗材料與實驗設計
方格星蟲對沉積物底層氮、磷物質的擾動實驗在塑料養殖箱(24 cm×17 cm×16 cm)中進行, 實驗時間共11 d。實驗共四個密度處理組, 分別為0條·箱–1(T0組)、1條·箱–1(T1組)、2條·箱–1(T2組)和4條·箱–1(T4組), 分別設置4個重復, 且對養殖箱隨機區組放置。養殖箱底層鋪設3200 g(厚度5 cm)的河沙(干重), 其有機質含量為27.6 mg·g–1; 上層鋪設2200 g(厚度3 cm)的細沙(過篩并混勻), 有機質含量為11.0 mg·g–1, 然后加入500目篩絹布過濾的海水3500 mL(深度15 cm), 待方格星蟲鉆入沙層后采集初始水樣。實驗用方格星蟲采自湛江遂溪, 養殖箱內方格星蟲的生物量分別為0 g·箱–1、7.80 g·箱–1、13.19 g·箱–1、21.38 g·箱–1(表1)。
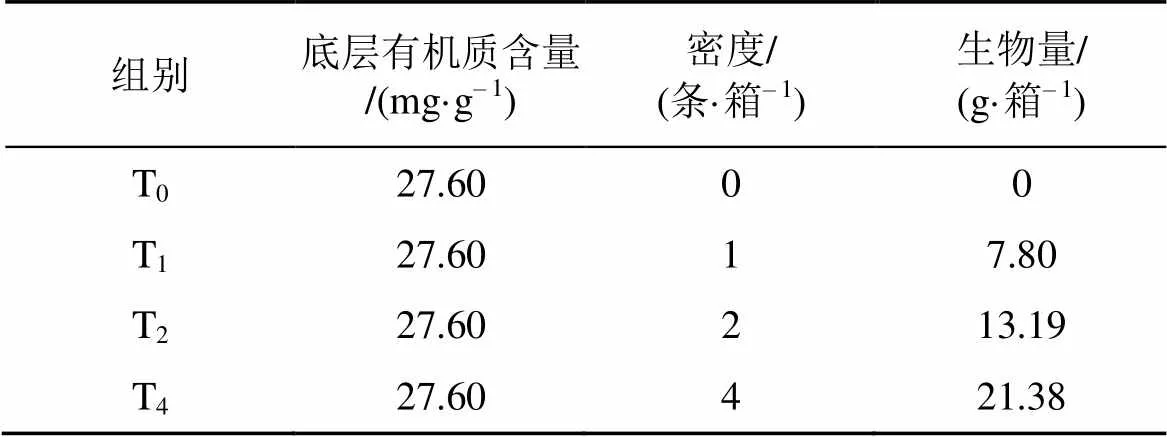
表1 方格星蟲生物擾動對底層沉積物氮磷物質釋放影響的實驗設計
1.2 日常管理
采用充氣石進行連續充氧, 溶解氧質量濃度高于6 mg ·L–1, 實驗期間不換水。水體的溫度、鹽度、pH 以及溶解氧采用YSI(556, YSI Incorporated, Yellow Springs, USA)進行現場測定。
1.3 樣品的收集及測定
第1—7天的采樣間隔為24 h, 最后一次采樣間隔為96 h。采用50 ml注射器取距離沙底2 cm處的水樣。每次采集水樣50 ml, 采用孔徑為0.45 μm的濾膜過濾后加入氯仿冷凍保存, 用于測定氨氮(NH4+—N)、硝態氮(NO3-—N)、亞硝氮(NO2-—N)和活性磷(SRP)含量。NH4+—N采用靛酚藍法測定, NO3—N采用鋅鎘還原法測定, NO2—N采用重氮—偶氮光度法測定, SRP采用磷鉬藍法測定[21]。在第1 d和第11 d分別采集中層水樣50 ml, 過濾后測定水樣中的懸浮顆粒物質含量。
1.4 數據分析
采用 SPSS 17.0進行數據統計和分析。不同處理組間的數據差異采用 One-way ANOVA 進行分析, 顯著度為<0.05。
2 結果
2.1 方格星蟲生物擾動對沉積物物理特征的影響
方格星蟲生物擾動明顯增加了沉積物側面和底部的管道網絡結構, 并且造成表層細沙物質的向下遷移(圖1)。實驗結束時, 養殖方格星蟲的沉積物中管道數量明顯增加, T4組沉積物側面的垂直管道平均數量為24個, 顯著高于T2(9個)與T1組(3個)(<0.05)。

圖1 實驗期間沉積物的物理結構變化
Figure 1 Physical structural change of the sediment during the experiment
2.2 方格星蟲生物擾動對沉積物再懸浮的影響
實驗結束時, 四個處理組水體中的懸浮顆粒物質含量與初期含量相近, 均無顯著差異(>0.05), 并且四個處理組之間的懸浮顆粒物質含量亦無顯著差異(>0.05), 表明方格星蟲生物擾動對于表層顆粒物質的再懸浮作用影響較小。
2.3 方格星蟲生物擾動對底層沉積物氮、磷釋放的影響
實驗期間第1—2 d, 各處理組水體中的亞硝態氮含量均無明顯增加, 第3—6 d T1、T2和T4組水體的亞硝態氮含量均表現出增加的趨勢, 并且隨著方格星蟲密度增加亞硝態氮含量顯著增加(<0.05); T0組水體中的亞硝態氮含量變化趨勢較小, 其含量變化范圍為0.014—0.042 mg·L–1, 平均值為0.03 mg·L–1, 顯著低于其它三組(0.11 mg·L–1、0.22 mg·L–1和0.37 mg·L–1) (<0.05)。
實驗期間第1—3d, 各處理組水體中的硝態氮含量均無明顯增加, 第4—11d, T1、T2和T4組水體中的硝態氮含量表現出明顯的增加趨勢, 而T0組水體中的硝態氮含量變化范圍為0.014—0.039 mg·L–1, 平均值為0.089 mg·L–1, 低于其它三組(0.34 mg·L–1、0.76 mg·L–1和1.62 mg·L–1)(<0.05)。在第4—11 d, T4組硝態氮含量顯著高于T0、T1組(<0.05), 且在第4、5、11 d顯著高于T2組(<0.05)。在第6、7、11 d時T2組顯著高于T0組, 在第7 d時顯著高于T1組(<0.05)。僅在第6 d時T1組顯著高于T0組(<0.05), 其它采樣時間硝態氮含量相近。
實驗期間, 各處理組的氨氮含量變化范圍較大, 無明顯的升高趨勢, 但在大部分采樣階段高密度處理組水體中的氨氮含量高于低密度組和對照組, 未達到顯著差異水平(>0.05), 只有T4組在第4 d顯著高于T0組(<0.05)。實驗期間, T0、T1、T2和T4組中的氨氮含量分別為0.48mg·L–1、0.59mg·L–1、0.58mg ·L–1和0.73mg·L–1。溶解態無機氮(DIN)含量的變化趨勢和亞硝態氮、硝態氮含量變化趨勢相近, 高密度組養殖水體中溶解態無機氮的含量均高于低密度組, 且在第4—11 d不同處理組之間出現了顯著差異(<0.05)。在第3—11 d, T4組均顯著高于T0組(<0.05); 在第3、5—11 d, T2組顯著高于T0組(<0.05), 而T1組僅在第6、11 d顯著高于T0組(<0.05) (圖3)。
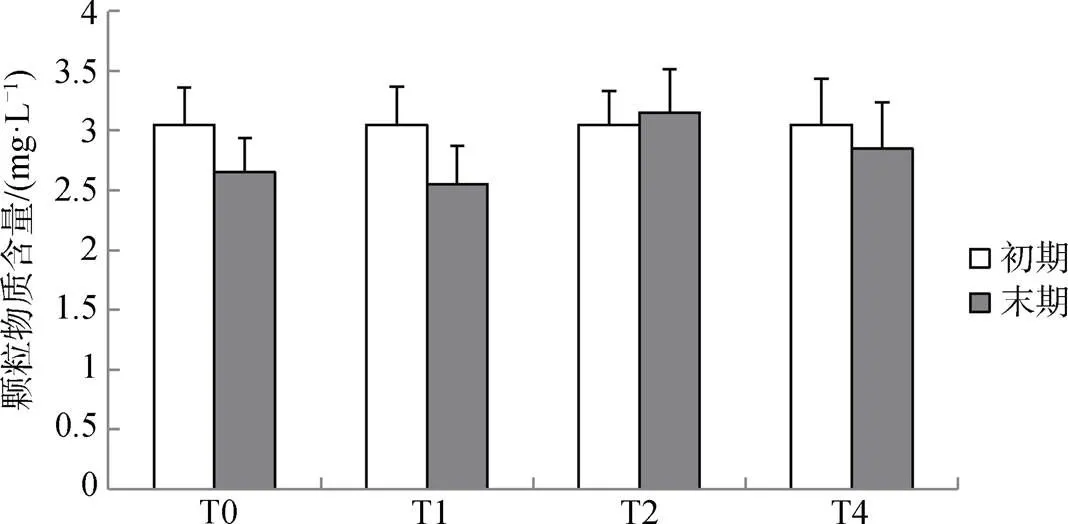
圖2 實驗期間水體內懸浮顆粒物質含量的影響
Figure 2 The particulate matter content in the water at the beginning and end of the experiment
實驗期間, 各處理組水體中活性磷含量具有相近的變化趨勢, T0組活性磷平均含量(0.035 mg·L–1)低于其它三組(0.048 mg·L–1、0.037 mg·L–1和0.046mg·L–1) (圖4)。實驗結果表明, 方格星蟲生物擾動可以促進底層沉積物含氮物質的釋放, 并且方格星蟲的養殖密度越大, 底層含氮物質的釋放越明顯。實驗期間, 養殖箱內未投入有機質, 因此方格星蟲的排泄、代謝等作用對水體中含氮物質量的影響較小,可知方格星蟲的鉆穴與擾動在含氮物質釋放過程中發揮較大作用。實驗期間, 方格星蟲對沉積物中含磷物質的釋放影響較小, 可能與活性磷物質的轉化和含量較低有關。
3 討論
底棲動物的擾動作用會對沉積物氮、磷的釋放造成顯著影響[22-25]。星蟲類和顫蚓等動物通過其管道網絡結構及擾動作用加速了沉積物間隙水與上覆水之間的物質流動[26]。本研究表明方格星蟲生物擾動可以增加沉積物管道網絡結構(圖1), 并且可以提高沉積物含水率, 這與其它生物擾動實驗的結果相近[25-28]。通過實驗結束與初始時養殖水體內顆粒物質含量的比較, 方格星蟲生物擾動對于表層沉積物的再懸浮作用不明顯, 這一結果與顫蚓、沙蠶生物擾動促進沉積物再懸浮的特征有所不同[25,29-31], 這可能與方格星蟲特殊的攝食方式和較弱的擾動程度有關系。方格星蟲攝食過程中通過伸縮吻部結構以攝取沉積物表層有機質, 無需將吻部伸出表面, 在沉積物表面形成明顯的花穴或漏斗穴[32], 因此, 方格星蟲生物擾動的程度較低是未造成表層顆粒物質再懸浮的主要原因。可以推測, 方格星蟲灘涂增養殖對于表層沉積物的顆粒再懸浮影響較小。
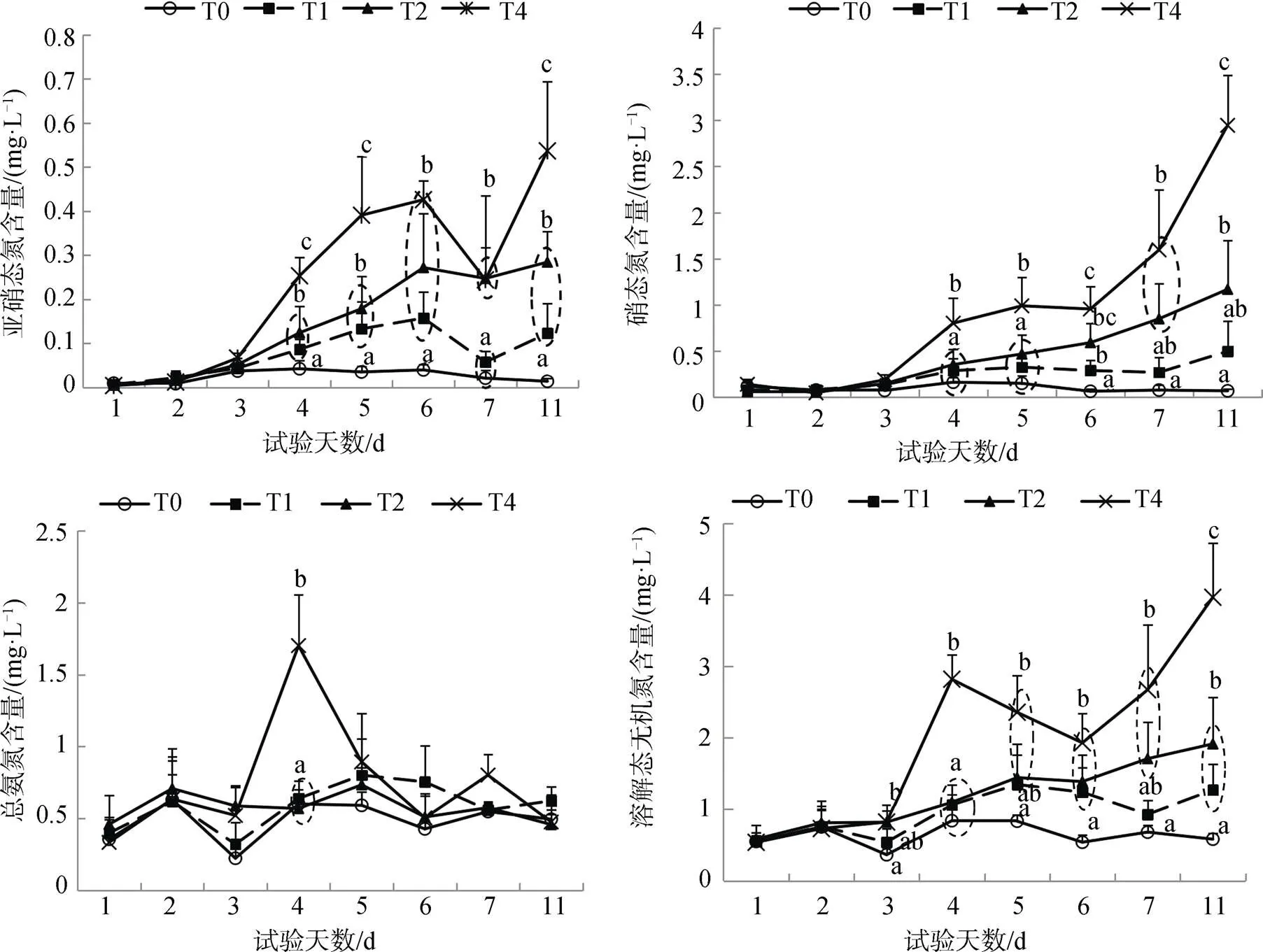
圖3 實驗水體中亞硝態氮、硝態氮、總氨氮、溶解態無機氮含量變化
Figure 3 NH4+—N, NO3—N, NO2—N, DIN content in the water column during the experiment
Mermillod-Blondin 等[23]研究表明, 顫蚓生物擾動對沉積物的氮釋放表現出促進作用, 這與顫蚓的遷移鉆行和在泥水界面的顫動有直接關系。顫蚓的生物密度越大, 沉積物中的總氮釋放越明顯[25]。本實驗方格星蟲對沉積物的氮釋放影響也表現出促進作用。實驗期間, 養殖水體中的亞硝態氮、硝態氮和總無機氮含量均隨著方格星蟲密度增加而顯著增加(<0.05), 并且低密度組與高密度組之間也具有顯著差異(<0.05)(圖3)。在實驗中, 方格星蟲的擾動作用表現為水體“氮源”的動力, 且生物密度越大, 對底層沉積物的擾動釋放作用越明顯。實驗水體中總無機氮的增加情況表明方格星蟲的密度越大, 其個體擾動強度會有所增加, 高密度組沉積物側面的垂直管道數量顯著高于低密度組也證實了方格星蟲生物擾動或筑穴行為會隨著密度增加而增強, 水體中無機氮增加的主要原因是管道增加了沉積物氮磷物質與外界水的交換面積。北部灣適養方格星蟲的灘涂面積約20萬畝, 方格星蟲擾動造成的無機氮、磷釋放會成為該海區氮磷循環的重要組成。本研究主要量化了底層沉積物有機質含量明顯高于表層, 且表層有機質含量較低情況下方格星蟲對底層無機氮磷的釋放作用。在方格星蟲灘涂增養殖區, 表層沉積物的有機質含量較高, 因此方格星蟲對于灘涂表層有機質的向下遷移和底層氮磷釋放的綜合作用仍需深入研究。
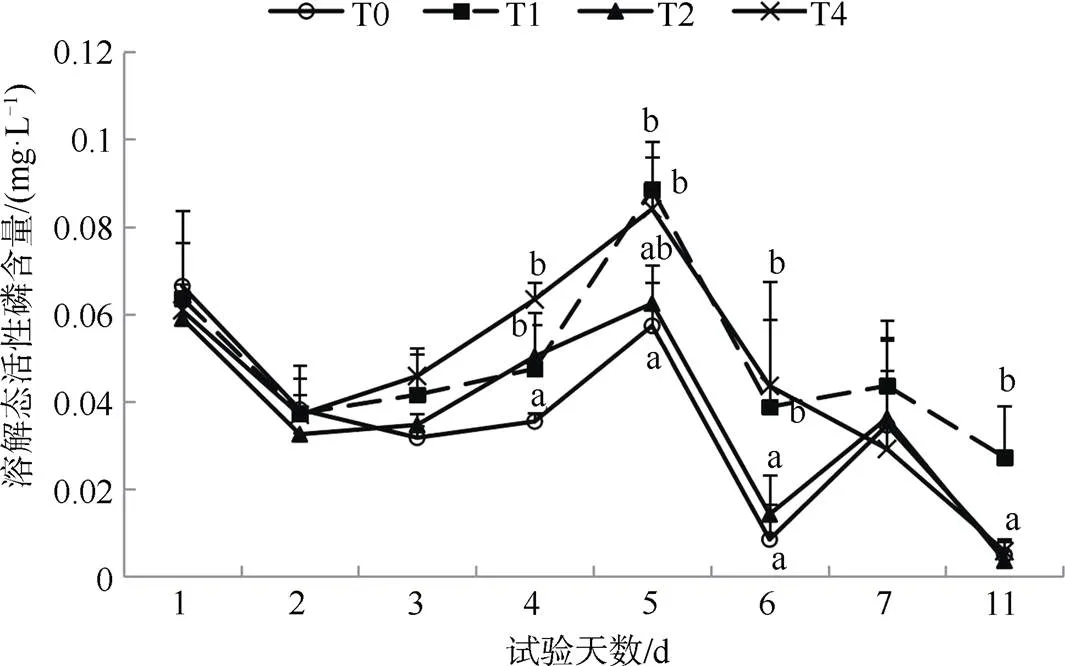
圖 4 實驗水體中活性磷含量變化
Figure 4 SRP content in the water column during the experiment
以往研究表明, 顫蚓擾動可以顯著影響間隙水中的磷濃度, 造成活性磷含量增加[23], 其擾動行為又會加快底層磷遷移到表層并釋放到水體中[24,33], 也有研究表明刺參生物擾動會促進有機磷的降解和礦化, 有助于部分磷向鐵/鋁結合態磷(NaOH-P)轉變, 可以增強沉積物對磷的吸附能力, 減少水體富營養化的風險[5]。本研究發現方格星蟲擾動對于沉積物中磷釋放無明顯促進作用, 而且各處理組活性磷含量在實驗后期表現出降低趨勢。本研究在室內開展擾動試驗, 仍具有一定光照強度, 未進行完全黑暗試驗可能是少量硅藻生長造成磷降低的因素之一。方格星蟲生物擾動對沉積物中磷等其它元素的形態轉化影響仍需進一步研究。
4 結論
方格星蟲生物擾動對沉積物的管道網絡結構影響顯著, 明顯增加沉積物管道數量, 在底層有機質含量高于表層時, 其擾動作用表現為水體“氮源”的動力。方格星蟲密度越大, 對底層沉積物氮的擾動釋放作用越明顯。實驗水體中總無機氮的增加情況表明密度越大, 方格星蟲的個體擾動強度會有所增加, 可能是由于食物或空間等競爭而導致攝食頻率和強度增加。
[1] 于子山, 王詩紅, 張志南, 等. 紫彩血蛤的生物擾動對沉積物顆粒垂直分布的影響[J].青島海洋大學學報, 1999, 29(2): 279–282.
[2] KRISTENSEN E. Impact of polychaetes (spp. andmarina)on carbon biogeochemistry in coastal marine sediments[J]. Geochemical Transactions, 2001, 2(1): 1–12.
[3] 杜永芬, 張志南. 菲律賓蛤仔的生物擾動對沉積物顆粒垂直分布的影響[J].中國海洋大學學報, 2004, 34(6): 988–992.
[4] 宋進喜, 任朝亮, 李夢潔, 等. 河流潛流帶顫蚓生物擾動對沉積物滲透性的影響研究[J]. 環境科學學報, 2014, 34 (8): 2062–2069.
[5] 侯詒然, 高勤峰, 董雙林, 等. 不同規格刺參的生物擾動作用對沉積物中磷賦存形態及吸附特性的影響[J]. 中國海洋大學學報, 2017, 47 (9): 36–45.
[6] 張雷, 古小治, 邵世光, 等. 河蜆擾動對湖泊沉積物性質及磷遷移的影響[J].環境科學, 2011, 32(1): 88–95.
[7] 孫思志, 鄭忠明. 大型底棲動物的生物干擾對沉積環境影響的研究進展. 浙江農業學報, 2010, 22 (2): 263–268.
[8] FANJUL E, ESCAPA M, MONTEMAYOR D, et al. Effect of crab bioturbation on organic matter processing in South West Atlantic intertidal sediments[J]. Journal of Sea Research, 2015, 95: 206–216.
[9] HULTH S, ALLER R C, CANFIELD D E, et al. Nitrogen removal in marine environments: Recent findings and future research challenges[J]. Marine Chemistry, 2005, 94(1–4):125–145.
[10] WIDDOW J, BRINSLEY M D, BOWLEY N, et al. A benthic annular flume for in situ measurement of suspension feeding/biodeposition rates and erosion potential of intertidal cohesive sediments[J]. Estuarine Coastal & Shelf Science, 1998, 46(1): 27–28.
[11] AHIGREN M O. Consumption and assimilation of salmon net pen fouling debris by the red sea cucumber: implications for polyculture[J]. Journal of the World Aquaculture Society, 1998, 29(2): 133–139.
[12] PALMER P J. Polychaete–assisted sand filters[J]. Aquaculture, 2010, 306(1): 369–377.
[13] LUPPI T, BAS C, CASARIEGO A M, et al. The influence of habitat, season and tidal regime in the activity of the intertidal crab[J]. Helgoland Marine Research, 2013, 67(1): 1–15.
[14] 李俊偉, 朱長波, 郭永堅, 等. 光裸方格星蟲生物擾動對混養系統沉積物及間隙水中營養物質的影響[J]. 漁業科學進展, 2015, 36(1): 103–110.
[15] 李鳳魯, 周紅. 中國沿海星蟲動物門名錄[J]. 青島海洋大學學報, 1992, 22(2): 72–88.
[16] 張琴, 許明珠, 童潼, 等. 飼料糖脂比對方格星蟲稚蟲生長、體成分和消化酶活性的影響[J]. 動物營養學報, 2014, 26(1): 153–160.
[17] 李俊偉, 朱長波, 頡曉勇, 等. 方格星蟲的繁育、養殖及研究開發進展[J]. 南方水產科學, 2014, 10 (5): 94–98.
[18] 孫剛, 房巖. 底棲動物的生物擾動效應[M]. 科學出版社, 2013: 80–98.
[19] SHIELDS M A, KEDRA M A. Deep burrowing sipunculan of ecological and geochemical importance[J].Deep Sea Research Part I Oceanographic Research Papers, 2009, 56 (11): 2057–2064.
[20] WANG Fei, WANG Weixiong, HUANG Xiaoping. Spatial distribution of gut juice extractable Cu, Pb and Zn in sediments from the Pearl River Estuary, Southern China[J]. Marine Environmental Research, 2012, 77(6): 112–119.
[21] 雷衍之. 養殖水環境化學實驗[M]. 北京: 中國農業出版社, 2006: 80–85.
[22] 余婕, 劉敏, 侯立君, 等. 底棲穴居動物對潮灘N遷移轉化的影響[J].海洋環境科學, 2004, 23(2): 1–4.
[23] MERMILLOD B F, NOGARO G, VALLIER F, et al. Laboratory study highlights the key influence of stormwater sediment thickness and bioturbation by tubificid worms on dynamics of nutrients and pollutants in stormwater retention systems[J]. Chemosphere, 2008, 72(2): 213–223.
[24] 聶小保, 吳淑娟, 吳方同, 等. 顫蚓生物擾動對沉積物氮釋放的影響[J].環境科學學報, 2011, 31(1): 107–113.
[25] 鄭余琦, 鄭忠明, 秦文娟. 縊蟶生物擾動對養殖廢水處理系統中沉積物磷賦存形態垂直分布的影響. 海洋與湖沼, 2017, 48 (1): 161–170.
[26] ALLER R C. Transport and reactions in the bioirrigated zone[M]// BOUDREAU B P, JORGENSEN B B (Eds.), The Benthic Boundary Layer. Oxford University Press, Oxford, 2001, 269–301.
[27] KRISTENSEN E, LIEBEZEIT G, DITTMANN S, et al. Organic matter diagenesis at the oxic/anoxic interface in coastal marine sediments,with emphasis on the role of burrowing animals[J]. Hydrobiologia, 2000, 426(1): 1–24.
[28] LI Junwei, ZHU Changbo, GUO Yongjian, et al. Experi-mental study of bioturbation byin a polyculture system[J]. Aquaculture, 2015, 437(9): 175– 181.
[29] 高麗. 生物擾動對黃河口潮灘沉積物侵蝕性的試驗研究[D].青島: 中國海洋大學, 2008:28–52.
[30] 李俐俐, 武安泉, 覃雪波. 沙蠶生物擾動對河口沉積物中菲釋放的影響[J].環境科學學報, 2014, 34(9): 2355– 2361.
[31] 覃雪波, 孫紅文, 彭士濤, 等. 生物擾動對沉積物中污染物環境行為的影響研究進展[J].生態學報, 2014, 34(1): 59–69.
[32] LI Junwei, XIE Xiaoyong, ZHU Changbo, et al. Edible Peanut Worm in the Beibu Gulf: Resource,aquaculture, Ecological Impact and Counterplan[J]. Journal of ocean university of China, 2017, 16(5): 823–830.
[33] 呂敬, 鄭忠明, 陸開宏, 等. 銅銹環棱螺生物擾動對“藍藻水華”水體底泥及其間隙水中碳、氮、磷含量的影響. 生態科學, 2010, 29 (6): 538–542.
Effects of the bioturbation activity ofon nitrogen and phosphorus release from sediments
LI Junwei1, HU Ruiping2, GUO Yongjian1, CHEN Suwen1, ZHU Changbo1*, XIE Xiaoyong1, ZHANG Wenwen1, CHEN Zhenguo3
1. Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture of China, Guangdong Provincial key Laboratory of Fishery Ecological Environment, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China 2. Guangzhou Haiwei Aquatic Science and Technology Co., Ltd, Guangzhou 510300, China 3. Bihaiwan Aquatic Science and Technology Co., LTD, Zhanjiang, Guangdong 524000, China
The effects of bioturbation ofon the release of nitrogen and phosphorus from sediments and the migration of surface material were studied by measuring the sediment structure and the nitrogen and phosphorus contents of the water in the breeding tanks (24 cm×17 cm×16 cm). The bottom layer was composed of coarse sand (3200 g, organic matter 27.6 mg·g-1), and the top layer was composed of fine sand (2200 g, organic matter 11.0 mg·g-1).The densities ofwere 0 (T0), 1 (T1), 2 (T2), 4 (T4) individuals per tank with 4 replicates in each group, and the experiment lasted for 11 days. The data showed that: 1) The number of pipelines on the sides and bottom of the sediments ofgroup increased, and fine sand on the surface migrated downwards. With the increment of the density of, the number of pipelines increased. During the experiment, there was no significant change in the suspended particulates (>0.05), and there was no significant difference between the groups (>0.05), indicating that the bioturbation ofhad no significant effect on the suspension of surface sediments. 2) No significant increase in nitrite nitrogen, nitrate nitrogen, ammonia nitrogen, and total inorganic nitrogen was found in the first three days of the experiment. However, the nitrogen showed a certain increasing trend on the fourth day of the experiment. And the higher density of group ofhad higher nitrogen contents (<0.05). During the experiment, the content of active phosphorus in each group had a decreasing trend, and the average content in the T0group was lower than the other three groups. The results showed that the bioturbation ofcould promote the release of nitrogen from the bottom layer, and the effect of nitrogen releasing increased with density of. The release of phosphorus in sediment was less affected by, which might be related to the low content of phosphorus and slow transformation process.
; Bioturbation; Sediment; Nutrient release
10.14108/j.cnki.1008-8873.2019.05.002
S96
A
1008-8873(2019)05-008-07
2018-10-30;
2018-11-15
海南省自然科學基金(318MS117); 國家自然科學基金(41606137); 中國水產科學研究院中央級公益性科研院所基本科研業務費項目(2019ZY13); 廣東省漁業生態環境重點實驗室開放基金(LFE-2016-9); 湛江市科技計劃項目(2018A03004)
李俊偉(1982—), 男, 助理研究員, 博士, 從事養殖生態學研究, E-mail: lijunwei303@163.com
朱長波(1978—), 男, 副研究員, 養殖容量學研究, E-mail: changbo@scsfri.ac.cn
李俊偉, 胡瑞萍, 郭永堅, 等. 光裸方格星蟲生物擾動對沉積物氮磷物質釋放的影響[J]. 生態科學, 2019, 38(5): 8-14.
LI Junwei, HU Ruiping, GUO Yongjian, et al. Effects of the bioturbation activity ofon nitrogen and phosphorus release from sediments[J]. Ecological Science, 2019, 38(5): 8-14.

