中華絨螯蟹肝胰腺壞死綜合征病因及其肝胰腺菌群的初步研究
朱志楊,沈 輝,萬夕和,任 乾,蔣 葛,范賢平,喬 毅,甄曉然,3
(1.南京師范大學海洋科學與工程學院,南京 210023;2.江蘇省海洋水產研究所,江蘇南通 226007;3.上海海洋大學水產與生命學院,上海 201306)
中華絨螯蟹(Eriocheirsinensis)又稱河蟹,是我國重要的水產養殖經濟品種。隨著養殖規模的不斷擴大,河蟹發生的病害問題日漸凸顯,其中顫抖病、腹水病和細菌性爛鰓病等疾病對河蟹養殖業造成了巨大的經濟損失。2015年,一種新型病癥-肝胰腺壞死綜合征(hepatopancreatic necrosis syndrome,HPNS)被首次報道[1],該病發病區域由江蘇北部逐漸蔓延至江蘇南部、安徽、湖北等地[2],一般發生在成蟹的第2、3、4次蛻殼期,病蟹肝胰腺呈灰白色[3],發病劇烈時肝胰腺壞死并伴有大量死亡,據不完全估計已造成經濟損失數億元[4],因此受到河蟹養殖業和學術界的廣泛關注。
目前,關于HPNS病因的研究報道主要集中在環境脅迫[1]、種質退化[5]、病毒感染及微孢子蟲感染等方面[4,6]。宋學宏[7]和朱健明等[8]研究認為水體中高pH脅迫和低氧脅迫引發河蟹肝胰腺白化,繼而在細菌的繼發感染下惡化形成HPNS;楊宗英等[1,9]研究并驗證了水質毒害因子脅迫引發河蟹HPNS早期的肝胰腺白化;楊先樂[10]研究認為苗種質量下降是引發HPNS的根本原因;崔龍波等[6]研究認為病毒、微孢子蟲以及細菌等多種病原微生物引發HPNS;Ding等[4]研究發現微孢子蟲可引發HPNS早期等肝胰腺白化現象。然而引起HPNS的病因尚未明確,已有研究發現,白斑綜合征病毒(White spot syndrome virus,WSSV)、傳染性皮下及造血組織壞死病毒(Infectious hypodermal & haematopoietic necrosis virus,IHHNV)的感染可改變甲殼動物肝胰腺、消化道等器官的微生物群落結構,影響其生理功能,并對組織和細胞的形態結構產生損傷,甚至引發河蟹肝胰腺白化[11-14]。與HPNS在發病初期出現不同程度的肝胰腺白化現象較為一致[1]。
本研究的前期工作中,對不同規格的河蟹進行了病原篩查,發現樣品中檢出較高比例的河蟹個體攜帶WSSV、IHHNV或同時攜帶IHHNV-WSSV,部分個體還具有HPNS癥狀(尚未發表)。在本研究中,利用變性梯度凝膠電泳(DGGE)技術對健康蟹、肝胰腺壞死綜合征病蟹、WSSV感染蟹、IHHNV感染蟹以及IHHNV-WSSV共感染蟹的肝胰腺菌群結構進行研究,探索其肝胰腺菌群相似性,以期初步探究河蟹肝胰腺菌群結構與河蟹HPNS的關系,病原感染與HPNS的關聯,從而揭示病原感染、肝胰腺菌群結構變化以及HPNS之間的相互關系,為今后河蟹HPNS的進一步研究、診斷和防治提供參考依據。
1 材料與方法
1.1 材料
河蟹樣品于2017年7月采自江蘇省泰州市興化某養殖場,其中健康蟹7只,WSSV感染蟹7只、IHHNV感染蟹5只,IHHNV-WSSV共感染蟹9只,肝胰腺壞死綜合征病蟹2只,樣品基本情況詳見表1。所有樣品均采于同一養殖池塘。樣品低溫冷藏,快速運至實驗室后,對肝胰腺進行無菌取樣,根據體表觀察和解剖學觀察結果判定健康狀況,其中“Healthy”表示健康蟹,“W”表示WSSV感染蟹;“I”表示IHHNV感染蟹;“DWI”表示IHHNV-WSSV共感染蟹 ;“HPNS”表示肝胰腺壞死綜合征病蟹。

表1 樣品基本情況表Tab.1 Basic information of sample crabs
1.2 方法
1.2.1 病原篩查
1.2.1.1 DNA提取
取100 mg肝胰腺組織樣品充分研磨后,按照上海博彩生物科技有限公司3S DNA Isolation Kit V2.2試劑盒的操作步驟提取基因組DNA,-20 ℃保存。Healthy組、W組、I組、DWI組中各隨機選取3份DNA,與HPNS組的2份DNA,進行后續的PCR-DGGE基因指紋圖譜構建與分析。
1.2.1.2 病原PCR檢測
以DNA為模板,通過聚合酶鏈式反應(PCR),對WSSV、IHHNV和中華絨螯蟹螺原體(Spiroplasmaeriocheiris)等常規病原進行篩查,參考檢測方法、引物及擴增條件詳見表2。

表2 病原檢測的引物序列Tab.2 Primers used in the pathogen detection
1.2.2 16S rDNA的PCR-DGGE基因指紋圖譜構建與分析
1.2.2.1 16S rDNA片段的PCR擴增
根據病原檢測結果,以隨機挑取的Healthy組、W組、I組、DWI組中的各3份DNA和HPNS組的2份DNA為模板,PCR擴增16S rDNA片段,參考方法、引物及擴增條件詳見表2。PCR產物經1%瓊脂糖凝膠電泳檢測,電壓160 V,電泳時間45 min。
1.2.2.2 16S rDNA V3區片段的PCR擴增
以16S rDNA片段的PCR產物為模板,PCR擴增16S rDNA V3區片段,參考方法、引物及擴增條件詳見表3。
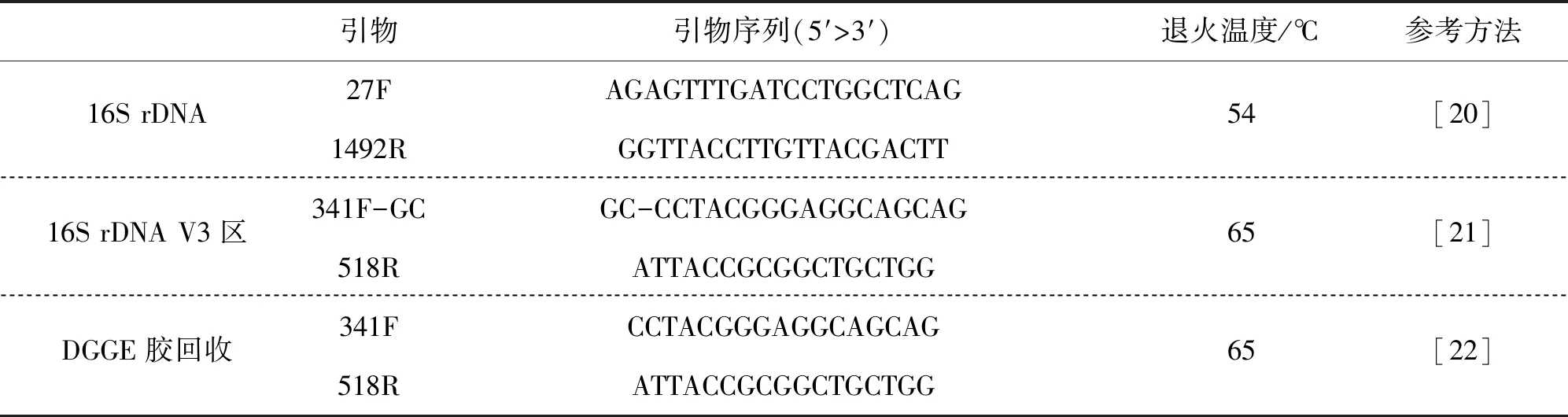
表3 16S rDNA V3區基因擴增的引物序列Tab.3 Primers used in the PCR of 16S rDNA V3 area
1.2.2.3 DGGE成像與分析
16S rDNA V3區的PCR產物經Bio.Rad電泳儀分析,DGGE的聚丙烯酰胺膠濃度為8%(w/v),變性梯度為40%~60%,DGGE電泳程序按文獻進行[22]。電泳結束后凝膠以SYBR? Gold Nucleic Acid Gel Stain染色,DGGE圖譜采用Quantity One軟件分析指紋圖譜,以非加權組算術平均法(Unweighted pair-group method with arithmetic means,UPMEGA)進行相似性聚類分析并構建系統進化樹。多樣性分析采用Shannon-Wiener指數H’,計算方法為:
H’=-∑(ni/N)lg(ni/N)
式中ni是第i條帶的光密度值,N是一個泳道所有條帶的光密度之和。在對所有條帶進行高斯建模的基礎上,以條帶光密度曲線下面積值作為物種的相對豐度。
1.2.2.4 DGGE條帶的序列分析
將DGGE凝膠進行DNA回收,于100 μL TE緩沖液中過夜保存;以上清液作為DNA模板進行PCR擴增,擴增引物及擴增條件詳見表3。純化后的PCR產物與pMD18-T載體連接,并轉化DH5α感受態細胞,每份樣品挑3份陽性克隆送至上海生工公司進行測序,測序結果在NCBI上進行比對,以其中同源性最高的序列確定為參照菌株,相似性≥97%的序列視為同一序列型。數據的處理和主成份分析采用Excel和SPSS軟件,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果與分析
2.1 不同患病河蟹的癥狀
不同組蟹的健康狀況以及病原檢測結果如表4和圖1所示, Healthy組蟹、W組蟹以及I組蟹的體質狀況、攝食情況以及肝胰腺外觀均正常,但病原檢測結果存在差異,Healthy組蟹未感染病原,W組和I組蟹分別出現WSSV感染、IHHNV感染;DWI組蟹雖未出現肝胰腺病變,但活力稍弱,病原檢測顯示IHHNV-WSSV共感染;HPNS組蟹的體質狀況減弱,停止攝食,解剖學觀察顯示肝胰腺白化,病原檢測顯示IHHNV-WSSV共感染。

表4 不同樣品蟹的健康狀況及病原測試結果Tab.4 Health status and pathogenic test results of different sample crabs
注:“-”表示未感染病原,“W+”表示感染WSSV病原,“I+”表示感染IHHNV病原。

圖1 不同組樣品蟹對比圖Fig.1 Comparison of different sample crabsa:Healthy組;b:W組;c:I組;d:DWI組;e:HPNS組
2.2 PCR-DGGE指紋圖譜與肝胰腺菌群差異
不同實驗組的肝胰腺菌群指紋圖譜如圖2所示,處于不同位置的條帶數為28條,各實驗組的DGGE條帶在數量、位置和條帶亮度上存在差異,I組條帶數最多(平均14條),Healthy組次之(平均13條),W組和DWI組再次之(平均11條),HPNS組最少(平均8條)。各實驗組間的條帶數量表現出除I組以外,W組、DWI組、HPNS組與Healthy組相比,肝胰腺菌群中條帶數量出現不同程度的降低。
各實驗組Shannon-Wiener指數計算結果顯示,Healthy組的肝胰腺菌群多樣性最高(為2.521 5),HPNS組最低(為1.96)。W組(多樣性指數為2.304 5)、I組(多樣性指數為2.266 6)、DWI組(多樣性指數為2.310 4)以及HPNS組與Healthy組相比,均出現肝胰腺菌群多樣性指數降低。

圖2 實驗組河蟹肝胰腺的DGGE指紋圖譜Fig.2 Bacterial DGGE profile of hepatopancreas from experimental crabs
UPMEGA相似性聚類結果如圖3所示。一支HPNS個體的肝胰腺菌群與一支DWI個體最先聚類(相似度0.83),再與HPNS另一個體聚類(相似度0.74),隨后依次與DWI組(相似度0.72)、I組(相似度0.69)、W組(相似度0.62)聚類,最后與Healthy組聚類(相似度0.56)。

圖3 實驗組河蟹肝胰腺菌群的UPMEGA相似性聚類分析Fig.3 UPMEGA cluster analysis of hepatopancreas microflora from experimental crabs
2.3 DGGE圖譜差異條帶測序結果分析
DNA條帶的測序結果顯示,28條DNA膠回收條帶屬于4個門21個菌屬,具體測序結果見表5。各實驗組在門水平上的肝胰腺菌群組成及其相對豐度如圖4所示。河蟹肝胰腺菌群主要分為四類,擬桿菌門(Bacteroidetes)、變形菌門(Proteobacteria)、放線菌門(Actinobacteria)和厚壁菌門(Firmicutes)。5個實驗組間在門水平上,菌群的相對豐度變化總體未顯示出差異性,與Healthy組相比,僅見Ⅰ組中變形菌門的相對豐度顯著增加;HPNS組中厚壁菌門的相對豐度顯著減少。
各實驗組在屬水平上的肝胰腺菌群組成及其相對豐度如圖5所示。除各實驗組均以沉積小桿菌屬(Sediminibacterium)為首要優勢菌屬外,Healthy組中的其它優勢菌屬依次為氣單胞菌屬、顆粒鏈球菌屬(Granulicatella)、慢生根瘤菌屬(Bradyrhizobium);W組中的其它優勢菌屬依次為慢生根瘤菌屬、氣單胞菌屬、紅球菌屬(Rhodococcus);I組中的其它優勢菌屬依次為慢生根瘤菌屬、氣單胞菌屬、顆粒鏈球菌屬;DWI組中的其它優勢菌屬依次為氣單胞菌屬、慢生根瘤菌屬、紅球菌屬;HPNS組中的其它優勢菌屬依次為氣單胞菌屬、紅球菌屬、希瓦氏菌屬(Shewanella)。
部分菌屬的相對豐度變化顯示(詳見圖5),慢生根瘤菌屬僅在HPNS組中未出現;鞘氨醇單胞菌屬(Sphingomonas)和鞘氨醇桿菌屬(Sphingobacterium)的相對豐度依次在Healthy組、W組、I組、DWI組、HPNS組中逐漸降低甚至消失(P>0.05);氣單胞菌屬在各實驗組中均存在,依次在Healthy組、W組、I組、DWI組、HPNS組中呈上升趨勢(P>0.05);假單胞菌屬的相對豐度依次在Healthy組、W組、DWI組、I組中呈上升趨勢(P>0.05);希瓦氏菌屬僅出現在HPNS組和DWI組中。

表5 DGGE代表條帶序列比對結果Tab.5 Result of sequence aligement of band in DGGE

圖4 不同實驗組在門水平上的相對豐度Fig.4 Comparision of relative abundance at the bacteria phylum levels among different experimental groups
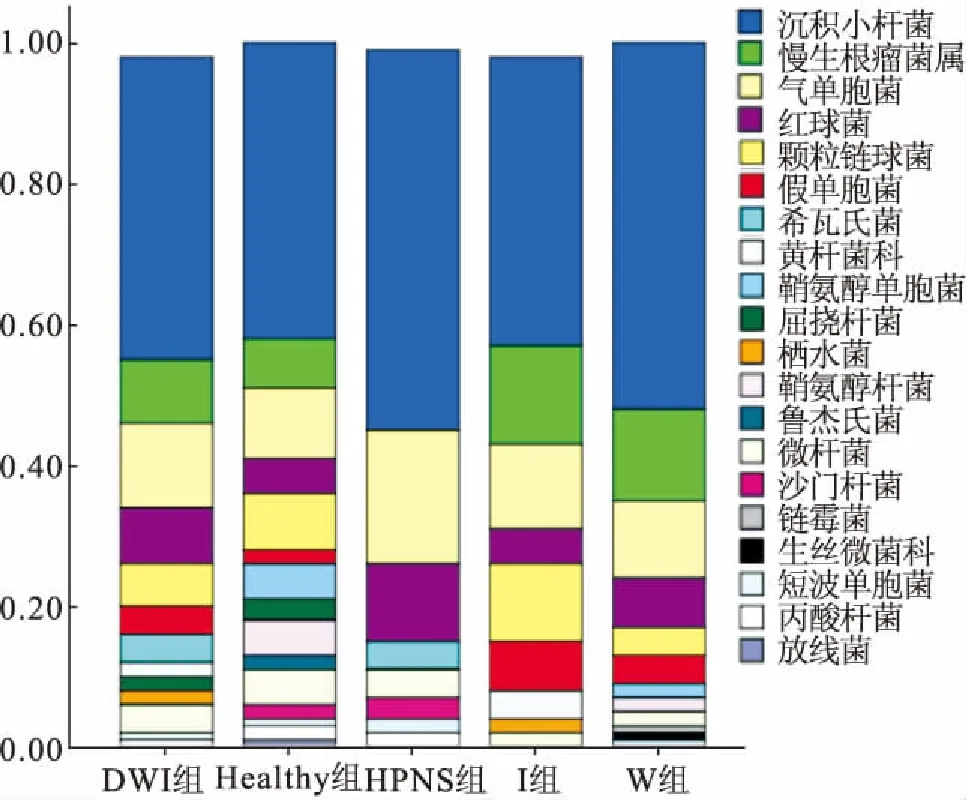
圖5 不同實驗組在屬水平上的相對豐度Fig.5 Comparision of relative abundance at the bacteria genus levels among different experimental groups
3 討論
本研究發現,HPNS組肝胰腺菌群的一支與DWI組中的一支最先聚類(相似度0.83),繼而HPNS組與DWI組聚類(相似度0.72),與Healthy組的肝胰腺菌群結構相似度最低(相似度0.56),表明HPNS病蟹的肝胰腺菌群結構與IHHNV-WSSV共感染蟹的肝胰腺菌群結構較為一致,而與Healthy蟹之間的肝胰腺菌群結構存在差異。因此,從微生物菌群結構相似性及菌群結構的變化結果來看,DWI組隨著時間的推移,可能會發展成為HPNS組,河蟹HPNS與WSSV-IHHNV共感染可能存在一定的關聯。
近年來,河蟹感染WSSV并出現批量死亡的報道日漸增多[6,23,24]。孫婷等[12]發現WSSV感染可引發河蟹肝胰腺白化,與河蟹HPNS在發病初期出現的肝胰腺白化現象較為一致[1],且相關報道發現,在HPNS病蟹體內檢出較高含量的WSSV[25]。本研究發現HPNS組的河蟹出現肝胰腺白化,并攜帶WSSV,與上述的研究結果較為一致,表明WSSV與HPNS的發生可能存在一定關聯。IHHNV的報道主要集中在對蝦的生理代謝和生長方面[14],當IHHNV-WSSV共感染時會加劇對蝦肝胰腺和肌肉組織的損傷[26]。目前,已有美青蟹(Callinectesarcuatus)、絨螯近方蟹(Hemigrapsuspenicillatus)、顆粒新厚蟹(Neohelicegranulate)感染攜帶IHHNV的報道,但未見明顯病理性變化[27,28]。IHHNV大規模感染河蟹的研究尚未見報道,但在本研究前期流行病學調查中,IHHNV在不同規格河蟹中均具有一定的陽性檢出率。蝦蟹混養模式下的克氏原鰲蝦(Procambarusclarkii)中IHHNV感染率很高[29],河蟹感染IHHNV有可能來自于宿主克氏原鰲蝦。由此初步推論,IHHNV-WSSV共感染與河蟹HPNS也許具有一定的相關性,其相關模擬實驗還需進一步開展和佐證。
目前,關于河蟹體內菌群的研究主要集中在腸道菌群上,研究發現河蟹腸道中優勢菌群為變形菌門、擬桿菌門、放線菌門、厚壁菌門和疣微菌門(Verrucomicrobia)[30,31]。而針對河蟹肝胰腺菌群的研究較少,Shen等[3]對健康蟹及肝胰腺壞死綜合征病蟹的肝胰腺微生物菌群進行研究發現,健康河蟹肝胰腺的優勢菌群為擬桿菌門、厚壁菌門、變形菌門、放線菌門;在HPNS發病過程中,病蟹肝胰腺菌群多樣性降低,優勢菌群結構發生變化,其中柔膜菌門(Tenericutes)和放線菌門的比例明顯增加,擬桿菌門細菌的數量急劇減少,導致病蟹肝胰腺中脂肪和纖維素代謝異常,營養物質吸收受到抑制。本研究同樣發現,與Healthy組相比,HPNS組肝胰腺菌群多樣性降低,放線菌門的比例顯著增加。表明病蟹肝胰腺菌群結構發生一定程度的改變,繼而影響其免疫、消化功能[32]。此外,本研究進一步發現,在屬水平上,HPNS組、W組、I組、DWI組與Healthy組相比,氣單胞菌屬、假單胞菌屬等致病菌屬的相對豐度增加,而鞘氨醇單胞菌屬、鞘氨醇桿菌屬等有益菌屬的相對豐度下降甚至消失,本研究結果不僅進一步從屬水平反映出HPNS病蟹的肝胰腺菌群發生變化,其正常生理功能下降,而且表明了病原感染可能與肝胰腺菌群中致病菌和有益菌豐度的變化存在一定的關聯。在相對豐度發生變化的致病菌屬中,氣單胞菌和假單胞菌產生的毒力因子可破壞宿主的凝血系統和免疫防御系統,造成廣泛的組織損傷[33-35]。Ding等[13]研究發現河蟹腸道菌群中氣單胞菌和假單胞菌的豐度在WSSV感染下顯著增加,崔龍波等[6]也研究發現HPNS病蟹肝胰腺中存在著病毒感染所特有的嗜酸性包涵體和大量以氣單胞菌為主的細菌。本研究結果與Ding等[13]和崔龍波等[6]的研究結果較為一致,表明病原感染可能引發肝胰腺中致病菌的增殖,繼而對肝胰腺產生損傷。在相對豐度發生變化的有益菌屬中,鞘氨醇單胞菌屬和鞘氨醇桿菌屬多數含有類胡蘿卜素類物質[36-39],具有較強的代謝能力和對貧營養環境的耐受力[40]。楊宗英等[1]研究發現類胡蘿卜素的大量消耗可能引發河蟹肝胰腺白化。因此,本研究結果初步表明病原感染可引發河蟹肝胰腺菌群中鞘氨醇單胞菌屬和鞘氨醇桿菌屬的減少,可能引發宿主肝胰腺中類胡蘿卜素含量降低,導致宿主的代謝能力和對貧營養環境的耐受力減弱,進而引發肝胰腺白化。
此外,本研究還發現,僅HPNS組未出現慢生根瘤菌,慢生根瘤菌主要來源于豆科植物[41],豆科植物是河蟹飼料的重要原料[42],慢生根瘤菌可能作為餌料形式短時間存在于河蟹體內。在HPNS組中未發現慢生根瘤菌,表明HPNS組蟹已經長時間未攝食,繼而檢測不到慢生根瘤菌,但在其余4組中,慢生根瘤菌為優勢菌,表明其余4組仍處于正常攝食狀態,這在本研究前期流行病學調查發現的HPNS組蟹停止攝食活動中得到證實。病蟹由于長期未攝食而處于饑餓狀態。有研究者在實驗室條件下,對河蟹進行饑餓實驗,實驗進行90 d后,河蟹肝胰腺指數明顯降低[43]。結合本研究結果,可初步推測在養殖條件下,由于IHHNV-WSSV共感染,導致肝胰腺正常的生理功能下降,繼而停止了攝食行為,從而逐漸發展形成HPNS。
本文結合肝胰腺菌群多樣性和聚類分析、病蟹生理學特征、IHHNV-WSSV共感染引發的河蟹肝胰腺菌群在屬水平上的變化以及菌屬變化可能產生的病理學影響,初步推論HPNS的發生可能與IHHNV-WSSV共感染存在一定的關聯, IHHNV-WSSV共感染可能引發肝胰腺正常的生理功能下降,繼而停止了攝食行為,從而逐漸發展形成HPNS初期的肝胰腺白化現象。

