甜菜夜蛾核多角體病毒VP39基因的克隆與生物信息學分析
李賽男,李 萌,趙海洲,姜玉霞
(肇慶學院 生命科學學院, 廣東 肇慶 526061)
桿狀病毒是一類特異性感染節肢動物的病源微生物,具有宿主特異性,每種病毒只限感染一種或少數幾種親緣關系較近的昆蟲,對人畜無害,已被認為是最安全的生物殺蟲劑之一[1-2]。此外,桿狀病毒還被用于在昆蟲細胞中表達外源重組蛋白[3]、基因治療[4]以及作為重組抗原表位的展示系統[5]。迄今為止,已從600多種昆蟲中分離出桿狀病毒,主要來自鱗翅目(如蝴蝶和蛾)、膜翅目(如蜻蜓)和雙翅目(如蚊子)[6]。桿狀病毒基因組DNA呈雙鏈閉合環狀,大小約為80~180 kbp,預測編碼89~183個ORF[7]。自苜蓿丫紋夜蛾核多角體病毒(Autographacalifornicamultiplenucleopolyhedrovirus,AcMNPV)全基因組[8]測序被完成以來,已有超過80株桿狀病毒基因組序列被測定。最新的桿狀病毒分類方法根據完成全基因組測序的桿狀病毒中的29個核心基因編碼的氨基酸序列,將桿狀病毒科分成4個屬,分別為Alphabaculovirus、Betabaculovirus、Gammabaculovirus和Deltabaculovirus[9]。根據對多角體蛋白基因的進化分析,Alphabaculovirus又可以進一步分為Group I和Group II NPV[10]。
甜菜夜蛾核多角體病毒(SpodopteraexiguaMNPV,SeMNPV)是Group II NPV的成員,其基因組全序列測定已經完成并已發表[11]。VP39是昆蟲桿狀病毒的核心基因之一,在感染的晚期表達,其編碼蛋白VP39疊環排列在核蛋白核心(nucleoprotein core)的周圍[12],是桿狀病毒核衣殼的最主要結構蛋白[13-15]。肌動蛋白(actin)在桿狀病毒入侵以及在細胞內復制過程中具有重要作用[16-19]。細胞中,actin以兩種形式存在,即單體(Globular actin,G-actin)和多聚體(Filamentous actin,F-actin)。研究發現,VP39與G-actin和F-actin都可以結合,但更傾向于結合G-actin[20]。在體外,純化的中國棉鈴蟲單粒包埋型核多角體病毒VP39蛋白能與G-actin以1∶5的比例結合,因此提出VP39蛋白在體外誘導G-actin形成F-actin索的模型:首先,VP39與G-actin以1∶1的分子比例結合形成核,然后這個核誘導其他4個G-actin聚集在它的周圍形成六聚體,接著許多六聚體互相結合形成微絲,最后微絲扭曲形成索狀結構[21]。但具體體內VP39結合G-actin所發揮的作用目前尚不明確。此外,有研究表明,AcMNPV VP39能與它本身以及其他病毒蛋白,如多角體蛋白、ODV-EC27、ODV-E56、IE1、38K和ODV-E66,以及宿主的kinesin-1具有相互作用[22-25],推測VP39參與了病毒入侵以及在宿主細胞內復制過程。
本文選取了國內外尚未進行研究的SeMNPV VP39(Sevp39)基因作為研究對象,利用生物信息學方法,預測了Sevp39基因編碼的Sevp39蛋白的理化特性、序列模式特性及二級結構,并進行了Sevp39及其同源蛋白的序列比對,為今后研究Sevp39蛋白在病毒入侵和在細胞內復制過程中所擔負的功能,探討宿主細胞蛋白與VP39蛋白間的相互作用機制,深入研究宿主與桿狀病毒之間的相互作用關系等提供依據。
1 材料和方法
1.1 材料
克隆載體pMD18-T和Premix Ex Taq Hot Start Version PCR 試劑盒購自TaKaRa公司;限制性內切酶購自Thermo Fisher公司;X-gal、IPTG和氨芐青霉素購自Sigma公司;質粒小量提取試劑盒和DNA凝膠回收試劑盒購自Omega公司;DNA分子質量購自東盛公司;其他試劑為國產分析純。
甜菜夜蛾核多角體病毒毒株SeMNPV-SeUS1為中山大學有害生物控制與資源利用國家重點實驗室贈送(其引自美國加州大學Riverside分校B.A.Federici教授實驗室);大腸桿菌(Escherichia coli) DH5α為肇慶學院生命科學學院保存。
1.2 SeMNPV基因組DNA的提取
SeMNPV基因組DNA的提取參照文獻[26]的方法進行。
1.3 引物設計及PCR
利用DNASTAR軟件,參照SeMNPV基因組全序列[11](Genbank accession No.NC_002169)中的Sevp39全長序列,設計一對擴增Sevp39基因全長的引物,由深圳華大基因股份有限公司合成。上游引物P1:5’-GAATTCATGGCTCTGACGCCTGTCTCCTCGA-3’,下劃線部分為引入的EcoRI酶切位點;下游引物P2:5’-GGTACCCTAGACGACGGCCGTGGGCCGAAG -3’,下劃線部分為引入的KpnI酶切位點。PCR模板為SeMNPV基因組DNA,反應體系為50 μL。PCR反應設計為:98 ℃,3 min;98 ℃,1 min,50 ℃,1 min,72 ℃,1 min,30個循環;72 ℃,10 min;4 ℃保存。擴增結束后,進行瓊脂糖凝膠電泳檢測,回收Sevp39基因的PCR產物。
1.4 質粒酶切分析及序列測定
將回收的PCR產物與克隆載體pMD18-T進行連接,轉化DH5α,挑取陽性克隆進行培養,提取質粒T-Sevp39,用EcoRI和KpnI進行雙酶切鑒定,并在深圳華大基因股份有限公司對插入的DNA片段進行測序。將測序結果與Sevp39基因序列進行比較。
1.5 生物信息學分析
將克隆并測序得到的Sevp39基因序列及其編碼的氨基酸序列作為原始數據,利用網絡服務器或生物學分析軟件,有針對性地分析了該基因及其編碼蛋白的氨基酸結構特點、理化性質等。一級結構采用DNASTAR軟件根據Sevp39基因序列推導出Sevp39蛋白的氨基酸序列,預計編碼的Sevp39蛋白的預測相對分子質量、等電點、氨基酸組成、化學特性、蛋白質結構域與模式的預測用DNASTAR軟件、EBI (http://www.ebi.ac.uk)和ExPASy (http://www.expasy.org)等網站上的ProtParam和MotifScan (https://myhits.isb-sib.ch/cgi-bin/PFSCAN),用Psipred (http://bioinf.cs.ucl.ac.uk/psipred/)等在線軟件進行蛋白質二級結構分析。在GenBank/EMBL數據庫中用BLAST搜索引擎尋找Sevp39同源序列,用Clustal W軟件進行多序列比較,用GeneDoc軟件進行編輯。
2 結果與分析
2.1 Sevp39基因的擴增
以SeMNPV基因組DNA為模板,從SeMNPV基因組中用PCR方法擴增了Sevp39基因,擴增片段大小為981 bp (圖1),與預期大小相符。回收PCR產物,連入pMD18-T載體,將連接產物轉化DH5α,挑取陽性克隆進行培養,提取質粒,得到質粒T-Sevp39,用EcoRI和KpnI進行雙酶切鑒定,獲得981 bp的目的片段和2692 bp的載體片段,與預期大小一致(圖2)。
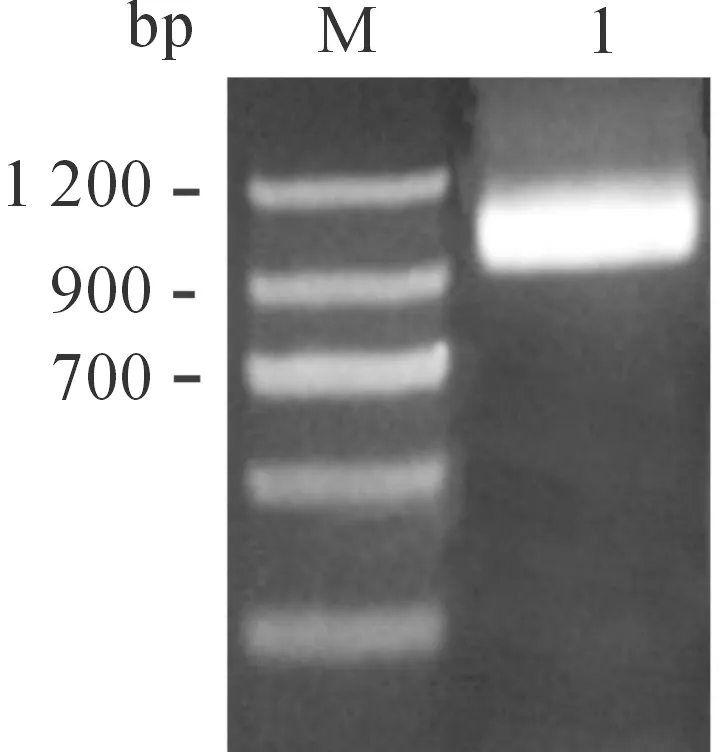
M.DNA分子量標準; 1.PCR產物
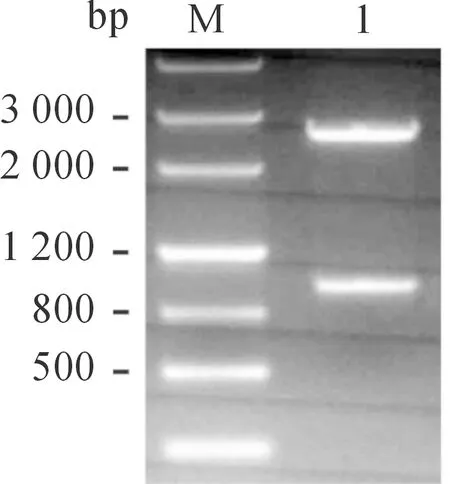
M.DNA分子量標準; 1.重組質粒T-Sevp39的EcoRI/KpnI雙酶切
2.2 T-Sevp39重組體測序
將酶切鑒定正確的T-Sevp39重組體進行測序。結果表明:除Sevp39第308位的堿基由G突變成T (圖3,紅色標記堿基),其余所有堿基與Genbank上公布的SeMNPV基因組全序列(Genbank accession No.NC_002169)中的Sevp39序列完全一致(圖3)。雖然進行了多次重復,測序結果均顯示在Sevp39第308位的堿基由G突變成T,原因可能是病毒毒株SeMNPV-SeUS1經過多次傳代培養,在該位點發生了變異。該位點的突變導致該編碼氨基酸的密碼子由GGT變為GTT,從而氨基酸由甘氨酸(Gly)變成纈氨酸(Val) (圖3,紅色方框標注),但是在培養病毒過程中,并沒有觀察到SeMNPV病毒的形態發生受到影響,因此該位點突變不影響Sevp39的功能。

圖3 Sevp39核苷酸序列和推導的氨基酸序列
2.3 生物信息學分析
運用在線軟件ProtParam和DNASTAR軟件分析Sevp39編碼的氨基酸序列的基本特征,結果如表1所示。Sevp39編碼326個氨基酸,預測相對分子質量為37 ku,蛋白等電點為5.859;氨基酸組成中帶負電荷氨基酸(Asp、Glu) 35個,占10.7%;帶正電荷氨基酸(Arg、Lys) 32個,占9.8%;親水性氨基酸128個,占39.3%,疏水性氨基酸176個,占54.0%;Sevp39蛋白在大腸桿菌中的半衰期大于10 h,蛋白的不穩定指數為42.31,是不穩定蛋白(蛋白的不穩定指數大于40.00就為不穩定蛋白)。
運用MotifScan分析發現(表2),Sevp39蛋白序列中包含3個可能的N-糖基化位點(153-156、174-177、223-226)、2個可能的酪蛋白激酶Ⅱ磷酸化位點(40-43、110-113)、6個可能的蛋白激酶C磷酸化位點(11-13、53-55、83-85、175-177、226-228、300-302)、1個可能的N-豆蔻酰化位點(267-272)和1個可能的酪氨酸激酶磷酸化位點(146-152)。

表1 Sevp39編碼蛋白氨基酸含量
注:* 疏水氨基酸, #親水氨基酸
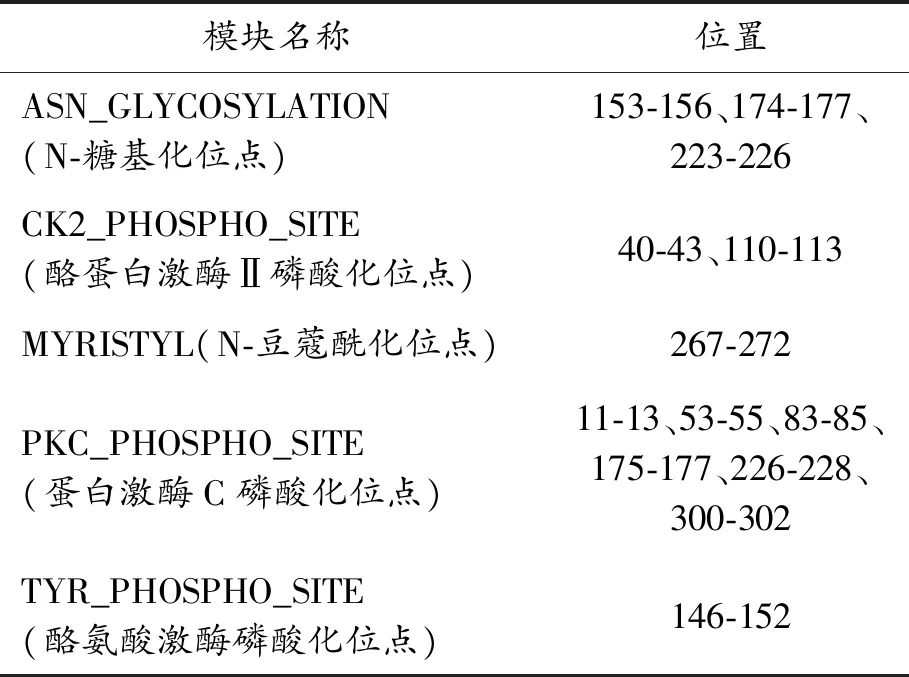
表2 Sevp39蛋白序列模式分析結果
BLAST搜索Sevp39的同源蛋白,并用Clustal W軟件比較其與同源蛋白的序列相似性。分析發現,Sevp39除與Neodiprionabietis(Neab)NPV、Neodiprionlecontii(Nele)NPV、Neodiprionsertifer(Nese)NPV 和Culexnigripalpus(Cuni)NPV的VP39蛋白序列相似性較低,介于12%~18%之間,與其余同源蛋白的序列相似性均大于30%,保守性適中。
從每個桿狀病毒屬中選擇Sevp39同源蛋白的氨基酸序列進行比對,結果顯示出6個高度保守的半胱氨酸殘基(Cys) (圖4),其中:Cys17、Cys48、Cys131存在于在所有的同源蛋白中;Cys28、Cys35存在于除NeabNPV、NeleNPV、NeseNPV、CuniNPV外的其他桿狀病毒的同源蛋白中;Cys168則存在于除CuniNPV外的其他桿狀病毒的同源蛋白中。
用Psipred分析Sevp39蛋白的二級結構,結果顯示Sevp39可能形成7個α螺旋和14個β折疊(圖5)。通過氨基酸序列比對所確定的保守Cys在圖中以星號標出以指示其在二級結構中的分布情況,發現上述6個保守的Cys中只有Cys17參與構成β折疊。
3 討論
在SpltMNPV中,VP39基因的轉錄在病毒感染后6 h即可檢測到,并且轉錄起始于保守的桿狀病毒晚期啟動子ATAAG中的第2個堿基A。Western blotting分析表明:VP39蛋白存在于BV和ODV的核衣殼中,因此VP39基因被認為是一個桿狀病毒晚期結構基因[27]。最近,有研究表明,家蠶核多角體病毒VP39基因的突變導致在培養細胞及家蠶幼蟲體內的感染性芽生型病毒粒子和包涵體的產生顯著下降[28]。因此,VP39在病毒復制過程中具有重要作用。
為揭示VP39的作用機理,本文運用DNASTAR等生物學軟件分析了Sevp39基因及其編碼蛋白Sevp39。結果表明:Sevp39蛋白在大腸桿菌中的半衰期大于10 h,是不穩定蛋白。Sevp39蛋白有多個位點可以發生糖基化修飾和磷酸化修飾。蛋白質的脫磷酸化和磷酸化在細胞信號傳導過程中具有重要作用,糖基化、磷酸化位點可能是Sevp39蛋白完成其生理功能的結構基礎。
同源性分析表明,Sevp39與絕大部分桿狀病毒同源蛋白的序列相似性均大于30%,保守性適中。從每個桿狀病毒屬中選擇Sevp39同源蛋白的氨基酸序列進行比對,結果顯示出6個高度保守的Cys,分別是Cys17、Cys28、Cys35、Cys48、Cys131、Cys168。利用Psipred在線軟件分析Sevp39蛋白的二級結構,結果顯示Sevp39可能形成7個α螺旋和14個β折疊,6個高度保守的Cys中只有Cys17參與了β折疊的形成。Cys在蛋白質中常形成二硫鍵,其中存在于蛋白質內部的二硫鍵通過影響蛋白空間結構而決定其功能;存在于蛋白之間的二硫鍵,形成蛋白之間一種共價鍵相互作用的方式。在對猴空泡病毒(Simian vaculating virus)、乳頭狀瘤病毒(Papillomavirus)的研究中均發現,核衣殼主要蛋白通過保守Cys之間的二硫鍵構成寡聚體來參與衣殼的裝配[29-30]。因此,推測Sevp39蛋白6個保守的Cys參與了蛋白空間結構的形成,在Sevp39的功能中具有重要作用。后續將致力于VP39蛋白中保守Cys的功能研究。
Eleven representative sequences were selected and aligned using Clustal X 1.83 and were edited with GeneDoc software.The VP39 protein sequences used are as follows:SeMNPV (NP_037835.1),AcMNPV (NP_054119.1),HyphantriacuneaNPV (HcNPV,YP_473253.1),LymantriadisparMNPV (LdMNPV,NP_047729.1),SpodopteralituraMNPV (SpltMNPV,NP_258349.1),AgrotissegetumGV (AgseGV,YP_006258.1),Xestiac-nigrumGV (XecnGV,NP_059259.1),NeabNPV (YP_667940.1),NeleNPV (YP_025289.1),NeseNPV (YP_025196.1) and CuniNPV (NP_203328.1).Amino acids with black shading denote 100% conservation in all sequences.Those with dark gray and light gray shading represent 80% and 60% conservation in all sequences,respectively.The asterisks indicate the location of the conservative cysteine amino acids.
圖4 Sevp39蛋白與其他昆蟲桿狀病毒VP39氨基酸序列的同源性比較

圖5 Sevp39二級結構預測結果

