HO-1通過下調TLR4介導的炎性反應抑制ox-LDL誘導的VSMC泡沫樣變*
尹延偉,孫倩倩,沈 勇,胡愛民,王 琦,陳大偉,趙炫柱,石 進△
(1.空軍特色醫學中心神經內科,北京 100142;2.北京衛戍區第九離職干部休養所 100021;3.武警河北省總隊醫院綜合病房,石家莊 050081;4.空軍特色醫學中心急診部,北京 100142)
動脈粥樣硬化是多種心腦血管疾病、外周血管疾病發生的病理基礎[1]。炎性反應在動脈粥樣硬化病變過程中發揮著重要的作用[2]。研究證實動脈粥樣硬化斑塊中泡沫細胞的形成與脂質代謝紊亂及炎性反應密切相關[3]。因此,積極探討炎性反應在泡沫細胞形成過程中的機制和關鍵的調控分子,對尋找防治動脈粥樣硬化的新靶點具有重要意義。
血紅素加氧酶-1(heme oxygenase-1,HO-1)在抑制體內氧化應激及炎性反應方面發揮重要的作用。近年研究表明HO-1在動脈粥樣硬化發生發展中起到關鍵的作用[4]。Toll樣受體4(Toll like recepter 4,TLR4) 是人體啟動先天性免疫和炎性反應的重要模式識別受體,其在人體中主要表達于巨噬細胞、單核細胞和樹突狀細胞等免疫細胞表面,同時在動脈壁的內皮細胞、血管平滑肌細胞 (vascular smooth muscle cells,VSMCs)、纖維原細胞等表面也有表達。TLR4可通過激活下游核因子-κB(NF-κB)炎癥信號通路參與機體的動脈粥樣硬化炎性反應過程[3,5]。本研究在C57BL/6J背景野生型小鼠與TLR4基因敲除(TLR4-/-)小鼠中對HO-1在VSMCs泡沫樣變過程中的具體作用進行探討,旨在為動脈粥樣硬化的防治提供新的理論依據,現報道如下。
1 材料與方法
1.1材料
1.1.1實驗動物 4~8周齡C57BL/6J背景野生型小鼠與TLR4-/-小鼠分別購自陸軍特色醫學中心野戰外科研究所實驗動物中心與上海南方模式生物科技發展有限公司,無特定病原體(SPF)級環境飼養。實驗用小鼠均為雄性小鼠。實驗過程中對動物的處置符合動物倫理學標準。
1.1.2主要試劑 DMEM培養液、胰酶購自美國Hyclone公司、胎牛血清(FBS)、青素溶液、鏈霉素溶液氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)購自廣州奕源生物有限公司;β-actin一抗、TLR4一抗、HO-1一抗購自美國Santa Cruz Biotechnology公司;油紅O、HO-1激動劑鈷原卟琳(CoPPIX)、HO-1抑制劑鋅卟啉(ZnPPIX)購自美國Sigma公司;山羊抗小鼠二抗購自上海碧云天生物技術有限公司;IL-6、TNF-α酶聯免疫吸附試驗(ELISA)檢測試劑盒購自美國R&D Systems公司。
1.2方法
1.2.1細胞培養與實驗分組 小鼠麻醉后取胸主動脈,組織貼塊法培養原代VSMCs。VSMCs均勻接種于培養皿中,用含10% FBS和1%青鏈霉素的DMEM培養液在37 ℃、5% CO2的細胞培養箱中培養;采用胰酶消化液進行傳代,選取3~6代狀態良好的細胞進行實驗。按實驗要求進行分組:空白對照組:VSMCs不加任何干預因素;ox-LDL組:加ox-LDL (80 μg/mL)刺激72 h;TLR4-/-+ox-LDL組:TLR4-/-VSMCs加ox-LDL(80 μg/mL)刺激72 h;CoPPIX+ox-LDL組:CoPPIX(50 μmol/L)預先處理VSMCs 12 h后再加入ox-LDL(80 μg/mL)刺激72 h;ZnPPIX+ox-LDL組:ZnPPIX(50 μmol/L)預先處理VSMCs 12 h后再加入ox-LDL(80 μg/mL) 刺激72 h。
1.2.2油紅O染色 各組VSMCs首先用磷酸鹽緩沖液(PBS)洗滌3次,然后用10%多聚甲醛固定VSMCs 20 min,在避光條件下用油紅O工作液染色VSMCs 30 min,最后應用去離子水沖洗VSMCs后顯微鏡下觀察。
1.2.3膽固醇水平的檢測 VSMCs膽固醇水平的檢測方法依據XUE等[6]的研究。各組VSMCs首先在離心管中應用萃取液(100 μL異丙醇)提取脂質成分;然后應用超聲破碎儀將VSMCs充分破碎,在1 500×g條件下離心10 min,收集離心管中的上清液;最后采用酶法檢測VSMCs中膽固醇水平。測定的結果根據細胞蛋白水平進行標準化。
1.2.4Western blot 細胞裂解法提取各組VSMCs蛋白并定量檢測;50 μg蛋白樣品上樣,經電泳、轉膜、封閉后,加一抗(HO-1一抗稀釋比例1∶1 000;TLR4一抗稀釋比例1∶1 000;β-actin一抗稀釋比例1∶1 000)4 ℃孵育過夜,緩沖液洗脫后,加二抗(1∶2 000)室溫孵育2 h,緩沖液洗脫。應用化學發光法曝光,最后應用Lab4.6軟件對掃描的Western blot圖像進行數據分析。
1.2.5ELISA VSMCs培養液中炎癥因子水平的檢測方法依據本課題組之前的研究[7]。簡而言之,首先收集 VSMCs培養液,設定標準孔、對照孔、待測樣品孔,酶標板上覆膜,室溫條件下靜置2 h,倒盡板孔中的液體并洗滌5次;然后每個板孔中添加100 μL IL-6或TNF-α偶聯物,加蓋覆膜,室溫靜置2 h;倒盡板孔中液體并再次洗滌5次;每個板孔中添加100 μL底物溶液,于暗室(室溫條件下)靜置30 min;最后每個板孔中添加100 μL終止液,搖晃反應3~5 min;用酶聯免疫檢測儀記錄450 nm處吸光度(A)值。

2 結 果
2.1ox-LDL顯著促進VSMCs細胞內脂質的聚集 VSMCs與ox-LDL共同孵育72 h后,VSMCs內有大量脂滴形成,符合泡沫細胞的形態特點;而空白對照組VSMCs內未見脂滴形成。此外,細胞膽固醇水平測定結果也顯示,與空白對照組VSMCs相比,ox-LDL組VSMCs細胞內膽固醇水平顯著升高,差異有統計學意義(P<0.05),見圖1。

A:油紅O染色;C:膽固醇水平檢測;C:TLR4 Western blot及其表達分析;D:IL-6表達水平檢測;E:TNF-α表達水平檢測;a:P<0.05,與空白對照組比較
圖1VSMCs泡沫樣變及膽固醇、TLR4、IL-6、TNF-α表達水平的檢測
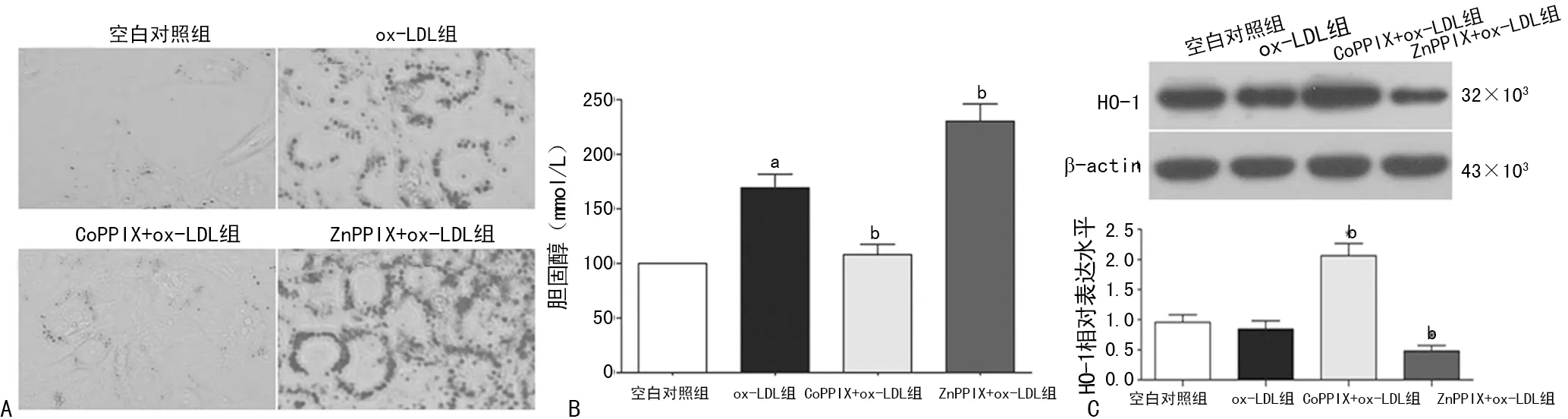
A:油紅O染色;B:膽固醇水平檢測;C:HO-1表達水平檢測;a:P<0.05,與空白對照組比較;b:P<0.05,與ox-LDL組比較
圖2VSMCs泡沫樣變、細胞內脂質聚集情況及HO-1表達水平的檢測
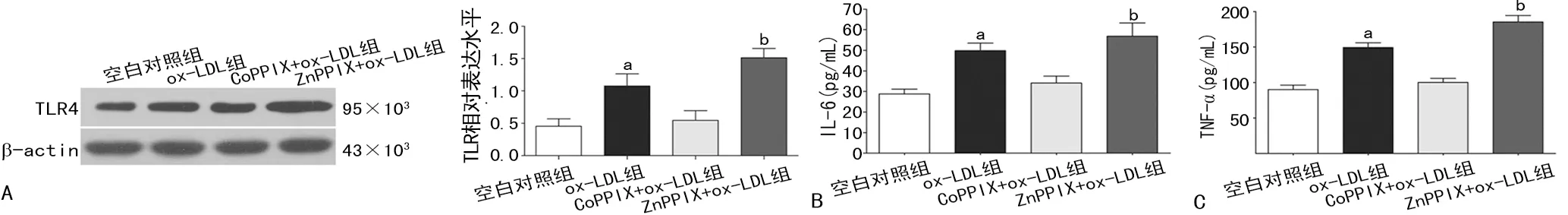
A:TLR4 Western blot及其表達分析;B:IL-6表達水平檢測;C:TNF-α表達水平檢測;a:P<0.05,與空白對照組比較;b:P<0.05,與ox-LDL組比較
圖3VSMCsTLR4、IL-6、TNF-α表達水平的檢測
2.2ox-LDL刺激通過激活TLR4介導的炎性反應促進VSMCs泡沫樣變 ox-LDL組中ox-LDL刺激較空白對照組顯著誘導了VSMCs內大量脂滴聚積,也顯著上調了TLR4及其介導的炎癥因子(IL-6、TNF-α)的表達水平,差異均有統計學意義(P<0.05);而對于TLR4-/-+ox-LDL組,ox-LDL刺激較空白對照組并不能有效促進VSMCs內脂滴聚積;此外,ox-LDL刺激也不影響TLR4-/-VSMCs內TLR4及其介導的炎癥因子(IL-6、TNF-α)的表達水平,差異均無統計學意義(P>0.05),見圖1、圖3。
2.3激活HO-1抑制ox-LDL誘導的VSMCs泡沫樣變 用CoPPIX預先處理VSMCs激活HO-1后再加入ox-LDL刺激,CoPPIX+ox-LDL組VSMCs內脂滴聚積明顯較ox-LDL組減輕;而用ZnPPIX預先處理VSMCs抑制HO-1后再加入ox-LDL刺激,ZnPPIX+ox-LDL組VSMCs內脂滴聚積情況較ox-LDL組更加明顯,差異均有統計學意義 (P<0.05),見圖2。
2.4HO-1下調TLR4介導的炎性反應抑制ox-LDL誘導的VSMCs泡沫樣變 用CoPPIX預先處理VSMCs激活HO-1后再加入ox-LDL刺激,CoPPIX+ox-LDL組并不能有效上調TLR4及其介導的炎癥因子(IL-6、TNF-α)的表達水平,與空白對照組比較差異均無統計學意義(P>0.05);進一步應用ZnPPIX預先處理VSMC抑制HO-1后再加入ox-LDL刺激,ZnPPIX+ox-LDL組TLR4及其介導的炎癥因子(IL-6、TNF-α)的表達水平較ox-LDL組上調更加明顯,差異均有統計學意義(P<0.05),見圖3。
3 討 論
動脈粥樣硬化是一種動脈血管進行性堵塞的慢性疾病。動脈粥樣硬化作為多種心腦血管疾病、外周血管疾病發生的共同病理基礎[1],目前其已經成為世界范圍內引起死亡的主要原因之一。因此,積極探討動脈粥樣硬化發生發展的具體機制對動脈粥樣硬化相關性疾病的防治具有重要的指導意義。泡沫細胞的形成是動脈粥樣硬化病變發生發展過程中非常重要的病理過程[3]。泡沫細胞主要來源于巨噬細胞及VSMCs。然而,相比巨噬細胞,目前關于VSMCs源性泡沫細胞形成的具體機制研究很少。
慢性炎性反應是動脈粥樣硬化病變發生、發展的一大病理基礎[3]。TLR4 是啟動免疫和炎性反應的重要膜受體,其在體內引發炎性反應方面發揮至關重要的作用。有研究顯示TLR4參與動脈粥樣硬化病變的發生發展過程,并與泡沫細胞的形成密切相關[3,5,7]。本研究中,筆者成功應用ox-LDL刺激C57BL/6J背景野生型小鼠來源VSMCs誘導其泡沫樣變,并檢測TLR4及其介導的炎性反應。結果提示ox-LDL刺激在明顯誘導VSMCs泡沫樣變的同時可顯著激活TLR4及其介導的炎性反應;而對于TLR4-/-小鼠來源的 VSMCs,ox-LDL刺激并不能有效誘導VSMCs的泡沫樣變,此外ox-LDL刺激也不能有效激活TLR4-/-小鼠來源VSMCs內炎性反應。說明VSMCs泡沫樣變過程中伴隨著TLR4介導的炎性反應激活,而TLR4缺陷損害ox-LDL對VSMCs泡沫樣變的促進作用。以上結果進一步說明了TLR4介導的炎性反應在VSMCs泡沫樣變的過程中發揮非常重要的作用。
HO-1是動物體內重要的保護性蛋白,在人體血管內皮細胞、巨噬細胞及VSMCs等細胞內均有表達,可被各種化學和生理應激所激活,如炎性反應、氧化應激反應及內毒素等。有研究表明HO-1可能參與了動脈粥樣硬化病變中TLR4介導的炎性反應的調控,如激活HO-1可能通過影響TLR4介導的炎性反應而抑制VSMC增殖與遷移[8-10]。但VSMC中激活的HO-1是否通過影響TLR4介導的炎性反應參與VSMC內脂質聚積和細胞的泡沫樣變過程,目前還未見有文獻報道。基于以上研究筆者推測:激活HO-1可通過干擾TLR4介導的炎性反應而影響VSMC泡沫樣變。為了驗證以上假設,筆者應用HO-1激動劑和抑制劑分別激活和抑制HO-1表達,觀察HO-1表達變化對ox-LDL誘導的VSMCs泡沫樣變的影響,同時檢測TLR4及其介導的炎性反應激活情況。結果顯示激活HO-1顯著抑制ox-LDL誘導的VSMC泡沫樣變,而抑制HO-1進一步促進ox-LDL誘導的VSMC泡沫樣變;同時在激活HO-1狀態下,ox-LDL刺激不能有效激活TLR4及其介導的炎性反應,而抑制HO-1后再加入ox-LDL刺激,TLR4及其介導的炎性反應較單獨ox-LDL刺激激活更加明顯。說明激活HO-1可通過下調TLR4介導的炎性反應抑制ox-LDL誘導的VSMCs泡沫樣變。
綜上所述,本研究發現在VSMC泡沫樣變過程中HO-1可通過下調TLR4介導的炎性反應抑制VSMCs對脂質的攝取進而阻礙泡沫樣變的發生。以上結論為動脈粥樣硬化相關性疾病的防治提供了新的理論基礎。

