特應性皮炎患兒血清中microRNAs芯片的生物信息學分析
韓 悅 姚 煦
特應性皮炎(Atopic dermatitis,AD)是一種常見的慢性復發性炎癥性過敏性皮膚病,好發于兒童,可伴有過敏性鼻炎、哮喘和食物過敏,臨床表現為劇烈瘙癢,嚴重影響患兒的生活質量和身心發育,是皮膚科最受關注的疾病之一[1,2]。近年來AD的發病率呈迅速升高的趨勢,有報道顯示我國多城市兒童AD發病率為12.94%[3]。然而目前AD發病機制尚未完全揭示,因此,積極探索AD的發病機制具有十分重要的意義。隨著科技的發展,生物信息學已成為預測基因功能、調控信號通路最重要的手段之一[4],如果能應用生物信息技術手段預測AD患兒血清中的某些基因功能和參與的信號通路,那么對輔助AD的臨床診治具有非常重要的科學意義。
microRNAs(miRNA)是一類真核生物體內分泌的長度為21~25個核苷酸的非編碼單鏈微小RNA,它能與mRNA轉錄因子結合并參與基因的調控,是重要的基因表達調控因子[5,6]。所以,我們可以通過分析AD患兒外周血中miRNA芯片信息并通過生信學軟件和數據庫預測其靶基因的功能和調控的信號通路來研究其對AD診治的意義。故本文擬基于高通量測序技術利用生物信息學方法分析miRNA在兒童AD中的表達差異及潛在的應用價值,為臨床尋找潛在的藥物靶點提供理論依據。
1 資料與研究方法
1.1 芯片信息 從NCBI(美國國立生物技術信息中心,https://www.ncbi.nlm.nih.gov/)公共數據平臺GEO(Gene Expression Omnibus)數據庫中下載的GSE 62404數據集,為人類芯片miRNAs表達譜數據,芯片平臺是GPL 9460(Applied Biosystems Human TaqMan Low Density Array,TLDA, v1.0),該芯片數據包括8例AD患兒和8名健康兒童血清中miRNAs表達譜,本研究選擇全部的芯片信息來進行下一步的分析。
1.2 數據歸一化及差異miRNA分析 用R語言軟件包對芯片表達矩陣進一步預處理及差異miRNA分析。利用R 3.4.1軟件edgeR包運用RMA 算法對下載數據進行背景校正、標準化,即將測序數據歸一化。利用R gplots包繪制熱圖,計算差異表達miRNA的篩選符合以下條件:①P<0.05 ;②|logFC|≥2。結合文獻選取最具差異表達的miRNA-126進行后續分析,并利用miRBase數據庫(http://www.mirbase.org/)分析其序列及保守性。
1.3 靶基因的預測 利用mirTarbase數據庫(http://mirtarbase.mbc.nctu.edu.tw/php/index.php)來預測miRNA-126靶基因,并統計相關靶基因總數。
1.4 靶基因的GO功能注釋及KEGG信號通路富集 利用cytoscape3.5.1及其插件ClueGO、CluePedia對靶基因進行GO(gene ontology)功能注釋和KEGG(Kyoto Encyclopedia of Genes and Genomes)信號通路富集。GO注釋功能富集主要有:生物學過程(biological process,BP)、分子功能(molecular function,MF)、細胞組分(cellular component,CC)。繪制KEGG網絡互作圖,以明確靶基因參與調控的信號通路之間的關系。對富集的GO注釋和KEGG信號通路注釋做統計學分析通過計算差異P值,篩選出P<0.05差異的GO功能注釋和KEGG信號通路富集。
1.5 標本采集 選取2017年5月至2018年5月期間我院收治的AD患兒與正常健康兒童各20名為實驗對象,分別采集清晨空腹外周血10 mL。本次研究均獲受試者知情并簽署知情同意書。納入標準:符合AD的診斷標準,年齡小于18歲,性別不限,心、肝、腎功能良好,無其他嚴重疾病者;排除標準:伴有其他皮膚疾病者、心腦血管疾病、酒精藥物濫用史、精神疾病史等。所采集的標本2000 rpm離心取上清后均于-80℃冰箱中保存備用。
1.6 試劑盒提取純化血清總RNA 使用miRNeasy Mini Kit試劑盒(QIAGEN,德國)提取標本中miRNA,操作嚴格遵照試劑盒內說明書進行:將1mL RNA-Solv加入血清中,靜置3 min后加入200 μL氯仿冰中孵育10 min,4℃離心12000 g 15 min,將上清液加入一半體積乙醇,將硅膠柱套入集液管,吸取混合液700 μL加到HiBind RNA Mini column,離心10000 g 30~60 s,流出液放入新收集管中,加入0.9倍體積的乙醇,將MicroElute RNA column放入新收集管中,加入硅膠柱,離心10000 g 30~60 s,棄去濾液,把硅膠柱套回收集管中,加入500 μL RWB Wash Buffer,重復上述過程一次,最后用20 μL的DEPC水洗脫miRNA。將純化后的RNA于-80℃中保存備用。
1.7 熒光定量PCR檢測miRNA 采用HiScript? II Reverse Transcriptase試劑盒(南京諾唯贊生物科技有限公司)將提取出來的總RNA逆轉錄合成cDNA,反應體系為20 μL,反應條件為42℃ 3 min,60℃ 15 min,85℃ 5 min。以cDNA為模板,利用ChamQ Universal SYBR qPCR Master Mix(南京諾唯贊生物科技有限公司)進行PCR擴增,反應體系為20 μL,反應條件為95℃ 2 min,1循環;60℃ 5 s,95℃ 10 s,40 個循環。以U6作為實驗的內參基因,相對表達量以2-△△Ct形式表示,其中△CT=CT(miRNA)-CT(U6)。每孔共設副孔兩個,重復三次。miRNA-126上游引物序列:5’- ACACTCCAGCTGGGCATTATTACTTTTGG-3’,下游引物序列:5’- CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCGCGTACC-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’。
1.8 統計學方法 文中實驗結果數據在SPSS 20.0 軟件中統計分析,統計圖在Graghpad Prism 8軟件中繪制和編輯加工,采用獨立t檢驗比較AD患兒和健康對照組間均數差異,實驗數據中計量資料以均數±標準差(mean±SD)形式表示,以P<0.05為差異有統計學意義。
2 結果
2.1 差異表達miRNAs篩選結果 通過對兩組數據的差異表達miRNAs的篩選,共獲得7個差異表達的miRNAs,其中上調miRNAs 2個,下調miRNAs 5個。圖1是芯片間數據用RMA 法進行校正后的箱圖。繪制兩組血清中miRNA的表達譜熱圖,見圖2。表1列出了AD患兒血清中對比正常兒童的差異表達的miRNAs。
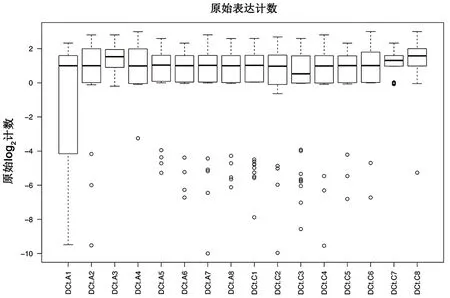
圖1 芯片間數據進行校正后的箱圖
圖2 芯片中兩組血清的miRNAs表達
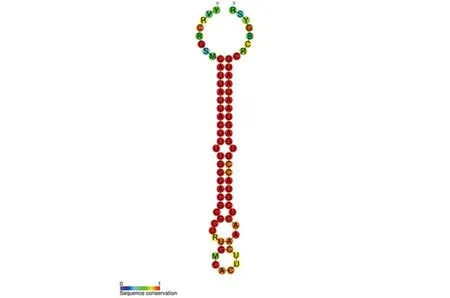
圖3 miRNA-126序列及保守性
2.2 選取最具差異表達的miRNA并預測其靶基因 根據logFC值和P值并結合文獻選取最具差異表達的miRNA-126進行后續生信學分析,并利用miRBase數據庫分析其序列及保守性,序列為5’端 CAUUAUUACUUUUGGUACGCG 3’端,莖環結構的保守性低于序列,詳見圖3。利用mirTarbase數據庫對miRNA-126的靶基因進行預測,結果見表2。
為了檢驗miRNA-126是否在實際中具有差異表達,我們篩選了本院收治的AD患兒與正常健康兒童各20例,其中AD組年齡為(16.18±9.57)歲,男/女比例為1.86;對照組年齡為(14.63±7.09)歲,男/女比例為1.22。采用q-PCR法檢測兩組血清中miRNA-126的表達水平。相對于對照組,AD組miRNA-126的表達水平顯著降低(1.0±0.30 vs 0.46±0.19),兩組間有明顯的統計學差異(P<0.001),如圖4。

表2 利用mirTarbase數據庫分析miRNA-126靶基因(前12項)
2.3 GO功能注釋結果 針對以上預測的靶基因,然后我們進行GO注釋和KEGG通路富集分析。通過GO注釋描述共得到11個分子功能注釋信息、28個生物學過程注釋信息,細胞組分注釋信息缺如。分析顯示miRNA-126預測靶基因集合富集在血管通透性的調節、RAC蛋白信號轉導、內皮細胞增殖的調節、基質黏附依賴性細胞擴散、活化MAPKK活性、磷蛋白結合等生物學過程和分子功能中(P<0.05),見表3、表4。
2.4 KEGG 信號通路富集結果 在GO注釋分類的基礎上,利用已有生物通路數據,對基因集合中的12個基因進行生物通路富集分析。結果顯示,在經典通路數據庫KEGG中miRNA-126顯著富集于FoxO信號通路、NF-κB信號通路、B細胞受體信號通路、VEGF信號通路等17個通路(P<0.05),見圖5。

表3 miRNA-126靶基因進行GO功能富集(生物學過程)
注:表中所列基因于GO功能富集中P<0.001
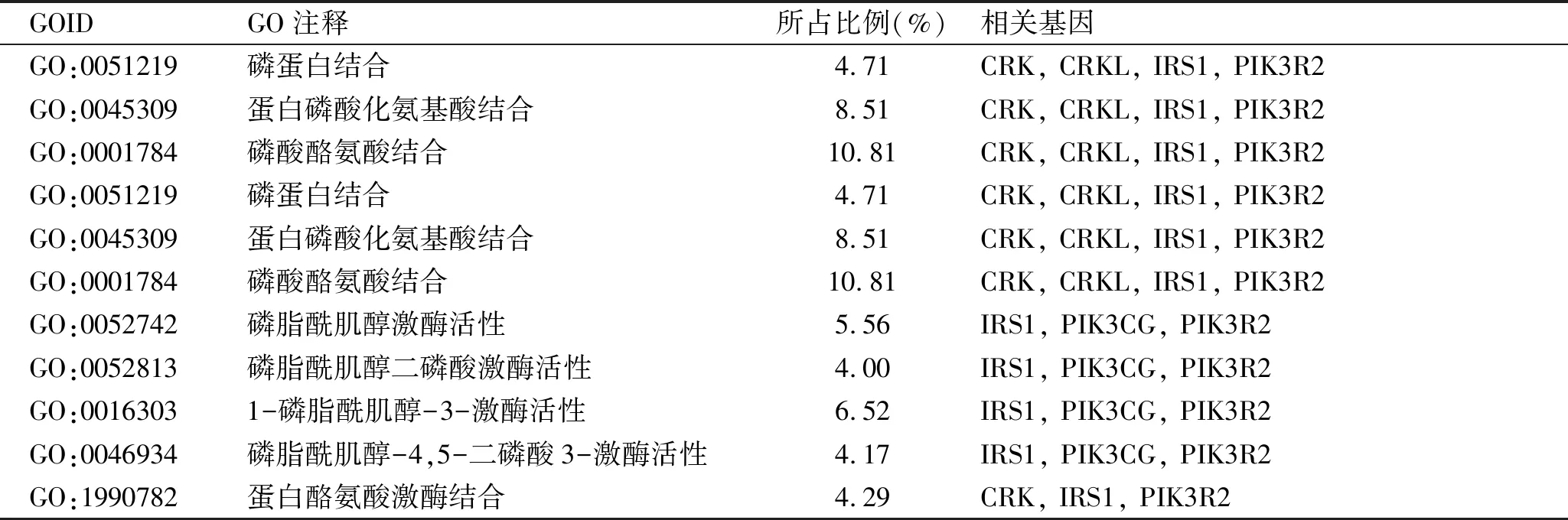
表4 miRNA-126靶基因進行GO功能富集(分子功能)
注:表中所列基因于GO功能富集中P<0.001
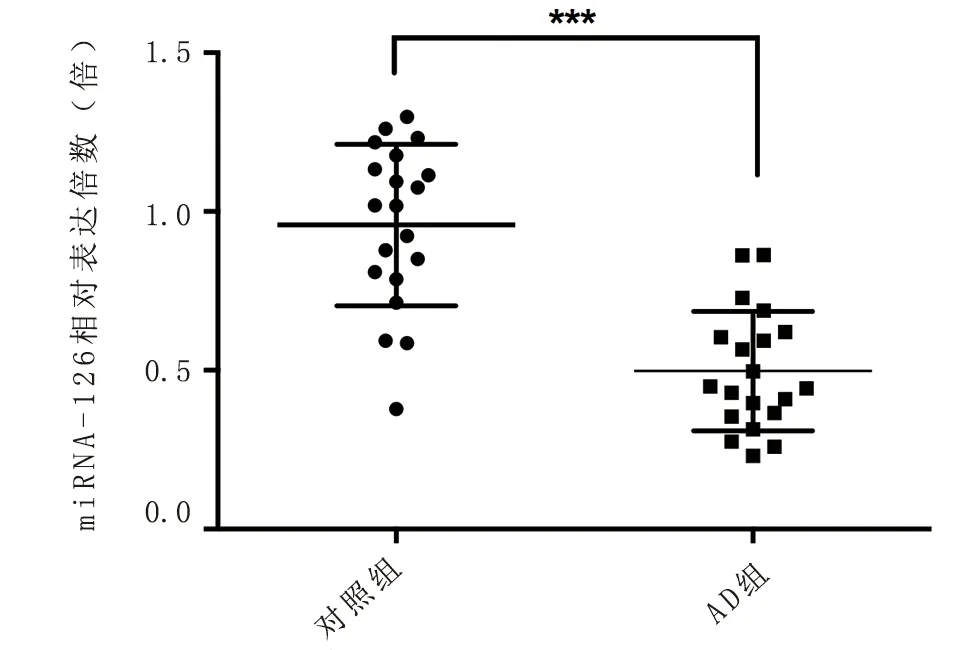
圖4 兩組血清中miRNA-126的表達水平

圖中紅色字體代表靶基因,綠色及灰色字體代表靶基因參與的信號通路,圓形大小代表其權重,圓形直徑越大,說明靶基因參與該信號通路越多
圖5KEGG信號通路富集結果
3 討論
特應性皮炎是迄今為止最常見的小兒過敏類皮膚病之一,具有一定的遺傳易感性[7],目前其發病機制尚未清楚,涉及多個基因位點和多條信號通路。為明確AD的發病機制,我們應深入探索AD發生發展中調控的基因及其背后的分子機制,為找出新的藥物治療靶點提供一定的理論依據。近年來,世界上開展的人類基因組計劃令高通量基因芯片技術廣泛應用于疾病的miRNAs表達譜分析、基因克隆和尋找疾病特異分子標志物等[8,9]。為深入了解AD發生發展的分子機制,我們篩選了可作為AD診斷的關鍵miRNA并預測其靶基因,本研究利用生物信息學方法對GEO數據庫下載的AD患兒血清和正常兒童血清中的生物芯片數據進行差異miRNAs分析、靶基因預測、功能聚類及信號通路富集,并利用q-PCR進行了實驗驗證。
經過AD患兒血清和正常兒童血清中miRNAs的差異比較,共篩選出7個差異表達miRNAs,其中上調miRNAs 2個:hsa-miR-590-5p、hsa-miR-106b;下調miRNAs 5個:hsa-let-7g、hsa-miR-126、hsa-miR-491-5p、hsa-miR-483-5p、hsa-miR-146a。研究顯示,上調miRNA-590-5p可能以TGFβ1為靶點,促進軟骨細胞凋亡和自噬,從而促進骨關節炎的發病機制[10];miRNA-106b參與多種細胞因子的分泌,如IL-10、IL-17、IL-23,可以干擾白塞病患兒外周血中Th17/Treg的平衡[11];基于二代測序技術發現let-7g參與調控肌萎縮側索硬化的發生發展,與其他的miRNAs、基因形成一個復雜的分子調控機制[12];在CD8+T細胞中,miRNA-491直接靶向細胞周期蛋白依賴激酶4、轉錄因子T細胞因子1,同時,TGF-β在CD8+T細胞中誘導了miRNA-491的表達,說明miRNA-491可以作為T淋巴細胞,特別是CD8+T細胞的負調節因子[13];軟骨細胞mTORC1可以激活miRNA-483通過靶向HDAC4基因調控骨關節炎的進展[14];miRNA-146a在關節炎患者組織中過表達,且參與關節炎的炎癥形成[15]。綜合以上,說明這些表達差異的miRNAs在各種免疫、炎癥性疾病中均有異常表達,并通過各種機制調控該類疾病的發生發展。
在差異表達的miRNAs,我們結合既往文獻選取了最具表達差異的miRNA-126進行下一步生信學分析。近年來,miRNA-126作為一個熱門非編碼RNA一直以來被廣泛的研究。我們通過生信學數據庫對miRNA-126進行了序列、二級結構及保守性的分析,發現miRNA-126具有標志性的發夾結構,經典的莖環結構且序列均處于發夾結構的臂上,莖環結構中的堿基保守性略低。很多學者發現miRNA-126參與多種免疫性炎癥性疾病的分子調控機制。最新研究顯示[16],在皮膚傷口愈合過程中,miRNA-126表達上調。miRNA-126的過度表達通過靶向抑制PLK2基因參與促進角質形成細胞(KC)的增殖和遷移。miRNA-126的過表達還激活了PI3 K/AKT信號通路。作為表皮中的重要組成細胞,KC在AD患者的經皮致敏中扮演著非常重要的角色。所以基于既往文獻及芯片數據,我們在篩選出的miRNA中選取miRNA-126來進行后續分析。此外,我們收集了我院AD患兒和健康兒童各20例,利用q-PCR方法檢測兩組人外周血血清中miRNA-126的表達水平,結果顯示,AD組中miRNA-126的表達顯著下調,與生信學分析結果吻合。
我們利用生信學數據庫對miRNA-126的靶基因進行預測,結果顯示共有110個基因,然后利用生信學軟件對這些基因進行GO功能注釋及KEGG信號通路富集分析。通過GO注釋描述共得到11個分子功能注釋信息、28個生物學過程注釋信息。分析顯示靶基因主要富集在血管通透性的調節、RAC蛋白信號轉導、內皮細胞增殖的調節、基質黏附依賴性細胞擴散、活化MAPKK、磷蛋白結合等生物學過程和分子功能中。這些均與免疫與炎癥的調節具有一定的關聯性。
在GO注釋分類的基礎上,利用已有生物通路數據,對基因集合中的12個基因進行生物通路富集分析。結果顯示基因顯著富集于FoxO信號通路、NF-κB信號通路、B細胞受體信號通路、VEGF信號通路等17個通路。Kumagai等[17]KC通過NF-κB信號通路可以激活增加TSLP的釋放,從而影響AD的發生發展。最近有文獻顯示[18],通過阻斷小鼠NF-kB信號通路可以下調Th2的比例,說明AD可以激活NF-κB信號通路。我們從分析結果中可以看出,miRNA-126靶向基因VCAM1、CXCL12、BCL2、NFKBIA參與NF-κB信號通路,由于miRNA-126抑制靶基因的表達,所以AD患兒血清中下調miRNA-126的表達會解除對這些靶基因的抑制作用,從而激活NF-κB信號通路。圖5結果顯示,NF-κB信號通路在靶基因參與調控的所有信號通路所占權重最大,以上生信學分析結果與既往文獻的結論相一致,說明NF-κB信號通路在AD的發病機制中發揮著重要的作用。
綜合以上所述,本文采用生物信息學和分子生物學實驗的方法對AD患兒miRNAs芯片數據進行深度挖掘和有效驗證,從整體和微觀的角度對AD相關miRNA及其調控基因、分子功能和生物學過程進行分析,以期在AD發生的機制研究、分子標志物的篩選及藥物靶點選擇奠定理論基礎。

