混合血小板裂解液對人骨髓間充質干細胞原代培養、增殖和成骨分化的影響
徐楊 林飛躍 尹曉明

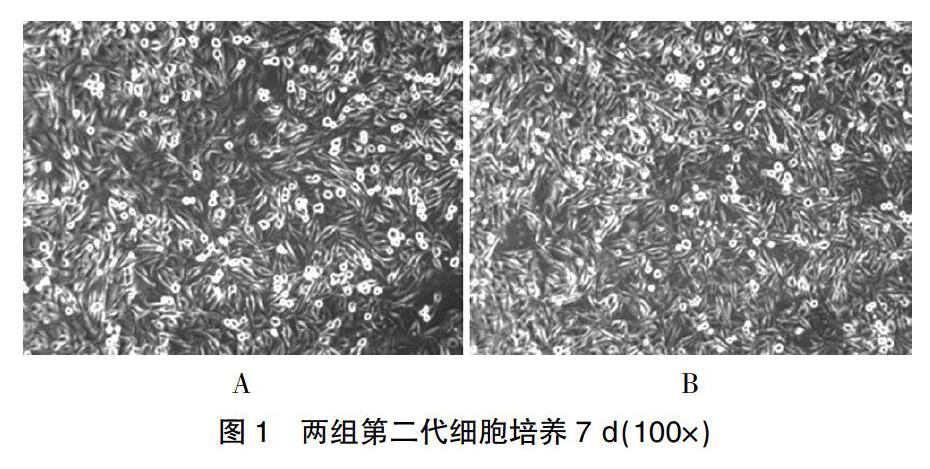
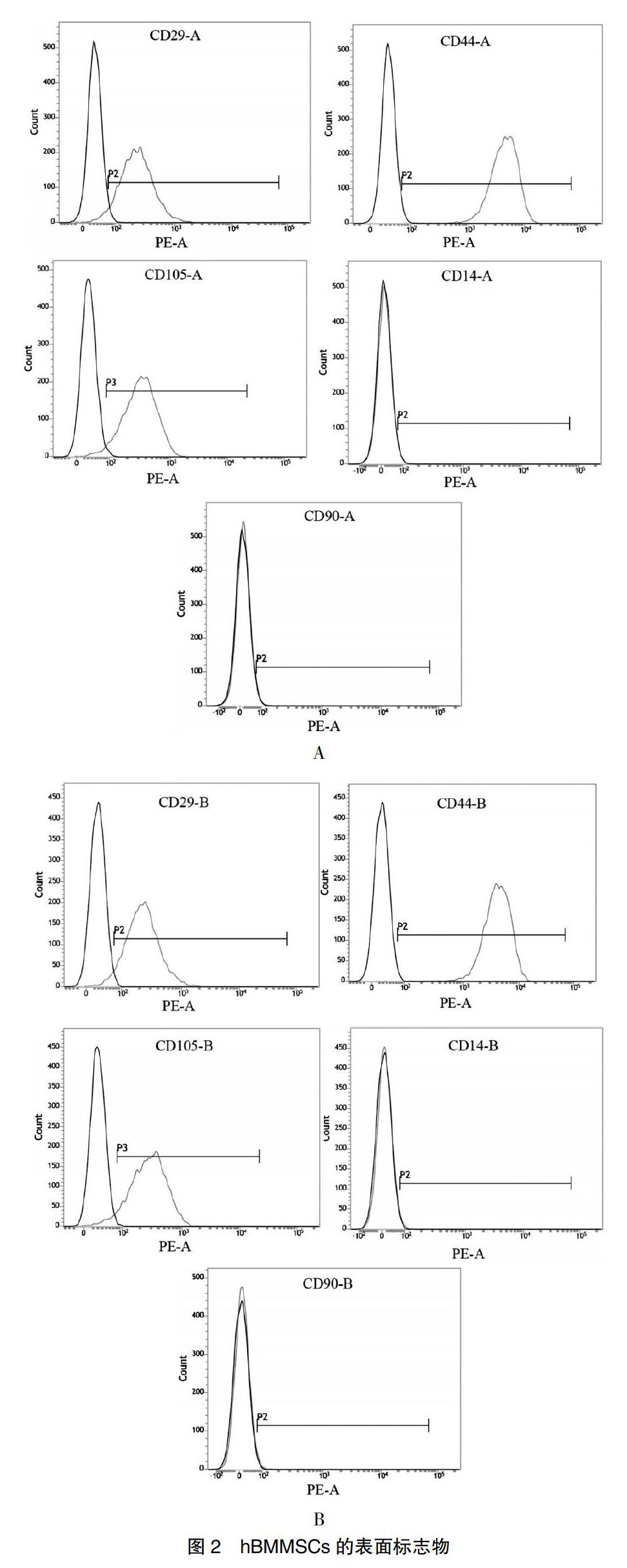
[摘要]目的 研究混合血小板裂解液(pHPL)對體外培養的人骨髓間充質干細胞(hBMMSCs)原代培養、增殖和成骨分化的影響。方法 使用臨床過期的多份濃縮血小板混合,多次凍融激活后制備pHPL,分別使用胎牛血清(FBS)和pHPL加基礎培養液原代培養hBMMSCs,比較兩組中的細胞形態、表面標志物、細胞骨架、細胞周期和增殖率,并在加入經典成骨誘導液后檢測兩組中堿性磷酸酶含量、成骨相關基因含量和礦化結節形成,比較其成骨分化能力。結果 FBS和pHPL培養組均能較好地支持hBMMSCs的原代培養,兩組中細胞形態、表面標志物、細胞骨架、細胞周期均無明顯差異,但pHPL組在5、7 d時的細胞增殖率明顯高于FBS組(P<0.05);在成骨誘導后,pHPL組中堿性磷酸酶含量、成骨相關基因含量也明顯高于FBS組(P<0.05),兩組中細胞均可以形成成熟的礦化結節。結論 pHPL能夠很好支持hBMMSCs的原代培養、增殖和成骨分化,且較FBS能更好地促進其增殖和成骨分化。
[關鍵詞]人血小板裂解液;骨髓間充質干細胞;原代培養;增殖;成骨分化
[中圖分類號] R722.12? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1674-4721(2019)6(c)-0013-06
[Abstract] Objective To investigate the effect of pooled human platelet lysate in supporting human bone marrow mesenchymal stem cells for primary culture, propagation and osteogenic differentiation. Methods Multiple outdated platelet concentrates were pooled together. Then pHPL was made after repeated freeze/thaw cycles to activate the platelet. Either pHPL or FBS was used as medium supplement plus basic culture media for primary culture of human bone marrow mesenchymal stem cells. Cell morphology, surface marker expression, Cytoskeleton, growing circle, growth curve and osteogenic markers including ALP level, gene expression and formation of calcified nodules after induction with classic mineralized solution were compared between the two groups. Results There were no difference between the two groups in cell morphology, surface marker expression, cytoskeleton and growing circle. Cell growth rate in pHPL group was much higher than FBS group at 5 and 7 d (P<0.05). Also ALP level and osteogenic markers gene expression in pHPL group were higher than FBS group (P<0.05). Formation of mature calcified nodules was observed in both groups. Conclusion pHPL can support hBMMSCs for primary culture, propagation and osteogenic differentiation, and it is better to promote their propagation and osteogenic differentiation than FBS.
[Key words] Human platelet lysate; Bone marrow mesenchymal stem cells; Primary culture; Propagation; Osteogenic differentiation
組織工程和細胞治療應用中,特定種子細胞在體外適宜條件下的培養、擴增乃至誘導分化是其中非常關鍵的一個環節[1]。既往人體細胞的體外培養均有賴于添加了胎牛血清(fetal bovine serum,FBS)的培養基。雖然其能夠較好地支持細胞的生長和分化,但由于其含有異種蛋白,使得培養后的細胞回植人體可能存在難以預料的風險,這也是實現臨床應用的最大障礙之一[2]。尋找FBS的替代品,建立質量穩定可控的體外培養體系一直是研究的熱點。本研究使用混合異體血小板裂解液(pooled human platelet lysate,pHPL)代替FBS,研究其對人骨髓間充質干細胞(human bone marrow mesenchymal stem cells,hBMMSCs)原代培養、增殖和分化的影響,現報道如下。
1材料與方法
1.1 pHPL的制備
福建省血液中心采用富血小板血漿法制備的5袋濃縮血小板,超過儲存時間而不能用于臨床輸注。濃縮血小板于-30℃冷凍24 h,37℃解凍,混合解凍后的濃縮血小板,并分裝在50 ml離心管內,重復凍融過程一次,獲得激活的pHPL,-30℃冷凍保存。使用時取分裝的pHPL解凍,4℃ 4000 r/min離心15 min,去除碎裂的細胞組織,吸取上清,按體積比10%加入DMEM-LG培養液中備用。本研究獲得福建省立醫院醫學倫理委員會批準,于2017年1月~2019年3月在福建省立醫院中心實驗室完成。
1.2 hBMMSCs的分離和培養
選取臨床上因為退變性疾病需要取髂骨植骨的患者,排除感染性和腫瘤性病變患者。術前獲得患者及家屬知情同意。術中抽取骨髓10~15 ml,通過密度梯度離心法分離hBMMSCs。細胞計數后,以1×107個/ml的密度等量接種于A組:10%FBS(PAN biotech,德國)+DMEM-LG培養液(Gibco,美國)和B組:10%pHPL+ DMEM-LG培養液中,在37℃、5%CO2、飽和濕度下進行培養。24 h半量換液,48 h全量換液,以后每3天換液,待細胞生長至80%~90%時傳代,取第2~4代細胞實驗。
1.3方法
1.3.1倒置顯微鏡觀察細胞形態
倒置顯微鏡逐日觀察兩組細胞的生長情況和形態特征。
1.3.2 hBMMSCs表面標志物的檢測
兩組均取第3代細胞,0.25%胰酶消化采集細胞,PBS洗滌計數后重懸,密度3×106個/ml,取細胞懸液100 μl,加入鼠PE標記的單克隆抗體CD29、CD44、CD105、CD14、CD90(eBlosdence,美國)各20 μl,并以鼠PE標記的IgG1作為同型固定陰性對照,充分混勻,室溫避光半小時。上流式細胞儀進行檢測,并用CellQuest軟件分析結果。
1.3.3細胞骨架免疫熒光染色
取第3代細胞,胰酶消化重懸后,以1×105個/ml的密度接種于12孔板,分別使用2種培養基培養48 h后,吸棄舊培養液,用預溫PBS(37℃)清洗細胞。4%多聚甲醛室溫固定10 min,用0.1% Triton X-100/PBS室溫破膜5 min。5 μl FITC-Phalloidin(聯科生物,中國)貯存液加入150 μl PBS中配成工作液(5 μg/ml)并用以染色細胞,室溫染色60 min。PBS清洗后加熒光封片液封片,倒置熒光顯微鏡下觀察細胞骨架系統,并用ImageJ軟件測量細胞的長度和寬度,計算長/寬比。
1.3.4細胞周期分析
取第3代細胞,消化重懸后以5×103個/ml的密度接種于24孔板內,分別加入兩種培養基,每組3個復孔。培養24 h后,胰酶消化采集細胞,以5×105個/ml的密度重懸于1 ml PBS中并反復振蕩形成單細胞懸液。加入2 ml冷無水乙醇,迅速混勻后4℃過夜固定細胞。用100 mg/ml PI(吉凱,中國)在4℃染色30 min。上流式細胞儀檢測,應用Modifit軟件分析。計算G0/G1期、S期和G2期的細胞百分比。
1.3.5細胞增殖率測定
取第3代細胞,消化重懸后以3×105個/ml的密度接種于96孔板中。邊緣孔用無菌水填充。在培養到一定的時間(1、3、5、7 d)時,向每孔加入10 μl CCK 8溶液(日本同仁),將培養板置于培養箱內孵育2 h。用酶標儀測定在450 nm處的吸光度,檢測細胞增殖率并繪制細胞生長曲線。
1.3.6 hBMMSCs向成骨方向誘導
分別在A、B組中培養液內加入經典成骨誘導液(10 mmol/L β-甘油磷酸鈉、10-8 mol/L 地塞米松、50 mg/L L-抗壞血酸)誘導其向成骨方向分化。
1.3.6.1堿性磷酸酶(alkaline phosphatase,ALP)檢測? 將hBMMSCs細胞懸液以5×103個/ml的濃度接種于24孔板內,分別加入兩種培養基,每組3復孔。48 h后加入成骨誘導液繼續培養。在誘導后第2、6、10、14、18天進行檢測。吸出舊培養基,每孔加入300 μl 0.2% Triton X-100,4℃冰箱過夜,采用ALP檢測試劑盒(碧云天,中國),檢測ALP含量。
1.3.6.2成骨相關基因檢測? 以2×104個/ml的密度將細胞接種于24孔板內,分別使用含有成骨誘導液的2種培養基培養10 d。到時間后,用TRIzol(Invitrogen,美國)溶解細胞,收集細胞內總RNA。將細胞集合到一起以獲得足夠的RNA量。每組等量的總RNA用Superscript Ⅱ first-strand cDNA試劑盒(Invitrogen,美國)反轉錄為cDNA。引物的設計根據RUNX2、ALP、Ⅰ型膠原(COLⅠ)和骨鈣素(Osteocalcin,OC)的核苷酸序列進行,利用引物設計軟件PrimerPrimer 5設計(表1),靶基因的表達水平用持家基因GAPDH的水平作標準化,使用熒光定量PCR(real time PCR)法檢測成骨相關基因含量。
1.3.6.3礦化結節茜素紅染色? 以5×103個/ml的密度分接種于24孔板內,分別加入兩種培養基。48 h后加入成骨誘導液繼續培養至14 d,吸出舊培養基,PBS緩沖液清洗3遍,體積分數75%乙醇固定10 min,采用莤素紅染色的方法檢測礦化結節,染色完成后,用蒸餾水反復漂洗至不再脫色,顯微鏡檢并拍照。
1.4統計學方法
采用SPSS 16.0統計學軟件對數據進行分析,計量資料以均數±標準差(x±s)表示,采用t檢驗,以P<0.05為差異有統計學意義。

