新加坡輔助健康產品分類和監管體系分析
陳結梅 劉偉德 李振 孫紅梅

摘?要:對新加坡市場的輔助健康食品分類和監管體系進行分析,為中國企業在新加坡發展輔助健康產品提供參考。
關鍵詞:新加坡;輔助健康產品;監管體系
新加坡的輔助健康產品和食品屬于不同分類,具有不同的法規和監管體系。
1?新加坡輔助健康產品的分類
在新加坡輔助健康產品與西藥、醫療器械、化妝品被共同列入健康產品的范疇。輔助健康產品又可細分為四個小類:傳統藥材、中成藥、健康補充劑、傳統藥物&順勢療法藥物。在新加坡,輔助健康產品均為非處方藥,無需在藥劑師的監督下即可銷售。
1.1?傳統藥材
傳統藥材是指源自植物、動物或者礦物的原生態藥材,或者經過簡單處理(如切割、干燥)的加工藥材。傳統藥材包括中成藥、傳統印度藥、傳統馬來西亞藥以及其他國家的植物藥中所使用的藥材。根據銷售時的形態可分為兩大類:一類以松散或散裝形式出售;另一類是以預包裝銷售形態(在包裝材料標明產品名稱、品牌、成分、和/或使用劑量和方法)出售[1-2]。
1.2?中成藥
中成藥在新加坡具有特定的含義,是指任何用于傳統中醫治療的藥品,此藥品必須:(a)已經被制成成品;(b)包含1種或多種完全來源于植物、動物、礦物或其組合的活性成分;(c)這些活性成分要求記載于現今版的《中藥大辭典》或《本草綱目》中,但是不包括:(i)任何用于人體注射的藥品;(ii)任何以從植物、動物或礦物中分離出的化學物質為有效成分的藥品;(iii)任何被《毒藥法令》列入毒藥名單的藥品[3-4]。
1.3?健康補充劑
健康補充劑是指用于補充飲食,以提高和改善人體的健康功能的任何產品,其包含以下一種或多種或組合成分:(i)維生素、礦物質、氨基酸、脂肪酸、酶、益生菌和其他生物活性物質。(ii)從自然來源,包括動物、礦物和植物材料的提取物及其他衍生物、分離、濃縮、代謝物。(iii)上述i和ii中提到的合成成分。健康補充劑按小劑量單位給藥,其具有如下劑型:膠囊劑、軟膠囊劑、片劑、溶液劑、糖漿劑以及衛生科學局認為合適的其他劑型(備注:不包含注射劑型)[5]。
1.4?傳統藥物順勢療法藥物
傳統藥物是指傳統印度藥和傳統馬來西亞藥。順勢療法藥物是指能使人體內產生“人工疾病”,進而增進機體免疫功能,引起身體自我保護來治療疾病,且沒有副作用的藥物。順勢療法藥物組成包括植物、動物、微生物、礦物等[6]。
2?新加坡輔助健康產品法規體系
新加坡現行輔助健康產品的法律體系包括《藥物法令》《毒藥法令》《藥品(廣告與銷售)法令》《藥品銷售法令》《藥品濫用法令》《健康產品法》等。此外,還包括依據這些法律制定的法規和指南等。其中,居于核心地位的是《藥物法令》。
2.1?藥物法令
藥物法令是建立醫藥產品注冊制度的法律基礎。該法令對醫藥產品內容及注冊、執照和許可證的發放、醫藥品交易、醫藥品商業活動、醫藥品容器、包裝及成分以及醫藥品銷售與廣告等多個方面的法律規范作了具體明確的闡述。
2.2?藥品銷售法令
藥品銷售法令對藥品作了嚴格定義,指出任何人類使用作為內用或外用藥物的物質或物質混合物,包括麻醉藥均為藥品而不論其是否宣傳或描述為藥品(但是不包括非醫療用途的物質和混合物及面用粉劑、除塵用品及衛生間清潔用品)。圍繞藥品,該法令就分析檢驗人員、管理機構官員、藥品檢驗程序和證明文件、違反法令的處罰等作了描述。該法令著重于藥品品質管理方面。
2.3?藥品(廣告與銷售)法令
藥品(廣告與銷售)法令中心內容是禁止藥品廣告。它明文規定不許向任何政府管理部門、公共醫療管理系統或得到授權的廣告管理機構提出申請制作藥品銷售廣告,違反規定即為違法。
2.4?健康產品法
除新加坡《藥物法令》所定義的藥品以外,還有很多與健康相關的其他產品,因此,新加坡制定了健康產品法。該法共分15個部分,對健康產品從生產、進口、供應、注冊、備案、零售商、廣告、活性成分、執法、假定和證據、違法和起訴、獸藥管理等方面作出了規定。新加坡各類別輔助健康產品所必須遵循的法律法規見附表。
3?新加坡輔助健康產品監管體系
3.1?監管機構
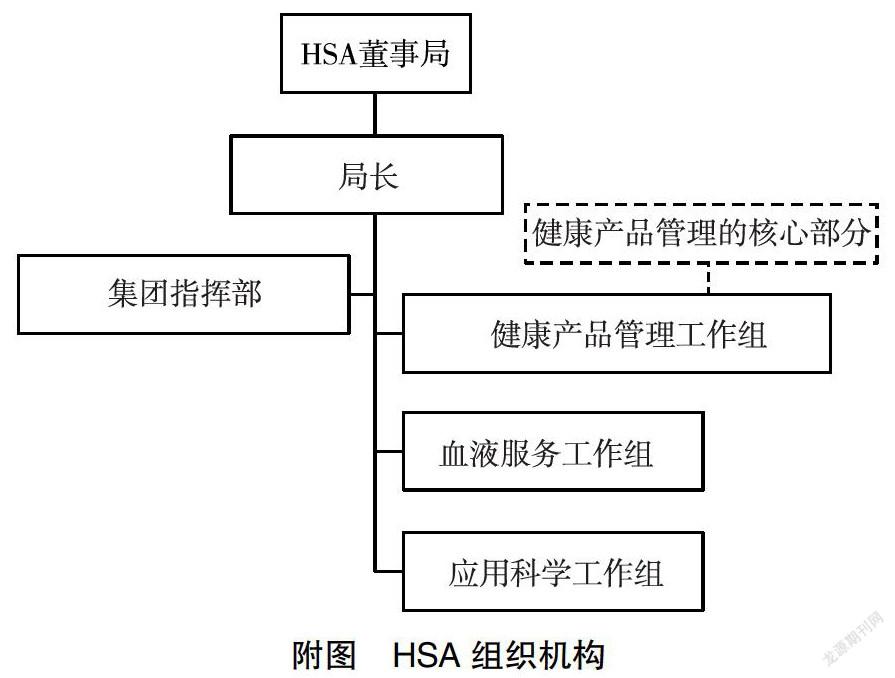
輔助健康產品在新加坡的監管機構是衛生科學局(Health Sciences Authority,HSA),成立于2001年4月,隸屬于新加坡衛生部。HSA下設1個集團指揮部和血液服務、健康產品管理、應用科學3個工作組(附圖),其中,健康產品管理工作組是負責新加坡健康產品管理的核心部門,下設上市前主管部門、上市后主管部門、審計和許可分部以及工作組主任辦公室。其中,上市前主管部門又設西藥分部、醫療器械分部、輔助健康產品分部、化妝品分部,上市后主管部門下設警戒分部、合規執行分部和煙草管理分部。
3.2?上市前審批
新加坡對不同類別輔助健康產品上市前許可管理的程度不盡相同,目前傳統藥材、健康補充劑、傳統藥物&順勢療法藥物這三類產品無需上市前審批即可在新加坡上市銷售。但中成藥必須通過上市前審批,獲得中成藥產品批準和中成藥經銷商執照后方可上市銷售[6]。
由于新加坡對健康產品的定義和歸類與其他國家之間可能存在差異,因此,新加坡HSA建立針對擬在新加坡上市健康產品的歸類咨詢服務機制,企業可通過填寫并發送咨詢表格向HSA咨詢目標產品歸類問題,以便進一步明確是否需要進行上市前審批或登記注冊。
3.3?上市后監管
3.3.1?產品供應鏈完整性監測?HSA健康產品管理工作組設專人負責“產品供應鏈完整性監測”,即對高風險產品供應鏈的各個環節,包括生產工廠、進口商、批發商、零售商等進行監測,以便通過主動監督檢查,盡早發現假劣產品以及其他不符合標準的輔助健康產品。
3.3.2?高風險產品全程監控、重點品種主動出擊?新加坡對輔助健康產品上市后的監管更體現出“高風險產品全程監控、重點品種主動出擊”。所謂高風險產品主要包括聲稱治療性功能障礙、減肥、糖尿病、關節炎等病癥或廣告宣傳虛假夸大的輔助健康產品,尤其加強了對無需上市前審批的健康補充劑的上市后監測。監測內容涵蓋產品的不良反應報告、投訴舉報、GMP檢查報告、廣告宣傳等。HSA根據收集到的信息進行綜合分析,鎖定重點監督的產品進行抽樣檢驗,對不合格產品及有非法添加物的產品及時進行查處。
4?結論
綜上,在新加坡,輔助健康產品被歸為健康產品,由新加坡HSA下屬的健康產品管理工作組進行管理。輔助健康產品大致分為傳統藥材、中成藥、健康補充劑、傳統藥物及順勢療法藥物四類。目前,中成藥必須通過上市前審批,獲得中成藥產品批準和中成藥經銷商執照后方可上市銷售,其他三類產品則無需上市前審批即可在新加坡上市銷售。盡管如此,進口商、生產商、批發商和銷售商有義務遵守相關產品的法律法規,確保產品上市前和上市后全流程的質量和安全。
參考文獻
[1]HEALTH SCIENCES AUTHORITY.Guidelines for Traditional Medicinal Materials[S].
[2]HEALTH SCIENCES AUTHORITY.Guidance on Advertisements of Traditional Medicinal Materials(Mar 2005)[S].
[3]HEALTH SCIENCES AUTHORITY.Guidelines on Application for Chinese Proprietary Medicines Dealers License[S].
[4]HEALTH SCIENCES AUTHORITY.Guidelines on Chinese Proprietary Medicines Product Listing[S].
[5]HEALTH SCIENCES AUTHORITY.Guidelines for Health Supplements(Revised February 2015)[S].
[6]HEALTH SCIENCES AUTHORITY.Transmissible Spongiform Encephalopathy(TSE)Guidelines(updated September 2008)[S].
(責任編輯?唐建敏)

