降膽固醇乳酸菌的益生特性及其作用機理
付永巖,趙悅含,王毅超,高達,孫長豹,姜瞻梅,劉飛,侯俊財
(東北農業大學乳品科學教育部重點試驗室,哈爾濱150030)
0 引言
近年來,因高膽固醇引起的動脈粥樣硬化及心腦血管等病發癥逐年升高,全球人類的健康受到了嚴重影響[1-2]。一些專家致力于益生菌的研究,包括其降膽固醇的益生作用逐漸被發掘,引發國內外廣泛關注[3]。在食品加工過程中,高效降膽固醇菌種具有重要的應用價值,通過添加益生菌的保健食品來控制人體內膽固醇含量,促進和防治心腦血管的健康及疾病,極有可能成為保健食品下一個高速發展的領域[4-5]。
本研究旨在通過引入共沉淀、體外去除膽固醇量等方法,初探乳酸菌降膽固醇作用機理,在通過模擬胃液胰液實驗測試菌株的耐受性以及抗生素抗性和疏水性指標來評價降膽固醇菌株的潛在益生特性,使之能更加有效的降低心腦血管等疾病的發病率,為以后的食品、醫療事業提供依據。
1 實驗
1.1 材料
膽固醇,正乙烷和95%乙醇,鄰苯二甲醛,牛膽鹽。植物乳桿菌117-1和23-1,鼠李糖乳桿菌118-1,糞腸球菌M 53-2,乳酸乳球菌L14-3五種菌株均由東北農業大學乳品科學教育部重點實驗室乳酸菌菌種庫提供。
1.1.1 儀器
潔凈工作臺VD-1320,電熱恒溫培養箱DHP-9272,DK-8D型電熱恒溫水槽,全自動高壓滅菌鍋HVE-50,低溫冷凍離心機,離心機GL-21M,DELTA320型pH計。
1.1.2 培養基
(1)MRS液體培養基成分如表1所示。

表1 MRS液體培養基
(2)配制MRS固體培養基:在液體培養基的基礎上加入1.8%(w/v)的瓊脂。
(3)配制MRS-Oxgall-CHOL液體培養基:在液體培養基的基礎上加入(體積分數0.2%)疏基乙醇酸鈉,過濾除菌的100μg/mL膽固醇和3 g/L牛膽鹽。
1.2 方法
1.2.1 膽固醇含量的測定
采用鄰苯二甲醛法[6]:取1 mL樣品、6 mL 95%乙醇和4 mL質量濃度500 g/L氫氧化鉀放入試管中,旋渦振蕩混勻。60°C恒溫水浴鍋中加熱10 min,添入10 mL正己烷,萃取20 s,添加4 mL蒸餾水,靜置15 min。吸取8 mL正己烷層,水浴氮氣(60°C)吹干。添加4 mL質量濃度0.5 mg/mL的鄰苯二甲醛溶液(已用冰醋酸定容),靜置10 min。向每個試管內部吸移2 mL濃硫酸,旋渦震蕩20 s,靜置顯色反應10 min。檢測OD550nm,空白對照為未接菌的培養液,重復3次。
膽固醇標準曲線的制作:無水乙醇把0.1 g膽固醇粉末定容成質量濃度1 mg/mL的溶液。配制成質量濃度為5,10,15,20,25和30μg/mL的膽固醇溶液,參照上述方法,檢測OD550nm,并以吸光度值為縱軸,以膽固醇質量濃度為橫軸[7]。
1.2.2 降膽固醇能力的測定
菌株活化兩代后,在MRS-Oxgall-CHOL液體培養基中接入體積分數為3%的接種量,厭氧37℃下,24 h后置于離心機(轉速12 000 r/min,10 min),空白對照選用未接種菌株培養液。參照1.2.1的方法,按膽固醇標準曲線計算膽固醇去除量,其計算公式為
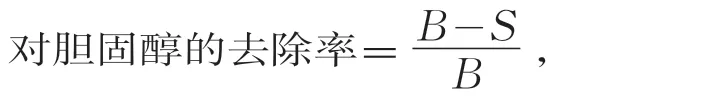
式中:B和S分別為未接種菌株和接種菌株培養液離心上清液的膽固醇質量濃度,μg/mL。
1.2.3 降膽固醇菌株潛在的益生特性
1.2.3.1 酸耐受性和膽鹽耐受性
制備人工胃液:用滅菌后的PBS將(1∶10000)胃蛋白酶配制成3 mg/mL的溶液,在用1 mol/L鹽酸調至成pH值為2.0和3.0,經0.22μm微孔濾膜過濾備用[8]。制備人工胰液:用滅菌后的PBS將(1∶250)胰蛋白酶配制成質量濃度為1 mg/mL溶液,在用濃度為1 mol/L氫氧化鈉調至成pH值為7.0,經0.22μm微孔濾膜過濾備用。
模擬人工胃液耐受性實驗:菌株活化兩代后,以體積分數為2%接種量接于MRS液體培養基中,培養18 h。并于轉速為8 000 r/min下離心10 min,用PBS洗滌2次。將菌體重新懸浮于5 mL的的人工胃液中。在p H值為2.0人工胃液中孵育0,0.5 h和p H值為3.0下孵育0,1 h和3 h后,采用平板涂布法計算活菌數量,重復3次實驗。
模擬人工胰液耐受性試驗:前期處理參照模擬胃液耐受性實驗,并重新懸浮于5 mL的人工胰液中,采用平板涂布法計算培養0,1,2,3 h的活菌數量,重復3次實驗[9]。
存活率=處理后活菌數/未處理活菌數×100%。
1.2.3.2 抗藥性
菌種活化兩代,在15 mL的MRS瓊脂培養基中,添加15 mL含有10%新鮮適宜濃度菌液的軟瓊脂(0.8%的瓊脂)。在無菌條件下,將藥敏檢測紙片輕貼與冷卻后的培養基中,培養24 h后觀察并測量抑菌圈直徑大小,質控菌:金黃色葡萄球菌ATCC 25923。方法與供試菌株相同,參照美國臨床和試驗室標準化協會公布的藥敏試紙標準[10],重復3次實驗。
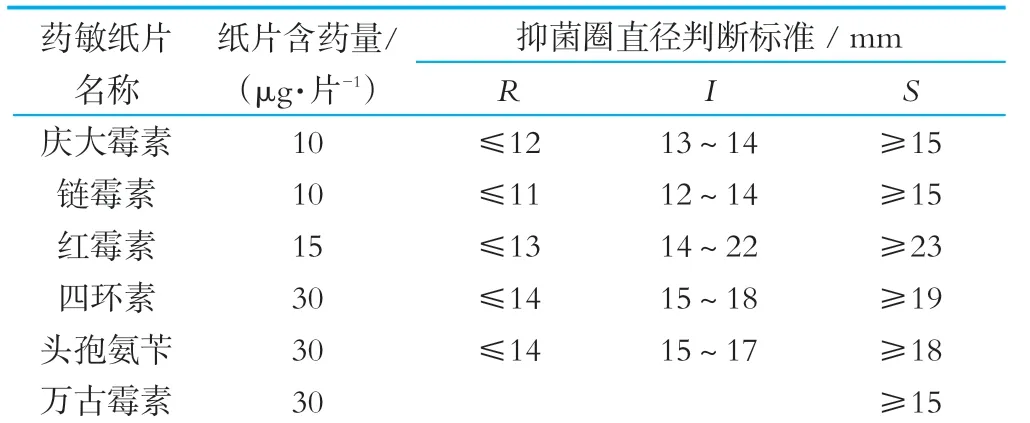
表2 藥敏紙片含藥量及抗性判斷標準
1.2.3 降膽固醇的作用機理
菌株活化2次后,在MRS液體培養基中添加質量濃度為2 g/L的牛膽鹽,121℃下滅菌15 min,加入除菌的100μg/mL膽固醇。
以體積分數為2%接種量分別加入添加和未添加膽鹽的MRS-CHOL液體培養基中,37℃下培養48 h,并在轉速為5 000 r/min下,離心10 min,參照1.2.1的方法,測定膽固醇濃度(標記為A、B)。用5 mL p H值為7.0濃度為0.1 mol/L的PBS重懸未添加膽鹽培養基中的菌泥(不添加膽鹽的MRS-CHOL培養基培養的菌泥),取各10μL濃度為50 mg/L的溶菌酶和質量分數為10%的SDS添加到1 mL菌懸液中,37℃水浴1 h,超聲破碎后置于離心機中(轉速8 000 r/min,10 min)離心,測定上清液膽固醇含量(D)。將剩余菌懸液再次離心(5 000 r/min,4℃),并測定上清液膽固醇質量濃度(C),在轉速為8 000 r/min,4℃下,用1 mL的PBS洗滌破壁處理后的剩余菌泥2次,離心10 min后棄上清,用1mL無水乙醇重懸菌泥,在5 000 r/min,10 min離心后,測定1 mL上清液膽固醇質量濃度(E)[11-12]。重復3次實驗,膽固醇去除量的計算公式為
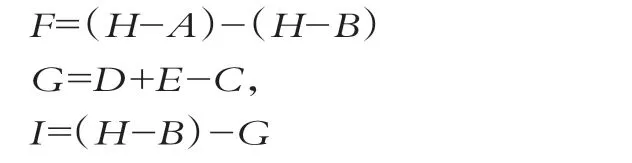
式中:F為膽酸鹽與膽固醇共沉淀量;G為菌體吸收去除膽固醇量;H為不接種的添加膽鹽的MRS-CHOL培養基中膽固醇質量濃度;I為細胞膜的結合量。
1.2.4 數據統計與分析
采用Excel2016軟件分析數據,每個實驗重復3次;采用SPASS19.0軟件進行差異顯著性分析,結果表示為平均值±標準差。
2 結果分析
2.1 膽固醇標準曲線的繪制
膽固醇標準曲線如圖1所示,膽固醇的濃度與OD值的關系為y=0.0297x+0.0377,線性相關系數R2=0.993,線性相關良好。
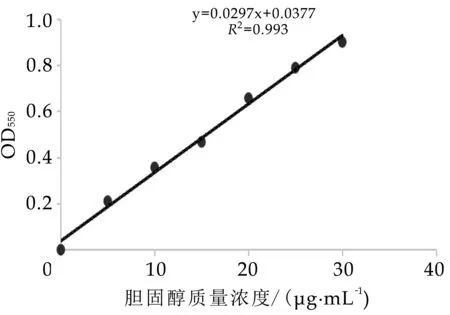
圖1 膽固醇標準曲線
2.2 乳酸菌株的降膽固醇測定
通過菌體在含膽固醇的培養基中培養前后的膽固醇含量變化的差值評價菌株的降膽固醇能力。依據圖1所繪膽固醇標準曲線,按照1.2.1的方法進行降膽固醇作用體外篩選,菌株名稱均采用原始編號。由表3可知,5株菌體外膽固醇去除率均在25%以上,對培養基中膽固醇的去除能力表現出了明顯的差異(P<0.05),乳酸乳球菌L14-3的膽固醇去除能力最強,為35.90%。

表3 乳酸菌對膽固醇的去除能力
2.3 降膽固醇菌株潛在的益生特性
2.3.1 酸耐受性
5株降膽固醇菌株對人工胃液的耐受性如圖2所示。
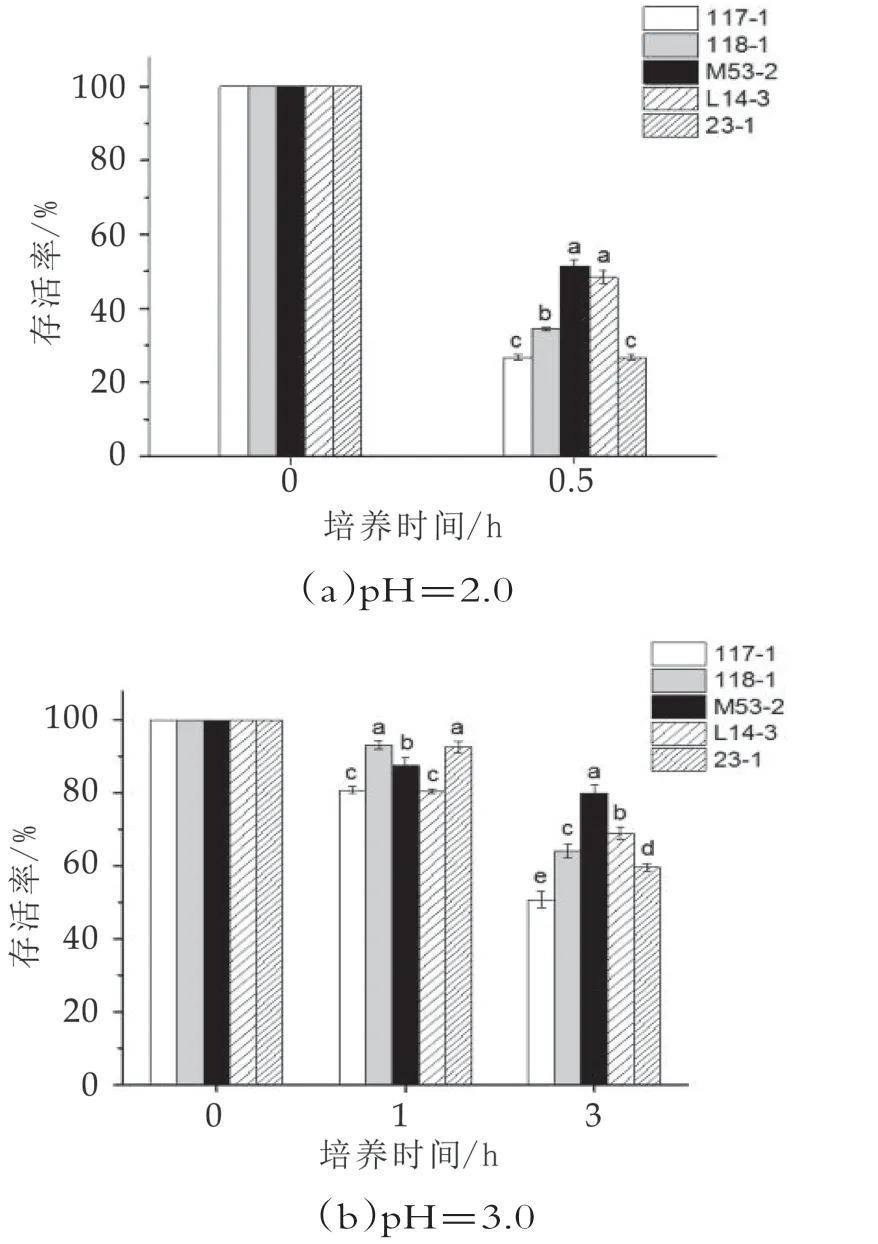
圖2 人工胃液的耐受性
受試菌在p H值為2.0的人工胃液中孵育1 h后,無活菌檢出。由圖2(a)可知,孵育0.5 h后,植物乳桿菌117-1,23-1和鼠李糖乳桿菌118-1活菌數都下降到103mL-1水平以下,說明這3株菌在p H值為2.0的環境下耐受性不好,存活率顯著降低。糞腸球菌M 53-2和乳酸乳球菌L14-3的活菌數顯著高于其他3株菌(P<0.05)。
由圖2(b)可知,在pH值為3.0條件下孵育1 h后,5株菌株的活菌數并未顯著減少,鼠李糖乳桿菌118-1和植物乳桿菌23-1存活率顯著高于其他菌株(P<0.05),說明這兩株菌在pH值為3.0和1 h時有較好的耐受性。3 h后,5株菌的存活率均存在顯著差異(P<0.05)。糞腸球菌M 53-2的存活率顯著高于其他4株菌,這說明菌株M 53-2對p H值為3.0的模擬胃液有較好的耐受性,其次是乳酸乳球菌L14-3和鼠李糖乳桿菌118-1。植物乳桿菌23-1和117-1的存活率相對較低。圖2中,數據角標不同即差異顯著(P<0.05)。下同。
2.3.2 膽鹽耐受性
5株降膽固醇菌株對人工胰液的耐受性見圖3。5株菌在人工胰液中的存活率較高,孵育1 h后活菌數較0 h時無明顯差異。但在孵育2~3 h后,菌株存活率有所下降。孵育2 h后菌株的存活率存在顯著差異(P<0.05),糞腸球菌M 53-2和乳酸乳球菌L14-3的存活率相對較低;在孵育3 h后,存活率最高的是鼠李糖乳桿菌118-1;存活率最低的是糞腸球菌M 53-2,活菌數降至2.07×107mL-1。綜上所述,鼠李糖乳桿菌118-1和植物乳桿菌117-1對人工胰液的耐受性更好,并且存活率顯著高于其他菌株(P<0.05)。
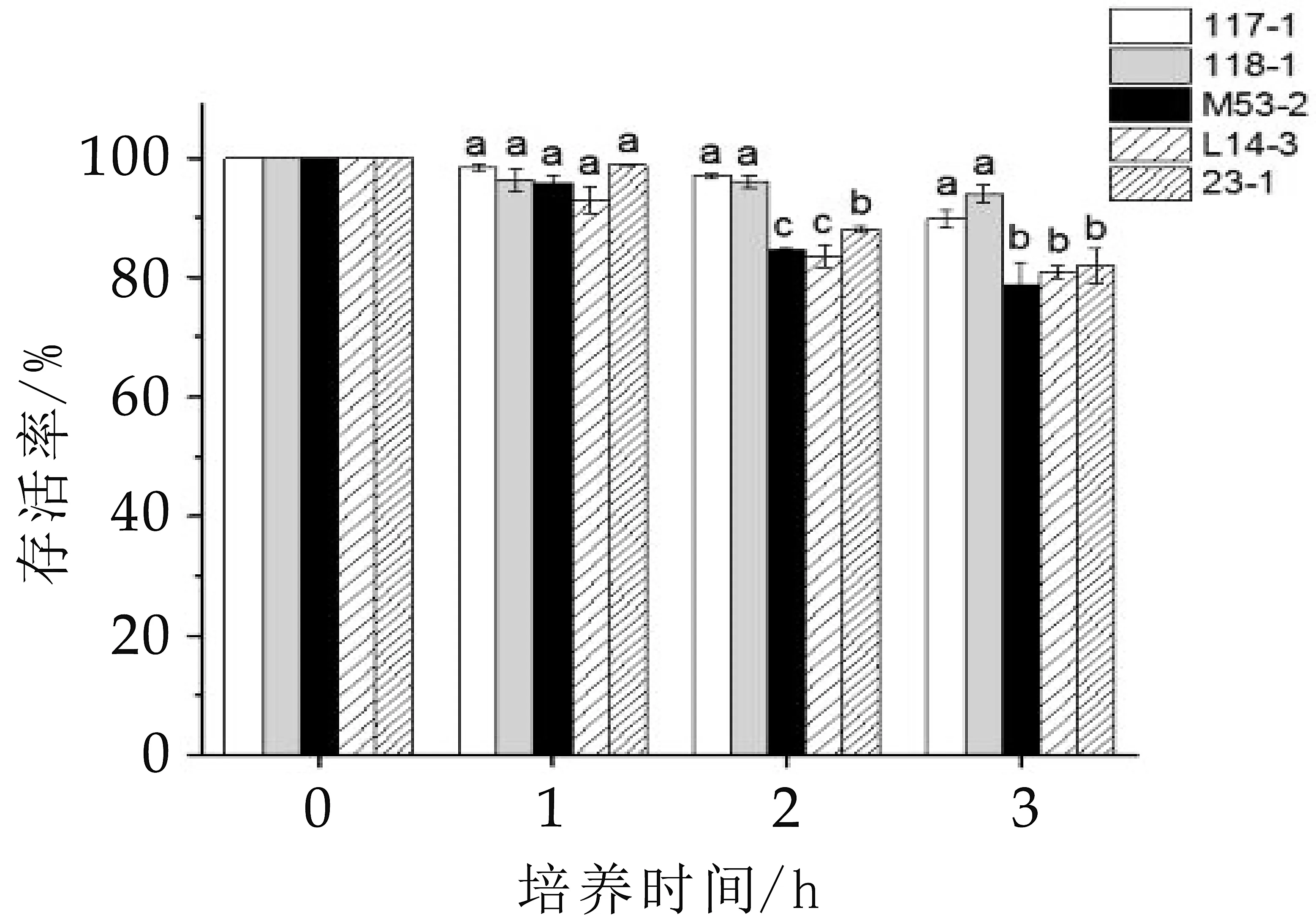
圖3 對人工胰液的耐受性
2.3.3 抗藥性
5株菌株對6種抗生素的抗藥性實驗,結果如表4所示。表4中,5株供試菌株都至少對一種抗生素具有抗性,植物乳桿菌117-1對4種抗生素表現為抗性,鼠李糖乳桿菌118-1、糞腸球菌M 53-2和植物乳桿菌23-1對3種抗生素表現為抗性,乳酸乳球菌L14-3僅對鏈霉素表現為抗性。
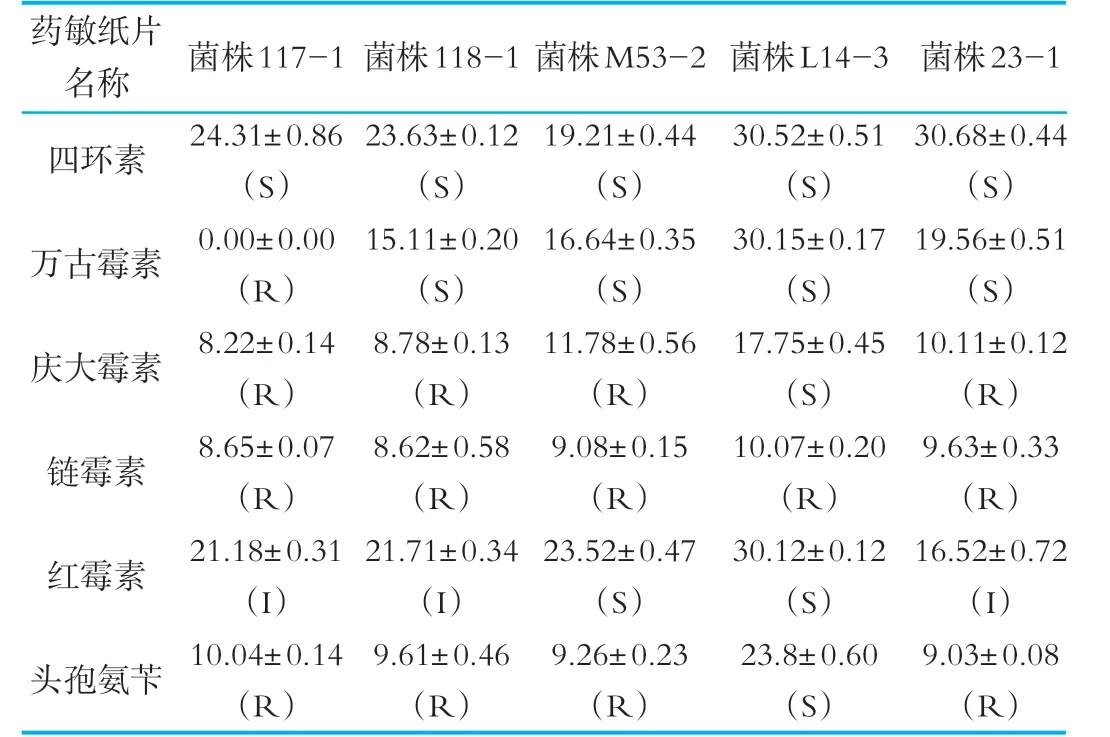
表4 抑菌圈直徑及抗性結果
2.4 菌體吸收和共沉淀作用
表5所示為5株菌株體外膽固醇去除率,以膽固醇、膽鹽的共沉淀作用和菌體細胞吸收為去除體外膽固醇的主要形式。在培養過程中5株菌株均會產酸。酸性條件下部分膽固醇與膽鹽行成沉淀,另一部分通過菌體吸收作用而除去,少部分依靠細胞膜的結合作用。鼠李糖乳桿菌118-1通過菌體吸收作用去除的膽固醇量占總去除率的比例最高,為31.81%,其次是植物乳桿菌117-1和23-1,分別為27.91%、26.59%,糞腸球菌M 53-2和乳酸乳球菌L14-3最低,分別為20.66%和16.33%;乳酸乳球菌L14-3通過共沉淀作用去除的膽固醇量占總去除率的比例最高,為81.23%,其次是菌株M 53-2和23-1,分別為74.03%和71.28%,菌株117-1和118-1最低,分別為66.36%和63.69%。
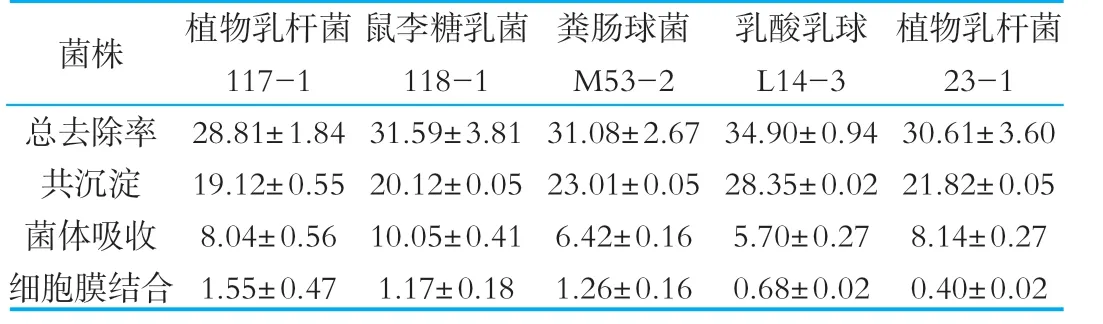
表5 菌株體外膽固醇去除率的分布 %
3 結果與分析
現如今國內外降膽固醇的作用機理尚未清晰,Rossi等人[13]認為膽固醇通過摻入細胞膜方式,從而改變細胞膜的韌性;Gilliland[6]認為是依靠于乳酸菌菌體的吸收作用;其他研究表明降膽固醇與菌體的膽鹽水解酶活力有關[14]。本研究中菌株通過膽固醇、膽鹽的共沉淀作用和菌體細胞吸收作用去除膽固醇所占比例大,與李昵[15]的研究結果相似。菌株118-1菌體吸收作用去除的膽固醇量占總去除率的比例最高,為31.81%,菌株117-1和菌株23-1分別為27.91%和26.59%,菌株M 53-2和菌株L14-3最低,分別為20.66%和16.33%。說明該5株菌具有在人體內降低血清膽固醇的潛力。
空腹時人體胃液的pH范圍在1.3~1.8,隨著食物或乳制品的攝入升高至3.0或更高,在pH值為3下存活1.5~2 h被認為是益生菌低p H值耐受性的一個標準。在p H值為2.0人工胃液的條件下孵育1 h后,5種菌株均無存活,說明抗性較差。食物在人體胃內的停留時間大約2 h,孵育2 h后,5種菌株的活菌數均在107mL-1水平及以上,其中植物乳桿菌23-1和鼠李糖乳桿菌118-1的活菌數在108mL-1水平,較初始活菌數相差不多,說明植物乳桿菌23-1和鼠李糖乳桿菌118-1耐酸性較好;在pH值為3.0條件下孵育3 h,5種菌株菌落數均在104mL-1水平及以上,其中糞腸球菌M 53-2和乳酸乳球菌L14-3的活菌數在106mL-1水平。說明在p H值為3.0條件下5株菌株耐受性良好。
益生菌對腸液的耐受性更為重要,只有在腸液中定植才能發揮更好的益生作用,人體的小腸屬中性環境,故選用人工胰液pH值為8.0測定菌株對胰液的耐受性。Begley等[16]人指出:不同乳酸菌對膽汁的耐受程度不同,Usman[17]和Liong等[18]人也相繼發現,不同乳酸菌對質量分數為0.3%牛膽鹽的耐受性不同,各菌株之間的耐受性有所差異。在模擬胰液的耐受性試驗中,在p H值為8.0人工胰液條件下孵育3 h,鼠李糖乳桿菌118-1和植物乳桿菌117-1的活菌數均能維持在108mL-1左右,說明這兩株菌對胰液具有較好的耐受性,而其他3株菌的活菌數均在107mL-1水平,對胰液的耐受性相對較弱。說明菌株在模擬人工胃腸道環境中存活性較好。
本研究結果表明,只有植物乳桿菌117-1對萬古霉素具有抗性。D'Aimmo等[19]研究表明,受試乳酸菌對慶大霉素表現為抗性,對紅霉素敏感,但是對鏈霉素、四環素的抗藥性差異較大。Zhou,N等[20]研究表明,從酸奶中分離的35株乳酸菌對鏈霉素、慶大霉素的抗藥率高于80%;秦宇軒等[21]研究表明所有供試乳酸菌均對慶大霉素和鏈霉素具有抗性,部分菌株對萬古霉素表現為抗性,對紅霉素和四環素表現為敏感或中度敏感。以上的研究結果與本研究基本一致,在5株菌株中植物乳桿菌117-1的抗藥性最好。
4 結論
本試驗結果表明,盡管降膽固醇機制有很多理論,但絕大多數是在體外以共沉淀和菌體吸收的形式來降低膽固醇,其作用機理仍需不斷深入研究。在降膽固醇乳酸菌的潛在益生性的研究中,5株菌株表現出能更加有效地降低高膽固醇引發的病發率潛在前景,綜合評價5株菌在模擬胃液、胰液中的存活率,表面疏水性及抗生素抗性的耐受情況,植物乳桿菌117-1和鼠李糖乳桿菌118-1抗逆性較強,可以為以后的食品、醫療等事業提供相應理論依據。

