水稻OsTFL2基因啟動(dòng)子的克隆及功能驗(yàn)證
劉芳 關(guān)和新 邱永福 陳立 張曉東 王心怡 韋清源 李虎 綦熿松


摘要:【目的】克隆水稻TFL2(OsTFL2)啟動(dòng)子序列,并分析其結(jié)構(gòu)和功能,為深入研究OsTFL2基因?qū)λ鹃_花和花發(fā)育的調(diào)控機(jī)理提供理論參考。【方法】采用同源克隆方法克隆OsTFL2基因啟動(dòng)子序列,利用PLACE和PlantCARE分析其結(jié)構(gòu)和功能,并將其連接至攜帶β-葡萄糖苷酸酶(GUS)基因的pCAMBIA1301載體以構(gòu)建pCAMBIA1301-Promoter植物表達(dá)載體,通過農(nóng)桿菌介導(dǎo)轉(zhuǎn)化水稻品種農(nóng)墾58愈傷組織,通過對(duì)轉(zhuǎn)基因植株進(jìn)行GUS組織化學(xué)染色以分析該基因啟動(dòng)子的表達(dá)特性和調(diào)控功能。【結(jié)果】克隆獲得的OsTFL2基因起始密碼子上游啟動(dòng)子序列1.8 kb,該序列除含有真核生物典型啟動(dòng)子元件TATA-box和CAAT-box外,還含有花粉特異識(shí)別的順式作用元件Pollen1lelat52(AGAAA)、開花基因轉(zhuǎn)錄相關(guān)的多功能轉(zhuǎn)錄因子CACTFTPPCA1(PACT,Y=C/T)、CCAAT box1(CCAAT)、DOFCORE(AAAG)和GATA box(GATA)、分生組織特異性元件CCGTCC-box及多個(gè)光誘導(dǎo)元件或光誘導(dǎo)相關(guān)元件如G-box、Box I、CATT-motif、GATA-motif和GT1-motif等,推測(cè)OsTFL2基因通過上述作用元件參與調(diào)控水稻花發(fā)育及開花。通過PCR檢測(cè)共篩選獲得16株陽性轉(zhuǎn)基因植株,對(duì)其進(jìn)行GUS組織化學(xué)染色,結(jié)果發(fā)現(xiàn)水稻的外穎、花、花藥、柱頭和子房中均可檢測(cè)到明顯的GUS色斑,而在葉片、莖尖和根尖無明顯的GUS色斑,說明OsTFL2啟動(dòng)子能驅(qū)動(dòng)GUS基因在水稻外穎、花藥和子房中表達(dá)。【結(jié)論】OsTFL2基因啟動(dòng)子具有啟動(dòng)活性和組織表達(dá)特異性,可在一定程度上影響OsTFL2基因表達(dá),對(duì)水稻花生長(zhǎng)發(fā)育和開花發(fā)揮重要調(diào)控作用。
關(guān)鍵詞: 水稻;開花;TFL2基因;啟動(dòng)子;轉(zhuǎn)基因;GUS染色
中圖分類號(hào): S511.035.3? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻(xiàn)標(biāo)志碼: A 文章編號(hào):2095-1191(2019)10-2188-08
Cloning and functional identification of rice OsTFL2 gene promoter
CHEN Li1, ZHANG Xiao-dong1, WANG Xin-yi1, WEI Qing-yuan1,2, LI Hu1,
QI Huang-song1, LIU Fang1, GUAN He-xin1, QIU Yong-fu1*
(1College of Agricultural/State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,
Guangxi University, Nanning? 530004, China; 2Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning? 530007, China)
Abstract:【Objective】The purpose was to clone the promoter sequence of gene OsTFL2 and then to study its structure and function,which would be favor for advanced mechanism analysis of rice flowering and flower development regulated by gene OsTFL2. 【Method】Homologous cloning method was applied to obtained the promoter sequence of OsTFL2 gene, PLACE and PlantCARE analysis were then conducted to analyze its structure and function. Furthermore,it was connected with vector pCAMBIA1301 carrying β-glucuronidase(GUS) gene to construct plant expression vector pCAMBIA1301-Promoter,which was then transferred to the callus tissue of rice variety Nongken 58 through agrobacterium induction. Finally,GUS staining method was conducted to detect the expression characterization and regulation function of the promoter with transgenic plants. 【Result】One 1.8-kb fragment of the upstream promoter sequence of OsTFL2 geneinitiation codon was cloned and it had typical promoter components of eukaryote,such as TATA box and CAAT-box. It also included the special cis-acting regulatory elements Pollen1lelat52(AGAAA),the specific multi-functional transcription factors that related to flowering genetic transcription CACTFTPPCA1(PACT,Y=C/T),CCAAT box1(CCAAT),DOFCORE(AAAG),and GATA box(GATA),the special component of meristem tissue CCGTCC-box,the light responsive elements G-box,Box I,CATT-motif,GATA-motif,and GT1-motif. The result suggested the OsTFL2 may regulate the flower development and flowering through the special elements. Furthermore,a total of 16 positive transgenic rice plants were obtained by PCR detection. The histochemical staining of GUS revealed that the GUS staining could be detected in the out glume,flower, anther,stigma and ovary of rice,but there were no obvious GUS staining in leaf, stem tip and root tip, which indicated the OsTFL2 promoter could be expressed in the out glume, anther and ovary. 【Conclusion】The cloned OsTFL2 promoter has promoting activity and shows tissue specific expression function,it affects expression of OsTFL2 gene to some extents and play a? role in regulation of flower development and flowering in rice.
Key words: rice(Oryza Sativa); flowering; OsTFL2 gene; promoter; transgenic gene; GUS staining
0 引言
【研究意義】開花是植物生命周期中最重要的生長(zhǎng)發(fā)育過程。水稻(Oryza sativa)作為我國(guó)重要的糧食作物,花的發(fā)育與其產(chǎn)量密切相關(guān)。隨著分子遺傳學(xué)技術(shù)的逐步完善,已發(fā)現(xiàn)大量參與調(diào)控植物開花的基因,如TFL2在植物花發(fā)育中發(fā)揮非常重要的作用(Guan et al.,2011)。研究表明,TFL2基因表達(dá)產(chǎn)物是異染色質(zhì)相關(guān)蛋白1(Heterochro-matin-associated Protein1,HP1)的同系物L(fēng)HP1(Gaudin et al.,2001;Kotake et al.,2003),HP1是多梳抑制復(fù)合物(Polycomb repressive complexes,PRCs)的重要組成成分,而PRCs通過抑制大量功能基因在花發(fā)育過程中發(fā)揮關(guān)鍵作用(Hecker et al.,2015)。因此,克隆水稻TFL2基因(OsTFL2)啟動(dòng)子,分析其結(jié)構(gòu)與功能,以了解開花和成花機(jī)理,對(duì)延長(zhǎng)水稻收獲期、提高其產(chǎn)量及降低生產(chǎn)成本具有重要意義。【前人研究進(jìn)展】目前,已有大量植物開花相關(guān)基因的研究報(bào)道,其中大多以模式植物擬南芥為研究對(duì)象。研究發(fā)現(xiàn),擬南芥的FLOWERING LOCUS T(FT)和TERMINAL FLOWER1(TFL1)基因突變將改變花序的結(jié)構(gòu)(Tsaftaris et al.,2012),且擬南芥中僅有一個(gè)HP1蛋白編碼基因,即AtLHP1,也稱為AtTFL2或AtTU8(Valdés et al.,2012;Berke and Snel,2015),其突變會(huì)導(dǎo)致早花、頂端花序、光周期敏感性低和植株矮小等表型(Rizzardi et al.,2011),也可抑制部分開花相關(guān)基因表達(dá),如Pistillata(PI)、Sepallata3(SEP3)(Kotake et al.,2003)、Flowering Locus C(FLC)(Kotake et al.,2003;Mylne et al.,2006;Liu et al.,2009)、Flowering Locus T(Takada and Goto,2003;Nakahigashi et al.,2005)、AgmousAG(AG)(Sung et al.,2006)、Vernalization 1(VRN1)(Liu et al.,2009)等。此外,在其他植物如黃瓜、甘蔗和玉米中也發(fā)現(xiàn)了TFL2基因(Guan et al.,2011)。可見,TFL2基因在植物花發(fā)育中發(fā)揮非常重要的作用。隨著分子技術(shù)的不斷發(fā)展,研究人員發(fā)現(xiàn)許多轉(zhuǎn)錄因子可通過與基因啟動(dòng)子區(qū)域內(nèi)各類元件相互作用以調(diào)控基因表達(dá),從而實(shí)現(xiàn)對(duì)環(huán)境信號(hào)的應(yīng)答反應(yīng)及植物生長(zhǎng)發(fā)育的調(diào)節(jié)(Le et al.,2010;Suzuki et al.,2011)。因此,分析目的基因啟動(dòng)子所含順式作用元件可為深入了解基因結(jié)構(gòu)與表達(dá)模式提供理論參考。研究發(fā)現(xiàn),麻風(fēng)樹中MOTHER OF FT AND TFL1(JcMFT1)基因啟動(dòng)子含有生長(zhǎng)調(diào)控元件,將該基因轉(zhuǎn)入擬南芥后發(fā)現(xiàn)其在擬南芥種胚中表達(dá),推測(cè)其與細(xì)胞分裂有關(guān)(Tao et al.,2014);葡萄VvSCL9基因啟動(dòng)子具有逆境脅迫作用元件,將該基因轉(zhuǎn)入煙草植株進(jìn)行超表達(dá),可明顯提高植株對(duì)NaCl的耐受性,且花期也提前(陳立勇等,2014);水稻OsGAR4基因?yàn)殚_花抑制因子,其啟動(dòng)子含多個(gè)激素響應(yīng)作用元件,用赤霉素(GA3)處理水稻后,植株中OsGAR4基因表達(dá)量降低,從而促進(jìn)水稻小穗的早期發(fā)育(劉秋華等,2015)。【本研究切入點(diǎn)】盡管在許多植物中發(fā)現(xiàn)了TFL2同源基因,但迄今關(guān)于OsTFL2基因啟動(dòng)子克隆及功能的研究鮮見報(bào)道。【擬解決的關(guān)鍵問題】克隆OsTFL2基因的啟動(dòng)子序列(Promoter),將其連接至攜帶β-葡萄糖苷酸酶(GUS)基因的pCAMBIA1301載體上從而構(gòu)建重組植物表達(dá)載體,轉(zhuǎn)化水稻后驗(yàn)證其生物學(xué)功能,檢測(cè)OsTFL2基因啟動(dòng)子的表達(dá)特征,并對(duì)其啟動(dòng)活性和組織特異性表達(dá)功能進(jìn)行分析,為深入研究OsTFL2基因?qū)λ鹃_花和花發(fā)育的調(diào)控機(jī)理提供理論參考。
1 材料與方法
1. 1 試驗(yàn)材料
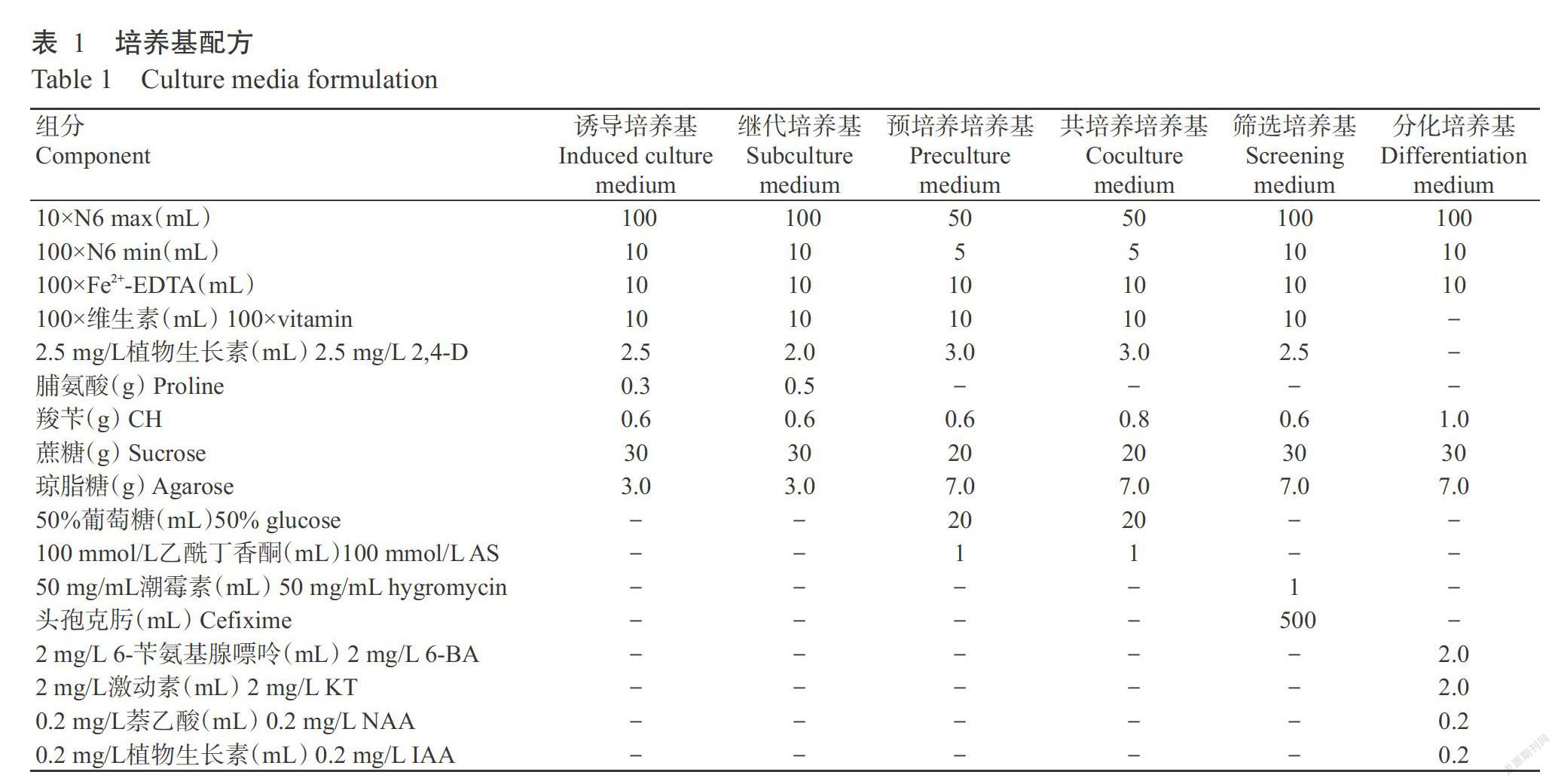
供試水稻品種為農(nóng)墾58。農(nóng)墾58種子、農(nóng)桿菌EHA105和pCAMBIA1301表達(dá)載體(含CaMV35S啟動(dòng)子和GUS基因系統(tǒng)的雙元載體)均由廣西大學(xué)農(nóng)學(xué)院實(shí)驗(yàn)室保存提供。主要試劑:pUCm-T克隆載體購(gòu)自TaKaRa公司;限制性內(nèi)切酶Nco I和Hind III購(gòu)自NEB公司;其他試劑均購(gòu)自生工生物工程(上海)股份有限公司。主要設(shè)備儀器:Thermal Cycler PCR儀、Imagine Master VDS凝膠成像系統(tǒng)和超微量紫外可見分光光度計(jì)購(gòu)自美國(guó)Bio-Rad公司;高速冷凍離心機(jī)購(gòu)自德國(guó)Eppendoff公司;DYCZ-30型垂直電泳槽、DYY-12型電腦三恒多用電泳儀、WD-9405B型水平搖床和高通量組織研磨儀購(gòu)自北京六一儀器廠。本研究所用的培養(yǎng)基配方如表1所示。
1. 2 試驗(yàn)方法
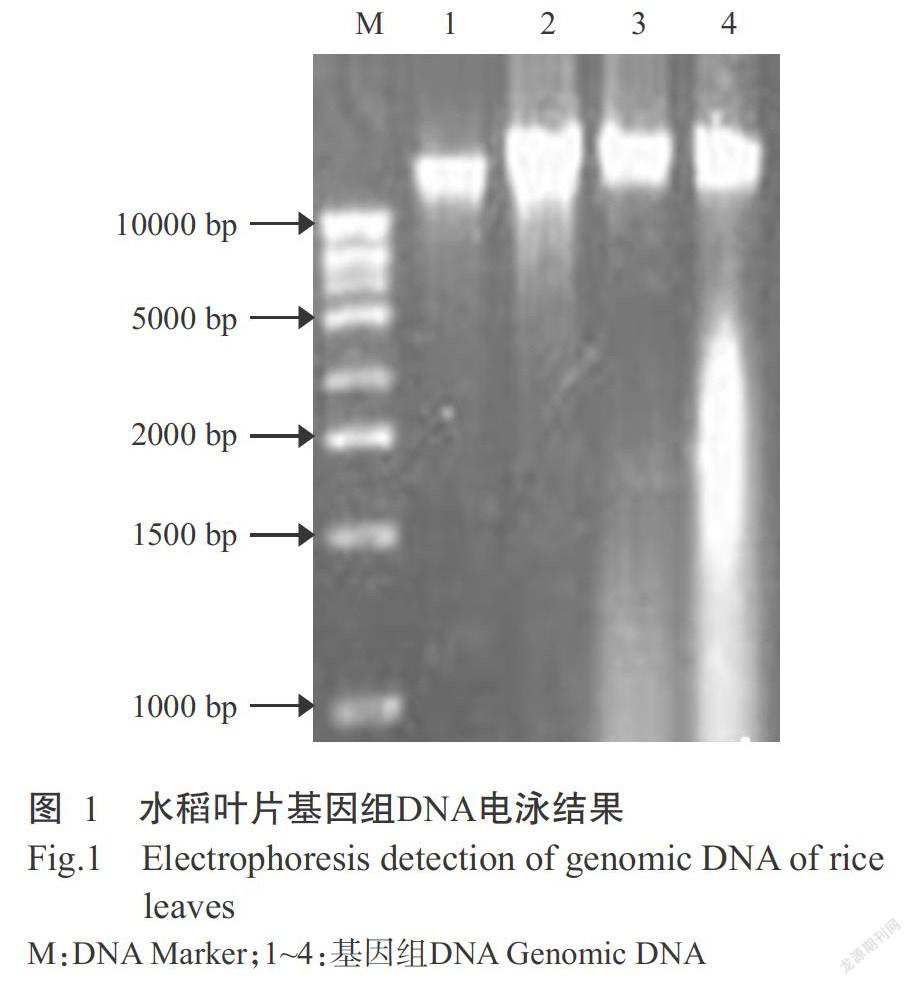
1. 2. 1 DNA提取與檢測(cè) 水稻幼苗于4月移栽至大田,當(dāng)長(zhǎng)至4~5葉期時(shí),每株取2 cm的幼嫩葉片,采用常規(guī)CTAB法提取其基因組DNA,并以1%瓊脂糖凝膠電泳進(jìn)行檢測(cè)。
1. 2. 2 OsTFL2基因啟動(dòng)子克隆 從NCBI中搜索下載OsTFL2基因序列,并將其提交至啟動(dòng)子預(yù)測(cè)軟件Promoter 2.0對(duì)該基因啟動(dòng)子進(jìn)行預(yù)測(cè),結(jié)果顯示,該基因起始密碼子ATG上游1800 bp處為啟動(dòng)子序列。根據(jù)該序列設(shè)計(jì)PCR擴(kuò)增引物,正向引物:5'-CGCAAGCTTCGCCAAGAAGTAACAAACACA
GC-3'(下劃線為Hind III酶切位點(diǎn));反向引物:5'-G
AATTCCCATGGGGCTACTCCTCTCTTTCTCGGA
T-3'(下劃線為Nco I酶切位點(diǎn))。上述引物由生工生物工程(上海)股份有限公司合成。以基因組DNA為模板,PCR擴(kuò)增OsTFL2基因啟動(dòng)子序列。PCR反應(yīng)體系10.0 μL:10×Buffer 1.0 μL,10 μmol/L正、反向引物各0.4 μL,10 μmol/L dNTPs 0.1 μL,DNA模板1.0 μL,ddH2O補(bǔ)足至10.0 μL。擴(kuò)增程序:94 ℃預(yù)變性4 min;94 ℃ 40 s, 55 ℃ 40 s,72 ℃ 1.5 min,進(jìn)行35個(gè)循環(huán);72 ℃延伸10 min,4 ℃保存。PCR產(chǎn)物用1.0%瓊脂糖凝膠電泳進(jìn)行檢測(cè)。
切膠回收目的片段,將其連接至pUCm-T載體上,從而獲得pUCm-T-Promoter重組質(zhì)粒,并轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞。通過菌落PCR檢測(cè)和雙酶切驗(yàn)證篩選出陽性克隆,將其送至生工生物工程(上海)股份有限公司測(cè)序。將測(cè)序結(jié)果提交至Plant CARE和PLACE對(duì)OsTFL2基因啟動(dòng)子中的順式作用元件進(jìn)行分析。
1. 2. 3 植物表達(dá)載體構(gòu)建與轉(zhuǎn)化 分別用Hind III和Nco I對(duì)pCAMBIA1301載體和pUCm-T-Promoter 重組質(zhì)粒進(jìn)行雙酶切,切膠回收目的片段,將克隆得到的OsTFL2基因啟動(dòng)子序列取代pCAMBIA1301載體中的CaMV35S啟動(dòng)子,并與GUS基因連接,從而構(gòu)建pCAMBIA1301-Promoter植物表達(dá)載體。然后將其轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞。通過菌落PCR檢測(cè)和雙酶切驗(yàn)證篩選出陽性克隆,將其送至生工生物工程(上海)股份有限公司測(cè)序。
將構(gòu)建的pCAMBIA1301-Promoter植物表達(dá)載體轉(zhuǎn)化水稻愈傷組織中,具體操作:將未損傷的水稻種子脫殼后先用70%乙醇消毒3~5 min,再用0.1%升汞消毒20~30 min,然后用無菌水清洗6次后接入誘導(dǎo)培養(yǎng)基中,于26 ℃暗培養(yǎng)28 d,將誘導(dǎo)出的愈傷組織轉(zhuǎn)接至繼代培養(yǎng)基上培養(yǎng)28 d后轉(zhuǎn)接至預(yù)培養(yǎng)培養(yǎng)基上,于26 ℃暗培養(yǎng)4 d,再將愈傷組織置于農(nóng)桿菌EHA105菌液中侵染30 min,中間輕輕搖動(dòng)數(shù)次,倒掉菌液,將愈傷組織放置滅菌濾紙上晾曬20 min,接入共培養(yǎng)培養(yǎng)基,于20 ℃暗培養(yǎng)3 d,愈傷組織用無菌水清洗8~10次后,用含頭孢克肟的無菌水(300~500 mg/L)清洗2次,再用該無菌水浸泡30 min,期間輕輕搖動(dòng)數(shù)次,將愈傷組織置于滅菌濾紙上晾曬20 min,接至篩選培養(yǎng)基,于26 ℃暗培養(yǎng),每14 d轉(zhuǎn)接至新的篩選培養(yǎng)基上,共篩選2次。最后,將愈傷組織接入分化培養(yǎng)基中,于16 h/8 h暗/光間隔培養(yǎng),最終獲得轉(zhuǎn)基因水稻植株。
1. 2. 4 轉(zhuǎn)基因植株的PCR鑒定 根據(jù)GUS基因的編碼區(qū)序列設(shè)計(jì)其PCR擴(kuò)增引物(正向引物:5'-GTCGCGCAAGACTGTAACCA-3';反向引物:5'-C
GGCGAAATTCCATACCTG-3'),用于檢測(cè)T0代陽性轉(zhuǎn)基因水稻植株。擴(kuò)增產(chǎn)物預(yù)期長(zhǎng)度為490 bp。
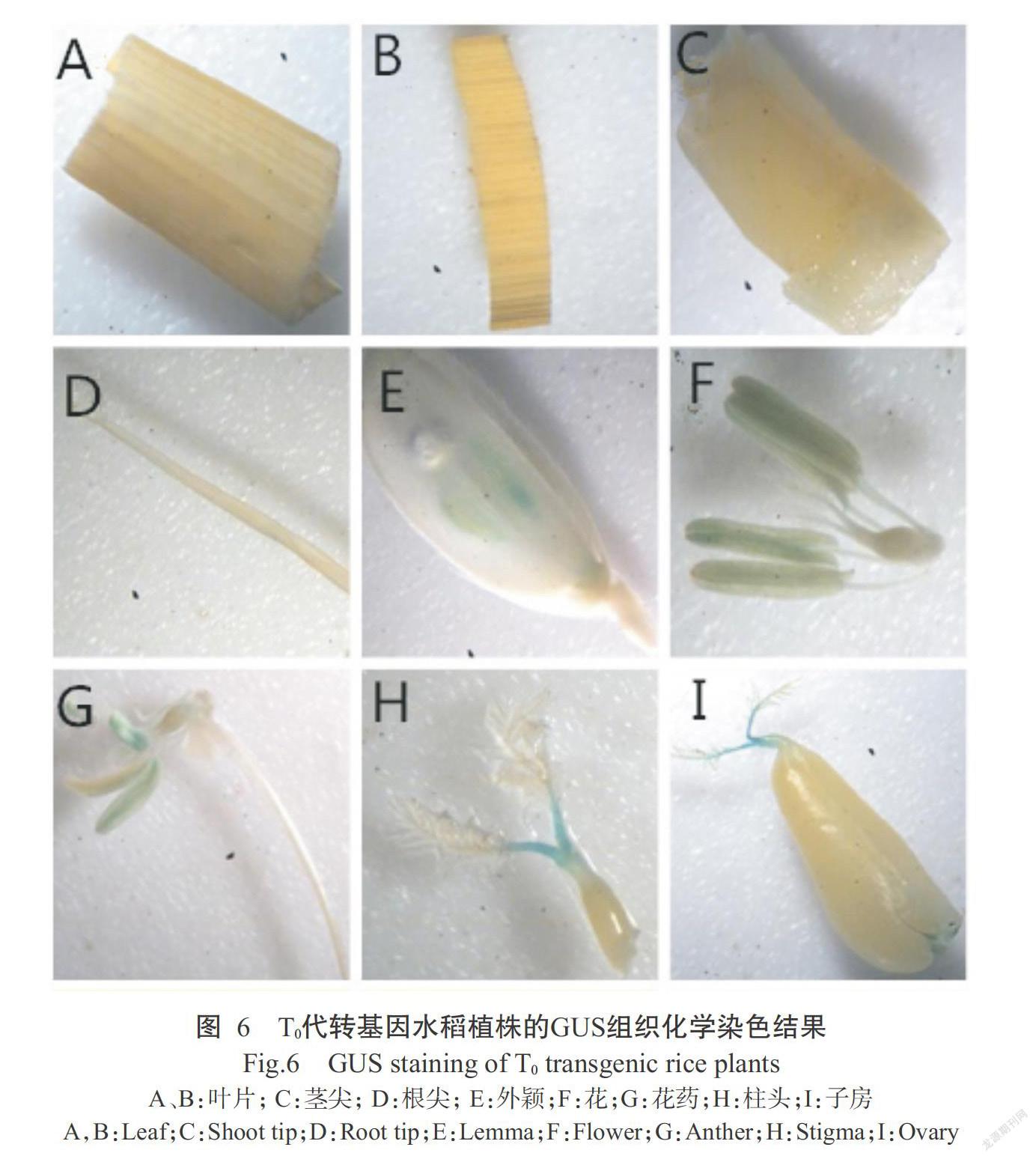
1. 2. 5 轉(zhuǎn)基因植株的GUS組織化學(xué)染色 參考吳智丹等(2012)的方法對(duì)T0代轉(zhuǎn)基因植株的不同組織器官(葉片、莖尖、根尖、外穎、花、花藥、柱頭和子房等)進(jìn)行GUS組織化學(xué)染色。
2 結(jié)果與分析
2. 1 OsTFL2基因啟動(dòng)子的克隆結(jié)果
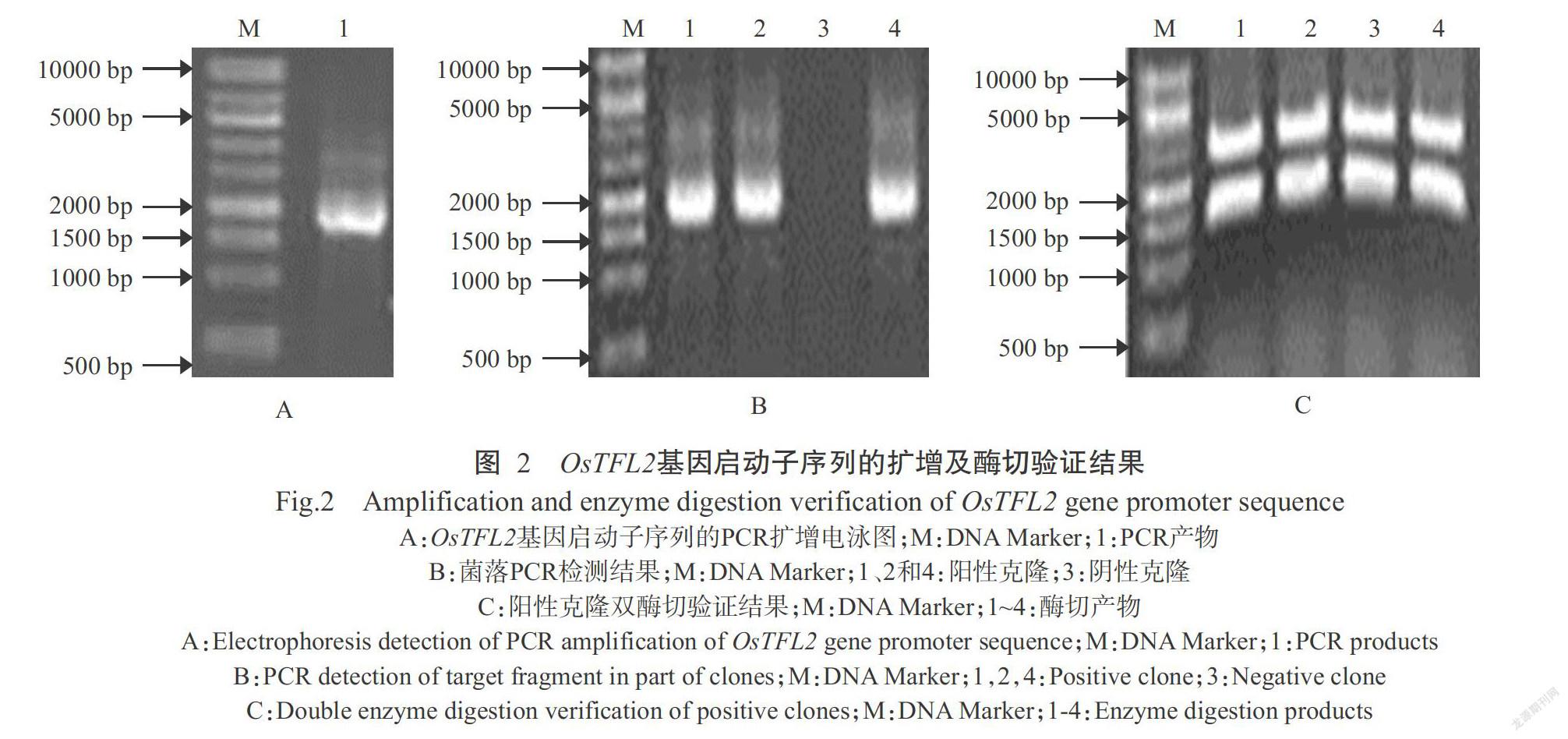
由圖1可知,利用常規(guī)CTAB法從水稻幼嫩葉片中提取的基因組DNA大于10 kb,且主帶清晰、降解少,符合實(shí)驗(yàn)要求。由圖2-A可知,OsTFL2基因啟動(dòng)子的PCR產(chǎn)物約1.8 kb,與預(yù)期相符。
將OsTFL2基因啟動(dòng)子序列連接至pUCm-T載體上,并轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞中,挑取部分白色單菌落進(jìn)行PCR檢測(cè),結(jié)果如圖2-B所示,成功篩選出陽性克隆。同時(shí),為了進(jìn)一步確認(rèn)目的片段已準(zhǔn)確地連接至pUCm-T載體上,分別挑取部分陽性單菌落進(jìn)行擴(kuò)大培養(yǎng),用堿裂解法提取質(zhì)粒DNA并用Hind III和Nco I雙酶切,結(jié)果如圖2-C所示,雙酶切產(chǎn)物中均出現(xiàn)目的條帶,表明目標(biāo)片段已連接至pUCm-T載體上。
2. 2 OsTFL2基因啟動(dòng)子序列分析結(jié)果
將PCR檢測(cè)和雙酶切鑒定為陽性的質(zhì)粒進(jìn)行測(cè)序分析,結(jié)果表明,啟動(dòng)子序列和載體嵌合的情況與預(yù)期完全一致,說明載體構(gòu)建正確,可進(jìn)行后續(xù)試驗(yàn)。將OsTFL2基因5'端上游調(diào)控區(qū)1.8 kb序列提交至啟動(dòng)子預(yù)測(cè)網(wǎng)站PLACE進(jìn)行順式作用元件預(yù)測(cè)分析,結(jié)果如表2所示。該序列除含有啟動(dòng)子元件TATA-box和CAAT-box外,還存在AT和GT富集區(qū)、花粉特異識(shí)別的順式作用元件Pollen1lelat52(AGAAA)及開花基因轉(zhuǎn)錄相關(guān)的多功能轉(zhuǎn)錄因子CACTFTPPCA1(PACT,Y=C/T)、CCAAT box1(CCAAT)、DOFCORE(AAAG)和GATA box(GATA)等。此外,該啟動(dòng)子還含有分生組織特異性元件CCGTCC-box及多個(gè)光誘導(dǎo)元件或光誘導(dǎo)相關(guān)元件如G-box、Box I、CATT-motif、GATA-motif和GT1-motif等,推測(cè)OsTFL2基因通過上述順式作用元件參與調(diào)控花發(fā)育及開花過程。
2. 3 植物表達(dá)載體的鑒定結(jié)果
構(gòu)建pCAMBIA1301-Promoter植物表達(dá)載體轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞,挑取部分單菌落進(jìn)行PCR檢測(cè),結(jié)果發(fā)現(xiàn)有多個(gè)單菌落能擴(kuò)增出目標(biāo)條帶(圖3-A),初步確定這些單菌落為陽性克隆。用堿裂解法提取陽性克隆的pCAMBIA1301-Promoter植物表達(dá)載體,分別用Hind III和Nco I對(duì)其進(jìn)行雙酶切,結(jié)果如圖3-B所示,酶切后的片段長(zhǎng)度與預(yù)期基本一致,表明OsTFL2基因啟動(dòng)子序列已連接至pCAMBIA1301表達(dá)載體。
2. 4 植物表達(dá)載體的轉(zhuǎn)化
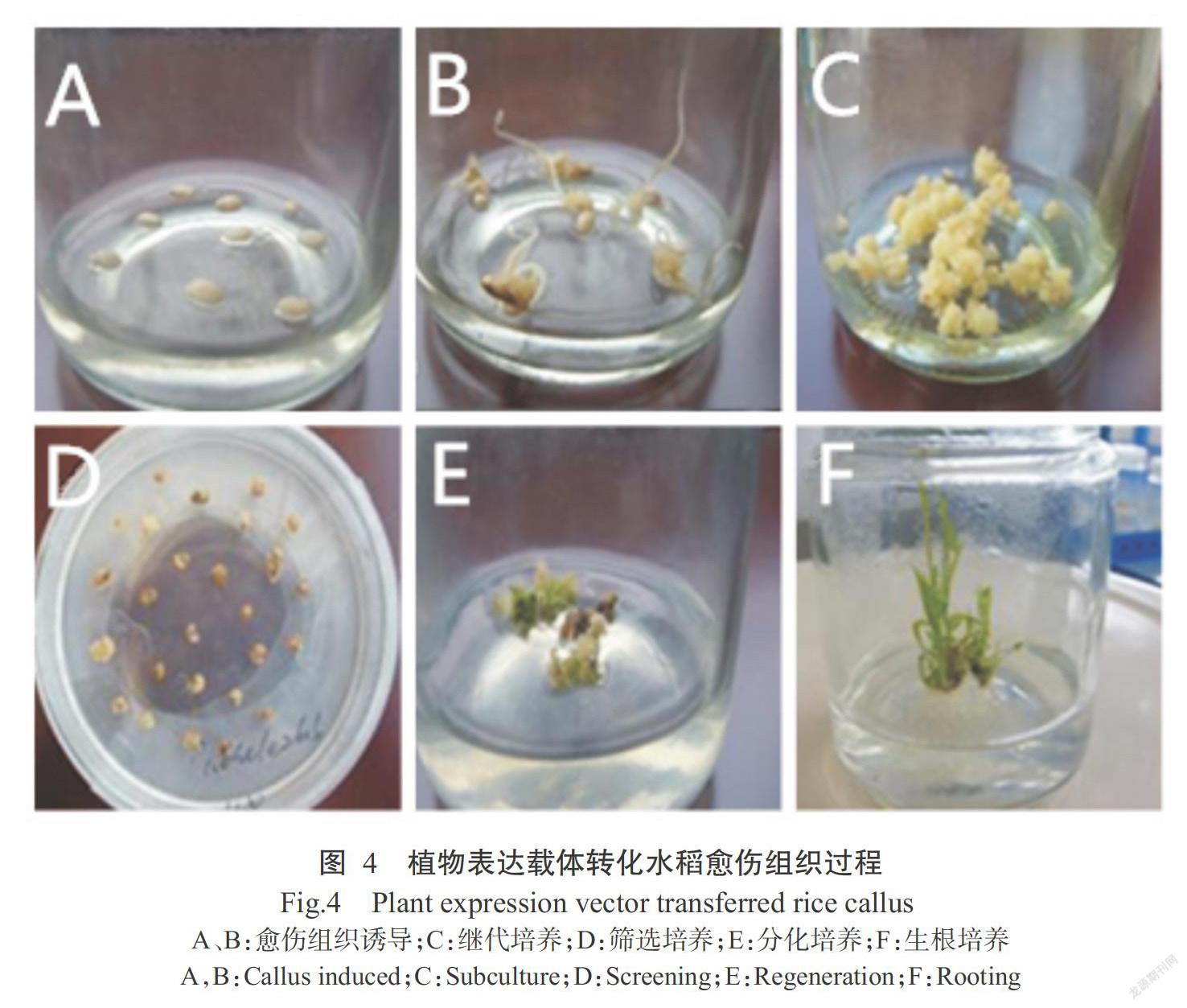
將構(gòu)建的啟動(dòng)子表達(dá)載體轉(zhuǎn)化水稻愈傷組織,如圖3所示。將種子脫殼消毒后轉(zhuǎn)入誘導(dǎo)培養(yǎng)基上(圖4-A)培養(yǎng)28 d后產(chǎn)生愈傷組織(圖4-B),繼代培養(yǎng)28 d后產(chǎn)生淡黃色的愈傷組織(圖4-C),再預(yù)培養(yǎng)4 d,可獲得共培養(yǎng)的受體。將愈傷組織和農(nóng)桿菌共培養(yǎng)3 d。經(jīng)過2代(14 d/代)篩選后可見瘤狀抗性愈傷組織(圖4-D)。將生長(zhǎng)旺盛的愈傷組織進(jìn)行分化培養(yǎng),14 d后愈傷組織出現(xiàn)綠點(diǎn)(圖4-E),21 d后開始長(zhǎng)出幼芽,接著長(zhǎng)出根,最后將再生的植株轉(zhuǎn)至生根壯苗培養(yǎng)基(圖4-F)。
2. 5 轉(zhuǎn)基因植株的鑒定及GUS組織化學(xué)染色結(jié)果
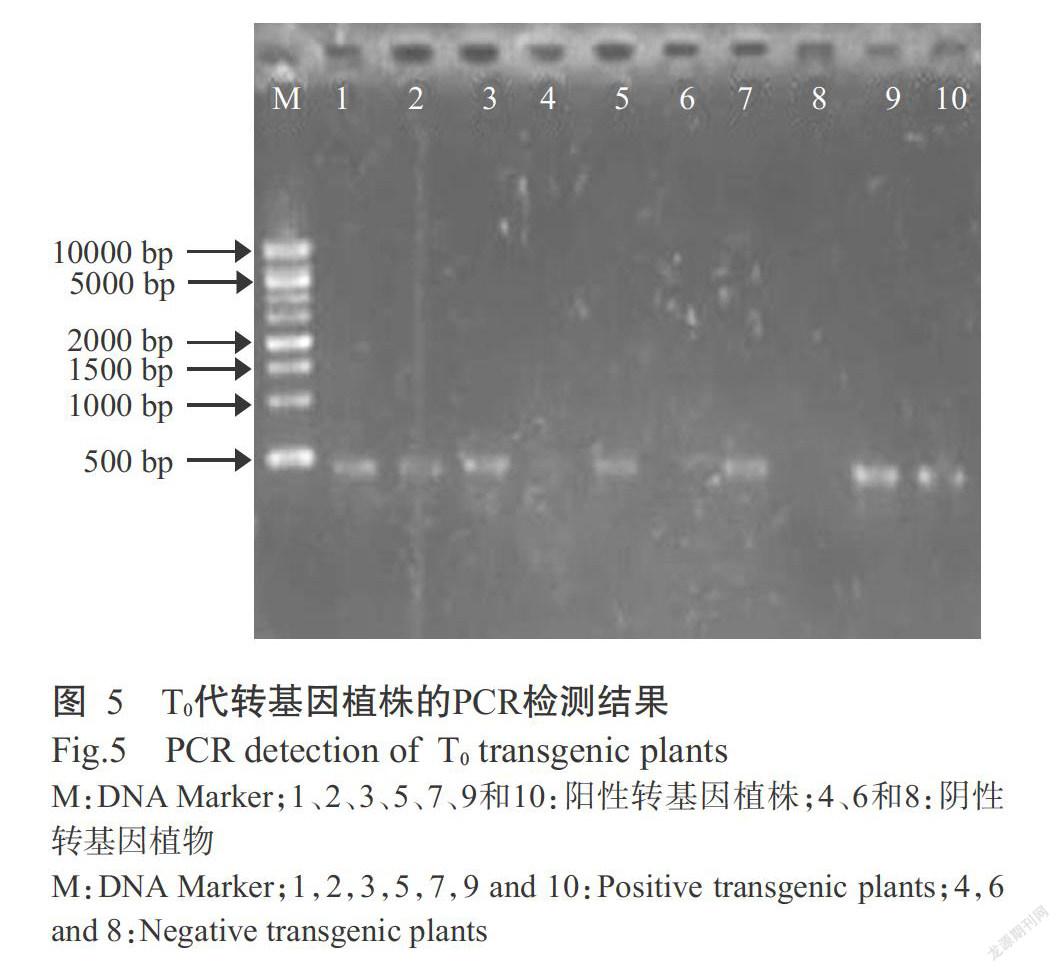
將生根壯苗培養(yǎng)獲得的植株移栽至盛有大田土壤的桶里,培養(yǎng)14 d后,共獲得22株存活的T0代轉(zhuǎn)基因植株,利用GUS基因的引物對(duì)其進(jìn)行PCR鑒定,結(jié)果顯示,有16株可擴(kuò)增出490 bp特異性條帶(圖5),說明其為陽性轉(zhuǎn)基因植株。對(duì)16株陽性轉(zhuǎn)基因植株的組織器官進(jìn)行GUS組織化學(xué)染色,結(jié)果發(fā)現(xiàn)在水稻的外穎(圖6-E)、花(圖6-F)、花藥(圖6-G)、柱頭(圖6-H)和子房(圖6-I)中均可檢測(cè)到明顯的GUS色斑,而在葉片(圖6-A和圖6-B)、莖尖(圖6-C)和根尖(圖6-D)無明顯的GUS色斑,說明OsTFL2基因啟動(dòng)子能驅(qū)動(dòng)GUS基因在水稻外穎、花藥和子房中表達(dá),推測(cè)OsTFL2基因的啟動(dòng)子可在一定程度上影響下游基因表達(dá),在水稻花的生長(zhǎng)發(fā)育過程中發(fā)揮重要調(diào)控作用。
3 討論
基因表達(dá)調(diào)節(jié)對(duì)環(huán)境信號(hào)的應(yīng)答反應(yīng)及植物生長(zhǎng)發(fā)育發(fā)揮重要作用,許多基因通過啟動(dòng)子序列中各類元件相互作用以調(diào)節(jié)基因表達(dá),現(xiàn)已成為植物分子生物學(xué)和生理學(xué)研究的重點(diǎn)(Le et al.,2010;Suzuki et al.,2011)。因此,分析特定基因啟動(dòng)子內(nèi)所含順式作用元件為研究基因的結(jié)構(gòu)、表達(dá)及調(diào)控模式提供理論參考。啟動(dòng)子主要由上游元件、核心啟動(dòng)子和應(yīng)答元件組成。上游元件包括TATA-box、CAAT-box和GC-box等,其中TATA-box是植物基因啟動(dòng)子最典型的元件。本研究克隆OsTFL2基因啟動(dòng)子序列,該序列含9個(gè)TATA-box和18個(gè)CAAT-box,說明其具有典型的啟動(dòng)子特征;該序列還含10個(gè)花粉特異識(shí)別的順式作用元件Pollen1lelat52(AGAAA)及開花基因轉(zhuǎn)錄相關(guān)的多功能轉(zhuǎn)錄因子CACTFTPPCA1(PACT,Y=C/T)、CCAAT box1(CCAAT)、DOFCORE(AAAG)和GATA box(GATA)等,其中,Pollen1lelat52(AGAAA)是調(diào)控花粉表達(dá)所必須的元件,推測(cè)OsTFL2基因受這些上游元件調(diào)控;此外,該啟動(dòng)子中還含有大量分生組織的特異性元件CCGTCC-box及光誘導(dǎo)元件或光誘導(dǎo)相關(guān)元件G-box等,推測(cè)OsTFL2基因通過上述作用元件參與調(diào)控花發(fā)育,且與光響應(yīng)、衰老、花粉和花藥發(fā)育相關(guān),與Guan等(2011)的研究結(jié)論基本一致。Tsaftaris等(2012)研究發(fā)現(xiàn),TFL2基因僅在花和芽的早期發(fā)育中表達(dá),而在葉中不表達(dá)。本研究將OsTFL2基因啟動(dòng)子序列轉(zhuǎn)化水稻品種農(nóng)墾58中獲得轉(zhuǎn)基因植株,通過GUS組織化學(xué)染色檢測(cè)發(fā)現(xiàn),在水稻的外穎、花、花藥、柱頭和子房等組織中均可檢測(cè)到明顯的GUS色斑,而在葉片、莖尖和根尖等部位無明顯的GUS色斑,該結(jié)果與Tsaftaris等(2012)的研究結(jié)果類似,說明OsTFL2基因的啟動(dòng)子可在一定程度上影響下游基因表達(dá),在水稻花的生長(zhǎng)發(fā)育過程中發(fā)揮重要調(diào)控作用。但Guan等(2011)研究表明,TFL2基因主要在擬南芥、水稻、玉米和甘蔗等的葉片和莖尖中大量表達(dá),推測(cè)該基因具有組織特異性,對(duì)維持植株形態(tài)發(fā)揮重要作用。還有研究表明,TFL2基因突變會(huì)降低植物生長(zhǎng)素合成速率,導(dǎo)致游離生長(zhǎng)素含量降低,進(jìn)而影響植株的重要生命過程。如擬南芥AtTFL2基因突變會(huì)影響花形成、葉和根的形態(tài)、光周期、株形、開花期、植物體內(nèi)激素水平及溫度的敏感性等(Kotake et al.,2003;Guan et al.,2011)。本課題組前期研究也發(fā)現(xiàn),OsTFL2基因表達(dá)被抑制后,水稻表現(xiàn)出植株矮小、花畸形、開花期對(duì)光敏感性低等多個(gè)性狀(Guan et al.,2011)。因此,在今后的研究中,應(yīng)結(jié)合啟動(dòng)子的結(jié)構(gòu)特征觀察植株的表型特征,從而深入探究該基因啟動(dòng)子在不同花發(fā)育階段受光、溫等影響下的表達(dá)特征,以期明確啟動(dòng)子結(jié)構(gòu)的組成及對(duì)應(yīng)的生物學(xué)功能,從而解析轉(zhuǎn)錄調(diào)節(jié)的分子機(jī)制。
4 結(jié)論
OsTFL2基因啟動(dòng)子具有啟動(dòng)活性和組織表達(dá)特異性,可在一定程度上影響OsTFL2基因表達(dá),對(duì)水稻花生長(zhǎng)發(fā)育和開花發(fā)揮重要調(diào)控作用。
參考文獻(xiàn):
陳立勇,陳麗華,柴麗娟,陳尚武,馬會(huì)勤. 2014. 葡萄VvSCL9基因和啟動(dòng)子的克隆及初步研究[J]. 中國(guó)農(nóng)業(yè)大學(xué)學(xué)報(bào),20(3):101-107. [Chen L Y,Chen L H,Chai L J,Chen S W,Ma H Q. 2014. Isolation and primary function study of VvSCL9 gene and its promotor[J]. Journal of China Agriculture University,20(3):101-107.]
劉秋華,羅曼,彭建宗,王小菁. 2015. 水稻OsGASR4基因及其啟動(dòng)子的克隆與表達(dá)分析[J]. 華南師范大學(xué)學(xué)報(bào)(自然科學(xué)版),47(1):81-86. [Liu Q H,Luo M,Peng J Z,Wang X J. 2015. Isolation and analysis of rice OsGASR4 gene and its promoter[J]. Journal of South China Normal University(Natural Science Edition),47(1):81-86.]
吳智丹,王光,郭玲,李林,劉鳳權(quán),邵敏. 2012. 水稻啟動(dòng)子OsN1p的克隆與功能分析[J]. 南京農(nóng)業(yè)大學(xué)學(xué)報(bào),35(2):10-14. [Wu Z D,Wang G,Guo L,Li L,Liu F Q,Shao M. 2012. Cloning and functional analysis of the promoter OsN1p of rice[J]. Journal of Nanjing Agricultural University,35(2):10-14.]
Berke L,Snel B. 2015. The plant polycomb repressive complex 1(PRC1) existed in the ancestor of seed plants and has a complex duplication history[J]. BMC Evolutionary Biology,15:44.
Gaudin V,Libault M,Pouteau S,Juul T,Zhao G,Lefebvre D,Grandjean O. 2001. Mutations in LIKE HETEROCHROMATIN PROTEIN 1 affect flowering time and plant architecture in Arabidopsis[J]. Development,128(23):4847-4858.
Guan H X,Zheng Z G,Grey P H,Li Y H,Oppenheimer D G. 2011. Conservation and divergence of plant LHP1 protein sequences and expression pattern in Angiosperms and Gymnosperms[J]. Molecular Genetics and Genomics,285(5):357-373.
Hecker A,Brand L H,Peter S,Simoncello N,Kilian J,Harter K,Gaudin V,Wanke D. 2015. The Arabidopsis GAGA-binding factor BASIC PENTACYSTEINE6 recruits the POLYCOMB-REPRESSIVE COMPLEX1 component LI-KE HETEROCHROMATIN PROTEIN1 to GAGA DNA motifs[J]. Plant Physiology,168(3):130-141.
Kotake T,Takada S,Nakahigashi K,Ohto M,Goto K. 2003. Arabidopsis TERMINAL FLOWER 2 gene encodes a he-terochromatin protein 1 homolog and represses both FLOWERING LOCUS T to regulate flowering time and several floral homeotic genes[J]. Plant & Cell Physiology,44(6):555-564.
Le B H,Cheng C,Bui A Q,Wagmaister J A,Henry K F,Pe-lletier J,Kwong L,Belmonte M,Kirkbride R,Horvath S. 2010. Global analysis of gene activity during Arabidopsis seed development and identification of seed-specific transcription factors[J]. Proceedings of the National Academy of Sciences of the United States of America,107(18):8063-8070.
Liu C,Xi W Y,Shen L S,Tan C P,Yu H. 2009. Regulation of floral patterning by flowering time genes[J]. Developmental Cell,6(5):711-722.
Mylne J S,Barrett L,Tessadori F,Mesnage S,Johnson L,Bernatavichute Y V,Jacobsen S E,F(xiàn)ransz P,Dean C. 2006. LHP1,the Arabidopsis homologue of HETEROCHROMATIN PROTEIN 1,is required for epigenetic silencing of FLC[J]. Proceedings of the National Academy of Scien-ces of the United States of America,103(13):5012-5017.
Nakahigashi K,Jasencakova Z,Schubert I,Goto K. 2005. The Arabidopsis heterochromatin protein 1 homolog(TERMINAL FLOWER 2) silences genes within the euchromatic region but not genes positioned in heterochromatin[J]. Plant Cell Physiology,46(11):1747-1756.
Rizzardi K,Landberg K,Nilsson L,Ljung K,Sundas-Larsson A. 2011. TFL2/LHP1 is involved in auxin biosynthesis through positive regulation of YUCCA genes[J]. The Plant Journal,65(6):897-906.
Sung S,He Y,Eshoo T W,Tamada Y,Johnson L. Nakahigashi K,Goto K,Jacobsen S E,Amashino R M. 2006. Epigenetic maintenance of the vernalized state in Arabidopsis thaliana requires LIKE HETEROCHROMATIN PROTEIN 1[J]. Nature Genetics,38(6):706-710.
Suzuki N,Sejima H,Tam R,Schlauch K,Mittler R. 2011. Identification of the MBF1 heat-response regulon of Arabidopsis thaliana[J]. The Plant Journal:for Cell and Molecular Biology,66(5):844-851.
Takada S,Goto K. 2003. Terminal flower 2,an Arabidopsis homolog of heterochromatin protein 1,counteracts the activation of flowering locus T by constants in the vascular tissues of leaves to regulate flowering time[J]. Plant Cell,15(12):2856-2865.
Tao Y B,Luo L,He L L,Ni J,Xu Z F. 2014. A promoter analysis of MOTHER OF FT AND TFL 1(JcMFT1),a seed-preferential gene from the biofuel plant Jatropha curcas[J]. Journal of Plant Research,127(4):513-524.
Tsaftaris A,Pasentsis K,Kalivas A,Michailidou S,Madesis P,Argiriou A. 2012. Isolation of a CENTRORADIALIS/TERMINAL FLOWER1 homolog in saffron(Crocus sativus L.):Characterization and expression analysis[J]. Molecular Biology Reports,39(8):7899-7910.
Valdés A E,Rizzardi K,Johannesson H,Para A,Sund?s-Lar-sson A,Landberg K. 2012. Arabidopsis thaliana TERMINAL FLOWER 2 is involved in light-controlled signa-lling during seedling photomorphogenesis[J]. Plant,Cell & Environment,35(6):1013-1025.
(責(zé)任編輯 陳 燕)

