百子蓮胚性愈傷組織在超低溫過程中的蛋白質組學研究
呂珊 張荻

摘要:【目的】從蛋白質組學層面揭示植物胚性細胞對超低溫保存復合逆境的響應調控機制,篩選出百子蓮胚性愈傷組織在超低溫保存中的差異表達蛋白,進一步豐富觀賞植物超低溫保存的分子生物學理論。【方法】利用iTRAQ技術鑒定百子蓮胚性愈傷組織在超低溫保存四個關鍵步驟(預培養、玻璃化脫水處理、洗滌和恢復培養)中的差異表達蛋白,應用生物信息學分析方法構建細胞響應超低溫保存復合逆境的蛋白調控網絡,篩選出植物超低溫逆境保護類蛋白。【結果】共鑒定到2730種蛋白,篩選出821個差異表達蛋白。GO功能注釋分析結果表明差異表達蛋白主要參與代謝、細胞過程和刺激應答等生物學過程,而催化活性和分子結合是最主要的分子功能類別。KEGG通路分析結果表明差異表達蛋白主要富集于能量代謝、蛋白的合成與降解、信號轉導及細胞質膜修復等通路。通過STRING軟件構建差異表達蛋白互作調控網絡,發現上調表達蛋白主要參與糖代謝、氧化還原過程和核糖體翻譯過程,下調表達蛋白主要參與ROS代謝、DNA修復、抑制細胞程序性死亡過程和細胞骨架。此外,篩選到96個與逆境保護相關的差異表達蛋白,分別參與能量代謝、氧化還原平衡、蛋白質合成與降解和信號轉導。【結論】在超低溫保存過程中,百子蓮胚性愈傷組織的能量代謝、氧化應激與蛋白降解及PCD有所加劇,而細胞的ROS清除和脅迫防御過程明顯下降,即百子蓮胚性愈傷組織在超低溫復合逆境下形成以糖代謝和抗氧化系統為主的抗逆保護機制。
關鍵詞: 百子蓮;胚性愈傷組織;蛋白質組學;超低溫保存;差異表達蛋白
中圖分類號: S682.19? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2019)11-2410-11
Proteomics analysis of embryogenic callus of Agapanthus praecox during cryopreservation
LYU Shan, ZHANG Di*
(School of Design, Shanghai Jiaotong University, Shanghai? 200240, China)
Abstract:【Objective】The aim of the study was to reveal the response and protection mechanism of plant embryogenic cells under complex stress during cryopreservation on the proteomics level, and to find the differentially expressed proteins(DEPs) during cryopreservation of embryogenic callus of Agapanthus praecox to enrich the molecular biology theory. 【Method】iTRAQ(isobaric tags for relative and absolute quantification) technology was performed to identify DEPs in the four key steps of cryopreservation(preculture,vitrification dehydration,dilution,recovery) of the embryogenic callus of A. praecox,bioinformatics analysis method was used to construct the protein regulatory network in response to complex stress during cryopreservation and select stressed-protected proteins in plants. 【Result】A total of 2730 proteins were identified,of which 821 DEPs were selected. GO annotation analysis showed that these DEPs were mainly involved in biological process such as metabolic process,cellular process and responses to stimulus,while catalytic activity and molecular binding were the most important parts of molecular function. KEGG pathway analysis indicated that DEPs were mainly enriched in energy metabolism,protein synthesis and degradation,signal transduction and membrane repair. The DEPs interaction regulatory network was constructed by STRING software,it was found that up-regulated DEPs were mainly involved in carbohydrate metabolism,oxidation-reductive process and ribosome translation,while down-regulated DEPs were mainly involved in ROS metabolism,DNA repair,inhibition of programmed cell death(PCD) process and cytoskeleton. In addition,96 DEPs related to stress protection were detected for energy metabolism,redox homeostasis,protein synthesis and degradation and signal transduction. 【Conclusion】Energy metabolism,oxidative stress,protein degradation and PCD events of embryogenic callus of A. praecox increase during cryopreservation;while the ROS clearance and stress defense process of cells decrease greatly. Embryogenic callus of A. praecox form resistance protection mechanism with glycometabolism and antioxidant system as the majority under cryopreservation compound stress.
Key words: Agapanthus praecox; embryogenic callus; proteomics; cryopreservation; differentially expressed protein
0 引言
【研究意義】百子蓮(Agapanthus praecox)為百子蓮科百子蓮屬植物,源于非洲南部,為多年生草本花卉。作為優良種質資源,百子蓮于2003年首次被引入我國,但由于夏季高溫高濕氣候條件的影響,其胚胎敗育率較高,不利于其推廣應用。通過建立百子蓮組織培養與體細胞胚胎發生體系,可實現百子蓮優良品種的無性快繁(李曉丹,2013)。體胚技術誘導的胚性愈傷組織(Embryogenic callus,EC)是植物離體快繁、分子育種及資源保存的重要材料,但長期繼代培養會使細胞的胚性逐漸退化甚至喪失,利用玻璃化法超低溫保存是實現百子蓮種質資源離體保存的重要途徑。玻璃化法超低溫保存是先將材料放置于由高濃度滲透和非滲透性保護劑組成的玻璃化溶液(Plant vitrification solution,PVS)中,使細胞在快速降溫過程中被固化成玻璃化態,以降低胞內致命冰晶的產生,最終在低溫條件下實現長期保存(任麗,2014)。然而,植物材料在保存過程中也面臨嚴重脫水、低溫和機械損傷等復合脅迫,引起胞內活性氧(ROS)失衡、質膜過氧化、蛋白變性及離子毒害等脅迫傷害(任麗,2014)。降低超低溫保存過程中的細胞脅迫傷害可有效提高植物超低溫保存效率。因此,通過蛋白質組學研究揭示植物胚性細胞在超低溫保存過程中的應答與保護機制,可為補充完善植物超低溫保存的逆境生理理論提供科學依據。【前人研究進展】前人已在百子蓮胚性愈傷組織超低溫保存的逆境生理方面開展了相關研究工作。陳冠群(2014)以添加適當濃度外源抗氧化物的方式優化了百子蓮胚性愈傷組織玻璃化法超低溫保存體系;何廣深等(2014)探究了超低溫保存過程中百子蓮胚性愈傷組織Ca2+分布情況及濃度變化對細胞適應能力的影響,發現Ca2+主要分布在細胞代謝活動旺盛的區域,且在細胞抗氧化過程中發揮重要作用;Zhang等(2015)揭示了ROS介導的氧化脅迫和細胞凋亡事件是直接影響超低溫保存過程中百子蓮胚性細胞活性的兩個關鍵因素,其中H2O2是引起氧化損傷最主要的ROS分子。近年來,以RNA-seq和雙向凝膠電泳為主的組學技術逐漸應用于一些農林作物和模式植物的超低溫保存研究領域。Carpenier等(2007)利用雙向電泳技術檢測香蕉分生組織在凍存過程中蛋白的差異表達變化,發現一些參與能量代謝和細胞防御、死亡及衰老過程的蛋白上調表達,而參與蛋白合成與細胞生長過程的蛋白下調表達;Forni等(2010)在低溫凍存的蘋果莖尖組織中發現了與細胞周期減緩和應激反應相關的重要蛋白;Ren等(2013,2015)研究發現,由于冷凍保護劑處理導致的膜脂過氧化是影響擬南芥低溫保存成活率的重要原因,隨后又從轉錄水平揭示calcium-binding protein、OXI1、WRKY及MYB家族成員作為ROS信號轉導的關鍵因子,對ROS的產生和清除發揮了重要作用; Folgado等(2014)在馬鈴薯莖尖組織的凍存研究中發現氧化還原平衡、碳代謝和蛋白修復過程增強,并證實糖類和參與氧化還原過程的蛋白對植物細胞在冷凍保存過程中的耐受性和適應性起重要作用。【本研究切入點】前人研究主要集中在百子蓮胚性愈傷組織的超低溫保存體系優化和逆境生理方面,但缺乏從蛋白質組學層面對其分子調控機制和蛋白保護功能進行深入探究。【擬解決的關鍵問題】利用iTRAQ技術結合生物信息學分析技術研究百子蓮胚性愈傷組織在超低溫保存過程中蛋白的表達情況,從蛋白質組學層面揭示植物胚性細胞對超低溫復合逆境的響應調控機制,并篩選出具有重要保護作用的差異表達蛋白,以進一步豐富觀賞植物超低溫保存的分子生物學理論。
1 材料與方法
1. 1 試驗材料
供試植物材料為藍色大花百子蓮(A. praecox ssp. orientails)胚性愈傷組織,由上海交通大學幼苗實踐培訓基地提供。
主要設備儀器:人工氣候箱(RXZ智能型,寧波江南儀器廠)、恒溫水浴鍋(DK-S22型,上海精宏實驗設備有限公司)、LC-20AB液相色譜儀(島津,日本)和Q-EXACTIVE質譜儀(ThermoFisher Scientific,美國)。
1. 2 試驗方法
1. 2. 1 超低溫保存方法及取樣 百子蓮胚性愈傷組織超低溫保存參照陳冠群(2014)的方法。主要步驟:(1)預培養:選取狀態良好的百子蓮胚性愈傷組織,放在含有0.5 mol/L蔗糖的MS固體培養基上,4 ℃低溫下暗培養48 h。(2)裝載:將預培養后的百子蓮胚性愈傷組織加入含有裝載液(MS+2.0 mol/L 丙三醇+0.4 mol/L蔗糖+10.0 mmol/L KNO3)的凍存管中,室溫下處理60 min。(3)玻璃化溶液脫水處理:將裝載液處理后的百子蓮胚性愈傷組織移入含有玻璃化保護液PVS2(MS液體培養基+15% DMSO+15%乙二醇+30%丙三醇+0.4 mol/L蔗糖)的凍存管中,在0 ℃下脫水處理50 min。(4)快速冷凍與解凍:液氮凍存1 h后,將放有百子蓮胚性愈傷組織的凍存管于40 ℃條件下水浴解凍90 s。(5)洗滌:在室溫下使用洗滌液(MS液體培養基+10.0 mmol/L KNO3+1.2 mol/L蔗糖)每間隔10 min對百子蓮胚性愈傷組織洗滌一次,重復3次。(6)恢復培養:將洗滌過后的百子蓮胚性愈傷組織放在MS固體培養基上,恢復培養24 h。取上述預培養、玻璃化溶液脫水處理、洗滌及恢復培養后的百子蓮胚性愈傷組織為試驗組樣品,以未經處理的百子蓮胚性愈傷組織為對照組樣品。
1. 2. 2 蛋白提取與測定 分別稱取1 g對照組和試驗組樣品,在液氮中充分研磨成粉末,加入適量蛋白裂解溶液溶解,分別添加終濃度為1 mmol/L的PMSF和2 mmol/L的EDTA,5 min后添加終濃度10 mmol/L的DTT;超聲溶解15 min后,25000×g離心20 min取上清液;加入5倍體積預冷丙酮,在-20 ℃沉淀2 h,1600×g離心20 min,收集沉淀;加入適量蛋白裂解溶解液,分別添加終濃度為1 mmol/L的PMSF和2 mmol/L的EDTA,5 min后添加終濃度10 mmol/L的DTT;超聲溶解15 min后,25000×g離心20 min取上清;上清液加入DTT至終濃度10 mmol/L,56 ℃水浴1 h;取出后迅速加入IAM至終濃度55 mmol/L,暗室靜置45 min;混合樣品后再次加入5倍體積預冷丙酮,-20 ℃沉淀2 h;隨后25000×g離心20 min取沉淀;沉淀在200 μL 0.5 mol/L TEAB中超聲溶解15 min后,25000×g離心20 min后取上清液。利用Brandford法測定蛋白濃度。
1. 2. 3 蛋白酶解與iTRAQ標記 提取后的各樣品蛋白經SDS-PAGE分析檢測后,精確稱取100 μg蛋白按蛋白與酶20∶1的比例加入Tryspin,在37 ℃下酶解2 h,然后按上述比例補加Tryspin再酶解8 h。真空離心泵抽干肽段后,用0.5 mol/L TEAB復溶肽段,利用分子質量為114、116、118、119和121的基團依次標記對照組與試驗組(預培養、玻璃化脫水、洗滌及恢復培養)蛋白,室溫培養2 h。
1. 2. 4 肽段分離與蛋白鑒定 將標記好的各組肽段等量混合后,采用島津LC-20 AB系統對樣品液相分離,分離后的肽段進入到串聯ESI質譜儀Q-EXACTIVE(ThermoFisher Scientific,San Jose,CA),進行液相串聯質譜分析。
1. 2. 5 數據處理 利用Mascot(2.3.02)將原始質譜數據與已建立的百子蓮轉錄組數據庫(https://www.ncbi.nlm.nih.gov/sra,登錄號:SRR850813)搜索匹配。基于數據庫搜索策略的肽段質量誤差為20 ppm,且蛋白至少含一個特異性肽段,被認為鑒定有效。
1. 2. 6 生物信息學分析 以差異表達變化倍數上調或下調大于1.5倍,篩選出差異表達蛋白。鑒定到的差異表達蛋白進行GO(Gene ontology)注釋,利用KEGG(Kyoto encyclopedia of genes and genomes)數據庫明確超低溫保存四個關鍵步驟的差異表達蛋白參與的顯著性富集通路;使用Genesis(1.8.1)對不同表達模式的差異蛋白進行聚類,并以此為基礎在STRING網站(https://string-db.org)上構建上下調差異表達蛋白的互作調控網絡。
2 結果與分析
2. 1 iTRAQ分析與差異蛋白篩選結果
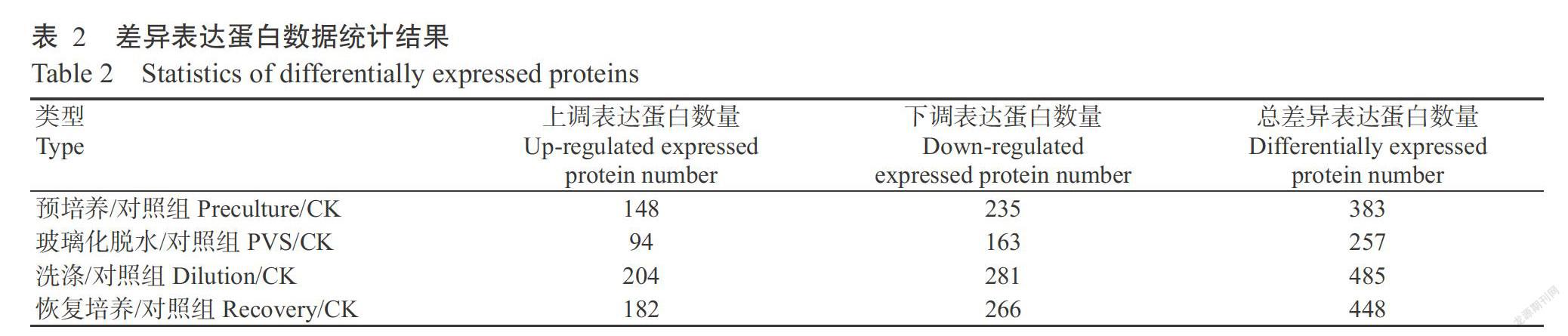
對5個測試的百子蓮胚性愈傷組織樣品進行蛋白iTRAQ定量分析,共識別獲得349591張二級譜圖,其中有42008張譜圖與已知譜圖匹配,含有特異性肽段的質譜圖數為37718張;共鑒定到肽段8466條,特有肽段7941條,蛋白2730種(表1)。在全蛋白的基礎上篩選出變化倍數大于1.5倍的作為差異表達蛋白(表2),與對照組進行對比,在預培養、玻璃化脫水、洗滌和恢復培養階段的差異表達蛋白數量依次為383、257、485和448個,四個階段樣品合計共有821個差異表達蛋白。
2. 2 差異表達蛋白的GO功能注釋分析結果
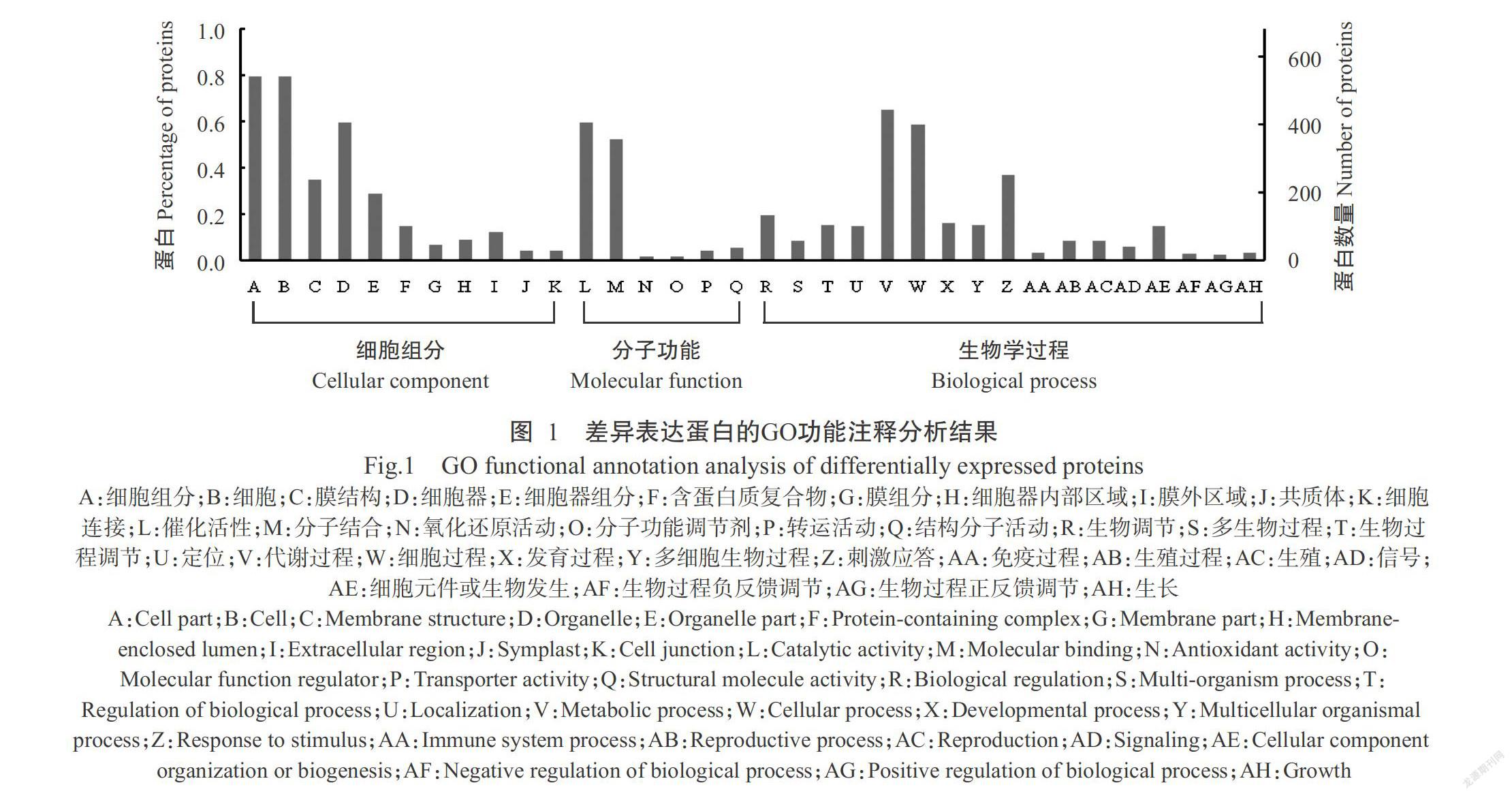
對差異表達蛋白進行GO功能注釋,以確定其主要行使的生物學功能。結果共有682個差異表達蛋白注釋到121個顯著性GO條目之中(圖1)。在細胞組分(Cell component)中,差異表達蛋白主要涉及細胞(Cell)、細胞器(Organelle)和膜結構(Membrane)等,分別占注釋差異表達蛋白的79.6%、59.4%和35.8%;在分子功能(Molecular function)中,差異表達蛋白在催化活性(Catalytic activity)、分子結合(Binding)及結構分子活動(Structural molecule acti-vity)上顯著富集,分別占注釋差異表達蛋白的59.5%、52.1%和5.4%;而在生物學過程(Biology process)中,差異表達蛋白主要參與了代謝過程(Metabolic process)、細胞過程(Cellular process)和刺激應答(Response to stimulus),分別占注釋差異表達蛋白的65.0%、58.4%和36.8%。由此可見,超低溫保存中百子蓮胚性愈傷組織的刺激應答和代謝過程具有明顯變化,并對細胞和細胞膜結構產生明顯影響。
2. 3 差異表達蛋白Pathway注釋結果
為深入了解超低溫保存過程中差異表達蛋白參與的代謝通路,用散點圖展示KEGG顯著富集的前20條Pathway(圖2)。在預培養階段(圖2-A),差異表達蛋白主要富集在代謝(Metabolic pathways)和次生代謝產物的生物合成(Biosynthesis of secondary metabolites)通路;在脫水階段(圖2-B),差異表達蛋白主要參與植物激素的信號轉導(Plant hormone signal transduction)和一些氨基酸的代謝活動(Alanine,aspartate and glutamate metabolism);洗滌階段(圖2-C)的差異表達蛋白富集通路明顯增多,且以糖代謝為主,主要作用于剪接體(Spliceosome)、鞘脂代謝(Sphingolipid metabolism)、鞘糖脂生物合成(Glycosphingolipid biosynthesis)、糖胺聚糖降解(Glycosaminoglycan degradation)和半乳糖代謝(Galactose metabolism)等;在最終恢復培養過程中(圖2-D),顯著富集的通路分別是淀粉和蔗糖代謝(Starch and sucrose metabolism)及色氨酸代謝(Tryptophan metabolism)等。由此可見,糖代謝與氨基酸代謝對超低溫保存具有積極的響應,在維持細胞的基礎生理功能,植物激素信號在脫水保護與凍存過程中發揮重要的調控作用。
2. 4 差異表達蛋白的表達模式分析結果
對所有差異表達蛋白進行聚類,以蛋白變化倍數的log2值繪制聚類分析熱圖,差異表達蛋白的表達模式共分為六組聚類(圖3),其中A組含有96個蛋白,B組含有29個蛋白,C組含有259個蛋白,D組含有104個蛋白,E組含有221個蛋白,F組含有112個蛋白。從總體變化趨勢來看,A和C兩組差異表達蛋白的趨勢相似,在超低溫四個階段中呈上調表達趨勢,而B、E和F三組差異表達蛋白表達趨勢均下調,D組蛋白的表達水平隨超低溫處理過程呈波動性變化。
根據聚類分析結果,將差異表達蛋白分為上調表達組(A和C組)和下調表達組(B、E和F組),分別含有355和362個蛋白。經STRING在線軟件分析蛋白的互作調控網絡,其中上調表達組中有187個蛋白存在相互調控作用(圖4),主要參與淀粉和蔗糖的代謝(Starch and sucrose metabolism)、糖酵解與糖異生(Glycolysis/gluconeogenesis)、三羧酸循環(TCA-cycle)、氧化還原過程(Oxidation-reductive process)和核糖體翻譯(Ribosome & translation)等,說明在超低溫保存過程中糖的代謝、氧化還原平衡及蛋白質加工修飾過程增強;下調表達組有249個蛋白構成互作網絡(圖5),主要包括ROS代謝(ROS metabolism)、抵御氧化脅迫(Against oxidative damage)、細胞骨架(Cytoskeleton)、結構分子活性(Structural molecule activity)、DNA修復和抑制PCD過程(Inhi-biting PCD)等過程。由此看出,在超低溫保存過程中百子蓮胚性愈傷組織的氧化應激、脅迫傷害、質膜受損及PCD過程有所加劇。
2. 5 響應超低溫復合逆境脅迫的差異表達蛋白
綜合鑒定差異表達蛋白的GO功能注釋、KEGG代謝通路及蛋白互作網絡,進一步篩選得到4類與超低溫復合逆境相關的96個蛋白(表3),分別參與能量代謝(Energy metabolism,44個)、氧化還原平衡(Redox homeostasis,18個)、蛋白質合成與降解(Protein synthesis and degradation,17個)及信號轉導過程(Si-gnal transduction,17個)。
3 討論
3. 1 能量代謝相關蛋白
糖代謝是細胞產生和獲取能量的主要方式,在植物抵御非生物脅迫時發揮重要作用。本研究發現大量與糖代謝相關的上調表達蛋白,包括參與糖酵解過程的磷酸丙糖異構酶、6-磷酸果糖激酶、丙酮酸激酶和葡糖磷酸酶,參與TCA循環的琥珀酰-CoA合成酶、蘋果酸合成酶、酮戊二酸脫氫酶及參與磷酸戊糖途徑的轉酮醇酶等,其中以參與糖酵解活動的差異表達蛋白居多,說明百子蓮愈傷組織在超低溫保存過程中主要依賴糖酵解途徑產生更多的能量以維持細胞在脅迫環境下正常的生理機能。另外,蔗糖積累也是一種植物對逆境響應常見的保護性反饋方式,在香蕉分生組織及馬鈴薯莖尖組織的低溫凍存中均發現蔗糖含量升高現象(Carpenier et al.,2007;Folgado et al.,2014)。本研究中發現一類上調表達的蔗糖合成酶,可促進細胞在逆境脅迫下蔗糖的積累,對調節細胞的滲透壓水平和維持細胞質膜結構的完整性起保護作用。
3. 2 氧化還原平衡相關蛋白
在逆境脅迫下細胞體內會產生過量的ROS,不斷積累導致膜質過氧化,對細胞結構及重要蛋白造成不可逆的傷害(Mittler et al.,2004)。植物自身存在一套完整的抗氧化系統,以維持細胞體內的ROS平衡。前期對百子蓮超低溫保存的逆境生理研究發現,過量ROS誘導的氧化脅迫傷害是影響細胞功能活性的關鍵因素之一(陳冠群,2014)。本研究發現2種超氧化物歧化酶和3種過氧化物酶呈下調表達,L-抗壞血酸過氧化物酶3和谷胱甘肽過氧化物酶2顯著上調表達,前幾類下調表達蛋白主要參與抗氧化系統的酶促反應,而后兩類上調表達蛋白主要參與谷胱甘肽和抗壞血酸等非酶促抗氧化過程。通過這些差異蛋白的表達變化判斷,在超低溫保存過程中非酶促抗氧化過程對于清除過量的ROS、緩解細胞的氧化還原平衡狀態發揮了重要作用,而高濃度冷凍保護劑可能使得胞內蛋白酶活性下降,進而影響酶促反應的程度。此外,二硫鍵的氧化還原狀態對維持蛋白的正確折疊及高級結構具有重要作用,過量的ROS會影響蛋白間二硫鍵的平衡狀態,導致蛋白的結構改變與失活(王秋霞,2008)。硫氧還蛋白(Thioredoxin,TRX)含有具氧化還原活性的二硫鍵,可通過硫醇—二硫鍵的可逆轉換對細胞進行氧化還原調節,穩定蛋白的結構與功能(張亞芳,2011)。本研究還發現一類H型TRX,在超低溫保存的四個階段均上調表達,對超低溫復合逆境中胞內蛋白結構與酶活性起重要的保護和調控作用。
3. 3 蛋白合成與降解相關蛋白
熱激蛋白(Heat shock protein,HSP)是一類重要的抗逆保護蛋白,具有分子伴侶的特性,主要通過蛋白的合成與降解、穩定蛋白結構、細胞定位等多種生物學過程來維持植物體的正常運轉(栗振義等,2016)。本研究發現1種上調表達和2種下調表達的HSP,表明不同類型的HSP以多種功能形式參與植物細胞的復合逆境響應。60S核糖體蛋白參與蛋白的翻譯與合成,本研究發現四類60S核糖體蛋白呈現不同的表達模式,說明蛋白的合成活動在超低溫保存過程中受到一定影響;二硫鍵異構酶和肽酰—脯氨酰順反式異構酶在細胞內參與蛋白的折疊、裝配及運輸等生物學過程(Price et al.,1994),本研究還發現二硫鍵異構酶2前體和2種肽酰—脯氨酰順反式異構酶均呈下調表達,表明超低溫復合逆境脅迫對胞內蛋白正常的加工與修飾過程具有一定阻礙作用,降低了蛋白的功能活性與結構穩定性。前期對百子蓮胚性愈傷組織的超低溫保存研究發現,過量H2O2誘導的氧化脅迫與細胞程序性死亡(PCD)是影響細胞超低溫保存凍后活性的主要因素(Zhang et al.,2015)。半胱氨酸蛋白酶是一類與植物PCD密切相關的蛋白酶,在番茄、擬南芥和百日菊中參與受損細胞降解與清除的PCD過程(史剛榮,2002);煙草天冬氨酸蛋白酶是在非生物脅迫下誘導細胞發生PCD所必須的蛋白(Chichkova et al.,2010;Vartapetian et al.,2011),枯草桿菌酶的蛋白前體也表現出類半胱天冬酶的活性,同樣參與植物的PCD過程(Hatsugai et al.,2009;Tran et al.,2014)。本研究發現這幾類重要的蛋白酶多在玻璃化脫水及恢復培養階段上調表達,推測其參與了由高濃度玻璃化溶液及超低溫凍后環境引起的PCD下游蛋白降解過程。
3. 4 信號轉導相關蛋白
鈣離子是植物體內重要的第二信使,其濃度變化影響著細胞的代謝活動(Bush et al.,1995)。在擬南芥中,鈣依賴蛋白激酶(Calcium-dependent protein kinases,CDPKs)和鈣調素結合蛋白(Calmodulin-binding protein,CaMBP)可顯著提高植物的抗逆性(Xu et al.,2011;Zhao et al.,2013)。在擬南芥幼苗超低溫保存的轉錄組研究中發現,鈣結合基因calcium-binding protein表達量顯著上調,是ROS信號轉導和清除網絡的重要因子(Ren et al.,2015)。本研究發現4種CDPKs和CaMBP在蛋白質組學層面均呈下調表達,可能源于植物幼苗與胚性愈傷材料在超低溫復合逆境下具有不同的應激響應模式,或CDPKs和CaMBP在超低溫復合逆境的轉錄調控與蛋白表達水平上存在負反饋調節機制。磷酸酶和蛋白激酶作為胞內信號分子可通過調節磷酸化程度控制其他酶類或蛋白質的活性,影響細胞的代謝活動。本研究發現多種類受體蛋白激酶和磷酸酶下調表達,說明在超低溫保存過程中,細胞內通過磷酸化和去磷酸化的信號調控方式受到抑制。14-3-3蛋白是一類高度保守的逆境信號響應蛋白(Oecking and Jaspert,2009),在脅迫條件下的甜菜、番茄和柑橘等植物中參與調節離子通道和酶活性(Robert et al.,2002;肖強和鄭海雷,2005;Denison et al.,2011)。本研究發現2種上調表達的14-3-3蛋白,推測其在超低溫過程中通過參與調節離子通道的活性和數量,從而維持細胞滲透壓水平,穩定質膜結構。肌醇單磷酸酶(Inositol monophosphatase,IMP)是磷酸肌醇信號通道的關鍵酶,在鷹嘴豆(Saxena et al.,2013)、南瓜(王安君等,2016)等植物中發現其在抵抗非生物脅迫和病害方面發揮重要作用。本研究發現1種肌醇單磷酸酶3在超低溫過程中上調表達,說明其可能通過調節肌醇的代謝水平對細胞質膜結構發揮重要的滲透保護作用。
4 結論
在百子蓮超低溫保存過程中,細胞內能量代謝、氧化應激及PCD有所加劇,ROS清除和脅迫防御活動明顯減弱,百子蓮胚性愈傷組織在超低溫復合逆境下形成以糖代謝和抗氧化系統為主的抗逆保護機制。
參考文獻:
陳冠群. 2014. 基于擬南芥抗氧化機制優化百子蓮胚性愈傷組織超低溫保存體系[D]. 上海:上海交通大學. [Chen G Q. 2014. Optimization of Agapanthus embryogenic callus cryopreservation based on the Arabidopsis antioxidant mechanism[D]. Shanghai:Shanghai Jiaotong University.]
何廣深,張荻,申曉輝. 2014. 百子蓮胚性愈傷組織在玻璃化法超低溫保存4個關鍵步驟中Ca2+的分布變化[J]. 上海交通大學學報(農業科學版),32(6):14-22. [He G S,Zhang D,Shen X H. 2014. Distribution change of Ca2+ in embryogenic callus of Arabidopsis praecox during the 4 key steps of vitrification cryopreservation[J]. Journal of Shanghai Jiaotong University(Agricultural Science),32(6):14-22.]
李曉丹. 2013. 百子蓮胚性愈傷組織玻璃化法超低溫保存技術的研究[D]. 哈爾濱:東北林業大學. [Li X D. 2013. Vitrification cryopreservation of embryonic callus of Agapanthus praecox[D]. Harbin:Northeast Forest University.]
栗振義,龍瑞才,張鐵軍,楊青川,康俊梅. 2016. 植物熱激蛋白研究進展[J]. 生物技術通報,32(2):7-13. [Li Z Y,Long R C,Zhang T J,Yang Q C,Kang J M. 2016. Research progress on plant heat shock protein[J]. Biotechnology Bu-lletin,32(2):7-13.]
任麗. 2014. 擬南芥幼苗對玻璃化法超低溫保存的逆境響應機制[D]. 上海:上海交通大學. [Ren L. 2014. The regulatory mechanism of Arabidopsis seedlings response to stress from vitrification-based cryopreservation[D]. Shanghai:Shanghai Jiaotong University.]
史剛榮. 2002. 植物細胞程序性死亡的誘導和調控[J]. 生物學教學,27(12):8-9. [Shi G R. 2002. Induction and regulation of programmed cell death in plants[J]. Biology Teac-hing,27(12):8-9.]
王安君,李玉丹,黃河勛,羅少波,吳廷全,李任強,鐘玉娟. 2016. 南瓜肌醇單磷酸酶基因CmIMP1和CmIMP2的克隆與表達分析[J]. 園藝學報,43(7):1315-1325. [Wang A J,Li Y D,Huang H X,Luo S B,Wu T Q,Li R Q,Zhong Y J. 2016. Cloning and characterization of two genes encoding myo-inositol monophosphatase 1(CmIMP1)and 2(CmIMP2)from pumpkin[J]. Acta Horticulturae Sinica,43(7):1315-1325.]
王秋霞. 2008. 鹽芥和擬南芥硫氧還蛋白在氧化脅迫中的功能研究[D]. 濟南:山東師范大學. [Wang Q X. 2008. The functional research of Thellungiella halophila TRXh and Arbidopsis thaliana TRXh[D]. Jinan:Shandong Normal University.]
肖強,鄭海雷. 2005. 14-3-3蛋白與植物細胞信號轉導[J]. 細胞生物學學報,27(4):417-422. [Xiao Q,Zheng H L. 2005. The 14-3-3 proteins and plant signal transduction[J]. Chinese Journal of Cell Biology,27(4):417-422.]
張亞芳. 2011. 水稻硫氧還蛋白OsTRXh1結合蛋白的鑒定及功能研究[D]. 石家莊:河北師范大學. [Zhang Y F. 2011. Identification and functional analysis of rice thioredoxin OsTRXh1 interaction proteins[D]. Shijiazhuang:Hebei Normal University.]
Bush D S. 1995. Calcium regulation in plant cells and its role in signaling[J]. Annual Review of Plant Biology & Plant Molecular Biology,46:95-122.
Carpentier S C,Witters E,Laukens K,van Onckelen H,Swennen R,Panis B. 2007. Banana.(Musa spp.) as a model to study the meristem proteome:Acclimation to osmotic stress[J]. Proteomics,7(1):92-105.
Chichkova N V,Shaw J,Galiullina R A,Drury G E,Tuzhikov A I,Kim S H,Kalkum M,Hong T B,Gorshkova E N,Torrance L,Vartapetian A B,Taliansky M. 2010. Phytaspase,a relocalisable cell death promoting plant protease with caspase specificity[J]. The EMBO Journal,29(6):1149-1161.
Denison F C,Paul A L,Zupanska A K,Ferl R J. 2011. 14-3-3 proteins in plant physiology[J]. Seminars in Cell & Development Biology,22(7):720-727.
Folgado R,Sergeant K,Renaut J,Swennen R,Hausman J F,Panis B. 2014. Changes in sugar content and proteome of potato in response to cold and dehydration stress and their implications for cryopreservation[J]. Journal of Proteomics,98(4):99-111.
Forni C,Braglia R,Beninati S,Lentini A,Ronci M,Urbani A,Provenzano B,Frattarelli A,Tabolacci C,Damiano C. 2010. Polyamine concentration,transglutaminase activity and changes in protein synthesis during cryopreservation of shoot tips of apple variety annurca[J]. Cryo Letters,31(5):413-425.
Hatsugai N,Iwasaki S,Tamura K,Kondo M,Fuji K,Ogasa-wara K,Nishimura M,Hara N I. 2009. A novel membrane fusion-mediated plant immunity against bacterial pathogens[J]. Genes & Development,23(21):2496-2506.
Mittler R,Vanderauwera S,Gollery M,Breusegem F V. 2004. Reactive oxygen gene network of plants[J]. Trends in Plant Science,9(10):490-498.
Oecking C,Jaspert N. 2009. Plant 14-3-3 proteins catch up with their mammalian orthologs[J]. Current Opinion in Plant Biology,12(6):760-765.
Price E R,Jin M,Lim D,Pati S,Walsh C T,Mckeon F D. 1994. Cyclophilin B trafficking through the secretory pathway is altered by binding of cyclosporin A[J]. Procee-dings of the National Academy of Sciences,91(9):3931-3935.
Ren L,Zhang D,Jiang X N,Gai Y,Wang M W,Reed B M,Shen X H. 2013. Peroxidation due to cryoprotectant treatment is a vital factor for cell survival in Arabidopsis cryopreservation[J]. Plant Science,212:37-47.
Ren L,Zhang D,Chen G Q,Reed B M,Shen X H,Chen H Y. 2015. Transcriptomic profiling revealed the regulatory mechanism of Arabidopsis seedlings response to oxidative stress from cryopreservation[J]. Plant Cell Reports,34(12):2161-2178.
Robert M R,Salinas J,Collinge D B. 2002. 14-3-3 proteins and the response to abiotic and biotic stress[J]. Plant Molecular Biology,50(6):1031-1039.
Saxena S C,Salvi P,Kaur H,Verma P,Petla B P,Rao V,Kamble N,Majee M. 2013. Differentially expressed myo-inositol monophosphatase gene(CaIMP) in chickpea(Cicer arietinum L.) encodes a lithium-sensitive phosphatase enzyme with broad substrate specificity and improves seed germination and seedling growth under abiotic stresses[J]. Journal of Experimental Botany,64(18):5623-5639.
Tran V,Weier D,Radchuk R,Thiel J,Radchuk V. 2014. Caspase-like activities accompany programmed cell death events in developing barley grains[J]. PLoS One,9(10):e109426.
Vartapetian A B,Tuzhikov A I,Chichkova N V,Taliansky M,Wolpert T J. 2011. A plant alternative to animal caspases:Subtilisin-like proteases[J]. Cell Death & Differentiation,18(8):1289-1297.
Xu G Y,Rocha P S,Wang M L,Xu M L,Cui Y C,Zhu Y X,Xia X . 2011. A novel rice calmodulin-like gene,OsMSR2,enhances drought and salt tolerance and increases ABA sensitivity in Arabidopsis[J]. Planta,234(1):47-59.
Zhang D,Ren L,Chen G Q,Zhang J,Reed B M,Shen X H. 2015. ROS-induced oxidative stress and apoptosis-like event directly affect the cell viability of cryopreserved embryogenic callus in Agapanthus praecox[J]. Plant Cell Reports,34(9):1499-1513.
Zhao Q,Zhang H,Wang T,Chen S X,Dai S J. 2013. Proteomics-based investigation of salt-responsive mechanisms in plant roots[J]. Journal of Proteomics,82:230-253.
(責任編輯 王 暉)

