經木香烴內酯誘導的骨髓間充質干細胞用于治療腦缺血再灌注損傷的研究*
江 羽,王葉葉,梁 晨,譚 睿,2**
(1.西南交通大學醫學院 成都 610031;2.西南交通大學生命科學與工程學院 成都 610031)
缺血性腦卒中現在仍是危害人類性命的重大疾病之一,其發病率、致殘率及死亡率都極高[1],由于該疾病的復雜性及神經修復的困難性,至今仍缺乏有效的治療與預后手段[2]。現有如抗炎、抗氧化等多種治療方案被報道,但在臨床治療效果評價中,均未取得顯著性突破[3]。令人欣喜的是,干細胞用于心腦血管疾病治療成為新的研究熱點,也為腦缺血的治療提供了新的方向。其中,骨髓間充質干細胞(Bone Marrow Mesenchymal Stem Cells,bMSCs)是一種來源于骨髓基質系統中的非造血組織干細胞,具有較強的增殖能力且有多向分化潛能,在特定的理化環境或一些細胞因子的誘導下可以向神經系細胞(如神經元細胞、星形膠質細胞等)分化[4,5],且bMSCs易獲取、易在體外培養,具有較強的增殖能力,因此常被用于干細胞分化與治療研究[6]。目前最常用于誘導bMSCs 分化為神經樣細胞的物質是β-巰基乙醇和堿性成纖維細胞生長因子(bFGF)[7,8],其中,bFGF 來源少且價格昂貴,而β-巰基乙醇易引起細胞死亡且誘導成功后維持時間較短[9],因此需進一步研發新型藥物分子用于干細胞治療。中藥單體來源廣泛,提取便利,其藥理效果越來越受到重視[10]。木香烴內酯是中藥木香的主要有效成分,是一種倍半萜內酯類化合物,主要有抗炎、抗腫瘤[11]等作用。有研究證明,木香烴內酯可通過提高Bcl-2 的表達量、降低Bax的表達量[12]及激活Keap1-Nrf2-ARE 通路誘導大量抗氧化分子的表達[13]達到神經保護的作用。同時,神經保護的另一重要機制是促進神經修復與再生,而誘導干細胞分化正是神經再生的途徑之一[14],因此考慮木香烴內酯是否有促進bMSCs 分化為神經樣細胞的作用。本實驗用木香烴內酯作為誘導劑,體外檢測其對bMSCs 向神經樣細胞分化的誘導效果,進一步通過誘導分化后bMSCs 對腦缺血再灌注損傷大鼠模型的治療作用進行研究。
1 材料與方法
1.1 材料
1.1.1 試劑及儀器
胎牛血清(gibco,批號:1908121);DMEM 低糖培養基(Hyclone,批號:J180003);胰蛋白酶(Hyclone,批號:J180003);四甲基偶氮唑鹽(MTT)(銳賽生物公司,批號:180315);2,3,5-氯化三苯基四氮唑(TTC)(源葉生物科技有限公司,批號:BCBR5460V);4%多聚甲醛(Biosharp,批號:180119);96 孔板(Thermo,批號:167008);蘇木素染液套裝(武漢谷歌生物科技有限公司,批號:G1005);NESTIN 一抗(武漢谷歌生物科技有限公司,批號:GB12137);GFAP一抗(武漢谷歌生物科技有限公司,批號:GB11096);NSE 一抗(武漢谷歌生物科技有限公司,批號:GB11376-1);二抗CY3山羊抗小鼠(武漢谷歌生物科技有限公司,批號:GB21301);二抗488 山羊抗兔(武漢谷歌生物科技有限公司,批號:GB25303);二抗CY3山羊抗兔(武漢谷歌生物科技有限公司,批號:GB21303)。
1.1.2 實驗動物
SPF 級成年雄性SD 大鼠40 只,平均體質量在280-300 g,用于制備腦缺血再灌注動物模型;SPF 級2-4 周齡雄性SD 大鼠2 只,平均體質量在120-140 g,用于制備骨髓間充質干細胞。
1.2 試驗方法
1.2.1 bMSCs的分離、培養
選取2-4周齡健康雄性SD大鼠脫頸處死,將全身浸入75%乙醇中消毒約10 min。在無菌條件下取出雙側脛骨和股骨,剪去兩端骨骺,用5 mL 注射器抽取5 mL 含15%胎牛血清的DMEM 完全培養基先自一端沖出骨髓,再從另一端沖洗,制成單細胞懸液,置于10 mL培養皿中,放置于37℃、體積分數為5%CO2及飽和濕度培養箱中,24 h 后全量換液,以后每2 天換液1次,去除非貼壁細胞。每日觀察細胞的生長情況,待原代細胞融合達到80%-90%時,按1∶3 比例進行傳代,并將培養基更換為含10%胎牛血清的DMEM 完全培養基。經多次傳代擴增培養,使骨髓間充質干細胞逐漸得到純化。
1.2.2 木香烴內酯對bMSCs毒性檢測
通過MTT 檢測木香烴內酯對bMSCs 的毒性。取第三代bMSCs,按照每孔1.0×104個細胞接種于96 孔板中,放置于培養箱中24 h使其貼壁。設置木香烴內酯的濃度梯度為2 μM,5 μM,10 μM,20 μM,40 μM,60 μM,80 μM,并按分組加入相應濃度藥物,置于培養箱中培養24 h。培養結束后,每孔加入MTT(5 mg·mL-1)20 μl,避光培養2 h 后吸出培養基,每孔加入100 μl DMSO,充分震蕩后使用酶標儀檢測吸光度,波長為570 nm,記錄結果,以藥物濃度為橫坐標,細胞存活率為縱坐標繪制bMSCs生存曲線。
1.2.3 木香烴內酯誘導bMSCs向神經樣細胞分化
選擇第3代bMSCs,按照每孔1.0×105個細胞接種于6 孔板,放置于培養箱中培養24 h 使其貼壁。根據MTT 結果,選擇濃度為10 μM 的木香烴內酯溶液對bMSCs進行誘導,根據時間設置4 h,12 h,24 h共3組,定時觀察細胞形態變化,并對其進行骨架染色。將誘導結束后的細胞固定,封片,通過免疫熒光染色的方法對其NSE,GFAP及Nestin三種神經細胞標志蛋白的表達量變化進行檢測。
1.2.4 腦缺血再灌注動物模型制備
將40 只大鼠隨機平均分為假手術組,模型組,MSC 組及木香烴內酯誘導MSC 組(誘導組)(n=10)。使用改良Zea Longa's 線栓法制作大腦中動脈閉塞(MCAO)局灶性腦缺血模型[15]。具體步驟為:以體積分數10%的水合氯醛溶液按0.33-0.36 mL·100g-1量進行腹腔注射麻醉后,將大鼠固定于手術板,頸部常規消毒后備皮,于頸部正中切口,用棉簽鈍性分離肌肉,暴露出右側頸總動脈,分離頸總動脈、頸內動脈及頸外動脈,結扎頸總動脈近心端,于結扎處上端剪口,將線栓插入剪口處并進線(在線栓近頭端1.5 cm處標記,進線時標記點到達Y型分支口即可),縫合,消毒,每只大鼠術后補充5 mL生理鹽水,2 h后拔出線栓進行再灌注。
根據Longa Z 的5 分制法進行神經功能損傷評分[16],選取1-2分的動物隨機分組,在拔線2 h后,每只由尾靜脈注射含1.0×106個細胞的bMSCs細胞或誘導后bMSCs細胞懸液1 mL(由PBS作溶劑),假手術組與模型組注射等量PBS。術后2 h,1天,3天,5天,7天對動物進行神經功能評分。于造模7 天后,處死大鼠并取腦,對大腦行TTC染色及HE染色,并采用干濕重法測量腦組織含水量。
1.2.5 統計學分析
采用SPSS 17.0對數據進行單因素方差分析,數據結果以均數 標準差(xˉ)表示,P <0.05表示有顯著性差異,有統計學意義。
2 結果
2.1 木香烴內酯對bMSCs毒性檢測
bMSCs 的存活率通過MTT 實驗檢測(圖1),隨木香烴內酯濃度增加,細胞在2-10 μM 濃度范圍內存活率均高于90%,而濃度超過10 μM 時細胞存活率明顯下降。說明木香烴內酯濃度在10 μM 以上時,具有較大的細胞毒性。因此,本實驗中選擇濃度為10 μM 的木香烴內酯對bMSCs進行誘導。
2.2 誘導后bMSCs形態學研究
bMSCs形態學變化用于評價木香烴內酯對bMSCs向神經樣細胞的誘導作用。光鏡下觀測結果(圖2),在0-24 h間,細胞由圖A到圖D,形態逐漸拉長并出現細胞分支,表現出神經細胞樣形態。
通過細胞骨架(β-actin)染色對細胞形態進一步觀察(圖3),細胞在木香烴內酯作用下,由圖A 中梭型、無分支樣逐漸變化為圖D中較長且有分支的形態,呈神經細胞樣。骨架染色結果與光鏡下觀察結果一致。表明在木香烴內酯的條件誘導下,bMSCs 逐漸向神經樣細胞分化。
2.3 神經細胞標志蛋白免疫熒光染色
神經元特異性蛋白NSE、Nestin 和星型膠質細胞特異性蛋白GFAP是用來檢測干細胞誘導分化后是否存在神經樣細胞的指標[17]。染色結果(圖4),與空白組相比,木香烴內酯誘導bMSCs 后三種神經細胞標志蛋白的表達量均有升高,其中蛋白GFAP 和Nestin 的表達量在誘導后24 h達到峰值,蛋白NSE 的表達量在誘導后12 h 達到最高值。證明bMSCs 在經木香烴內酯誘導后逐漸向神經樣細胞分化,且最終確定誘導條件為10 μM木香烴內酯孵育細胞24 h。
2.4 神經功能損傷評分
術后動物根據Longa Z 的5 分制法進行神經功能損傷評分(表1),術后2 h及1天內,MSC組及誘導組動物的評分有所降低,但與模型組相比無顯著性差異(P >0.05);術后5天、7天內,與模型組相比,MSC組評分有明顯下降(P <0.05),而誘導組評分與模型組相比差異更加明顯(P <0.01)。

圖1 木香烴內酯對bMSCs細胞毒性測定

圖2 光學顯微鏡下觀察bMSCs形態學變化(×100)(A:空白組;B:誘導4 h;C:誘導12 h;D:誘導24 h)

圖3 bMSCs細胞骨架染色免疫熒光檢測(×400)(A:空白組;B:誘導4 h;C:誘導12 h;D:誘導24 h)
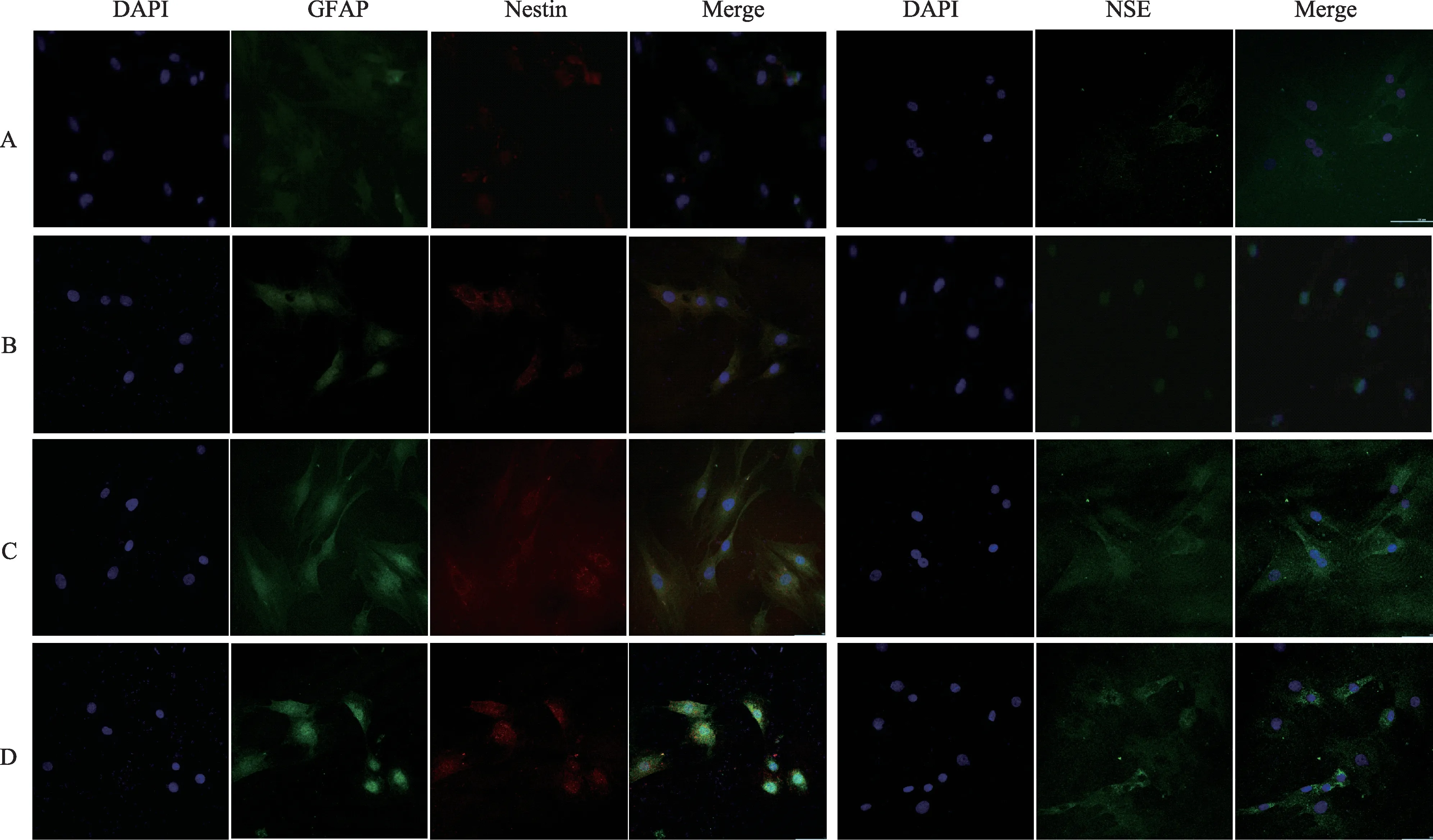
圖4 誘導后bMSCs細胞NSE,GFAP及Nestin免疫熒光染色(×200)(A:空白組;B:誘導4 h;C:誘導12 h;D:誘導24 h)

表1 術后動物神經功能損傷評分(n=10)
2.5 TTC染色,腦梗死體積及腦組織含水量
術后7 天,腦梗死情況(圖5),MSC 組及誘導組大鼠腦梗死體積明顯小于模型組,且誘導組大鼠腦梗死體積相較于MSC 組有明顯減小。誘導組大鼠腦部梗死體積為14.76%±0.56,與模型組相比明顯下降,且有顯著性差異(P <0.01);MSC 組腦部梗死體積為23.15%±0.08,與模型組相比有所下降,但無顯著性差異(P >0.05);誘導組大鼠腦部梗死體積與MSC組相比也有顯著下降(P <0.01)。模型組大鼠腦組織的含水量為81.19%±0.27,與假手術組相比明顯增加,有顯著性差異(P <0.05);MSC組腦組織含水量為80.80%±0.20,與模型組相比有所下降,但無顯著性差異(P >0.05);誘導組大鼠腦組織的含水量為78.93%±0.38,與模型組相比明顯下降,且有顯著性差異(P <0.05),與MSC 組相比也有顯著性差異(P <0.05),說明bMSCs與誘導后bMSCs均可使腦缺血損傷大鼠腦梗死體積減小并降低腦含水量,且誘導組效果優于MSC組(表2)。
2.6 HE染色
大鼠腦缺血半暗區組織學觀察顯示(圖6),假手術組神經元細胞結構正常,排列整齊緊密,染色均勻,細胞核大而圓;模型組神經元細胞結構損傷,可見神經元細胞核出現明顯固縮和深染,細胞間質水腫,結構疏松;MSC組與誘導組均可見大鼠缺血半暗帶區固縮、濃染神經元減少,組織間隙水腫減輕,但兩組相比,誘導組缺血半暗帶區恢復效果優于MSC 組。以上實驗結果說明,誘導后的bMSCs 對腦缺血再灌注損傷的治療作用更加明顯。
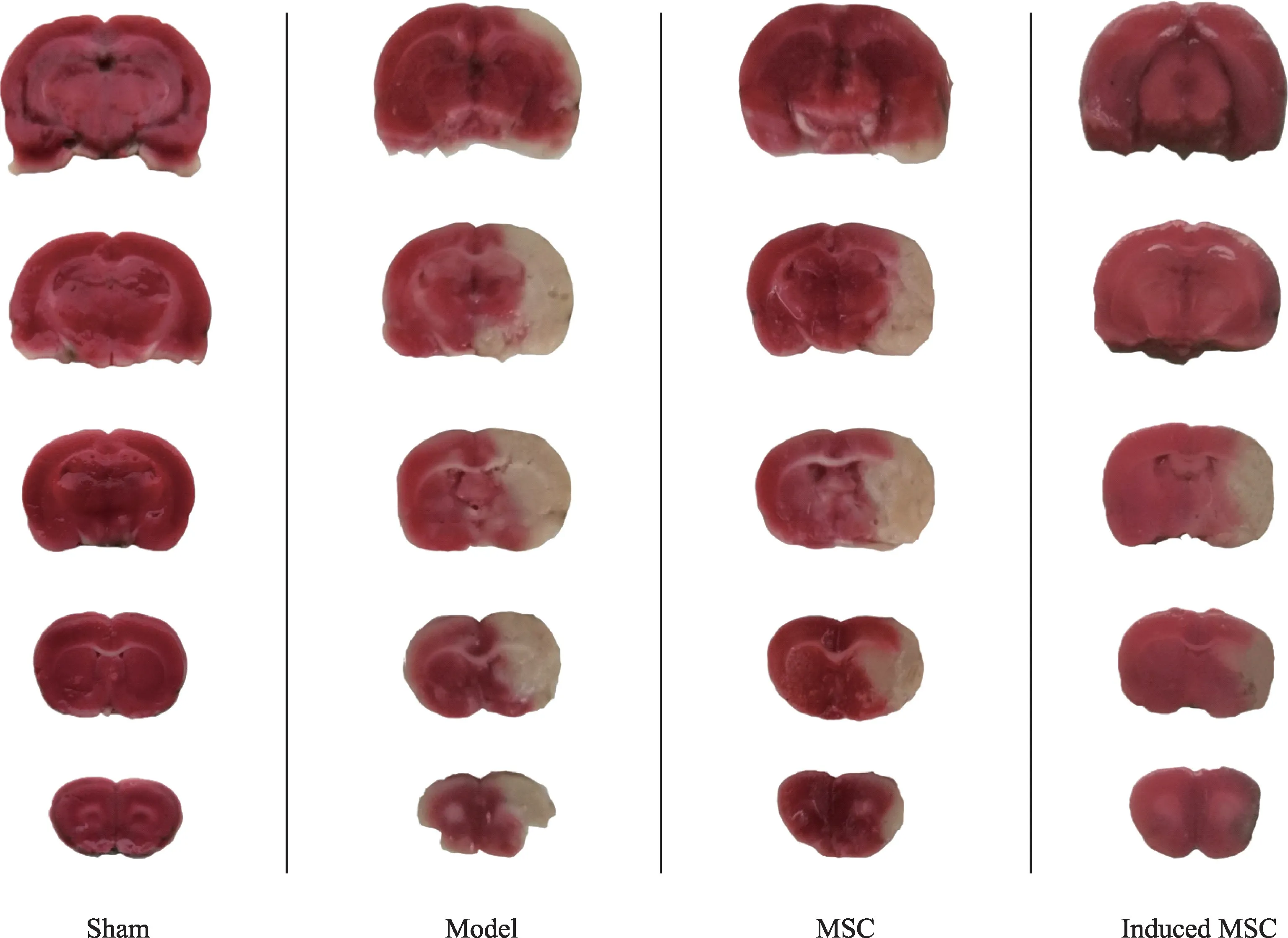
圖5 術后動物腦組織TTC染色(白色為梗死部位,紅色為正常部分)
3 討論
干細胞用于心腦血管疾病治療是近年來的研究熱點[18]。在針對腦缺血的治療中,主要有注射神經干細胞[19,20]及注射bMSCs[21,22]兩種研究方向。但外源神經干細胞主要來源于胚胎或胎兒,其應用廣受爭議,而骨髓間充質干細胞可從自體器官獲得,無倫理爭議,且無需進行免疫抑制治療[23],是當下干細胞治療領域的研究重點。2000 年左右,bMSCs 向神經細胞樣分化的實驗是在體內進行的,Kopen 等將標記的大鼠bMSCs 直接注射入新生小鼠的側腦室發現其能在腦微環境影響下分化為神經樣細胞[24],但bMSCs 細胞在體內的分布及分化存在多種可能性,難以完全向預期方向發展。隨著研究的深入,Woodbury等報道bMSCs可通過體外誘導向神經樣細胞分化[6]。bMSCs 在體外分化為神經樣細胞后,會有較好的腦靶向性,能更多地分布在腦病灶部位,發揮更加有效的治療作用[25]。
膠質纖維酸性蛋白(GFAP)是星形膠質細胞活化的標志物;神經元特異性烯醇化酶(NSE)是神經元和神經內分泌細胞所特有的一種酸性蛋白酶;巢蛋白(Nestin)是一種中間絲類型的蛋白,為神經干細胞的*P <0.05,**P <0.01:與模型組相比;&P <0.05,與假手術組相比;#P <0.05,##P <0.01,與MSC組相比。特征性標志物[26,27]。這三種蛋白是用于證明干細胞經誘導后向神經細胞分化的主要標志蛋白[28]。本研究中發現隨木香烴內酯對bMSCs 誘導時間的延長,細胞形態逐漸拉長并出現分支,表現出神經樣細胞形態,同時NSE,GFAP 及Nestin 三種神經細胞標志蛋白的表達量也有所上調,證明木香烴內酯可誘導bMSCs 向神經樣細胞分化。在此基礎上,利用腦缺血再灌注大鼠模型對誘導后bMSCs 的治療效果進行驗證,由神經功能損傷評分可見誘導組動物術后神經恢復情況較MSC 組更佳,且狀態更活躍,能主動進食飲水。腦梗死體積與腦含水量結果顯示,誘導組及MSC組皆可減輕術后腦部損傷,而兩組對比,誘導組動物腦梗死體積的減小及腦含水量的降低均更為顯著。由腦組織HE染色結果可知,誘導組及MSC組大鼠的缺血半暗帶組織結構均有不同程度的恢復,其中誘導組病灶部位的神經元較完整、組織更加緊密。通過對兩組治療結果進行對比,可見誘導組的治療效果明顯優于MSC組。

表2 術后動物腦梗死體積及腦組織含水量變化(n=10)

圖6 大鼠腦組織HE染色(×50)(A:假手術組;B:模型組;C:MSC組;D:誘導組)
綜上所述,bMSCs 經木香烴內酯誘導后可向神經樣細胞分化,且用誘導后bMSCs 治療腦缺血可顯著降低病灶部位的損傷。干細胞治療這一領域仍有無限潛能,今后可能會為治療心腦血管疾病提供更好的方向與思路,具有很高的臨床價值。

