基于碳納米管組裝電化學傳感器測定金絲桃苷的含量
李小蓉,郭 惠,龍 旭,劉江濤,劉靖麗,李佳佳,張永枚
(陜西中醫藥大學藥學院,陜西西安 712046)
金絲桃苷(Hyperoside),又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一種黃酮醇苷類化合物,是金絲桃屬藥用植物的一種主要有效成分。近年來,大量文獻報道其具有多種藥理學活性,如抗急性肝損傷[1]、抗炎[2]、抗抑郁、抗血栓、抗氧化應激、抗菌、抗癌等。因此,對藥用植物或藥品中金絲桃苷的含量檢測具有非常重要的意義。

基于單壁碳納米管(SWCNTs)具有良好的催化活性、導電性和較大的比表面積等特性,本文采用SWCNTs修飾玻碳電極(GCE),構建電化學傳感器,對中藥有效成分金絲桃苷的含量進行檢測,建立一種簡單、高靈敏的金絲桃苷的電化學檢測方法,并用于實際樣品疏肝解郁膠囊中金絲桃苷的測定,以期為中藥有效成分檢測提供新技術支持。
1 材料與方法
1.1 材料與儀器
金絲桃苷對照品(純度≥98%) 上海源葉生物科技有限公司;N,N-二甲基甲酰胺 分析純,天津恒興化學試劑制造有限公司;SWCNTs 深圳市納米港有限公司;鐵氰化鉀、氯化鉀 分析純,上海化學試劑有限公司;甲醇 分析純,天津市天力化學試劑有限公司;疏肝解郁膠囊 成都康弘藥業集團股份有限公司;實驗用水 均為二次蒸餾水;其余試劑均為國產分析純。
CHI660E電化學工作站 上海辰華儀器有限公司;SG8200H超聲波清洗機 上海冠特超聲儀器有限公司;pHS-3C型精密pH計 上海日島科學儀器有限公司。
1.2 實驗方法
1.2.1 修飾電極的制備
1.2.1.1 SWCNTs的羧基化 精密稱取2 g SWCNTs置于50 mL的小燒杯中,加入一定量36%的HCl,超聲6 h(40 kHz)后,用去離子水洗滌,直至洗出液的pH大于6.0為止。然后加入2 mol/L的HNO3溶液,靜置1 h后,在溫度為90 ℃的恒溫水浴鍋中放置10 h,接著超聲1 h(40 kHz),最后用去離子水沖洗SWCNTs至洗出液的pH為中性。在減壓真空干燥箱中于60 ℃干燥20 h,即得羧基化的SWCNTs[15]。
1.2.1.2 GCE的處理 將GCE(直徑3 mm)在麂皮上用0.5 μm的Al2O3拋光至鏡面,然后用二次蒸餾水清洗干凈,晾干。然后將其置于1.0×10-4mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中,掃描循環伏安(CV)圖。重復上述操作,直至得到對稱且可逆的氧化還原峰,峰電位差小于80 mV,取出電極備用。
1.2.1.3 SWCNTs/GCE修飾電極的制備 稱取羧基化的SWCNTs 2.0 mg,加入1 mL的N,N-二甲基甲酰胺,超聲3 h(40 kHz),得到均勻的分散液,精密移取一定體積的分散液,滴在處理好的GCE表面,空氣中自然晾干。
1.2.2 修飾電極的電化學表征
1.2.2.1 不同電極面積的計算 在1.0×10-4mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中,采用計時庫侖法,得到裸GCE電極和SWCNTs/GCE電極的計時庫倫曲線,根據計時庫倫曲線的Q-t數值,繪制Q-t1/2曲線,得到不同電極的Q-t1/2曲線方程及線性相關系數。依據不同電極Q-t1/2曲線的斜率和Anson 公式,可以計算出不同電極的面積。Anson公式的表達式為:
式中:n是電子轉移數目,對K3[Fe(CN)6]溶液,n=1;F為法拉第電解常數,F=96485C/mol,A為電極的表面積,c是溶液的濃度,D是擴散系數,在1.0×10-4mol/LK3[Fe(CN)6](含0.1 mol/L KCl)溶液中,D=7.6×10-6cm2/s;Qdl為雙電層的充電量,Qads為法拉第電荷。
1.2.2.2 修飾電極的電化學性質 以濃度1.0×10-5mol/L金絲桃苷為測定液,采用CV法對裸電極和修飾電極進行表征,并和裸電極相比較,以確定修飾電極的電化學性能。
1.2.3 金絲桃苷在修飾電極表面作用機制 為了研究金絲桃苷在傳感器表面的反應機制,實驗中考察了掃描速度對金絲桃苷的電化學行為的影響,研究掃描速度分別為0.02、0.05、0.10、0.15、0.20、0.25、0.30時,金絲桃苷在傳感器上的峰電位和峰電流的數值,得到氧化峰電流及還原峰電流與掃描速度的關系,以確定其作用機制。
1.2.4 實驗條件的優化 以0.1 mol L-1的磷酸緩沖溶液(PBS)為介質,1.0×10-5mol/L金絲桃苷溶液作為測定液,固定掃描電位為-0.2~0.8 V,掃描速度為0.10 V/s,SWNTs用量為10 μL,采用CV法考察金絲桃苷溶液的pH分別為2.0、3.0、4.0、5.0、6.0、7.0、8.0時傳感器的響應信號;固定pH為6.0,考察SWCNTs用量分別為5、7、10、12、15、18 μL時對電極的修飾效果;SWNTs用量為10 μL,pH為6.0,采用i-t曲線法考察初始電位值分別為0.20、0.25、0.30、0.34、0.40、0.45 V時傳感器的響應值。
1.2.5 電化學測量 實驗中采用三電極系統,以SWCNTs/GCE修飾電極或GCE為工作電極、鉑片為對極,飽和甘汞電極(SCE)為參比電極。選擇SWCNTs用量分別為10 μL,以+0.34 V(vs. SCE)為工作電位,在0.1 mol/L PBS(pH=6.0)中記錄傳感器的背景電流;然后將傳感器浸入含濃度分別為3.0×10-9、7.0×10-9、1.0×10-8、3.0×10-8、7.0×10-8、1.0×10-7mol/L金絲桃苷溶液中記錄傳感器的響應電流。兩次電流的差值即為傳感器對金絲桃苷的響應電流。
1.2.6 樣品的處理 稱取0.35 g疏肝解郁膠囊,置于50 mL小燒杯中,加入10 mL甲醇,超聲45 min,然后離心10 min,取上清液,過濾,重復上述提取過程3次,合并濾液,濃縮至10 mL。取所得液體10 μL,用緩沖溶液稀釋至100 mL作為待測液。
1.3 數據處理
以上實驗均平行3次,所得數據經CHI660E電化學工作站記錄和導入后,采用Origin 8.0繪圖。
2 結果與討論
2.1 電極面積的測定結果
電極面積的大小直接影響到對傳感器的響應信號及檢測的靈敏度,實驗中計算了裸電極和修飾電極的面積,結果如圖1所示。根據圖1可得,裸GCE的Q-t1/2曲線線性方程為:Q(10-4C)=0.0279 t1/2(s1/2)+0.0104(r=0.999);SWCNTs/GCE修飾電極Q-t1/2曲線線性方程為:Q(10-4C)=0.4075 t1/2(s1/2)+2.2375(r=0.996);根據Anson公式計算出兩者的電極面積分別為0.10、1.36 cm2。表明和裸GCE相比較,SWCNTs/GCE電極的面積極大地增加,可以提高金絲桃苷檢測的靈敏度。
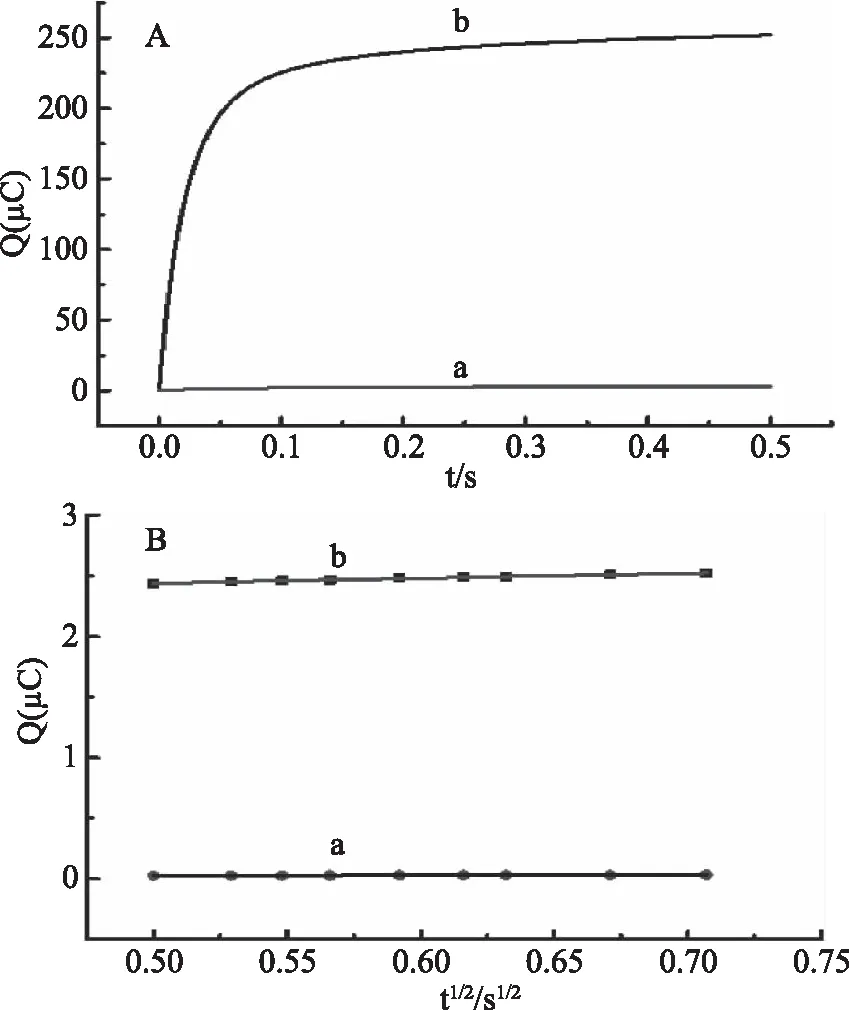
圖1 1.0×10-4mol/L K3[Fe(CN)6](含0.1mol/L KCl)在GCE電極(a)、SWCNTs/GCE電極(b)上的計時庫侖曲線(A)及Q-t1/2曲線(B)
2.2 金絲桃苷在不同電極上的電化學響應
本實驗研究了不同電極的電化學活性,考察了不同電極在1.0×10-5mol/L金絲桃苷溶液中上的循環伏安行為,結果如圖2所示。從圖2中可以看出,在裸GCE電極上金絲桃苷出現了一對氧化還原峰,但峰電流較小。在SWCNTs/GCE電極上金絲桃苷的氧化峰電流和還原峰電流急劇增加,氧化峰電流大約是裸電極的56倍,還原峰電流約是裸電極的38倍。峰電流的增大表明,SWCNTs能夠對金絲桃苷的電子轉移起到促進作用,具有較高的電催化活性,這主要是由于SWCNTs具有優異的導電性和較大的比表面積的原因。

圖2 1.0×10-5mol/L金絲桃苷在裸GCE(a)、SWCNTs/GCE電極(b)上的CV圖(A);在SWCNTs/GCE電極上,加入1.0×10-5mol/L金絲桃苷前(c)和后(d)的CV圖(B)
2.3 金絲桃苷在修飾電極表面作用機制
圖3展示了不同掃描速度下金絲桃苷的CV曲線。由圖3可以看出,隨著掃描速度的增加,氧化峰電流和還原峰電流逐漸增加。氧化峰電流及還原峰電流在一定范圍內與掃描速度的平方根成正比,其線性關系分別為:ipa=93.4v1/2-6.1624(r=0.9844)和ipc=209.46v1/2-30.023(r=0.992),表明金絲桃苷在電極上的反應是受擴散控制的過程。

圖3 1.0×10-5mol/L金絲桃苷在SWCNTs/GCE電極上不同掃描速度下的CV曲線(A)及氧化峰電流ipa-v1/2(a)和還原峰電流ipc-v1/2(b)的線性關系圖(B)
2.4 實驗條件的優化
2.4.1 溶液pH的選擇 實驗中發現,隨著pH的變化,金絲桃苷在傳感器表面的電化學行為也發生了變化,如圖4所示,主要體現在隨著溶液pH的增加,金絲桃苷的氧化峰電流先迅速增加,當pH達到6.0時,氧化峰電流達到最大值;繼續增大pH,氧化峰電流又急劇降低。因此,綜合考慮氧化峰電流和峰形的因素,本實驗中選取pH為6.0的PBS緩沖液的作為最佳底液。而隨著溶液pH的增加,氧化峰電位及還原峰電位均發生負移,說明電極反應過程有H+參與。
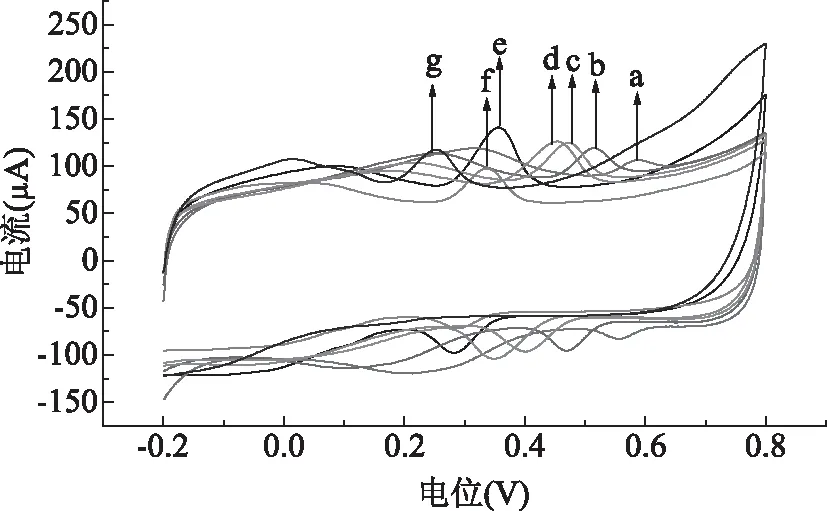
圖4 1.0×10-5mol/L金絲桃苷在SWCNTs/GCE電極上不同pH時的CV疊加圖
2.4.2 SWCNTs用量的選擇 實驗中考察了SWCNTs用量對修飾電極性能的影響。根據實驗結果(圖5)可知,氧化峰電流先隨著SWCNTs用量的增加而增加,當SWCNTs用量為10 μL時,峰電流達到最大;隨著SWCNTs用量的繼續增加,氧化峰電流迅速降低,這主要是因為當SWCNTs用量過多時,修飾層的厚度就會增大,反而阻礙電子的傳遞。因此,實驗選擇SWCNTs的用量為10 μL。
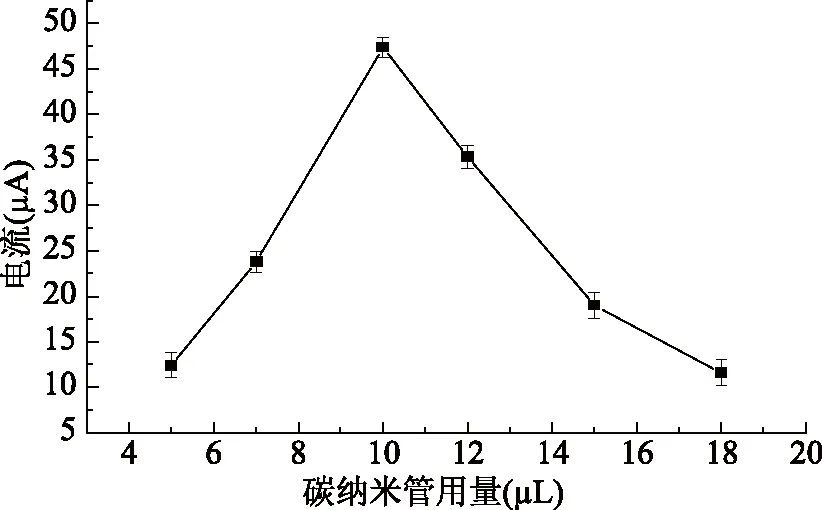
圖5 SWCNTs用量對金絲桃苷氧化峰電流的影響
2.4.3 電位的選擇 采用i-t曲線法測量時,初始電位值對金絲桃苷的氧化電流會產生重要的影響。因此實驗中在0.2~0.45 V的電位范圍內,研究了電位對金絲桃苷的氧化電流的影響,結果見圖6。當電位在0.2~0.34 V變化時,隨著電位的增加,氧化電流也增加,在0.34 V達到最大。此后,隨著電位的繼續增加,氧化電流迅速降低。因此實驗中選擇金絲桃苷的測定電位為0.34 V。

圖6 電位對金絲桃苷氧化電流的影響
2.5 標準曲線和檢出限
在優化實驗條件下,考察了氧化電流隨金絲桃苷濃度的變化情況,見圖7。結果表明,隨著金絲桃苷濃度的增加,氧化電流也隨之增加,在3.0×10-9~1.0×10-7mol/L范圍內,金絲桃苷濃度與氧化電流呈現良好的線性關系,線性回歸方程為i=1.2262C+0.0105(r=0.9921),檢出限(S/N=3)為2.41×10-9mol/L。與文獻已報道的檢測方法相比,具有較低的檢出限[16]。
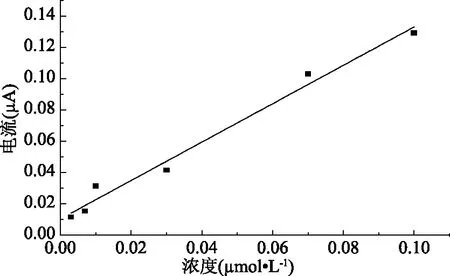
圖7 金絲桃苷濃度與氧化電流的關系
2.6 重現性與穩定性
傳感器的重現性和穩定性對測量結果具有重要的影響,因此在優化的實驗條件下,研究了傳感器的重現性和穩定性。每次使用后將該傳感器放在pH=6.0的磷酸緩沖溶液中,采用CV法在電位區間-0.8~0.8 V范圍內掃描10圈,使修飾電極表面重新活化。采用該修飾電極對1.0×10-8mol/L金絲桃苷進行6次重復測定,得到相對標準偏差為2.5%。用同樣的方法分別制作3支修飾電極,對1.0×10-8mol/L金絲桃苷測定的相對標準偏差為1.2%,表明構筑的傳感器重現性較好。通過分析該傳感器在儲存的過程中響應信號的變化情況來探索其穩定性,實驗結果見表1。將在室溫下放置15 d的電極,在同樣條件測定金絲桃苷,氧化電流電流仍能達到最初的95.6%,表示該傳感器具有良好的穩定性。
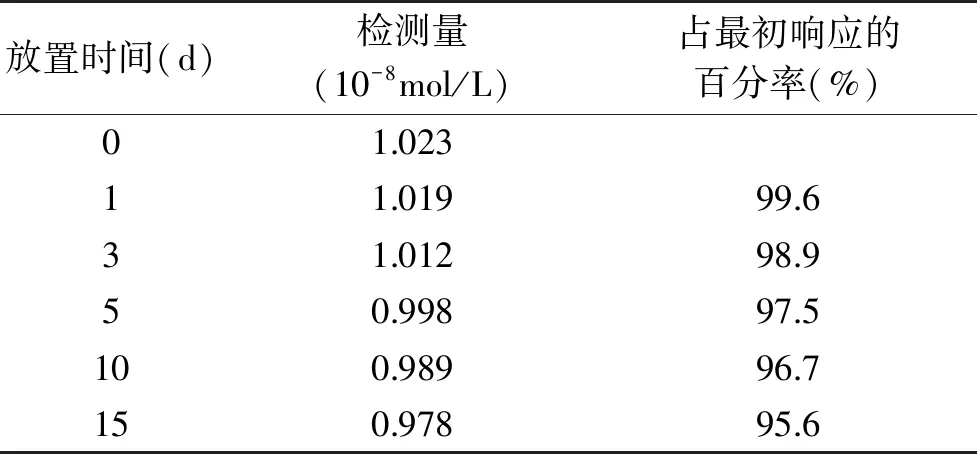
表1 不同時間傳感器的響應Table 1 The response of the sensor at different time
2.7 干擾實驗
2.8 實際樣品分析
利用制備的傳感器對疏肝解郁膠囊中的金絲桃苷進行了加標回收檢測,在相同條件下平行檢測3次,取其平均值,以提高傳感器檢測的準確性,測定結果見表2。傳感器對1.0×10-8mol/L金絲桃苷測定的回收率為103.0%~106.4%,標準偏差為1.2%~3.3%。結果表明,該傳感器可用于實際樣品中金絲桃苷的含量測定。
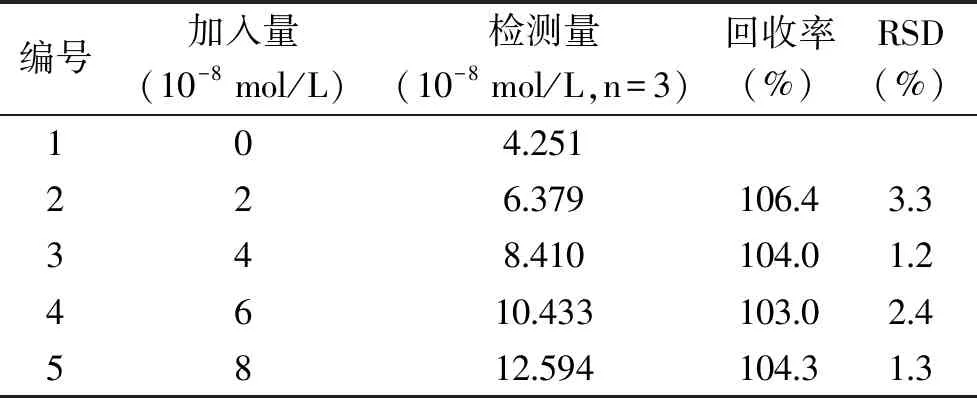
表2 疏肝解郁膠囊中金絲桃苷的檢測 Table 2 Results of analysis of hyperoside in Shugan Jieyu capsule
3 結論
本文通過酸氧化法在SWCNTs表面引入功能基羧基,將其修飾在GCE表面,構建了一種電化學傳感器用于金絲桃苷的檢測。該傳感器面積為1.36 cm2,面積較大,對金絲桃苷具有較好的電催化活性。對金絲桃苷檢測的線性方程為:i=1.2262C+0.0105(r=0.9921),檢出限為2.41×10-9mol/L。平均回收率為103.0%~106.4%,檢測結果的RSD為1.2%~3.3%,低于5%。該傳感器在金絲桃苷的檢測中具有線性范圍較寬、檢測限較低、制作簡單、成本較低等優點。本研究為金絲桃苷的檢測提供了一種新的思路。

