α皰疹病毒的神經傳導——軸突上的“穿梭”
祁寒松,吳紅霞,仇華吉,孫元
α皰疹病毒的神經傳導——軸突上的“穿梭”
祁寒松,吳紅霞,仇華吉,孫元
中國農業科學院哈爾濱獸醫研究所 獸醫生物技術國家重點實驗室,黑龍江 哈爾濱 150069
α皰疹病毒經過長期的進化與宿主形成了良好的相互適應關系。其中部分α皰疹病毒具有典型的嗜神經特性,受到廣泛的關注和深入的研究。嗜神經性α皰疹病毒能突破宿主屏障而感染神經元,并在其胞體內大量繁殖進而完成進一步的擴散或在胞體中建立潛伏感染。病毒無論是感染神經元還是在進一步擴散的過程中都會經歷沿軸突或樹突的傳導過程,所以此過程是病毒生命周期中不可或缺的一部分,同時也是影響病毒入侵神經系統的關鍵因素。對嗜神經性α皰疹病毒在神經元內傳導過程的研究不僅能深入地了解病毒,而且還能針對性地研發相應的疫苗或靶向性治療藥物,同時還可利用其神經嗜性將病毒作為解析神經環路的有力工具。文中主要對α皰疹病毒在軸突中的傳導機制進行了綜述,并提出病毒在軸突中傳導的研究發展方向和應用價值,可為防控α皰疹病毒感染提供參考。
α皰疹病毒,神經元,軸突,傳導
α皰疹病毒 (Alphaherpesviruses) 是哺乳動物重要的嗜神經性病原體。近年來隨著超高分辨率顯微技術的發展和熒光標記技術的廣泛應用,進一步解析了α皰疹病毒粒子及其亞單位結構在細胞內的行為方式。對嗜神經性α皰疹病毒的研究主要集中于病毒在神經系統中的潛伏感染和病毒粒子在神經元內的運行等方面。這些研究對于解析α皰疹病毒的生物學特性和致病機制都起著至關重要的作用。尤其體現在病毒粒子在軸突中的傳導情況,目前針對病毒在軸突中的傳導過程研發了安全高效的疫苗和靶向藥物。文中主要對α皰疹病毒在神經元中定向傳導的研究進展及其應用進行了闡述和剖析。
1 α皰疹病毒與神經系統
1.1 α皰疹病毒的分類及特征
皰疹病毒科分為3個亞科:α、β和γ皰疹病毒亞科 (圖1)。α皰疹病毒為雙鏈DNA病毒,其病毒粒子大小為200–250 nm,由核酸、衣殼、基質和囊膜組成[1]。部分α皰疹病毒的宿主譜非常廣,能夠在多種宿主中建立潛伏感染[2]。人類α皰疹病毒包括單純皰疹病毒1型 (Herpes simplex virus type 1,HSV-1) 和單純皰疹病毒2型 (Herpes simplex virus type 2,HSV-2) 及水痘-帶狀皰疹病毒 (Varicella-zoster virus,VZV)。除此之外,還包括動物皰疹病毒如牛皰疹病毒1型 (Bovine herpesviruses type 1,BHV-1)、馬皰疹病毒Ⅰ型 (Equine herpesviruses type 1,EHV-1)、偽狂犬病病毒 (Pseudorabies virus,PRV)、馬立克氏病病毒 (Marek’s disease virus,MDV)和禽傳染性喉氣管炎病毒 (Avian infectious laryngotracheitis virus,AILTV) 等。目前已對多數具有神經嗜性的α皰疹病毒進行了深入的研究,包括HSV、VZV、PRV、BHV-1,但常作為模式病毒來研究的主要是PRV和HSV-1。這類病毒具有廣泛的組織嗜性和神經侵襲力,病毒一旦進入外周或中樞神經系統,就會在神經元間進行跨突觸傳播,并對神經系統造成損傷或在感覺神經元胞體中建立終身潛伏感染[3]。
1.2 神經元的結構
神經元是高度分化的細胞,是神經系統最基本的結構和功能單位。神經元通常由突起和胞體組成,突起分為軸突和樹突兩種。樹突短而分枝多,直接由胞體擴張突出形成樹枝狀,其作用是接受其他神經元軸突傳來的沖動并傳給胞體。軸突長而分枝少,為粗細均勻的細長突起,常起于軸丘,其作用是接受外來刺激再由胞體傳出。軸突除分出側枝外,其末端形成樹枝樣的神經末梢,分布于某些組織器官內形成各種神經末梢裝置。根據胞體發出突起的多少將神經元分為3類:假單極神經元、雙極神經元和多極神經元。α皰疹病毒粒子在軸突和樹突中的雙向傳導是病毒在宿主體內和宿主間傳播必不可少的[4]。
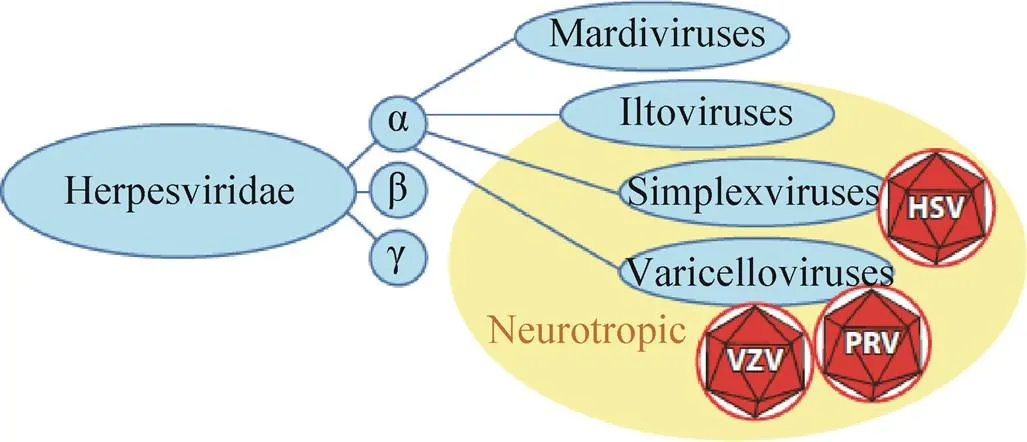
圖1 α皰疹病毒的分類[4]
1.3 α皰疹病毒在神經元之間的傳播
α皰疹病毒在神經系統中的擴散包括病毒在相鄰神經元之間長距離的跨突觸傳播[5-6]。在入侵神經系統之前,α皰疹病毒通常感染體細胞,如上皮細胞。病毒在這些細胞中復制后,通過入侵分布于組織中的神經末梢而進入神經元。為了進一步入侵宿主的神經系統,病毒粒子進入神經末梢后逆向傳導進入胞體,并在感覺神經元胞體中建立終身的潛伏感染[7]。但在天然宿主中建立潛伏感染是基于入侵神經系統的病毒量較少,若大量病毒粒子入侵神經元,則會在胞體中進行復制并進一步傳導[8]。當宿主處于應激或某種特殊狀態時潛伏感染可被再激活,再激活后新合成的病毒粒子通過依賴于軸突分選的方式正向傳導至外周,通常可引起宿主上皮組織的病變 (圖2)[9]。例如HSV-1和HSV-2感染導致的復發性表皮病變(冷瘡)。病毒再激活后偶爾會傳播至中樞神經系統,而這與α皰疹病毒感染導致的致死性后果具有很大關系,如PRV感染引起豬只的腦炎[10]。有報道稱,PRV引起豬只的死亡也與其誘導的系統性炎癥因子有關,其中包括神經系統的炎癥因子風暴[11]。雖然目前對α皰疹病毒粒子在神經元中的定向傳導了解甚少,但它是α皰疹病毒完整生命周期的重要組成部分。
2 α皰疹病毒在神經元中的復制周期
2.1 病毒粒子的吸附和入侵
α皰疹病毒入侵神經系統是從感染外周神經元開始的,而病毒感染宿主是由成熟的病毒粒子所發起的,其具有復雜的多層結構,這些結構在所有皰疹病毒中都是保守的[3]。HSV-1的感染過程,首先是糖蛋白gC和gB介導病毒粒子吸附于細胞表面的硫酸乙酰肝素蛋白聚糖受體,進一步的入侵依賴于糖蛋白gD,它與細胞膜表面的受體結合,其中包括Nectin-1、皰疹病毒入侵因子(Herpesvirus entry mediator,HVEM) 和3--硫酸化乙酰肝素(3--sulfated heparan sulfate)[12-15]。對于PRV,gD介導病毒粒子穿過細胞膜進入細胞中,但不參與細胞間的傳播和神經侵襲[16]。而VZV gE在感染初期可能通過與胰島素降解酶(Insulin- degrading enzyme,IDE) 結合發揮與gD類似的功能,因此認為IDE是VZV的一種受體[17]。病毒粒子結合后由糖蛋白gB、gH和gL介導病毒囊膜與細胞膜的融合[18-19]。
病毒粒子通過膜融合進入細胞后會經歷一個基質蛋白解聚的過程,促使大部分病毒基質蛋白進入細胞質中。然而,某些特定的基質蛋白(UL14、UL16、UL21、UL36、UL37、US3和ICP0) 在進入細胞后仍附著在衣殼上 (圖3)[20]。這些衣殼基質復合體會逆向沿軸突向胞體運輸,最終進入核周域與核孔對接。利用活細胞成像和電子顯微鏡技術發現3種蛋白(UL36、UL37和US3) 與胞內的PRV衣殼粒子共轉運[21]。最近的研究主要集中在基質蛋白UL36和UL37在病毒入侵過程中的作用。UL36和UL37在感染期間具有多種功能,其中UL37在病毒粒子進入神經元后參與了病毒極早期基因的表達調控以及病毒在軸突中的逆向傳導[22];UL36的功能包括運輸衣殼至細胞核,使衣殼對接到核孔并釋放病毒基因組至核內。
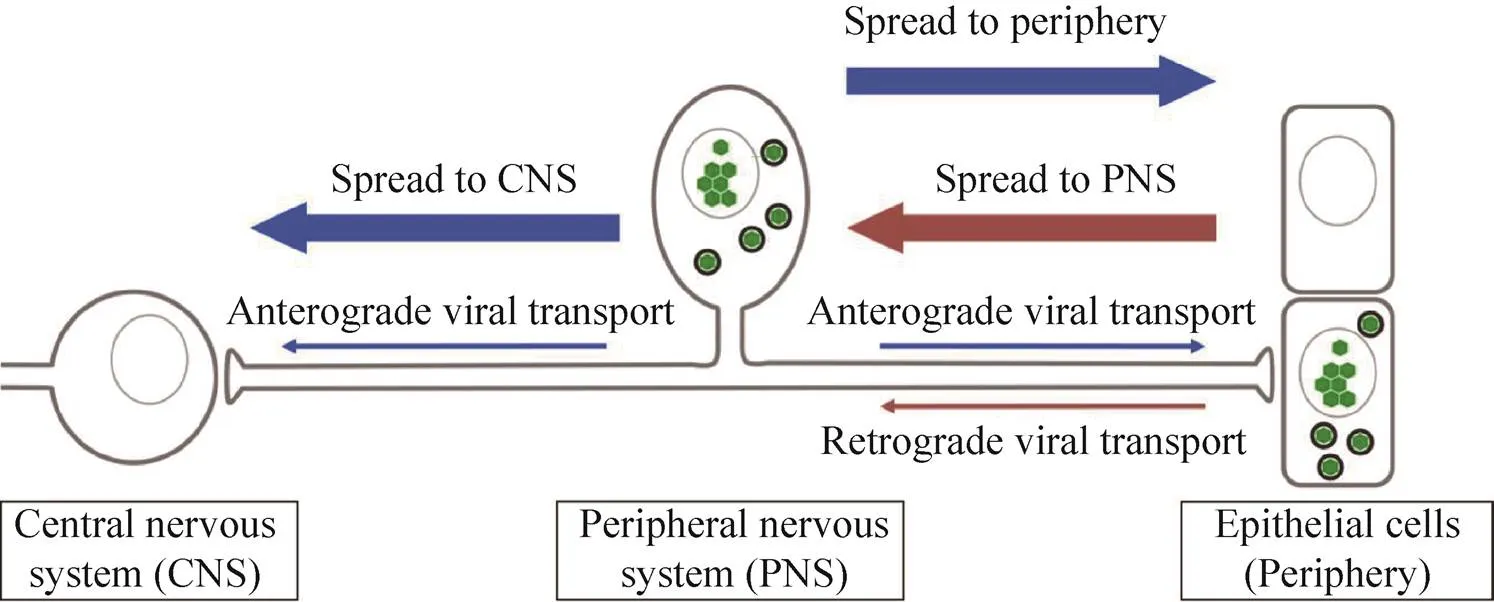
圖2 α皰疹病毒在軸突中傳導模式圖[9]
2.2 病毒基因組的復制
病毒在入侵神經元后經過基質蛋白的解聚、軸突的逆向傳導、衣殼與核孔的對接最終將病毒基因組釋放入核。基因組進入細胞核后,線性病毒基因組開始環化,環形DNA作為模板進行病毒基因組的復制。最初為θ型復制,然后轉換為滾環復制,最終合成的線性基因組包裝進入衣殼[1-2]。病毒基因組進入細胞核還啟動了高度時序性的病毒基因轉錄級聯反應,這是皰疹病毒感染的特征。病毒基因可以被細分為3類依次表達的轉錄物:立即早期基因、早期基因和晚期基因。對于PRV來說,基因轉錄的啟動是通過表達立即早期基因(HSV同源物)開始的,IE180是一種有效的轉錄激活因子,可誘導病毒早期基因的表 達[1]。早期基因主要編碼與核苷酸代謝有關的酶,而晚期基因編碼基因組包裝和組裝新合成病毒粒子所必需的結構成分。
2.3 病毒粒子的組裝和釋放
新復制的病毒基因組在細胞核內被包裝到衣殼中,這一過程涉及復制形成的多聚DNA被切割成單體線性基因組,隨后包裝進入衣殼。包裝后,PRV核衣殼從細胞核中穿過核膜進入細胞質。目前的研究表明,出核過程開始于核衣殼通過出芽的方式,跨過內核膜進入核周質,這個過程使衣殼被內核膜包裹,這是第一次獲得囊膜。隨后囊泡與外核膜融合將核衣殼釋放到細胞質中。皰疹病毒核衣殼的出核依賴于病毒蛋白UL31、UL34和US3[23]。但最近的研究表明,其他的病毒基質蛋白和核膜糖蛋白也與病毒粒子第一次獲得囊膜有關,但這些蛋白在出核過程中的作用仍不清楚。
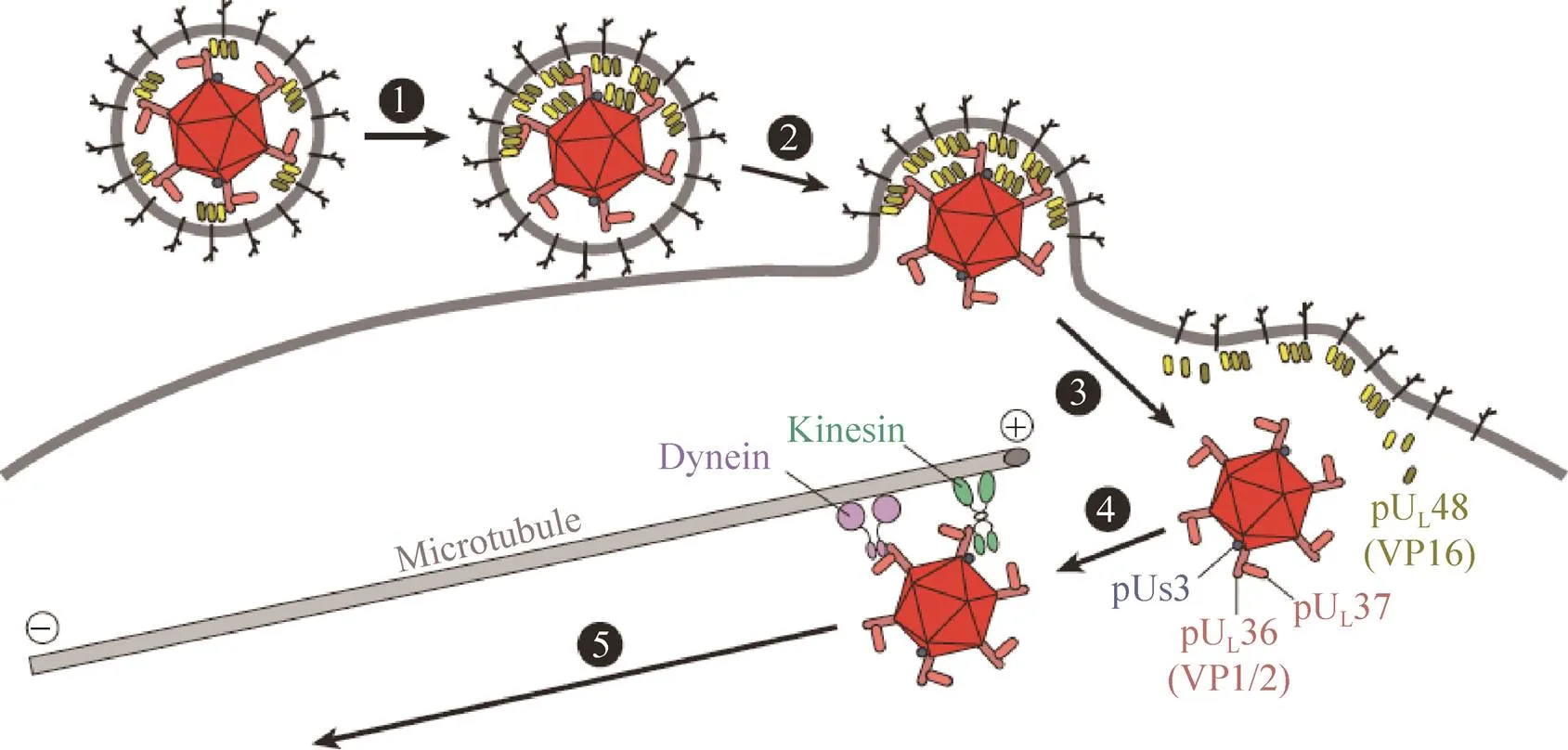
圖3 α皰疹病毒早期入侵過程[4]
病毒粒子出核之后在細胞質中經歷組裝和成熟,在胞質中它們獲得了基質蛋白并出芽到囊泡中獲得最終的囊膜[24]。獲得基質蛋白后的病毒粒子在運輸囊泡中第二次獲得囊膜。盡管用于二次囊膜裝配的膜結構其確切細胞起源仍然未知,但這些膜結構包含一些病毒和細胞的蛋白,有利于病毒粒子的組裝和釋放。關于嗜神經性α皰疹病毒在軸突正向傳導前病毒粒子的組裝狀態共有兩種模型。其中“匹配模型”認為,在軸突分選和運輸到細胞膜上釋放位點之前,病毒粒子在胞體中發生組裝和二次囊膜的裝配[25]。相反,“分離模型”認為,裸衣殼(核衣殼與部分基質蛋白組裝,但還未獲得囊膜) 和用于二次囊膜裝配的組分分別進行軸突分選和運輸,這些組分最終在釋放位點或靠近釋放位點處進行組裝[26-27]。目前研究結果表明,PRV感染后的組裝過程符合匹配模型[28]。
病毒粒子的出胞是通過運輸囊泡膜與細胞膜融合將病毒粒子釋放到細胞外。該過程的詳細分子機制尚不清楚,但可能是依賴于介導細胞囊泡胞吐的可溶性N-乙基馬來酰亞胺附著蛋白受體(Soluble N-ethylmaleimide attachment protein receptor,SNARE) 蛋白來完成的[29-30]。在神經元中病毒的出胞過程有兩種方式,一種是病毒粒子經軸突正向傳導出胞進入外周組織,另一種是沿樹突或軸突正向傳導出胞,并通過跨突觸傳播進入更高級的神經元及入侵中樞神經系統,通過軸突正向傳導進入中樞神經系統的神經元一般為假單極神經元。但關于樹突傳導的研究較少,大部分的研究都集中在軸突的傳導上,因為軸突中的傳導在病毒入侵細胞和釋放病毒的過程中均起著重要的作用。
3 α皰疹病毒在神經元中的定向傳導
3.1 細胞骨架的組成與功能
細胞骨架作為細胞結構的重要組成部分,在細胞生命周期中起著重要的作用,它們不僅參與維持細胞形態還參與胞內物質的運輸,其主要由微絲、微管和中間纖維組成。包括PRV和HSV在內的許多α皰疹病毒依賴于病毒與宿主細胞骨架間的相互作用來進行有效的傳播和轉運。其中,微絲和微管骨架在α皰疹病毒感染過程中起著非常重要的作用。微絲主要由肌動蛋白組成,其中肌動蛋白絲(F肌動蛋白) 在短距離物質運輸中起著至關重要的作用。蛋白絲由G肌動蛋白(球形肌動蛋白) 單體亞基組成,形成兩個相互纏繞的原絲。肌動蛋白絲直徑在5–9 nm之間,通常在細胞內形成三維網絡,但集中在細胞皮層。細胞中物質的定向轉運是由動力蛋白中肌球蛋白超家族介導的,已證實動力蛋白家族的幾個成員參與了蛋白在軸突中的靶向運輸過程[31-32]。
微管與微絲細胞骨架相反,其主要促進胞內物質的長距離運輸。微管是由α微管蛋白和β微管蛋白異二聚體亞基組成的剛性圓柱體,它們通過頭尾結合形成原絲。通常13條這種原絲結合形成中空的微管,其外直徑為25 nm。由于微管絲具有固定結構極性,所以微管具有高度動態的“正”極(通常朝向細胞外圍) 以及相對穩定的“負”極[朝向微管組織中心 (Microtubule organizing center,MTOC)][33]。這也是病毒在神經元中傳導方向的標識。在神經元中,微管的排布是高度特異性的,軸突中的微管幾乎都只定向于軸突末端的正極,而樹突中包含混合極性的微管,這種組織模式維持了不同神經元分室間的特性[32-33]。有兩類分子馬達蛋白介導了微管依賴性的定向運輸,動力蛋白馬達促進逆向運輸(朝向微管負極),而驅動蛋白家族馬達促進順向運輸(朝向微管正極)[35]。實質上驅動蛋白家族的分子馬達更加多樣化;哺乳動物基因組可編碼多達45種不同的驅動蛋白馬達,它們被分成14個不同的亞家族[36]。肌動蛋白和微管細胞骨架通常協同作用以維持穩定的細胞極性和促進其動力學的改變。
3.2 病毒入侵過程中的逆向傳導機制
為了進入細胞質,入侵的病毒粒子必須經過皮層肌動蛋白層。雖然病毒粒子結合細胞膜表面受體誘發肌動蛋白細胞骨架的重塑,但這個過程對于病毒入侵神經元的重要性目前尚不清楚[37-38]。用肌動蛋白解聚劑細胞松弛素D對細胞進行預處理不影響病毒入侵中的動態變化。相比之下,用微管解聚劑諾可達唑 (Nocodazole) 或秋水仙素 (Colchicine) 預處理細胞,可終斷病毒衣殼粒子向細胞核的逆向轉運,這表明在病毒入侵過程中微管細胞骨架起主要作用[22]。熒光標記的PRV和HSV-1衣殼在培養神經元軸突中的活細胞成像表明,逆向轉運是一個以約1 μm/s的速率發生的穩定過程,該速度與逆行性動力蛋白的快速軸突運輸速度一致[39]。此外,衣殼在軸突中的運輸雖具有逆行傾向性但仍具有雙向性,即病毒在軸突中進行轉運時不是單純的逆向運輸,而是同時具有短暫的正向運輸過程,但正向運輸在病毒通過軸突入侵細胞的過程中僅占極少部分,所以病毒通過軸突入侵胞體的過程具有逆行傾向性。同時這也表明驅動蛋白可能也參與了該過程。現已證實,存在于胞漿提取物中的驅動蛋白-1和驅動蛋白-2與病毒粒子入侵細胞后形成帶有部分基質蛋白的衣殼粒子相互作用[40]。
目前對于病毒粒子在軸突中的逆向轉運機制仍處于探索階段,其詳細的機制尚不明確。在這個過程中,病毒利用宿主的動力蛋白馬達來牽引其核衣殼沿著軸突進行逆向轉運,同時在軸突中的轉運受到宿主蛋白的調控。據報道,一小部分病毒衣殼蛋白和基質蛋白招募分子馬達來促進逆向運輸,其中包括UL36、UL37和VP26 (UL35)[41]。之前認為,UL36為病毒直接招募動力蛋白的主要蛋白,而UL37或VP26在該過程中并沒有起到關鍵性作用。因為UL36突變的病毒或注射UL36的抗體均可阻斷衣殼粒子向細胞核的傳遞,與此相反,UL37或VP26的缺失或突變似乎不具有相同的特性[42]。除此之外,近期的研究發現,UL36在參與軸突傳導過程中招募動力蛋白和動力蛋白激活蛋白來促進病毒粒子的運輸,其在該過程中直接與動力蛋白的亞基DIC (Dynein intermediate chain) 和動力蛋白激活蛋白的亞基p150和p50相互作用,并且UL36中的S區域在該過程中起到關鍵作用[43]。最新的研究表明,在UL37蛋白R2區域中突變5個氨基酸后病毒也喪失了逆向傳導能力,導致病毒衣殼不能進入胞體,同時在該過程中突變體病毒失去了逆行傾向性,在軸突中的正向傳導過程增加而逆向傳導過程減少,最終在軸突中的總位移幾乎為零[22]。該研究證明了UL37在逆向傳導過程中的重要性,并且可能是通過調控病毒衣殼粒子與驅動蛋白的相互作用來發揮其功能。
病毒粒子在軸突中的逆向運輸過程雖然主要由動力蛋白介導完成,但該過程仍需要多種軸突蛋白的參與,其中包括LIS1、Anxa2和Prph等。已有研究結果證實,敲低LIS1、Anxa2和Prph能顯著降低PRV病毒粒子入侵神經胞體的效率,并且LIS1和Anxa2都是在PRV入侵神經細胞后經歷軸突逆向傳導過程中新合成的[44]。這些軸突蛋白可能作為該過程的調控元件來影響PRV在軸突中逆向傳導,但這種作用方式究竟是PRV特異性的,還是宿主物質轉運所固有的調控機制,還有待進一步的探究。除了宿主蛋白分子的調控外,還包括病毒蛋白的化學修飾對傳導過程的調控。已有研究表明,PRV UL36蛋白動態泛素化修飾的過程顯著影響了病毒入侵神經元,泛素化和去泛素化的動態變化直接參與了PRV突破宿主屏障從體細胞入侵到神經系統和在神經元中沿軸突傳導的過程。其中,UL36的去泛素化協助病毒突破宿主屏障進入神經系統,而泛素化過程驅使了病毒粒子沿軸突轉運的過程,且其泛素化關鍵位點為第442位賴氨酸[45]。雖然UL36上關鍵賴氨酸位點的動態泛素化修飾顯著影響了病毒在軸突中的傳導過程,但泛素化和去泛素化的動態過程是如何被調控的仍需要進一步研究,其極有可能是通過對UL36上核定位信號中關鍵賴氨酸位點的泛素化來調控病毒沿軸突入核的過程。
目前對于α皰疹病毒逆向傳導機制的認識僅限于病毒基質蛋白UL36與動力蛋白和動力蛋白激活蛋白相互作用,促使病毒核衣殼沿著微管移動至核周域。該過程中還涉及到UL37與宿主蛋白的相互作用及LIS1、Anxa2和Prph等蛋白與病毒粒子或動力蛋白間的相互作用,但其中具體的機制和作用方式及調控模式都未知。雖然已有證據表明動力蛋白和動力蛋白激活蛋白與UL36相互作用,但仍不能排除其他蛋白也與動力蛋白復合體相互作用的可能性。有研究表明,在缺失UL37之后病毒粒子在軸突中正向傳導的比例明顯變高,且總位移幾乎為零[22]。這暗示著UL37蛋白也可能與動力蛋白復合體或驅動蛋白存在相互作用,且作為病毒粒子沿微管移動的“方向盤”或是動力馬達分子間的轉換器。在缺失UL37后病毒傳導方向的變化呈隨機分布,最終正向傳導和逆向傳導的比例幾乎相等 (圖4)。
3.3 病毒的正向傳導和軸突分選機制
α皰疹病毒經逆向傳導進入神經元胞體內進行復制后,將會經歷在神經元內的正向傳導,而在感染神經元期間的正向傳導取決于軸突分選和病毒粒子的長距離運輸。病毒粒子的正向傳導對于潛伏感染再激活之后病毒再次感染受神經支配的組織及在宿主之間的有效傳播是必不可少的[3]。α皰疹病毒的正向傳導過程主要分為兩個過程:首先是病毒粒子逆向傳導至胞體進行復制,然后沿著軸突正向傳導回到受神經支配的上皮組織。另一個過程則是病毒在胞體中復制后沿著軸突或樹突向更高級的神經元正向傳導,最終通過跨突觸傳播到達更高級的神經元。但這其中的具體分子機制仍然不清楚,還需要進一步的探索。
目前認為病毒粒子的軸突正向傳導主要由病毒相關蛋白與驅動蛋白相互作用有關,驅動蛋白攜帶病毒粒子沿微管移動來完成正向傳導過程。三種病毒膜蛋白(gE、gI和US9)是其在體內神經回路中正向傳播所必需的蛋白[47]。單獨缺失、或基因的突變體在體外表型差異較大。基因缺失的突變體完全喪失了正向跨神經元傳播的能力[48]。US9是一種小的(106個氨基酸) Ⅱ型尾錨定膜蛋白 (Type Ⅱ tail-anchored membrane protein),其表達具有晚期動力學效應,且富含抗洗滌劑膜微結構域,稱為脂筏[49]。在沒有US9的情況下,病毒粒子能在胞體中組裝但不能分選到軸突,但基因缺失的突變株具有神經元特異性。研究表明,US9與KIF1A存在相互作用,而KIF1A是驅動蛋白3 (Kinesin-3) 家族中的微管依賴性分子馬達[50]。KIF1A也是軸突分選和病毒粒子在軸突中病毒向釋放位點長距離運輸所必需的。KIF1A已知的多種功能與其在介導病毒粒子軸突分選和轉運中的作用一致[51]。雖然介導該過程的病毒蛋白和宿主蛋白仍不太清楚,但Kinesin-1是一個極佳的候選蛋白,因為它在轉運多種胞內物質方面發揮著重要的功能,且在幾乎所有哺乳動物細胞類型中廣泛表達。盡管如此,仍然不能排除其他細胞蛋白也可能介導募集kinesin-1或其他分子馬達到囊膜化病毒粒子上。
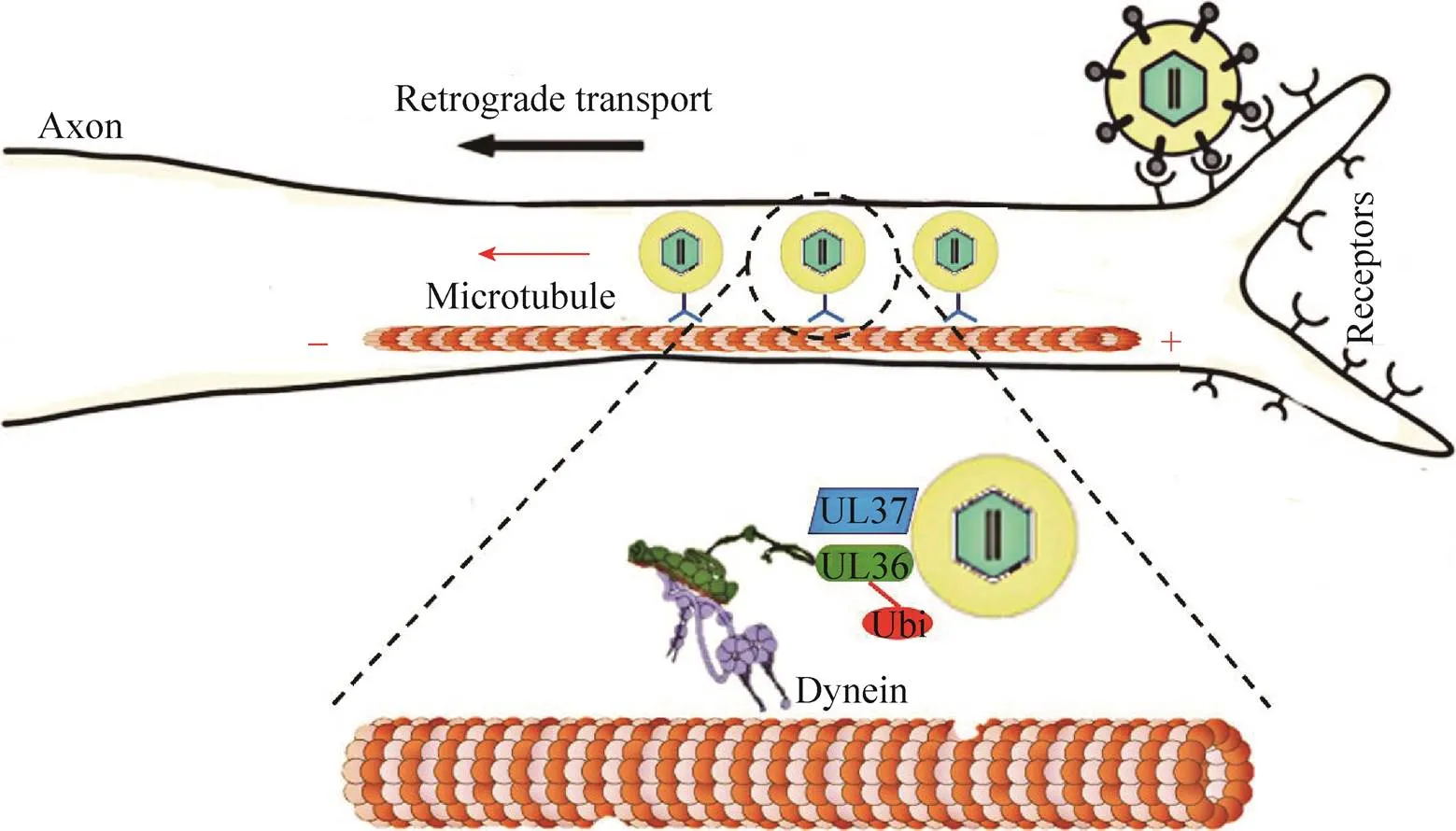
圖4 軸突逆向傳導模型(改自Orkide等[46])
對于PRV和基因缺失的突變體雖然能夠進行正向傳播,但與野生型相比其傳導能力降低[52]。gE/gI都是Ⅰ型膜蛋白,其在內質網 (Endoplasmic reticulum,ER) 中形成異源二聚體,在離開內質網后gE/gI主要定位于高爾基體、細胞質囊泡和細胞膜[53]。已有研究通過對細胞表面蛋白的生物素標記或使用特異性抗體證明了gE/gI從細胞膜上進行內吞并積聚在較大的囊泡中[53]。對于PRV來說,gE/gI復合物在體內的跨神經元傳播中是非必需的。但缺失gE的細胞質結構域或全長蛋白則導致病毒在非神經元細胞中形成的空斑變小,這表明其參與了在不同類型細胞間的傳播。相反,US9缺失突變體形成的空斑與野生型PRV形成的大小一致[54]。總體而言,這些結果意味著gE/gI和US9在調節正向跨神經元的傳播中具有不同的功能。
目前對于軸突正向轉運調控方面的研究相對匱乏,仍需不斷摸索。有研究表明,在病毒入侵神經元后,軸突轉運過程中UL36的442位賴氨酸泛素化使其正向傳導速度明顯降低,在傳導過程中靜止的時間也明顯增多,但這并沒有影響病毒入侵時逆向傳導的過程。反而是1 613位賴氨酸的泛素化雖不影響正向傳導的速度和靜止時間,但明顯縮短了逆向傳導的時間,這可能是1 613位氨基酸泛素化后加快了逆向傳導速度或增加了逆向運輸在傳導過程所占的比例[45]。與此同時,最近的研究結果顯示PRV UL37 R2突變體在軸突逆向傳導過程中顯著增加了正向傳導所占的比例[22]。以上實驗結果更加體現出α皰疹病毒在軸突中傳導過程的復雜性,并不是單一的正向傳導或是逆向傳導,而是一個精細的動態化過程 (圖5)。
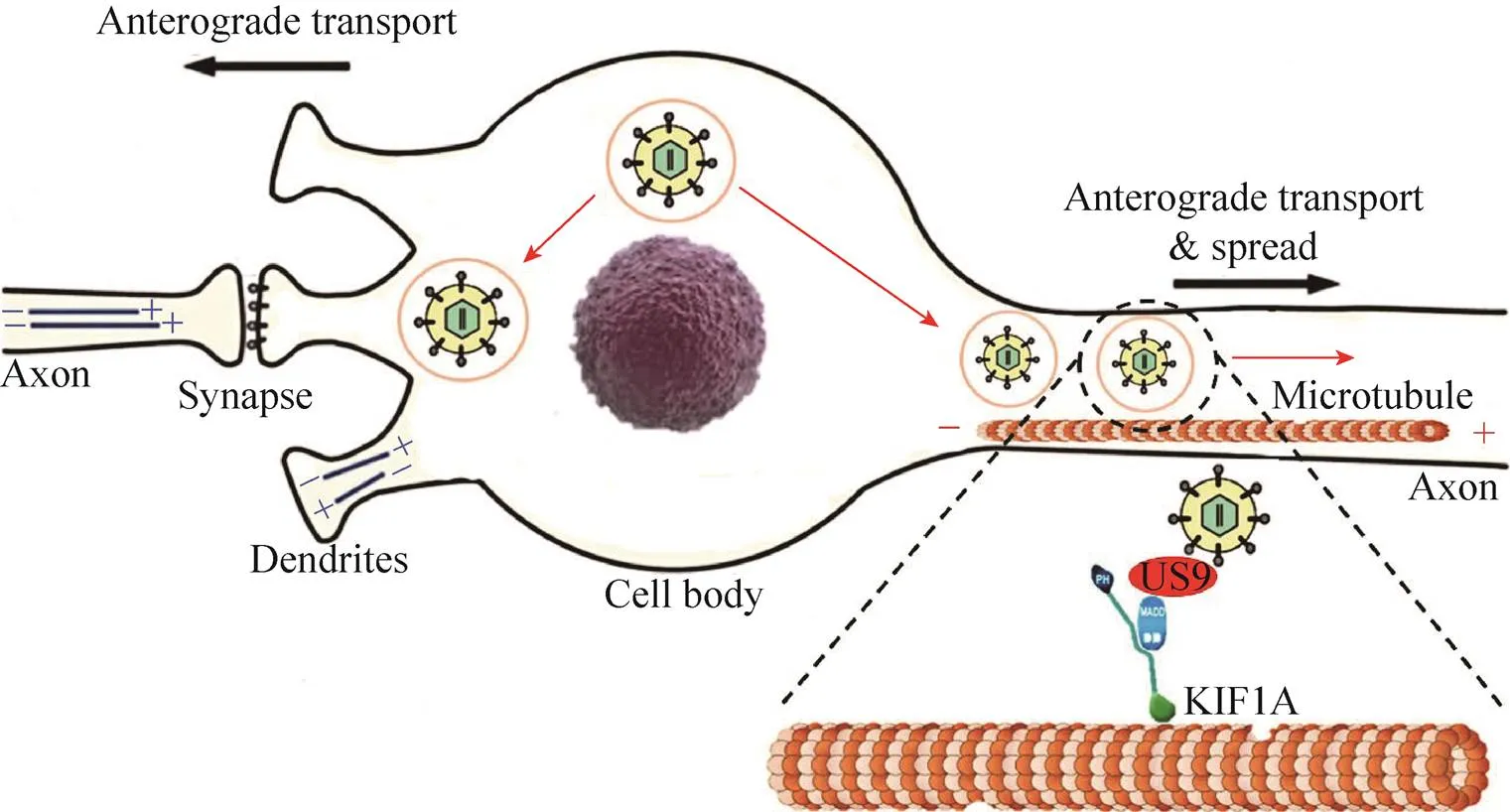
圖5 軸突正向傳導模型(改自Orkide等[46])
4 α皰疹病毒定向傳導研究的意義
4.1 神經回路的解析
α皰疹病毒在解析神經回路方面的應用通常與病毒標記示蹤技術相結合,主要探究外周神經系統與中樞神經系統間的聯系和中樞神經系統內局部環路兩方面。此外,α皰疹病毒作為解析神經回路的有力工具,優勢是其能夠在神經環路中復制,因此可以放大示蹤信號,增加檢測的靈敏度,同時使神經環路更好地實現可視化。PRV通常作為神經逆向傳導的示蹤工具揭示傳入神經通路[55]。已有研究利用GFP與β半乳糖苷酶 (β-gal)標記的PRV對中樞神經中神經元的功能進行了探究。將GFP-PRV接種入星狀神經節,同時將β-gal-PRV注射入初級運動皮層,通過對雙標記神經元的鑒定揭示了中樞神經元可能支配的神經通路[56]。而HSV-1通常作為順行的神經環路示蹤工具揭示傳出神經網絡[57-58]。利用細菌人工染色體 (Bacterial artificial chromosome,BAC) 技術構建了能夠同時表達4個GFP分子的HSV-1 H129株,高熒光強度使其能夠有效標記神經元并實現了其形態的高度可視化,包括對樹突、棘突和軸突纖維的可視化。將基因敲除后,可實現對單個突觸的示蹤,通過對神經環路細節的可視化以及對神經網絡的標記,有助于提升對中樞神經系統內神經網絡的認識,也為研究神經退行性大腦疾病提供了參考和借鑒意義[59]。
4.2 靶向抗病毒藥物的研發
HSV-1是引起復發性口炎和水泡的重要病原,其對人類健康造成了嚴重的危害。病原廣泛存在于人體神經系統中,因為少量病毒感染機體后能在神經元胞體中建立終身的潛伏感染。在潛伏感染期間病毒僅表達極少量的基因且不進行復制,這極大程度上避免了被宿主免疫系統清除,所以即使用疫苗來對抗該病毒也不能起到良好的控制效果。在這種情況下,靶向神經的抗病毒藥物顯得尤為重要。潛伏感染的病毒被再激活后都會經歷軸突或樹突正向運輸回到上皮組織或進入中樞神經系統,引起病理損傷。目前對于HSV的靶向治療問題,多數科學家嘗試通過對HSV病毒基因的編輯或阻斷病毒在胞體內的復制來解決。例如通過靈長類解旋酶抑制劑靶向抑制靈長類DNA解旋酶的活性從而阻斷病毒的復制,并探索了其在臨床上應用的潛在價值[60];再如通過HSV-1 m5核酸內切酶識別HSV-1的基因,并對其進行靶向的切割使病毒的關鍵基因被破壞而不能存活,從而獲得HSV-1靶向治療效應[61]。與此同時也可通過靶向神經的藥物來抑制病毒的傳導過程,從而阻止病毒的傳播。在該過程中可以通過抑制或敲低參與軸突運輸病毒蛋白的表達來抑制病毒傳播的效率,從而對發病患者進行有效的治療。雖然對于此類治療策略還未見報道,但仍然是HSV靶向治療藥物開發的一個方向。
4.3 疫苗研發
在PRV疫苗上應用比較廣泛的疫苗株為經典的Bartha-K61株,它是PRV強毒株(Becker株)缺失了、、基因的弱毒株。該毒株在神經軸突上的傳導能力與Becker株具有明顯的差異,Becker株能在神經軸突中雙向傳導,而Bartha-K61株僅能正向傳導[62]。gE蛋白是PRV從視網膜、嗅覺上皮細胞和三叉神經節侵入中樞神經組織所必需的,對PRV侵襲神經和沿著神經傳遞起著決定性的作用。其機制為gE與gI蛋白形成二聚體間接促進或穩定US9蛋白與驅動蛋白分子KIF1A之間的相互作用,使病毒核衣殼及其他蛋白分選至神經軸突中進行正向傳導[63]。其中、和三個基因均是與病毒在神經元中傳導相關的,這也說明了病毒在神經元中的傳導過程影響了病毒的神經毒力。雖然該疫苗株具有良好的免疫原性和保護效力,但仍能入侵神經元胞體,因而具有潛在的風險。最近報道的缺失突變株是一個良好的疫苗候選株,單獨缺失的突變株喪失了在軸突中逆向傳導的能力,即病毒無法進入胞體進行復制和潛伏感染,極大地提高了其作為疫苗株的安全性,同時在該研究中測試了其免疫原性,結果顯示其具有良好的免疫原性和安全性[22]。由于HSV感染人多處于潛伏感染狀態,只有當處于應激等特定的環境下才會發病,而有效的HSV疫苗仍然處于研究階段,所以靶向治療性的藥物開發顯得更為重要。
5 總結及展望
α皰疹病毒感染神經元后的定向運輸對于病毒在宿主體內和宿主之間的復制和傳播是必不可少的。病毒在神經系統內外的有效傳播取決于病毒粒子在軸突和樹突中的長距離運輸,病毒粒子的運輸像其他胞內物質的運輸一樣需要微管依賴的馬達分子。逆向傳導依賴于入侵病毒的衣殼和基質蛋白與動力蛋白之間的相互作用。對于感染的正向傳導需要驅動蛋白促進病毒粒子向近膜端的釋放位點運動。病毒粒子蛋白質的組成決定了募集和激活哪些馬達分子,從而決定了這些病毒粒子在感染細胞中被運輸到的最終位點。
要了解病毒復合體如何利用宿主蛋白在其宿主體內進行有效的長距離運輸還需深入研究,例如:病毒蛋白如何與動力蛋白或驅動蛋白相互作用來行使其功能;病毒粒子在軸突中的傳導如何受軸突中沿途表達的宿主蛋白分子來調控傳導過程;α皰疹病毒通過宿主細胞內的馬達分子來進行其在胞內的運輸是否具有特異性,抑或是軸突宿主蛋白對病毒傳導過程的調控是靶向病毒分子還是馬達分子等。這些都是目前亟待解決的問題,這對于認識α皰疹病毒在神經元軸突中的傳導和宿主內在的物質轉運機制都十分重要。此外,未來的研究還將探索病毒感染對細胞組分排布、動力學和內穩態改變的意義,這類研究對于理解α皰疹病毒在神經系統中傳播的特性和發病機制都極為重要。
α皰疹病毒作為嗜神經病毒中的一員,對其在神經元或神經系統中活動的深入研究除了探究其生活史和發病機理外,還希望能從研究中去探尋其嗜神經活動的生物學意義,以期對嗜神經病毒有一個更深層次的理解和認識。之前關于α皰疹病毒嗜神經的原因歸結為逃避宿主的免疫系統,以此更好地進行病毒的復制和傳播,但這與病毒在宿主體內建立潛伏感染似乎有些矛盾。α皰疹病毒在神經元中的潛伏狀態似乎預示著這種病毒與宿主機體間“祥和”的相互作用,驅使著這兩者未來的共生關系而不是單純的寄生關系。α皰疹病毒背后蘊含的寶藏還有待深入挖掘。
[1] Pomeranz LE, Reynolds AE, Hengartner CJ. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine. Microbiol Mol Biol Rev, 2005, 69(3): 462–500.
[2] Pellett PE, Roizman B. The Herpesviridae: a brief introduction//Knipe DM, Howley PM, Griffin DE, et al, Eds. Fields Virology. 5th ed. Philadelphia: Lippincott, Williams & Wilkins, 2007: 2479–2500.
[3] Bloom DC. Alphaherpesvirus latency: A dynamic state of transcription and reactivation. Adv Virus Res, 2016, 94: 53–80.
[4] Smith G. Herpesvirus transport to the nervous system and back again. Annu Rev Microbiol, 2012, 66: 153–176.
[5] Chen SH, Yao HW, Huang WY, et al. Efficient reactivation of latent herpes simplex virus from mouse central nervous system tissues. J Virol, 2006, 80(24): 12387–12392.
[6] Fekete R, Cserép C, Lénárt N, et al. Microglia control the spread of neurotropic virus infection via P2Y12 signalling and recruit monocytes through P2Y12-independent mechanisms. Acta Neuropathol, 2018, 136(3): 461–482.
[7] Antinone SE, Smith GA. Retrograde axon transport of herpes simplex virus and pseudorabies virus: a live-cell comparative analysis. J Virol, 2010, 84(3): 1504–1512.
[8] Koyuncu OO, MacGibeny MA, Hogue IB, et al. Compartmented neuronal cultures reveal two distinct mechanisms for alpha herpesvirus escape from genome silencing. PLoS Pathog, 2017, 13(10): e1006608.
[9] Kramer T, Enquist LW. Directional spread of alphaherpesviruses in the nervous system. Viruses, 2013, 5(2): 678–707.
[10] Steiner I, Kennedy PGE, Pachner AR. The neurotropic herpes viruses: herpes simplex and varicella-zoster. Lancet Neurol, 2007, 6(11): 1015–1028.
[11] Laval K, Vernejoul JB, van Cleemput J, et al. Virulent PRV infection induces a specific and lethal systemic inflammatory response in mice. J Virol, 2018, 92(24): e01614–e01618.
[12] Petermann P, Thier K, Rahn E, et al. Entry mechanisms of herpes simplex virus 1 into murine epidermis: involvement of nectin-1 and herpesvirus entry mediator as cellular receptors. J Virol, 2015, 89(1): 262–274.
[13] Thier K, M?ckel M, Palitzsch K, et al. Entry of herpes simplex virus 1 into epidermis and dermal fibroblasts is independent of the scavenger receptor MARCO. J Virol, 2018, 92(15): e00490–e00518.
[14] Koujah L, Suryawanshi RK, Shukla D. Pathological processes activated by herpes simplex virus-1 (HSV-1) infection in the cornea. Cell Mol Life Sci, 2018, 76(3): 405–419.
[15] Kopp SJ, Banisadr G, Glajch K, et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proc Natl Acad Sci USA, 2009, 106(42): 17916–17920.
[16] Ch'ng TH, Spear PG, Struyf F, et al. Glycoprotein D-independent spread of pseudorabies virus infection in cultured peripheral nervous system neurons in a compartmented system. J Virol, 2007, 81(19): 10742–10757.
[17] Suenaga T, Satoh T, Somboonthum P, et al. Myelin-associated glycoprotein mediates membrane fusion and entry of neurotropic herpesviruses. Proc Natl Acad Sci USA, 2010, 107(2): 866–871.
[18] Chowdary TK, Cairns TM, Atanasiu D, et al. Crystal structure of the conserved herpesvirus fusion regulator complex gH-gL. Nat Struct Mol Biol, 2010, 17(7): 882–888.
[19] Heldwein EE, Krummenacher C. Entry of herpesviruses into mammalian cells. Cell Mol Life Sci, 2008, 65(11): 1653–1668.
[20] Radtke K, Kieneke D, Wolfstein A, et al. Plus- and minus-end directed microtubule motors bind simultaneously to herpes simplex virus capsids using different inner tegument structures. PLoS Pathog, 2010, 6(7): e1000991.
[21] Copeland AM, Newcomb WW, Brown JC. Herpes simplex virus replication: roles of viral proteins and nucleoporins in capsid-nucleus attachment. J Virol, 2009, 83(4): 1660–1668.
[22] Richards AL, Sollars PJ, Pitts JD, et al. The pUL37 tegument protein guides alpha-herpesvirus retrograde axonal transport to promote neuroinvasion. PLoS Pathog, 2017, 13(12): e1006741.
[23] Speese SD, Ashley J, Jokhi V, et al. Nuclear envelope budding enables large ribonucleoprotein particle export during synaptic Wnt signaling. Cell, 2012, 149(4): 832–846.
[24] Mettenleiter TC, Klupp BG, Granzow H. Herpesvirus assembly: an update. Virus Res, 2009, 143(2): 222–234.
[25] Wisner TW, Sugimoto K, Howard PW, et al. Anterograde transport of herpes simplex virus capsids in neurons by both separate and married mechanisms. J Virol, 2011, 85(12): 5919–5928.
[26] Ibiricu I, Huiskonen JT, D?hner K, et al. Cryo electron tomography of herpes simplex virus during axonal transport and secondary envelopment in primary neurons. PLoS Pathog, 2011, 7(12): e1002406.
[27] Taylor MP, Kramer T, Lyman MG, et al. Visualization of an alphaherpesvirus membrane protein that is essential for anterograde axonal spread of infection in neurons. mBio, 2012, 3(2): e00063–12.
[28] Kratchmarov R, Taylor MP, Enquist LW. Making the case: married versus separate models of alphaherpes virus anterograde transport in axons. Rev Med Virol, 2012, 22(6): 378–391.
[29] Curanovic D, Enquist LW. Directional transneuronal spread of α-herpesvirus infection. Future Virol, 2009, 4(6): 591–603.
[30] Cai HQ, Reinisch K, Ferro-Novick S. Coats, tethers, Rabs, and SNAREs work together to mediate the intracellular destination of a transport vesicle. Dev Cell, 2007, 12(5): 671–682.
[31] Lewis TL Jr, Mao TY, Arnold DB. A role for myosin VI in the localization of axonal proteins. PLoS Biol, 2011, 9(3): e1001021.
[32] Hirokawa N, Niwa S, Tanaka Y. Molecular motors in neurons: transport mechanisms and roles in brain function, development, and disease. Neuron, 2010, 68(4): 610–638.
[33] Lüders J, Stearns T. Microtubule-organizing centres: a re-evaluation. Nat Rev Mol Cell Biol, 2007, 8(2): 161–167.
[34] Conde C, Cáceres A. Microtubule assembly, organization and dynamics in axons and dendrites. Nat Rev Neurosci, 2009, 10(5): 319–332.
[35] Bhabha G, Johnson GT, Schroeder CM, et al. How dynein moves along microtubules. Trends Biochem Sci, 2016, 41(1): 94–105.
[36] Ogawa T, Saijo S, Shimizu N, et al. Mechanism of catalytic microtubule depolymerization via KIF2-Tubulin transitional conformation. Cell Rep, 2017, 20(11): 2626–2638.
[37] Reuther C, Mittasch M, Naganathan SR, et al. Highly-efficient guiding of motile microtubules on non-topographical motor patterns. Nano Lett, 2017, 17(9): 5699–5705.
[38] Zheng K, Xiang YF, Wang X, et al. Epidermal growth factor receptor-PI3K signaling controls cofilin activity to facilitate herpes simplex virus 1 entry into neuronal cells. mBio, 2014, 5(1): e00958–13.
[39] Smith GA, Pomeranz L, Gross SP, et al. Local modulation of plus-end transport targets herpesvirus entry and egress in sensory axons. Proc Natl Acad Sci USA, 2004, 101(45): 16034–16039.
[40] Radtke K, Kieneke D, Wolfstein A, et al. Plus- and minus-end directed microtubule motors bind simultaneously to herpes simplex virus capsids using different inner tegument structures. PLoS Pathog, 2010, 6(7): e1000991.
[41] Schipke J, Pohlmann A, Diestel R, et al. The C terminus of the large tegument protein pUL36 contains multiple capsid binding sites that function differently during assembly and cell entry of herpes simplex virus. J Virol, 2012, 86(7): 3682–3700.
[42] D?hner K, Radtke K, Schmidt S, et al. Eclipse phase of herpes simplex virus type 1 infection: Efficient dynein-mediated capsid transport without the small capsid protein VP26. J Virol, 2006, 80(16): 8211–8224.
[43] Zaichick SV, Bohannon KP, Hughes A, et al. The herpesvirus VP1/2 protein is an effector of dynein-mediated capsid transport and neuroinvasion. Cell Host Microbe, 2013, 13(2): 193–203.
[44] Koyuncu OO, Perlman DH, Enquist LW. Efficient retrograde transport of pseudorabies virus within neurons requires local protein synthesis in axons. Cell Host Microbe, 2013, 13(1): 54–66.
[45] Huffmaster NJ, Sollars PJ, Richards AL, et al. Dynamic ubiquitination drives herpesvirus neuroinvasion. Proc Natl Acad Sci USA, 2015, 112(41): 12818–12823.
[46] Koyuncu OO, Hogue IB, Enquist LW. Virus infections in the nervous system. Cell Host Microbe, 2013, 13(4): 379–393.
[47] Brittle EE, Reynolds AE, Enquist LW. Two modes of pseudorabies virus neuroinvasion and lethality in mice. J Virol, 2004, 78(23): 12951–12963.
[48] Lyman MG, Feierbach B, Curanovic D, et al. Pseudorabies virus Us9 directs axonal sorting of viral capsids. J Virol, 2007, 81(20): 11363–11371.
[49] Lyman MG, Curanovic D, Enquist LW. Targeting of pseudorabies virus structural proteins to axons requires association of the viral Us9 protein with lipid rafts. PLoS Pathog, 2008, 4(5): e1000065.
[50] Kramer T, Greco TM, Taylor MP, et al. Kinesin-3 mediates axonal sorting and directional transport of alphaherpesvirus particles in neurons. Cell Host Microbe, 2012, 12(6): 806–814.
[51] Maniar TA, Kaplan M, Wang GJ, et al. UNC-33/CRMP and ankyrin organize microtubules and localize kinesin to polarize axon-dendrite sorting. Nat Neurosci, 2011, 15(1): 48–56.
[52] Ch’ng TH, Enquist LW. Neuron-to-cell spread of pseudorabies virus in a compartmented neuronal culture system. J Virol, 2005, 79(17): 10875–10889.
[53] Howard PW, Wright CC, Howard T, et al. Herpes simplex virus gE/gI extracellular domains promote axonal transport and spread from neurons to epithelial cells. J Virol, 2014, 88(19): 11178–11186.
[54] Miranda-Saksena M, Boadle RA, Diefenbach RJ, et al. Dual role of herpes simplex virus 1 pUS9 in virus anterograde axonal transport and final assembly in growth cones in distal axons. J Virol, 2015, 90(5): 2653–2663.
[55] Nassi JJ, Cepko CL, Born RT, et al. Neuroanatomy goes viral! Front Neuroanat, 2015, 9: 80.
[56] Krout KE, Mettenleiter TC, Loewy AD. Single CNS neurons link both central motor and cardiosympathetic systems: a double-virus tracing study. Neuroscience, 2003, 118(3): 853–866.
[57] Wojaczynski GJ, Engel EA, Steren KE, et al. The neuroinvasive profiles of H129 (herpes simplex virus type 1) recombinants with putative anterograde-only transneuronal spread properties. Brain Struct Funct, 2015, 220(3): 1395–1420.
[58] McGovern AE, Driessen AK, Simmons DG, et al. Distinct brainstem and forebrain circuits receiving tracheal sensory neuron inputs revealed using a novel conditional anterograde transsynaptic viral tracing system. J Neurosci, 2015, 35(18): 7041–7055.
[59] Zeng WB, Jiang HF, Gang YD, et al. Anterograde monosynaptic transneuronal tracers derived from herpes simplex virus 1 strain H129. Mol Neurodegener, 2017, 12: 38.
[60] James SH, Larson KB, Acosta EP, et al. Helicase-primase as a target of new therapies for herpes simplex virus infections. Clin Pharmacol Ther, 2015, 97(1): 66–78.
[61] Aubert M, Boyle NM, Stone D, et al.inactivation of latent HSV by targeted mutagenesis using an HSV-specific homing endonuclease. Mol Ther Nucleic Acids, 2014, 3: e146.
[62] Ch’ng TH, Enquist LW. Efficient axonal localization of alphaherpesvirus structural proteins in cultured sympathetic neurons requires viral glycoprotein E. J Virol, 2005, 79(14): 8835–8846.
[63] Kratchmarov R, Kramer T, Greco TM, et al. Glycoproteins gE and gI are required for efficient KIF1A-dependent anterograde axonal transport of alphaherpesvirus particles in neurons. J Virol, 2013, 87(17): 9431–9440.
Transport of alphaherpesviruses in neurons——axonal “shuttling”
Hansong Qi, Hongxia Wu, Hua-Ji Qiu, and Yuan Sun
State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, Heilongjiang, China
After a long-term co-evolution, alphaherpesviruses have established mutual adaptability with their hosts. Some alphaherpesviruses have typical neurotropic characteristics, which have received extensive attention and in-depth research. Neurotropic alphaherpesviruses can break through the host barrier to infect neurons and multiply in large numbers in the neuron cell body to complete further proliferation or establish latent infection in the cell body. Either in the process of infecting neurons or further spreading, alphaherpesviruses will undergo transmission along axons or dendrites, so this process is an integral part of the life cycle of the viruses, and is also a key factor for the viruses to spread in nervous system. Therefore, studies on transportation of alphaherpesvirusesin neurons will provide new insights of the viruses and promote the development of corresponding vaccines or targeted therapeutic pharmaceuticals. In addition, the neurotropism of alphaherpesviruses is conducive to the analysis of nerve circuits. Herein, the mechanisms of alphaherpesvirus transport in axons were reviewed, and the research direction and application of the transport of alphaherpesviruses in axons were put forward, which can provide reference for the prevention and control of alphaherpesviral infections.
alphaherpesviruses, neuron, axon, transport
January 26, 2019;
March 18, 2019
Supported by: National Natural Science Foundation of China (No. 31570149).
Yuan Sun. Tel/Fax: +86-451-51051709; E-mail: sunyuan@caas.cn
Hua-Ji Qiu. Tel/Fax: +86-451-51051708; E-mail: qiuhuaji@caas.cn
國家自然科學基金(No. 31570149) 資助。
2019-04-10
http://kns.cnki.net/kcms/detail/11.1998.q.20190408.1418.002.html

祁寒松, 吳紅霞, 仇華吉, 等. α皰疹病毒的神經傳導——軸突上的“穿梭”. 生物工程學報, 2019, 35(8): 1361–1373.Qi HS, Wu HX, Qiu HJ, et al. Transport of alphaherpesviruses in neurons——axonal “shuttling”. Chin J Biotech, 2019, 35(8): 1361–1373.
(本文責編 郝麗芳)

