全身放射治療對宮頸癌荷瘤小鼠腫瘤微環境免疫細胞誘導協同刺激分子及其配體的影響
龔 星 田 添 梁素美*
放射治療是臨床治療惡性腫瘤的主要手段,但會引起脫氧核糖核酸(deoxyribonucleic acid,DNA)的破壞、信號轉導通路異常以及影響機體免疫功能,腫瘤通過異常抗原實現免疫逃逸,因此改變腫瘤免疫應答對治療腫瘤起著重要作用[1]。
T淋巴細胞在機體的細胞免疫和體液免疫中都發揮著重要作用,T細胞可分化為不同功能的T細胞,其中調節性T細胞(Treg)參與腫瘤的免疫逃逸和遷移、侵襲[2]。Th2細胞分泌白介素10(interleukin-10,IL-10)等細胞因子,起到免疫抑制的作用[3]。
近年來的研究顯示,T細胞的活化和分化受到可誘導協同刺激分子(inducible costimulator,ICOS)及其配體(inducible costimulator ligand,ICOSL)的調節,電離輻射會影響ICOS及ICOSL的表達水平,但關于放射治療對免疫細胞以及ICOS和ICOSL的研究極少[4]。為此,本研究主要探究全身放射治療對宮頸癌荷瘤小鼠腫瘤微環境免疫細胞ICOS/ICOSL的影響,為臨床更好的利用放射治療提供依據。
1 材料與方法
1.1 實驗動物與材料
選用4~5周齡的所有BALB/c無胸腺裸鼠(中國醫學科學院上海實驗動物中心),平均體質量為(20±2)g。實驗瘤株子宮頸未分化鱗癌細胞系U14(中國醫學科學院北京藥物研究所);所有引物均獲自Genewiz中國江蘇蘇州公司。
1.2 儀器與試劑
采用XHA600C型醫用電子直線加速器6 MV X射線(山東新華醫療),Varioskan Flash全波長掃描式多功能讀數儀(美國Thermo Scientific公司);BD FACSCalibur流式細胞儀(美國Becton Dickerson公司)。Becton-Dickinson試劑盒(美國Becton-Dickinson公司);ECL化學發光法檢測試劑(上海榕柏生物);逆轉錄試劑盒(日本TaKaRa公司,D6110A);流式細胞術試劑盒(南京凱基生物科技有限公司)。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美國Bio-Rad實驗室)。
1.3 建模及放射治療方法
采用數表法將45只小鼠隨機分為對照組、模型組和放療組,每組15只。將U14細胞分離并在新鮮培養基中再生長1 d。模型組和放療組小鼠皮下注射(1.0鼠皮下6個)U14細胞,在第4 d左右瘤體可生長至1 cm3左右,并通過病理學檢查確定為宮頸未分化鱗癌。對照組皮下注射等量0.9%氯化鈉注射液,不進行治療。在第4 d放療組小鼠接受全身放射治療,每日照射劑量為700 cGy,劑量率為50 cGy/min,每日1次。建模后每2 d用卡尺測量小鼠皮下腫瘤體積,測量腫瘤垂直直徑(長、寬,L>W),腫瘤體積(V)計算為公式1:

在建模后12 d脫頸處死,取小鼠的胸腺、脾臟及腫瘤組織進行后續檢測。
1.4 免疫印跡檢測
使用蛋白質印跡(Western Blotting)檢測小鼠胸腺(1/3個胸腺)中ICOS、ICOSL蛋白以及腫瘤組織中基質金屬蛋白酶2(MMP2)和MMP9的水平。Varioskan Flash全波長掃描式多功能讀數儀繪制標準曲線并計算樣品蛋白濃度,然后進行12%SDS-PAGE聚丙烯酰胺凝膠電泳,將電泳后凝膠上的蛋白質轉移至PVDF膜上,對PVDF膜進行免疫印跡檢測,并在室溫下用5%脫脂奶粉溶液室溫孵育封閉1 h。加入雙抗后室溫下孵育PVDF膜后脫色,加入電化學發光法檢測試劑,轉印膜上的電化學發光信號在X光膠片上感光,用IPWIN6.0軟件分析結果。
1.5 qRT-PCR檢測
使用[定量實時逆轉錄(quantitative real time,qRT)-聚合酶鏈反應(polymerase chain reaction,PCR),qRT-PCR]檢測小鼠胸腺(1/3胸腺)中ICOS、ICOSL以及腫瘤組織中MMP2和MMP2及其mRNA的水平。組織研磨后使用RNA分離試劑盒分離RNA,使用逆轉錄試劑盒對RNA樣品進行逆轉錄測定以合成cDNA。逆轉錄反應條件為37 ℃,反應15 min,逆轉錄酶失活條件為85 ℃,反應15 s;后進行實時熒光定量PCR實驗,通過在95 ℃下激活DNA聚合酶5 min進行PCR,然后進行40個循環的兩步PCR(95P、10 s和60 ℃、30 s),最終延伸75 ℃、10 min,保持在4 ℃。使用2-ΔΔCT法分析mRNA表達水平。
1.6 流式細胞術檢測
使用流式細胞術檢測胸腺和脾臟(1/3胸腺+1/3脾臟)中Th1、Th2和Treg細胞含量。將1×106細胞加入PE-CD25抗體、FITC-CD4抗體、PE-Cy5-FOXP3以及相應的對照Fc block、PE-Cy5-IgG2a,在4℃下避光孵育15~30 min,通過使用流式細胞儀立即分析染色的細胞。使用CellQuest軟件分析,根據檢測的CD4+CD25+FOXP3+細胞的數量計算Treg細胞的百分比。
使用流式細胞術檢測Th1、Th2細胞,細胞計數將2×105個細胞加入流式管,分別使用CD3-PE Cy5、CD8-PE Cy7抗體各 4 μl細標記,避光孵育15 min,再使用IFN-γ-FITC、IL-4-PE標記,使用磷酸緩沖鹽溶液(phosphate buffer saline,PBS)清洗,后使用流式細胞儀檢測,CD3+CD4+IFN-γ+為Th1細胞,CD3+CD4+IL-4+為Th2細胞,記錄Th1、Th2細胞百分比。
1.7 統計學方法
使用SPSS19.0軟件對所有實驗數據進行統計分析,計量資料以均值±標準差(±s)表示。統計分析,進行單因素方差分析(ANOVA)和獨立樣本t檢驗(groupt-test),評估各組之間的差異,以P<0.05為差異有統計學意義。
2 結果
2.1 腫瘤體積比較
在建模后第4 d,模型組和放療組小鼠的腫瘤體積達到1 cm3左右,隨即放療組開始放射治療。模型組小鼠的腫瘤體積隨著建模時間的延長顯著升高,在建模后第6 d、8 d、10 d和12 d,放療組小鼠的腫瘤體積顯著低于模型組,差異有統計學意義(F=56.405,P=0.000),見表1和圖1。

圖1 小鼠腫瘤體積變化情況
2.2 三組MMP2和MMP9比較
模型組的MMP2蛋白和MMP9蛋白水平顯著高于對照組,差異有統計學意義(F=2.461,F=0.393,P=0.000);放療組的MMP2和MMP9mRNA的水平顯著低于模型組,差異有統計學意義(F=1.590,F=0.601;P=0.000),見表2。
2.3 三組免疫細胞比較
模型組的Th1細胞比例顯著降低,而Treg和Th2細胞比例顯著升高,放療組的Th1細胞比例顯著高于模型組,而Treg和Th2細胞比例顯著低于模型組,差異有統計學意義(F=2.427,F=3.349,F=9.951;P=0.000),見表3。
2.4 三組ICOS/ICOSL水平比較
模型組的ICOS蛋白和ICOSL蛋白的水平顯著高于對照組,差異有統計學意義(F=2.837,F=3.576;P=0.000);放療組的ICOS、ICOSLmRNA的水平顯著低于模型組,差異有統計學意義(F=0.793,F=3.750;P=0.000),見表4。
表1 模型組與放療組小鼠腫瘤體積比較(cm3,±s)
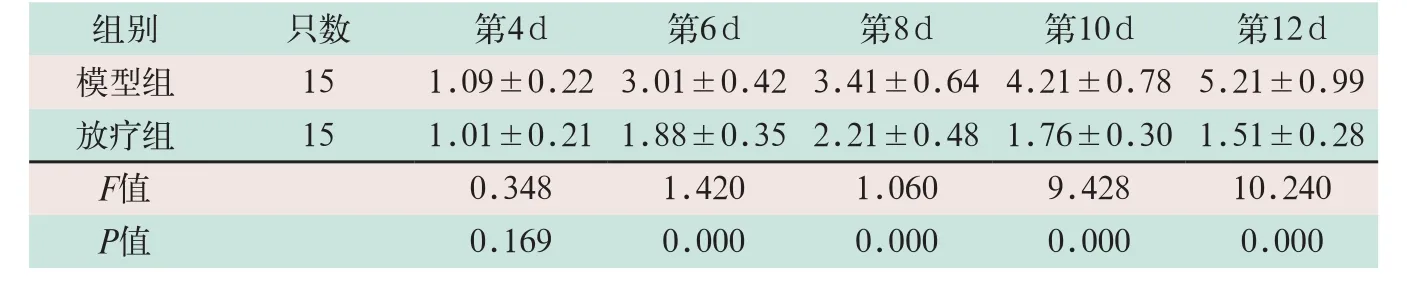
表1 模型組與放療組小鼠腫瘤體積比較(cm3,±s)
注:由于對照組腫瘤體積都為0,模型組和其對比是為了表明建模成功,故此表只統計模型組和放療組
組別 只數 第4 d 第6 d 第8 d 第10 d 第12 d模型組 15 1.09±0.223.01±0.423.41±0.644.21±0.785.21±0.99放療組 15 1.01±0.211.88±0.352.21±0.481.76±0.301.51±0.28 F值 0.348 1.420 1.060 9.428 10.240 P值 0.169 0.000 0.000 0.000 0.000
表2 三組MMP2和MMP9比較(±s)
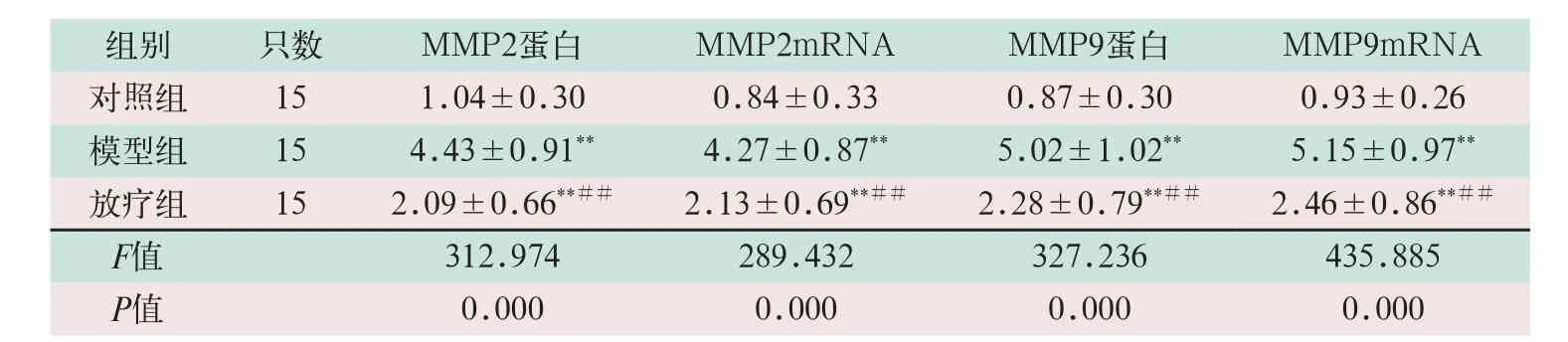
表2 三組MMP2和MMP9比較(±s)
注:表中*為與對照組比較,P<0.05;**為與對照組比較,P<0.001;#為與模型組比較,P<0.05;##為與模型組比較,P<0.001
組別 只數 MMP2蛋白 MMP2mRNA MMP9蛋白 MMP9mRNA對照組 15 1.04±0.30 0.84±0.33 0.87±0.30 0.93±0.26模型組 15 4.43±0.91** 4.27±0.87** 5.02±1.02** 5.15±0.97**放療組 15 2.09±0.66**## 2.13±0.69**## 2.28±0.79**## 2.46±0.86**##F值 312.974 289.432 327.236 435.885 P值 0.000 0.000 0.000 0.000

表3 三組免疫細胞比較(%)
表4 三組ICOS/ICOSL水平比較(±s)
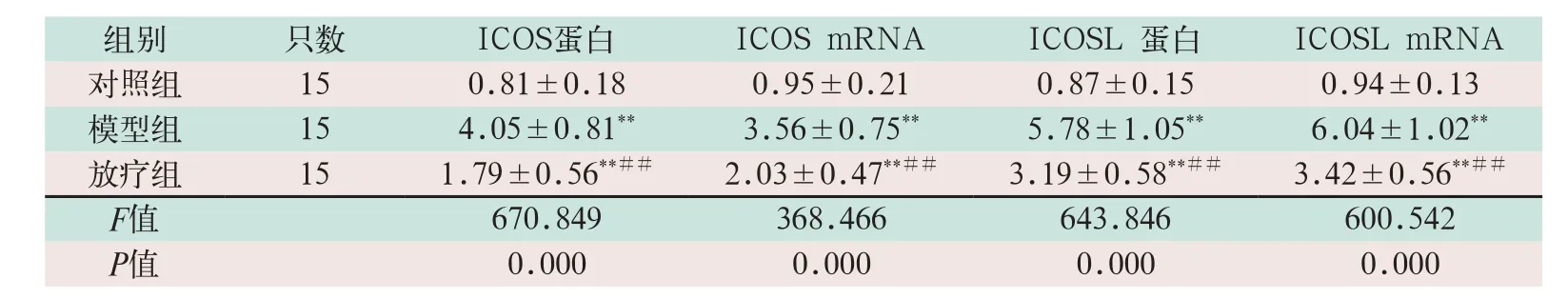
表4 三組ICOS/ICOSL水平比較(±s)
注:表中*為與對照組比較,P<0.05;**為與對照組比較,P<0.001;#為與模型組比較,P<0.05;##為與模型組比較,P<0.001
組別 只數 ICOS蛋白 ICOS mRNA ICOSL 蛋白 ICOSL mRNA對照組 15 0.81±0.18 0.95±0.21 0.87±0.15 0.94±0.13模型組 15 4.05±0.81** 3.56±0.75** 5.78±1.05** 6.04±1.02**放療組 15 1.79±0.56**## 2.03±0.47**## 3.19±0.58**## 3.42±0.56**##F值 670.849 368.466 643.846 600.542 P值 0.000 0.000 0.000 0.000
3 討論
宮頸癌是最常見的婦科腫瘤,據報道,世界每年有近500,000例新發宮頸癌病例,是女性第三大常見癌癥,可分為鱗癌、腺癌和腺鱗癌三種類型,而宮頸癌的轉移是臨床治療的難點[5]。早期發現宮頸癌通常可治愈,但是多數患者在診斷時出現局部晚期宮頸癌,其中III期和IVa期宮頸癌患者的5年生存率分別為40%和15%[6]。基于順鉑的放射治療(combination radiotherapy,CRT)被認為是局部晚期宮頸癌患者的標準治療方法,而近年來以放射治療為主的綜合治療越來越受到關注,使放射治療抑制腫瘤細胞轉移的機制以及放射治療解除腫瘤免疫逃逸的機制備受重視。本研究使用U14細胞荷瘤裸鼠作為模型進行全身放射治療,其結果顯示,在建模后第4 d模型組和放療組的腫瘤體積達到1 cm3左右,并開始接受全身放射治療,模型組小鼠的腫瘤體積隨著建模時間的延長顯著升高,在建模后第6 d、8 d、10 d和12 d,放療組的腫瘤體積顯著低于模型組,表明全身放射治療可顯著的抑制腫瘤的生長。
腫瘤的遷移和侵襲與許多酶的過度表達有關,MMP2、MMP9是基質金屬蛋白酶家族的重要組成部分,可以水解細胞間基質蛋白,使細胞具有轉移能力[7-8]。本研究結果顯示,模型組的MMP2和MMP9水平顯著高于對照組,放療組的MMP2和MMP9蛋白和mRNA的水平顯著低于放療組。Ager等[9]研究顯示,抑制MMP的表達可以提高放射治療的治療效果,提示全身放射治療可在一定程度上抑制腫瘤細胞的轉移。
腫瘤浸潤和轉移與腫瘤的微環境改變、血管生成、上皮間充質轉化及免疫反應等有關。Th2細胞會通過分泌IL-4、IL-10等因子發揮免疫抑制作用并促進細胞生長[10]。Treg水平的升高會抑制免疫,并影響細胞功能參與腫瘤發生和發展[11]。本研究結果顯示,模型組的Th1細胞比例顯著降低,而Treg和Th2細胞比例顯著升高,放療組的Th1細胞比例顯著高于模型組,而Treg和Th2細胞比例顯著低于模型組。Th1/Th2細胞處于動態平衡中,Th1和Th2分別參與促炎和免疫抑制的作用[12]。Th1細胞占主要優勢時機體處于抗腫瘤狀態,而Th2細胞過高時則出現免疫逃逸。過往研究顯示,卵巢癌患者Th1/Th2平衡向Th2漂移,而Treg具有促進Th1/Th2平衡向Th2漂移的作用[13-14]。
為進一步的探究放射治療影響免疫細胞的機制,本研究分析了ICOS/ICOSL的表達水平,其結果顯示,模型組的ICOS和ICOSL的水平顯著高于對照組,放療組的ICOS和ICOSL蛋白和mRNA的水平顯著低于模型組。ICOS/ICOSL表達于腫瘤細胞的表面,影響Treg細胞表達和促進Th2活化,使腫瘤逃避機體的免疫系統,Zheng等[15]研究顯示,ICOS/ICOSL可通過調節Treg細胞提高B淋巴瘤細胞對ABT-199的敏感性;Kieusuong等[16]研究表明,Treg的產生與ICOS/ICOSL的結合有關,靶向ICOS/ICOSL途徑調節Treg細胞可能是一種有前景的治療濾泡性淋巴瘤免疫療法。
全身放射治療可有效的抑制宮頸癌荷瘤小鼠腫瘤組織的生長,放射治療一方面通過下調MMP2和MMP9表達水平抑制腫瘤細胞遷移,另一方面通過抑制ICOS和ICOSL的表達水平下調Treg細胞和Th2細胞的比例,從而解除免疫逃逸起到抑瘤作用。

