Marc-145細胞為載體培養條件優化研究
趙 剛 閆 冰 劉鑫瑩
(哈藥集團生物疫苗有限公司,黑龍江哈爾濱 150069)
目前國內Marc-145細胞培養均采用轉瓶生產工藝,由于受到轉瓶表面積和培養條件的限制,生產細胞密度低,勞動強度大,操作過程易污染,疫苗質量難以得到保證。自從60年代微載體生物反應器培養技術建立以來,國外許多國家對其在疫苗生產中的應用進行了廣泛研究,本研究采用Marc-145細胞微載體培養,并對培養過程中的各項技術條件進行優化,從而總結出一套較為合理的生產工藝,為Marc-145細胞的大規模培養提供可靠的參考數據。
1 材料與方法
1.1 材料
1.1.1 細胞株與微載體 Marc-145細胞(購自中國獸醫藥品監察所),微載體 Cytodex1(購自美國GE公司)。
1.1.2 試劑與儀器 新生牛血清(濟南勁牛生物科技有限公司);0.25%胰酶(美國Gicbo公司);MEM培養基(美國Gibco公司);結晶紫細胞裂解液有哈藥集團生物疫苗有限公司研發中心配制;立式壓力蒸汽滅菌鍋(上海博訊有限公司);二氧化碳培養箱(美國Thermo Fisher,參數設置:37℃,5% CO2);細胞培養磁力攪拌器(美國Wheaton);倒置相差顯微鏡(日本OLYMPUS)。
1.2 方法
1.2.1 Marc-145細胞復蘇培養
將細胞凍存管自液氮罐中取出,置37 ℃水浴,使管內凍存液迅速融化。常溫1000 r/min,離心5 min。棄去上清,用少量細胞生長液將細胞重懸后移入細胞培養瓶中,加入10 ml細胞生長液,于37 ℃、5 % CO2培養箱中靜置培養。待細胞長成單層后,用胰酶消化液消化,并按1:3的比率進行擴增培養。
1.2.2 微載體預處理
稱取所需質量的微載體Cytodex-1,按100 ml:1 g的比例用PBS浸泡微載體,輕微攪拌使微載體均勻浸泡3 h,121 ℃、滅菌30 min;倒掉PBS,以30 ml:1 g的比例用培養基將微載體洗滌2次,將微載體放置在4 ℃冰箱內平衡過夜,待用。
1.2.3 微載體細胞計數
取1 ml含微載體的培養液,900 r/min離心5 min,后棄掉上清,加入與上清相同體積的0.1%結晶紫溶液,混勻后于37 ℃中孵育1 h,然后用血球計數板計數釋放出來的細胞核,即為1ml培養液中的細胞數。
1.2.4 微載體培養Marc-145細胞試驗條件的優化
(1)攪拌轉速的確定
以微載體Cytodex-1用量為2 g/L、細胞接種密度為2×105cells/mL,加入細胞生長液后分別設定轉速為30、40和50 rpm培養細胞,每天取樣,觀察微載體上細胞吸附和生長情況,并采用結晶紫方法計數,確定出合適的攪拌速度。
(2)Marc-145細胞接種密度的確定
微載體Cytodex-1用量為2 g/L,分別以0.5×105、1.0×105、2.0×105和4.0×105cells/mL密度接種細胞。每天取樣,觀察微載體上細胞吸附和生長情況,并采用結晶紫方法計數,確定出合適的接種密度。
(3)微載體含量的確定
按照確定的接種密度2.0×105cells/mL與微載體用量2 g/L的比例關系,即在cells/g微載體相同的條件下接種Marc-145細胞,考察Cytodex-1含量分別為1 g/L、2 g/L、4 g/L微載體上細胞吸附和生長情況,并采用結晶紫方法細胞計數,確定出合適的微載體含量。
2 結果
2.1 Marc-145細胞培養
Marc-145細胞于傳代后3 d即可長成致密單層(圖1),在顯微鏡下可以觀察到,細胞形態良好,透光性好,界限清晰。
圖1 Marc-145細胞
2.2 攪拌轉速的確定
當轉速分別為30、40、50 rpm時培養細胞,細胞生長情況如圖2所示。從圖中可以看出,在培養過程中隨著攪拌速度的增加,細胞最大生長密度先升高后降低,當攪拌速度為40 rpm時,細胞密度最大為1.4×106cells/mL,培養效果最理想。因此本試驗攪拌速度采用40 rpm。
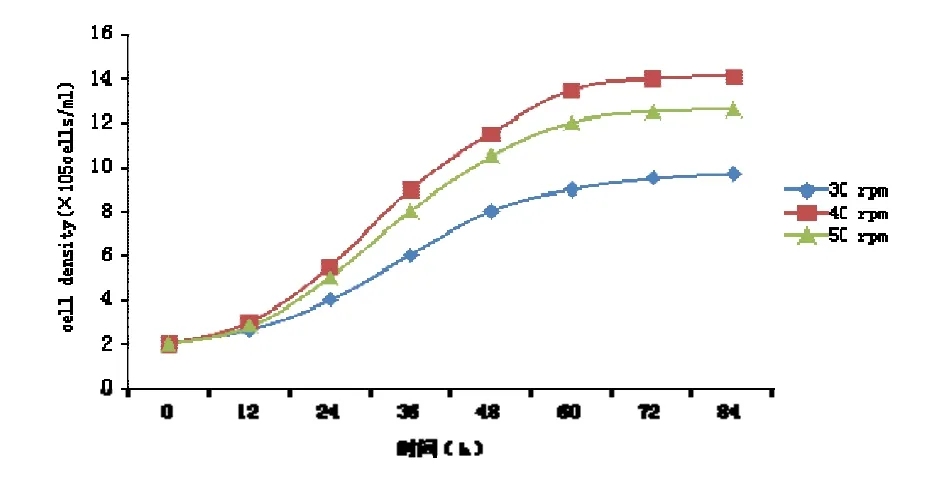
圖2 不同攪拌速度細胞生長曲線
2.3 細胞接種密度的影響
當微載體Cytodex-1用量為2 g/L,以0.5×105、1.0×105、2.0×105和4.0×105cells/mL密度接種細胞。每天取樣分析,細胞生長動力學過程如圖3所示。
從圖3可以看出,當微載體含量相等,接種密度不同時,細胞生長趨勢與文獻報道相似[75]。以0.5×105、1.0×105cells/mL接種時,接種密度低時,接種后84 h內仍在緩慢生長,沒有進入穩定生長期的明顯標志,而且細胞密度也比較低;而以2.0×105和4.0×105cells/mL接種細胞時,接種密度高,細胞在接種后60 h即開始進入穩定生長期,細胞密度較高都在1.4×106cells/mL以上。因此綜合考慮,本試驗選擇細胞的接種密度是2.0×105cells/mL。

圖3 不同接種密度Marc-145細胞生長曲線
2.4 微載體含量的確定
在微載體濃度為1 g/L、2 g/L、4 g/L的不同試驗條件下,每天分別從培養瓶中取樣并進行細胞計數,結果顯示當培養瓶中微載體的濃度為4 g/L時,培養到72 h時細胞密度最大為1.8×106cells/mL,培養效果最理想。細胞計數的結果如圖4所示,因此本試驗微載體含量采用4 g/L。
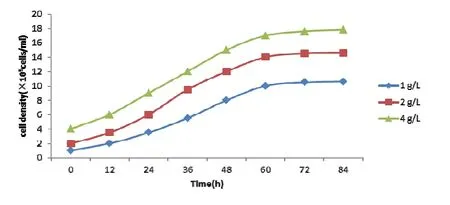
圖4 不同Cytodex-1濃度對Marc-145細胞生長曲線
3 討論
本研究通過設置不同攪拌轉速、細胞接種密度和微載體含量3個條件,研究了不同培養條件對Marc-145細胞生長的影響。
適當的攪拌速度對于微載體懸浮培養是非常重要的,若攪拌轉速過低,微載體有沉降的趨勢,細胞不僅不能均勻生長,而且會發生結團。若轉速提高,會促進營養物質的傳遞和供氧,有利于細胞的生長。但當轉速過高時,雖然細胞與微載體的接觸機率會相應的提高,但剪切力增加,對細胞的損傷也隨之增加,同時微載體間連接的細胞橋也會斷裂,細胞被拉長,裂解死亡。
當微載體含量相等時,以不同密度接種細胞,每個載體顆粒上開始的細胞數量不相同,細胞接種密度高時,每個微載體上的細胞數量增加,細胞在載體上分布比較均勻,細胞生長的空間大,不會或很少受到生長面積的限制,而且細胞消耗的營養物質和代謝產物的積累也相應降低,因此,細胞表現出較高的平均比生長速率。但細胞接種密度也不應過高,過高時由于受到生長面積的限制,細胞的擴展受到影響,使得平均比生長速率降低,同時降低了載體利用率。
本試驗比較了在不同微載體濃度Marc-145細胞的增殖狀況,摸索出了培養Marc-145細胞時最合適的微載體加入量,認為當加入的微載體顆粒濃度為4 mg/mL時,接種Marc-145細胞后是最有利于細胞增殖的,此時收獲的Marc-145細胞數量最多。另外,微載體濃度過高時,在懸浮培養的過程中顆粒之間相互碰撞的機率就會大大增加,造成微載體顆粒破碎和細胞脫落;另一方面,高含量載體培養時,在攪拌時,載體間碰撞幾率增加,會增加碰撞損傷細胞的機會,這也不利于細胞培養,而且,細胞的生長狀況如果不好,也會影響到接下來的病毒增殖過程。因此本試驗選擇的微載體濃度最高為4 g/L。
4 結論
攪拌轉速、細胞接種密度和微載體含量都會對Marc-145細胞增殖造成一定的影響,只有細胞生長條件適宜,才會最大程度的使細胞增殖,并達到預期效果,既設定攪拌速度為40 rpm、細胞接種密度為4.0×105cells/ml、微載體含量為4 g/L,培養72 h時,微載體上細胞匯合度大于90%,細胞密度最大為2.0×106cells/ml。

