單寧酸對鳶烏賊肌原纖維蛋白膜性能的影響
仇超穎,榮 婧,胡 曉,楊賢慶,*,李來好
(1.中國水產科學研究院南海水產研究所,農業部水產品加工重點實驗室,國家水產品加工技術研發中心,廣東 廣州 510300;2.暨南大學理工學院食品科學與工程系,廣東 廣州 510632;3.上海海洋大學食品學院,上海 201306)
隨著人們對環境問題關注度的日益提高,可降解食品包裝膜的開發受到了研究者的高度重視。蛋白質為典型的天然食品聚合物,其來源廣泛,產量高并具有獨特的結構,已廣泛應用于可食用包裝膜材料的制備研究[1-2]。低值水產蛋白是制備可食用蛋白膜的良好原料,肌原纖維蛋白含有豐富的巰基,有利于形成二硫鍵而賦予產品良好的凝膠特性[3]。鳶烏賊(Symplectoteuthis oualaniensis)屬于柔魚科、鳶烏賊屬,是廣泛分布于我國南海海域的一種大型可食用軟體動物[4]。鳶烏賊體內含有低脂高蛋白,是一種營養價值較高的海產品。但由于鳶烏賊肌肉組織致密,肉質較硬等口感缺陷導致其市場占有量較低。國內目前多將鳶烏賊粗加工成魷魚絲,其產品加工層次較低。因此開展鳶烏賊資源深加工利用,高效高值化利用蛋白對于擴大鳶烏賊的市場具有重要意義[5]。
水產蛋白具有較高的透光性及機械性能,但大多數耐水蒸氣能力較低[2]。目前,國內外學者多利用肌肉蛋白制備蛋白膜,研究其加工工藝以及功能特性。而采用酸堿提取等電點沉淀蛋白方法制備蛋白膜的工藝研究相對較少[6]。采用醛類物質交聯方法以改善蛋白膜機械性能,此類方法有一定毒性[7]。采用蛋白-多糖接枝,或使用酚類物質作交聯劑的方法不會產生毒性及污染,目前對于這類改性蛋白的應用研究相對較少。葡聚糖是一種高分子鏈中性多糖,具有良好的水溶性及穩定性[8],對鳶烏賊蛋白接枝能夠改善蛋白膜的功能特性。此外,糖分子可增大蛋白的空間位阻形成致密的空間網狀結構,進而維持膜體的穩定性[9]。單寧酸是一類廣泛存在于蔬菜水果中具有多個酚羥基等活性集團的高分子化合物,與蛋白質結合能力較強[10],堿性條件下氧化多酚羥基可與蛋白的側鏈氨基發生交聯作用,酸性和中性條件時則主要發生非共價相互作用[11-12]。同時由于單寧酸具有較好的抗氧化性,添加此類物質可將食用膜應用在高油脂食品包裝領域[2]。
本研究采用酸、堿法分別提取鳶烏賊分離蛋白,并對鳶烏賊肌原纖維蛋白進行葡聚糖接枝改性,研究單寧酸對以上3 種蛋白膜性質的影響,為制備鳶烏賊蛋白可食用包裝材料提供理論依據。
1 材料與方法
1.1 材料與試劑
鳶烏賊購于湛江水產市場。單寧酸、葡聚糖(分子質量67 000 Da)、鄰苯二甲醛(o-phthalaldehyde,OPA)、亮氨酸(99%)、5,5’-二硫代雙(2-硝基苯甲酸)(5,5-dithio-2-nitrobenzoate,DTNB)、三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)、牛血清蛋白 美國Sigma-Aldrich公司;其他試劑均為國產分析純。
1.2 儀器與設備
T50型均質機 德國IKA公司;3K30型高速冷凍離心機 德國Sigma公司;ALPHA1-4冷凍干燥機德國Christ公司;電熱恒溫鼓風干燥箱 上海一恒公司;UV2550紫外分光光度計、IRAffinity-1紅外光譜儀 日本島津公司;SP2258型熒光光度儀 美國Ropera Scientific公司;DK-S24型恒溫水浴鍋 上海森信實驗儀器廠有限公司;1530VP掃描電鏡 德國LEO公司。
1.3 方法
1.3.1 酸、堿法提取鳶烏賊蛋白
取低溫解凍并絞碎的烏賊肉,加冰蒸餾水(料液比1∶6(g/mL))10 000 r/min均質1 min,分別用2 mol/L HCl溶液和2 mol/L NaOH溶液調pH值至3和11,低速攪拌30 min后離心(10 000×g、20 min、4 ℃),取上清液調pH 5.0,離心(10 000×g、20 min、4 ℃),沉淀即得酸提和堿提鳶烏賊蛋白。
1.3.2 糖基化肌原纖維蛋白的制備
參照Saeki[13]的方法。取絞碎的烏賊肉置于3 倍原料肉體積的50 mmol/L NaCl、質量分數0.5%的Triton X-100溶液中漂洗10 min,倒掉懸浮物。漂洗過的肉置于8 倍原料體積的上述溶液,經均質機20 000 r/min均質2 min后紗布過濾,所得濾液8 000×g離心10 min,取沉淀用50 mmol/L NaCl溶液漂洗并離心,重復3 次,尼龍布過濾,沉淀即為肌原纖維蛋白,上述實驗步驟通過冰水浴控制在低于8 ℃進行。肌原纖維蛋白溶于50 mmol/L的NaCl溶液中,調溶液中蛋白質量濃度5.0 mg/mL與葡聚糖定量(質量比1∶1)混合均勻,之后冷凍干燥,取凍干粉在相對濕度35%、溫度50 ℃條件下干熱反應12 h,之后溶解再次凍干得到糖基化肌原纖維蛋白。
1.3.3 蛋白膜的制備
參考Shiku等[14]的方法。取上述酸、堿提取及糖基化肌原纖維蛋白樣品溶于去離子水中,使蛋白質量濃度為2 g/100 mL,加入糖基化肌原纖維蛋白質量50%的甘油作為增塑劑,3 000 r/min均質1 min,堿法提取蛋白溶液及糖基化改性肌原纖維蛋白溶液調節pH 11,酸法提取蛋白溶液調節pH 3,分別添加糖基化肌原纖維蛋白質量0%、1%、2%、3%的單寧酸至溶液中,混合液于室溫攪拌30 min,70 ℃保溫30 min,迅速降溫,低速離心脫氣。準確量取適量成膜液,倒入聚四氟乙烯小圓盤中,于60 ℃烘箱中干燥3 h成膜。之后在裝有飽和NaBr溶液的干燥器中(56%、20 ℃)平衡48 h后待測。
1.3.4 自由氨基含量測定
參考Lertittikul等[15]方法。取蛋白溶液(125 μL)稀釋5 倍后與2.0 mL 2 mol/L的磷酸鹽緩沖液(pH 8.2)混合,之后加入1.0 mL 0.01% TNBS溶液混合均勻后在50 ℃暗處反應30 min,加入2.0 mL 0.1 mol/L亞硫酸鈉終止反應。空白采用蒸餾水代替0.01% TNBS添加于緩沖液中,420 nm波長處測定吸光度,由L-亮氨酸標準曲線計算自由氨基濃度(mmol/L)。
1.3.5 巰基含量測定
參考Beveridge等[16]的方法。測定成膜液的總巰基含量。取1.0 mL樣品成膜液,加入9 mL鹽酸胍磷酸緩沖液(鹽酸胍 6 mol/L、磷酸鹽緩沖液0.1 mol/L、pH 8.0),取4 mL以上混合液加入質量分數0.1% 的DTNB溶液0.4 mL,置于水浴鍋中45 ℃保溫反應25 min,于412 nm波長處測定吸光度。巰基含量由摩爾吸光系數13 600 L/(mol·cm)計算,以每克蛋白質中所含的物質的量表示。
1.3.6 蛋白膜厚度測定
在膜材料上隨機取5 個點,用千分尺測量膜的厚度,取平均值,精確至0.01 mm。
1.3.7 蛋白膜機械性能測定
選擇厚度均勻,無氣泡的膜材料裁切成20 mm×80 mm的長條,將膜固定于質構儀測試部件兩端,初始距離30 mm、速率30 mm/min對膜拉伸直至斷裂,記錄拉伸過程中的最大應力及膜斷裂時的拉伸長度。拉伸強度表示為膜材料拉伸過程中的最大應力與膜的橫截面積之比,斷裂伸長率表示為膜材料斷裂時膜長度與測試部件初始距離之比。拉伸強度和斷裂伸長率計算公式如下:

式中:TS為拉伸強度/MPa;F為膜拉伸過程中的最大應力/N;S為膜的橫截面積/m2。

式中:EAB為斷裂伸長率/%;L為膜斷裂時的長度/mm;L0為膜拉伸前的原始長度/mm。
1.3.8 蛋白膜色度的測定
采用色差儀對蛋白膜顏色進行測定(L*值(黑-白)、a*(紅-綠)、b*(藍-黃))。在膜材料上隨機取5 個點測量,取平均值。
1.3.9 蛋白膜含水量及水溶性測定
將膜剪裁為20 mm×20 mm的正方形并稱質量(m1),置于105 ℃恒溫干燥箱中烘至質量恒定(m2)。將質量恒定后的干膜浸泡在水中,24 h之后,小心移走燒杯中的水,將浸泡后的膜置于105 ℃恒溫干燥箱中烘至質量恒定(m3)。含水量和水溶性計算公式如下:

式中:MC為含水量/%;WS為水溶性/%;m1為膜材料的初始濕質量/g;m2為膜材料的初始干質量/g;m3為溶解后膜材料干質量/g。
1.3.10 膜材料水蒸氣透過率的測定
根據文獻[17]方法對膜材料水蒸氣透過率進行測定。透濕杯直徑為22 mm,深度為50 mm,向杯中注入一定量蒸餾水。將直徑為50 mm的圓形膜材料,遮蓋住透濕杯杯口,用石蠟將膜材料與杯口連接處密封,使瓶口與膜之間緊密結合,稱取透濕杯質量。將透濕杯置于裝有五氧化二磷的密閉干燥器內,干燥器內裝有風扇,保持空氣循環流動。測試裝置置于25 ℃,每3 h將透濕杯取出并稱質量,膜的水蒸氣透過率計算公式如下:

式中:WVP為膜的水蒸氣透過率/(g/(s·m·Pa))W為測量杯增質量/g;L為膜材料厚度/m;t為時間/s;s為膜材料的有效測試面積/m2;Δp為膜兩側水蒸氣壓差/Pa。
1.3.11 蛋白膜不透明指數測定
選擇厚度均勻,無氣泡的膜材料裁切成30 mm×9 mm的長條,將薄膜緊貼于比色皿的內壁上,于波長600 nm處測吸光度,使用空白比色皿作對照,不透明指數為吸光度與膜厚度的比值。
1.3.12 蛋白膜紅外光譜分析
稱取適量凍干的肌原纖維蛋白及糖基化反應12 h的產物與溴化鉀研磨均勻(質量比1∶100),壓成薄片,置于樣品室,采用紅外光譜儀全波段(500~4 000 cm-1)掃描。
1.3.13 蛋白膜微觀結構表征
膜表面及截面微觀結構采用掃描電鏡分析,用雙面膠將裁切好膜材料置于樣品盤上觀測。
1.4 數據處理
所有數據均測量3 次,采用SPSS 19.0和Origin pro 8對實驗數據進行統計、分析,實驗數值間以Duncan法(P<0.05)進行顯著性分析。
2 結果與分析
2.1 蛋白成膜液自由氨基和巰基含量
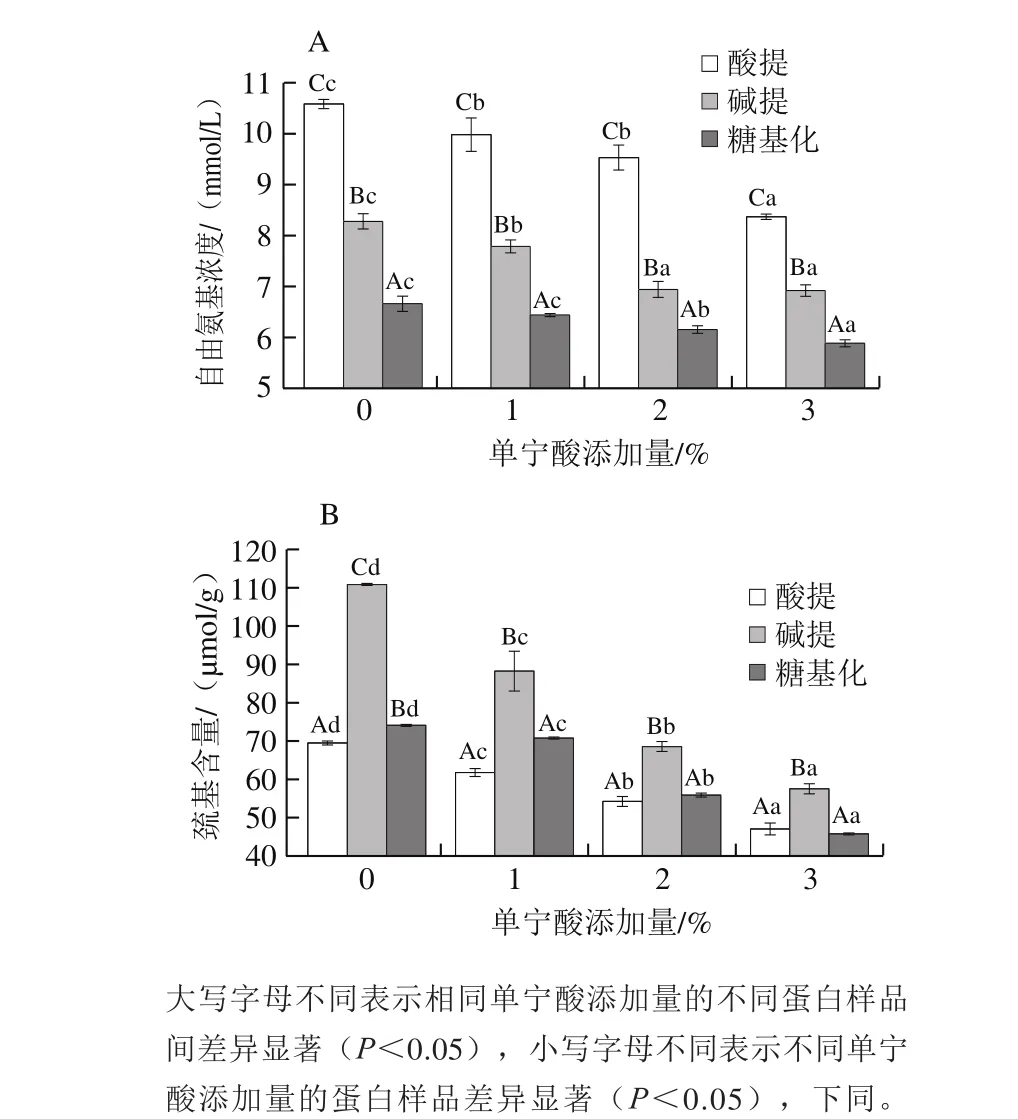
圖1 添加單寧酸對蛋白成膜液自由氨基(A)和巰基(B)含量的影響Fig. 1 Influence of tannic acid on free amino group (A) and total sulfhydryl content (B) of film-forming solutions
如圖1A所示,糖基化蛋白的自由氨基含量顯著低于酸提和堿提蛋白,表明糖基化過程中自由氨基與糖分子發生了接枝反應。酸提蛋白的自由氨基含量高于堿提蛋白,這可能是由于酸提過程中蛋白發生一定程度的降解,使部分自由氨基暴露。圖1B中,堿提蛋白成膜液中巰基含量明顯高于酸性及糖基化蛋白成膜液,可能是因為堿性條件導致蛋白質分子結構伸展,有助于增強蛋白質分子間的相互作用[6]。與對照組(0%)相比,當單寧酸添加量為1%~3%時,蛋白成膜液中巰基含量均顯著降低(P<0.05)。酚類化合物中的羥基易氧化為醌,與蛋白分子中的氨基或巰基發生相互作用,形成C—N或C—S鍵[18]。Prodpran等[19]發現魚肉肌原纖維蛋白添加酚類物質巰基含量降低,與該實驗研究結果一致。
2.2 蛋白膜色度、含水量、水溶性及外觀
可食用膜的顏色會影響產品的外觀和消費者的接受程度[20]。如表1所示,對照組蛋白膜接近于無色,添加單寧酸之后,3 種蛋白膜顏色均隨單寧酸添加量的增加而增加,其中堿提及糖基化改性蛋白膜的b*值增加程度遠高于酸提蛋白膜,主要是由于單寧酸分子中的酚羥基堿性條件下氧化為醌中間體,作為交聯劑起到對蛋白分子的交聯作用[21]。同時可以發現,酸提蛋白和堿提蛋白含水量差異不顯著,單寧酸加入并未對二者形成的蛋白膜有顯著影響,而糖基化蛋白膜含水量明顯低于酸提和堿提蛋白膜,并且單寧酸顯著降低了糖基化蛋白膜的含水量,這主要是由于糖基化蛋白由于葡聚糖分子的引入,滲透壓增大,同時單寧酸增加了蛋白的交聯和聚集,降低了蛋白與水分子的相互作用,導致蛋白膜的含水量顯著降低。從表1還可發現,堿提蛋白膜水溶性略低于酸提蛋白膜,可能是因為堿性時蛋白質分子間的疏水相互作用或二硫鍵的交聯作用更強,這也與其巰基含量變化(圖1)一致。糖基化蛋白由于引入了親水基團導致水溶性顯著升高,更適合用做含有活性物質的包裝材料,膜中活性物質易于釋放,并且膜更容易降解。單寧酸加入顯著降低了蛋白膜材料的水溶性,表明多單寧酸通過交聯作用使蛋白聚集。此外,雖然不存在共價交聯,酸性蛋白膜加入單寧酸后水溶性也顯著下降,表明非共價反應如氫鍵或疏水相互作用同樣會導致蛋白質水溶性的降低。
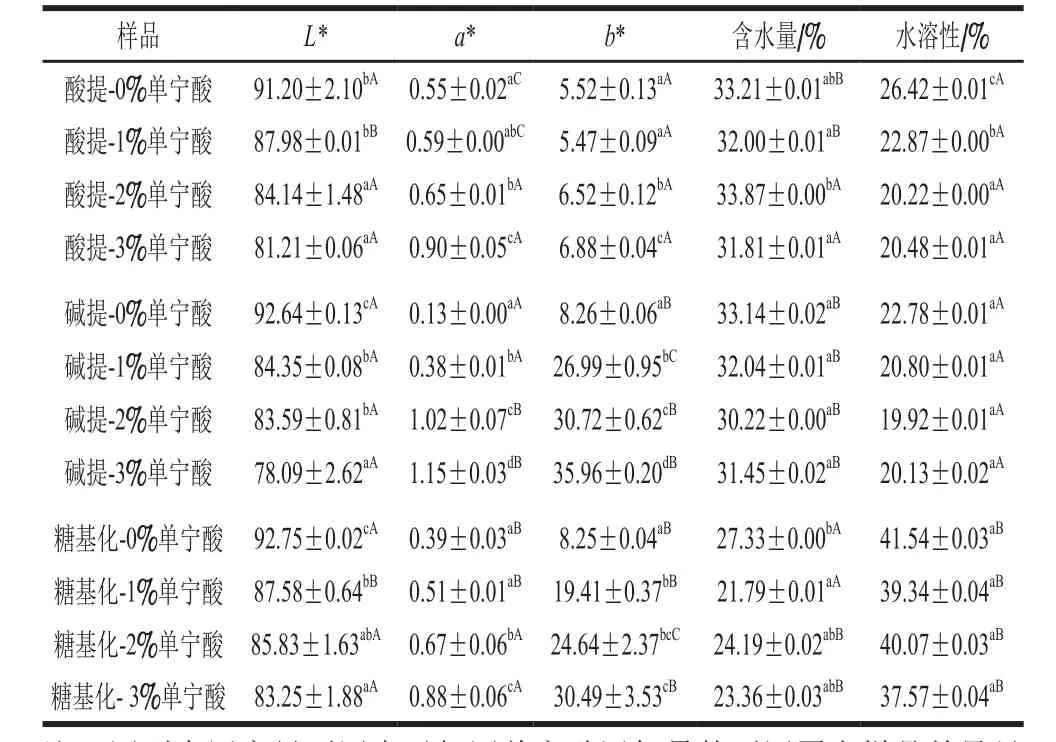
表1 添加單寧酸對蛋白膜色度、含水量及水溶性的影響Table 1 Influence of tannic acid on color parameters, moisture content and water solubility of protein-based films


圖2 單寧酸添加量對蛋白膜外觀的影響Fig. 2 Influence of different tannic acid concentration on film appearance
如圖2所示,未添加單寧酸的蛋白膜均為均勻透明,加入單寧酸后堿性蛋白膜與糖基化蛋白膜顏色明顯變黃,而糖基化蛋白在1%單寧酸存在時b*值增加程度較低,表明此時糖基化減弱了肌原纖維蛋白與氧化單寧酸之間的相互作用。
2.3 蛋白膜微觀結構分析


圖3 酸提、堿提、糖基化蛋白膜截面和表面微觀結構圖Fig. 3 Microstructure of film cross section and surface of acid-, alkaliextracted and glycosylated protein with addition of 1% TA
由圖3可見,酸提、堿提及糖基化蛋白膜的截面圖與表面均光滑無氣泡。其中糖基化蛋白膜表面有少量裂紋,這可能是由葡聚糖與肌原纖維蛋白的相互作用以及糖基化蛋白膜含水量較低造成。添加單寧酸后,堿性及糖基化蛋白膜的截面及表面均變得粗糙不平,表明肌原纖維蛋白與氧化的單寧酸發生了交聯作用導致聚集,但在酸性蛋白膜中這一現象并不明顯。
2.4 蛋白膜機械強度測定結果
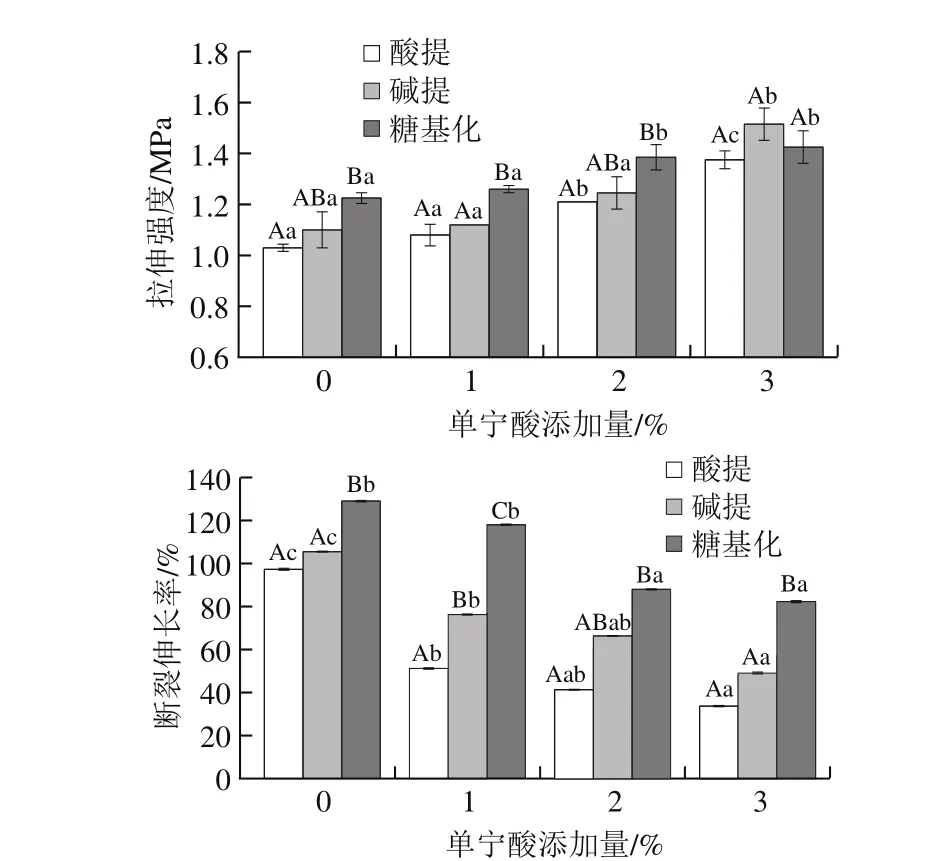
圖4 添加單寧酸對蛋白膜機械強度的影響Fig. 4 Influence of tannic acid on mechanical properties of films
如圖4所示,相比于酸提和堿提蛋白膜,糖基化蛋白膜的拉伸強度及斷裂伸長率在0%~2%單寧酸添加量時較高。這與Zhang Huajiang等[22]的研究一致,說明糖分子與蛋白質相互作用,使得膜材料的結構更加均勻致密,膜的力學性能提高。同時,堿提蛋白膜的拉伸強度及斷裂伸長率均高于酸性蛋白膜,這可能是由于堿性提取條件下蛋白聚集增強。添加單寧酸顯著增加了蛋白膜的拉伸強度,而降低了蛋白膜的斷裂伸長率(P<0.05)。其中,添加1%的單寧酸的糖基化蛋白具有較高的膜拉伸強度和斷裂伸長率,分別為1.26 MPa和118%,Rattaya等[23]曾對添加海藻提取物的魚皮明膠蛋白膜進行研究,同樣發現明膠蛋白膜的拉伸強度升高,斷裂伸長率降低,與該實驗結果一致。多酚與蛋白分子中的氨基和巰基交聯反應,形成高分子共價聚合物,同時單寧酸具有穩定的六環結構,與蛋白交聯阻礙了蛋白分子中鍵的自由旋轉,增強蛋白質分子間緊密性,使得蛋白膜拉伸強度提高,但脆性的增加也使斷裂伸長率降低[24]。
2.5 蛋白膜水蒸氣透過率測定結果
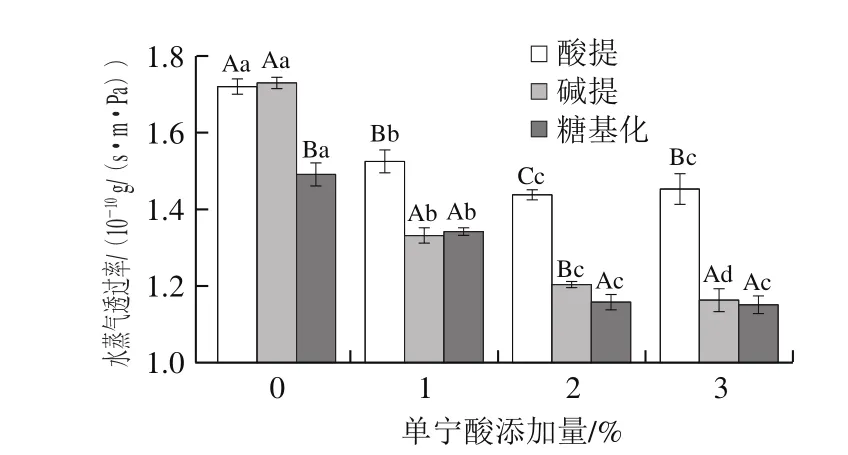
圖5 添加單寧酸對蛋白膜水蒸氣透過率的影響Fig. 5 Influence of tannic acid on water vapor permeability of films
水蒸氣透過率反映了食品和大氣間水分交換能力,水蒸氣透過率越低越利于食品保鮮[25]。由圖5可知,糖基化蛋白膜的水蒸氣透過率最低。雖然糖基化蛋白膜水溶性較高(表1),但蛋白膜基質致密性增強,因此降低了水分子透過蛋白膜材料的擴散速率。同時可以發現,單寧酸加入顯著降低了膜的水蒸氣透過率。這是由于酚類可通過氫鍵及共價鍵與蛋白質相互作用,形成更致密的膜基質[26],減少了蛋白質與水分子的氫鍵結合,從圖3結果也可知含單寧酸的蛋白膜粗糙度較高,膜材料結構更致密,因此減慢了水蒸氣的透過性。Arfat等[27]研究也指出,膜材料中蛋白質分子間的相互作用越強,水分子透過膜材料的滲透性越低。
2.6 蛋白膜不透明指數測定結果

圖6 添加單寧酸對蛋白膜不透明指數的影響Fig. 6 Influence of tannic acid on opacity index of films
如圖6所示,堿提蛋白膜的不透明指數最高,酸提蛋白膜的透明度最高。主要是由于酸提蛋白膜及糖基化蛋白膜的交聯程度低,而堿性條件下提取的蛋白質聚集程度高。添加單寧酸后,蛋白膜材料的不透明度顯著增大,這與Blanco-Pascual等[6]的研究一致。透明度的差異與薄膜顏色有關,隨著單寧酸添加量增加,膜顏色逐漸變黃,導致透明度下降。
2.7 蛋白膜紅外光譜測定
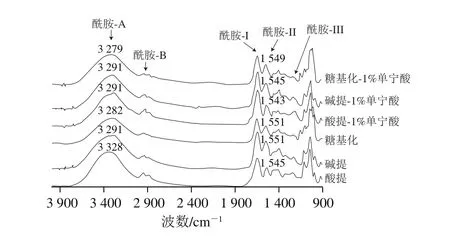
圖7 酸提、堿提及糖基化蛋白膜的紅外光譜圖Fig. 7 Infrared spectra of acid-, alkali-extracted and glycosylated protein- based films
由圖7可知,所有膜材料均有3 個主要振動帶:1 633 cm-1為酰胺I帶,C=O和H—N之間的氫鍵性質決定酰胺I帶的振動頻率;1 536 cm-1為酰胺II帶,代表N—H彎曲振動和C—H伸縮振動;1 238 cm-1為酰胺III帶,代表C—H和N—H振動,所有膜在1 036~1 039 cm-1范圍內均有振動,為甘油—OH與蛋白間的相互作用。在3 280~3 300 cm-1范圍為酰胺A基團振動帶代表N—H與氫鍵振動。在2 926~29 28 cm-1范圍為酰胺B基團振動帶代表C—H和—NH2間的不規則伸縮振動[28]。
波長1 040 cm-1為葡聚糖CH2—OH基團中C—O的伸縮振動,979 cm-1和987 cm-1為C—C的振動吸收峰[29]。如圖7所示,糖基化使蛋白紅外光譜發生明顯變化,其中在1 000~1 100 cm-1范圍內的2 個吸收峰合并為1 個峰,表明葡聚糖分子接枝在了蛋白分子上。3 種蛋白膜中,酸提蛋白膜酰胺A帶的波數最大(3 328 cm-1),而糖基化蛋白膜最低(3 282 cm-1),表明糖基化蛋白膜中蛋白分子間的相互作用最弱,而水、蛋白與增塑劑之間氫鍵作用較強[24]。酸性條件下蛋白在膜中分布較為均勻。而堿提蛋白膜和糖基化蛋白膜在堿性條件下蛋白分子發生聚集,且葡聚糖接枝引入更多氫鍵[30]。添加單寧酸后酰胺A帶轉移至較低波長處,蛋白質通過共價鍵及非共價鍵與氧化或未氧化的單寧酸反應,均促進了蛋白在膜網絡結構中的交聯。此外,酰胺II帶代表N—H的彎曲振動,添加單寧酸后,3 種蛋白膜材料的酰胺II帶均轉移到較低波數,也證明了蛋白質基質與單寧酸之間發生了相互作用[31]。
3 結 論
本實驗比較不同制取方式的鳶烏賊肌原纖維蛋白膜的性質,酸提、堿提及糖基化蛋白膜均具有較光滑平整的外觀及較高的透明度,其中糖基化蛋白膜具有較低的水蒸氣透過性和較高的機械強度,結構較為致密。單寧酸與蛋白產生交聯作用顯著增強了膜的拉伸強度,降低了水溶性和水蒸氣透過率,但斷裂伸長率略有下降,同時膜表面較為粗糙。紅外光譜的波數移動也證明了單寧酸與蛋白分子的交聯作用。綜合考慮,糖基化改性同時添加1%的單寧酸在膜溶液中能夠顯著改善蛋白膜的機械性能和水蒸氣透過率,蛋白膜具有較佳的綜合性能。

