伊拉克油田巖心酸化反應動力學參數研究
王 貴,丁文剛,唐 婧,陳 凱,陳 軍
(中海油田服務股份有限公司油田生產研究院,天津 300459)
伊拉克X油田儲層巖石屬于含粉屑生物碎屑灰巖,巖石具顆粒結構,巖石主要成分為藻類化石、有孔蟲化石、粉屑及0.031 3 mm~0.003 9 mm微晶方解石,微晶方解石具重結晶現象,溶孔為不規則狀,少許鐵泥質、有機質不均勻污染狀分布,其中方解石含量高達95%以上,該儲層巖心氣測滲透率為0.1 mD~2.2 mD,最大孔喉半徑0.332 μm~9.348 μm,其中微裂縫、溶孔、溶洞較為豐富,具有酸化儲層改造措施物質基礎。
筆者通過使用TEMCO公司CRS-500-35旋轉巖盤實驗儀對伊拉克X油田天然巖心進行酸巖反應動力學實驗參數測定,通過對應速度常數、反應級數、H+有效傳質系數等動力學參數研究,定量描述酸巖反應過程不同時刻、不同溫度酸巖反應速度,確定酸的消耗時間及穿透距離,對酸壓設計優化和酸液體系優選具有重要的指導意義。
1 實驗部分
1.1 實驗儀器及藥品
實驗儀器:CRS-500-35旋轉巖盤實驗儀(TEMCO公司)。實驗材料:天然巖心(伊拉克X油田)、鹽酸(分析純)、氫氧化鈉(分析純)及酚酞指示劑等。
1.2 實驗方法
1.2.1 反應動力學常數K等參數確定 碳酸鹽巖油氣層,其主要礦物成分為碳酸鈣和碳酸鈣鎂。碳酸鹽巖油氣層通常用鹽酸酸化,其酸巖反應方程式為:

白云巖:

酸巖反應速度可用單位時間內酸液濃度降低值表示,根據質量作用定律:當溫度、壓力恒定時,化學反應速度與反應物濃度m次方的乘積成正比。由于酸巖反應為復相反應,巖石反應物濃度可視為定值。因此,酸巖反應速度可表示為:

式(3)中:J-反應速度,表示單位時間流到單位巖石面積上的物流量,mol/s·cm2;V-參加反應的酸液體積,L;S-巖盤反應表面積,cm2;K-反應速度常數,[(mol/L)-m·mol/s·cm2];C-t時刻酸液內部酸濃度,mol/L;m-反應級數,無因次。
對J=KCm式兩邊取對數,得:

因此,用lgJ和lgC作圖得一直線,此直線斜率為m,截距為lgK,從而確定酸巖反應動力學方程[1]。
1.2.2 H+有效傳質系數確定 酸巖反應時,氫離子的傳遞是對流擴散過程,根據對流擴散偏微分方程,利用邊界條件求得其解析解為[2]:

式(5)中:De-H+有效傳質系數,cm2/s;μ-酸液平均運動黏度,cm2/s;ω-旋轉角速度,s-1;Ct-時間為 t時酸液內部濃度,mol/L。
1.2.3 酸巖反應活化能確定 根據阿倫尼烏斯(Arrhenius)理論,反應速度常數和溫度變化規律可表示為[3-5]:
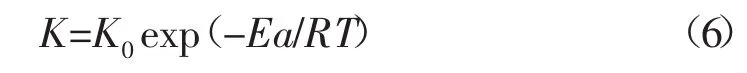
將其代入J=KCm得:
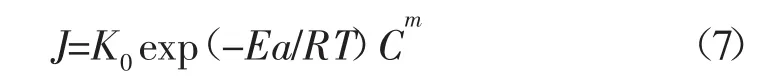
其中:K0-頻率因子;Ea-反應活化能,kJ/mol;R-氣體常數,8.314 J/mol·K;T-絕對溫度,K。
對式(7)中 J=K0exp(-Ea/RT)Cm兩邊取自然對數可得:lnJ=ln(K0Cm)-(Ea/R)1/T。實驗中,使用同一濃度酸液在不同溫度下進行反應,得到不同溫度下的反應速度,在半對數坐標中繪制lnJ~1/T關系曲線,曲線為一直線,直線斜率為-(Ea/R),截距為 ln(K0Cm),用圖解法或用線性回歸分析法即可確定Ea、K0值。
使用15%HCl對直徑為2.54 cm的伊拉克X天然巖心進行酸巖反應實驗。酸巖反應為固液非均相反應,理論上反應速度與壓力無關,但是酸巖反應的生成物有CO2,低壓條件下CO2在巖心表面生成并逸出,影響酸巖反應速度。根據CO2溶解方程,當壓力大于7 MPa時,生成的CO2溶解在酸液中,酸巖反應成為固相液相反應,壓力變化對反應速率不再產生大的影響,因此實驗壓力選擇7 MPa。對于直徑為2.54 cm的巖盤,經計算轉速為500 r/min時,反應酸液的流動狀態與施工排量為4 m3/min時注入液的流動狀態相近,因此,實驗在測定反應動力學參數時,巖盤轉速設定為500 r/min。
2 結果與討論
2.1 實驗結果
使用CRS-500-35旋轉巖盤實驗儀,測試了15%鹽酸與該天然巖心90℃、120℃、140℃溫度下反應的相關參數,實驗結果(見表1,表2,表3)。
使用上述實驗方法,同時結合90℃、120℃及140℃的酸巖反應測試數據,對氫離子傳質系數、反應動力學方程及反應活化能進行計算,結果(見表4,表5)。
2.2 結果分析
H+有效傳質系數數據分析:通過實驗可看出,無論是90℃,還是120℃,或者是140℃,隨著酸巖反應時間不斷推進,氫離子有效傳質速率都是逐漸降低的,這是因為隨著酸巖反應的進行,巖石表面氫離子逐漸消耗,氫離子擴散至巖石表面需要一定時間,且有部分反應產物在巖石表面富集,影響了氫離子擴散速度;隨著溫度上升,氫離子有效傳質速率增加,尤其從120℃至140℃時,溫度對氫離子有效傳質速率影響更加顯著。

表1 90℃酸巖反應實驗結果Tab.1 The date of acid-rock reaction of 90℃
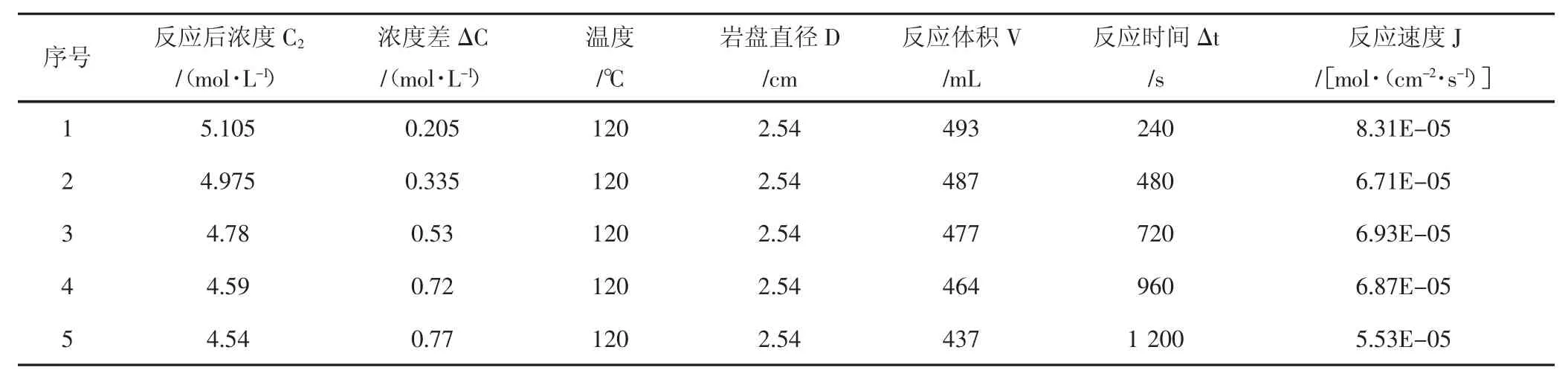
表2 120℃酸巖反應實驗結果Tab.2 The date of acid-rock reaction of 120℃
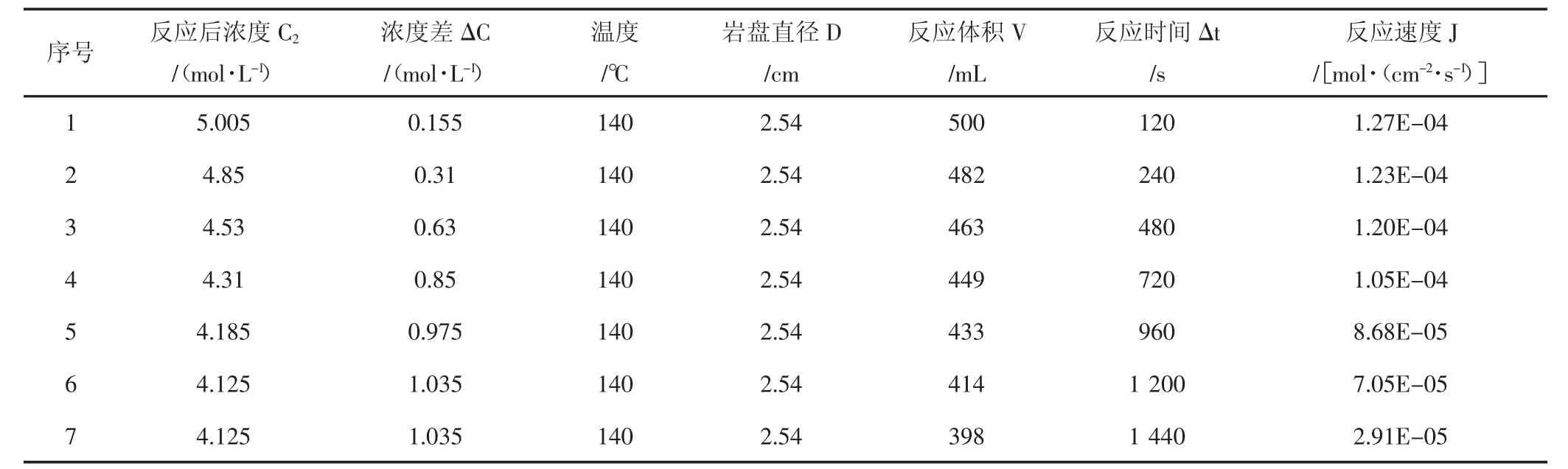
表3 140℃酸巖反應實驗結果Tab.3 The date of acid-rock reaction of 140℃

表4 H+有效傳質系數Tab.4 H+effective mass transfer coefficient
反應速率常數K分析:反應速率常數K其數值與反應物濃度或壓力無關,與溫度、反應介質和催化劑等因素有關,是體現反應速率快慢和反應發生難易程度的動力學參數,從以上數據可知,隨著溫度升高,反應速率常數不斷升高,反應速率加快。
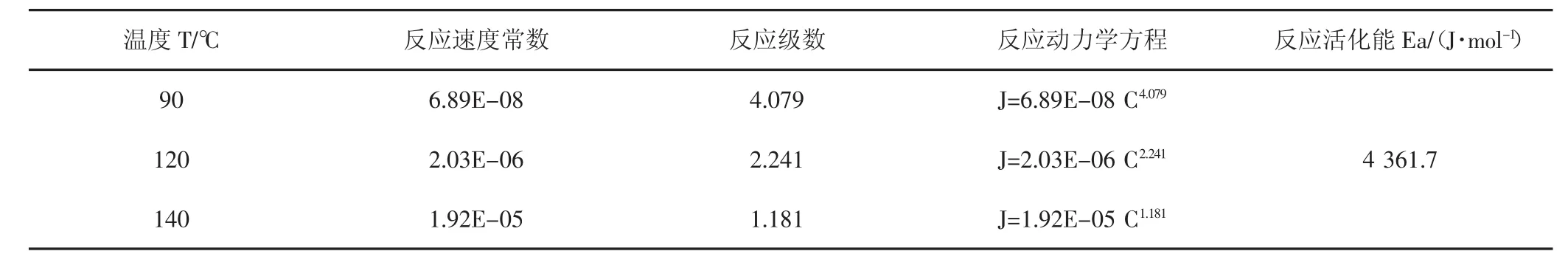
表5 酸鹽反應動力學方程及反應活化能測試結果Tab.5 Acid reaction kinetic equation and reaction activation energy test results
反應級數m分析:反應級數m是反應速率方程中各反應物濃度項的指數代數和,其數值表示反應物濃度對反應速率的影響程度,從數據可知,隨著溫度升高,溫度對酸巖反應難易的影響程度逐漸增加,而濃度對酸巖反應難易影響程度逐漸變小。
反應活化能分析:反應活化能是指活化分子的平均能量與反應物分子的平均能量之差,其大小可以體現反應速度的快慢和反應發生的難易程度。由實驗結果可知15%鹽酸與本天然巖心的反應活化能Ea為4 361.7 J/mol。
3 結論
(1)無論是90℃,還是120℃,或者是140℃,隨著酸巖反應時間不斷推進,氫離子有效傳質速率都是逐漸降低的;隨著溫度升高,反應速率常數不斷升高,反應速率加快。
(2)隨著溫度升高,溫度對酸巖反應難易的影響程度逐漸增加,而濃度對酸巖反應難易影響程度逐漸變小;15%鹽酸與伊拉克X油田天然巖心的反應活化能為4 361.7 J/mol。

