TRPV1在大鼠氣管內注入胃液導致肺纖維化過程中的作用
付悅 孔靈菲
中國醫科大學附屬第一醫院呼吸與危重癥醫學科,沈陽110001
特發性肺纖維化(Idiopathic pulmonary fibrosis,IPF)是一種慢性、進行性、不可逆的間質性肺疾病。美國每年約有40 000例發病,診斷后的中位生存期僅為3~5年[1-2],尚缺乏療效顯著的治療藥物。很多研究發現胃食管反流病(gastroesophageal reflux disease,GERD)和胃內容物誤吸在IPF患者中很常見,西方IPF患者GERD發病率高達67%~88%,在中國為62.3%。目前,IPF病因尚不明確,但胃食管反流已經被公認為IPF的危險因素之一。Lee等[3]發現,IPF患者肺泡灌洗液的p H值下降且胃蛋白酶濃度有所升高。此外,許多動物實驗已經證實,慢性持續胃酸吸入會導致肺纖維化和其他呼吸系統疾病[4-6]。
瞬時感受器電位香草酸受體1(transient receptor potential vanilloid 1,TRPV1)最初被認為是表達在初級神經元上的辣椒素和相關天然刺激物的受體,后來發現是一種表達在多種類型細胞上的非選擇性陽離子通道,可被熱、辣椒素、內源性H+以及反流胃液中的鹽酸激活[7-8]。TRPV1主要通過信息整合,經由Ca2+通道對細胞的功能產生影響,與心肌、肝、腎等多種組織纖維化密切相關[9-10]。本研究采用氣管內注入胃液的方式復制胃食管反流引起胃液誤吸的模型,采用TRPV1抑制劑辣椒平 (capsazepine,CPZ)進行干預,觀察TRPV1對大鼠胃液微吸入導致肺纖維化的作用。
1 材料與方法
1.1 實驗動物 SPF級雄性SD大鼠30只,6~7周齡,體質量 (200±20)g,由遼寧長生生物有限公司提供,將大鼠飼養于溫度為20~25℃,濕度40%~70%,人工12 h晝夜循環的環境中,自由進食水。
1.2 主要試劑 羥脯氨酸測定試劑盒 (南京建成公司),Masson染色試劑盒 (南京建成公司),大鼠轉化生長因子β1(transforming growth factor-β1,TGF-β1)酶聯免疫吸附試驗試劑盒 (美國R&D公司),CPZ(美國 MCE公司),TRPV1一抗(美國 Abcam 公司),α-平滑肌肌動蛋白(α-smooth muscle action,α-SMA)一 抗 (美國Abcam公司),Ⅰ型膠原蛋白一抗 (美國Abcam公司),免疫組織化學二抗試劑盒 (福州邁新生物技術開發公司),DAB顯色試劑盒,ECL發光液(美國Bio-rad公司)。
1.3 動物分組 將30只SD大鼠隨機分為3組:對照組、模型組和CPZ干預組,每組10只。模型組經氣管插管注入大鼠胃液0.5 ml/kg,對照組注入等量生理鹽水,CPZ干預組在氣管插管前30 min腹腔注射CPZ 10 mg/kg。所有操作每周1次,連續8周。
1.4 造模方法 將健康雄性SD大鼠適應性飼養1周后,采用氣管插管注入大鼠胃液的方式模擬胃食管反流大鼠誤吸胃內容物的模型。將大鼠用10%水合氯醛以3.5 ml/kg的劑量腹腔注射麻醉后,針刺大鼠腳掌無反射,證明麻醉充分。將大鼠仰臥位置于手術板上,頭朝向術者,固定頭部和四肢,手術板頭側抬高30~45°,用紗布包裹鼠舌,將鼠舌向左外上方拉出口腔,使其暴露聲門。調整額鏡將照射光源對準聲門,即可看見聲門隨呼吸開閉,趁聲門開啟時順勢將靜脈留置針插入氣管,見管口棉球隨呼吸擺動,證明插管成功。將胃液注入氣管,隨即注入少量空氣,保證液體全部注入氣管,完畢后立即將動物直立、左右搖晃,以確保液體在肺內均勻分布,待其清醒后,放回鼠籠。
1.5 標本采集 首次氣管灌注9周后,稱重,以10%水合氯醛麻醉大鼠,收集大鼠肺泡灌洗液,取右肺于4%多聚甲醛內固定,用于組織學和免疫組織化學分析,取左肺放于-80℃冰箱保存,用于蛋白質印跡檢測。肺組織中羥脯氨酸含量和BALF中TGF-β1水平檢測具體操作分別按照試劑盒說明書進行。
1.6 組織學檢測 將肺組織常規固定,脫水透明,石蠟包埋,切片后進行組織學染色。HE染色:充分烤片后脫蠟水化,蘇木精染液3 min,流水沖洗,鹽酸酒精分化3 s,自來水沖洗15 min,伊紅染液2 min,蒸餾水洗,梯度酒精脫水,透明,中性樹膠封片。Masson染色操作步驟按照試劑盒說明書進行。采用免疫組織化學方法檢測大鼠肺組織中TRPV1表達水平。充分烤片后,脫蠟水化,抗原修復,滅活內源性過氧化物酶,封閉,一抗孵育,二抗孵育,DAB顯色,蘇木素復染,脫水,中性樹膠封片。
1.7 組織學分析 使用Szapiel法評價肺泡炎和肺纖維化程度,根據HE染色結果對肺泡炎程度進行評分。0分:無肺泡炎;1分:輕度肺泡炎,病變范圍占全肺20%以下,肺泡間隔因炎癥細胞浸潤而增寬,病變局限;2分:中度肺泡炎,病變范圍占全肺的20%~50%,近胸膜處受累更嚴重;3分:中度肺泡炎,病變范圍超過全肺的50%,呈彌漫性分布。根據Masson染色結果對纖維化程度進行評分。0分:無肺纖維化;1分:輕度肺纖維化,纖維化范圍占全肺20%以下,胸膜和胸膜下間質受累,存在肺泡結構紊亂;2分:中度肺纖維化,纖維化范圍占全肺的20%~50%;3分:重度肺纖維化,纖維化范圍超過全肺的50%,呈彌漫性分布。
1.8 蛋白質印跡檢測 采用蛋白質印跡檢測大鼠肺組織中α-SMA、Ⅰ型膠原蛋白和TRPV1蛋白的表達水平。提取肺組織總蛋白,BCA法檢測蛋白濃度,SDS聚丙烯酰胺凝膠電泳,轉印至PVDF膜,脫脂牛奶封閉,一抗孵育過夜,二抗孵育,ECL法顯色,以GAPDH為內參,應用Image J軟件對條帶灰度值進行分析。
1.9 統計學分析 采用SPSS 20.0軟件,實驗結果以±s表示,經方差齊性檢驗和正態性檢驗后,采用單因素方差分析進行比較,組間多重比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般狀況 首次氣管灌注后,對照組大鼠活動正常,皮毛光亮,呼吸平穩,精神狀態尚可,飲水、進食量略少于灌注前,1周后恢復;模型組大鼠活動減少,皮毛光澤差,呼吸急促,精神萎靡,飲水、進食量明顯少于灌注前,2周后恢復;CPZ干預組大鼠一般狀況較對照組略差,但較模型組有所改善。首次灌注后2周內,各組大鼠體質量均出現增長緩慢,以模型組最明顯;第2周后,各組大鼠體質量逐漸恢復增長,各組大鼠體質量差異無統計學意義。見表1。
2.2 肺組織病理學變化
2.2.1 肺泡炎程度 HE染色結果顯示,對照組大鼠肺泡結構基本完整,肺泡和間質僅有少量炎癥細胞浸潤,肺泡間隔未見增厚;模型組大鼠定期吸入胃液導致肺泡結構破壞明顯,肺泡間隔增寬,大量炎癥細胞浸潤,成纖維細胞增生,可見纖維組織形成和膠原沉積;CPZ干預組大鼠雖然存在肺泡結構破壞和炎癥細胞浸潤,但病理改變程度與模型組相比明顯改善。量化肺泡炎程度,模型組肺泡炎評分高于對照組 (t=5.79,P<0.01),而CPZ干預組評分比模型組明顯降低 (t=-2.17,P<0.05)。見圖1、2。
表1 3組大鼠不同時間體質量變化 (g,±s)

表1 3組大鼠不同時間體質量變化 (g,±s)
組別 鼠數 0周 2周 4周 6周 8周對照組 10 208.6±12.1 216.3±8.4 249.2±8.1 267.0±15.8 302.8±17.8模型組 10 204.0±11.2 204.2±13.9 239.6±19.9 264.4±15.7 296.1±16.1辣椒平干預組 10 205.7±9.6 210.4±7.9 240.5±10.3 264.9±16.2 297.8±12.6 F值 0.450 3.367 1.485 0.075 0.495 P值 0.645 0.049 5 0.244 0.928 0.615
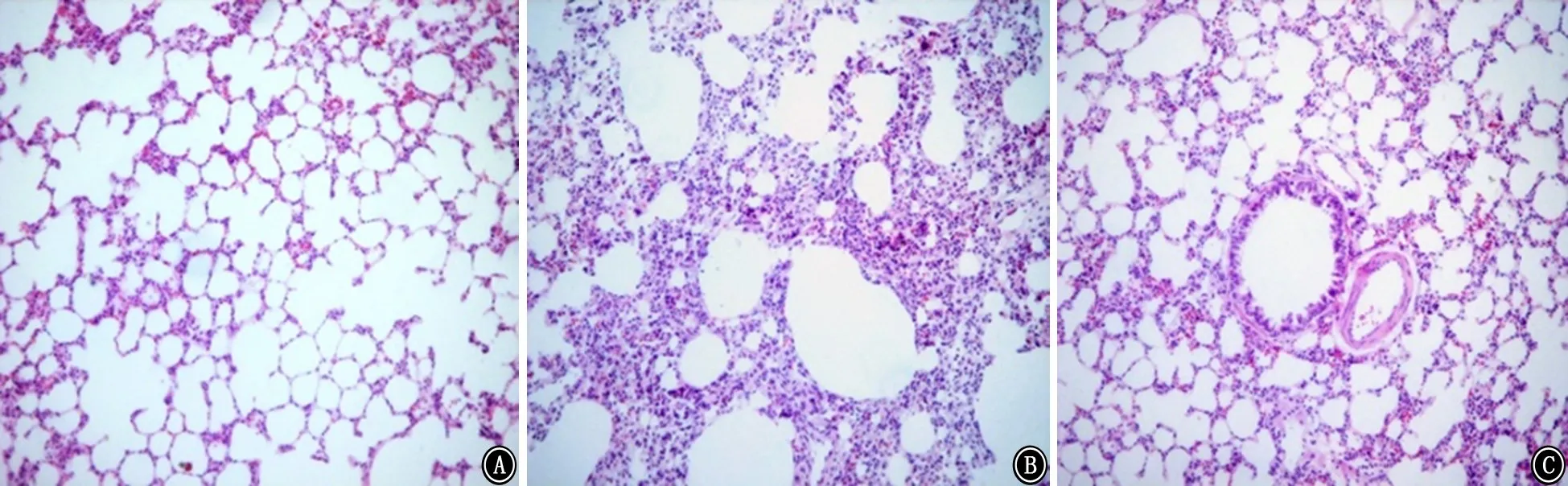
圖1 各組大鼠肺泡炎程度 HE ×100 A:對照組;B:模型組;C:辣椒平干預組
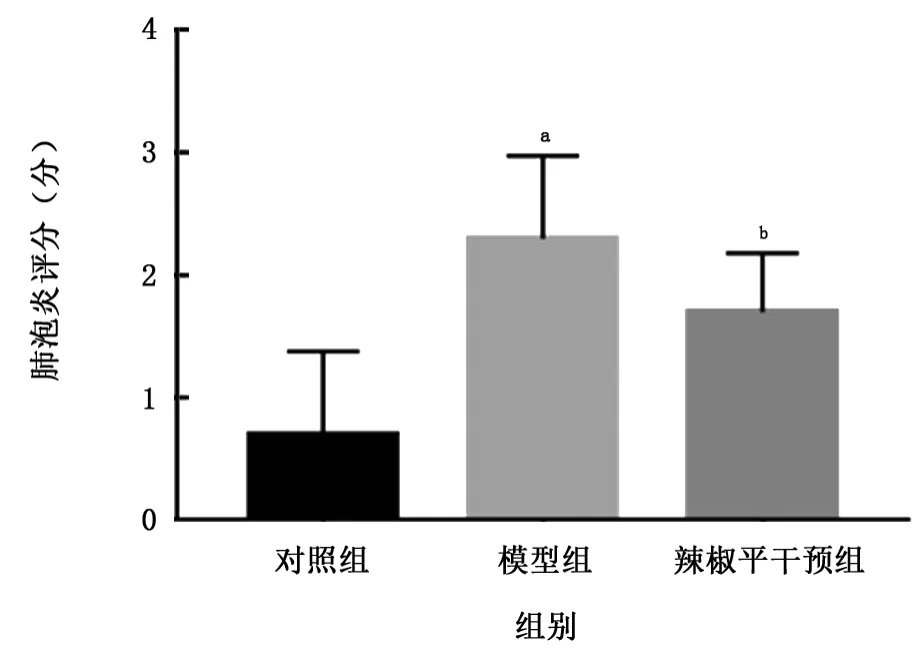
圖2 各組大鼠肺泡炎評分
2.2.2 肺組織纖維化程度 Masson染色結果顯示,對照組大鼠肺泡結構完整,僅有少量膠原沉積;模型組大鼠肺泡結構破壞嚴重,肺泡壁增厚,細胞外基質增多,肺泡及氣管周圍有大量膠原沉積,肺纖維化評分顯著高于對照組 (t=6.91,P<0.01);與模型組比較,CPZ干預組纖維化程度顯著改善,肺纖維化評分明顯降低 (t=-2.54,P<0.05)。見圖3、4。
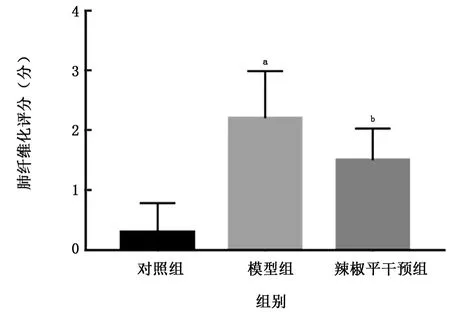
圖3 各組大鼠肺纖維化評分

圖4 各組大鼠肺組織纖維化程度 Masson ×100 A:對照組;B:模型組;C:辣椒平干預組
2.3 肺組織中α-SMA及Ⅰ型膠原蛋白的表達蛋白質印跡結果表明,模型組大鼠肺組織中α-SMA表達顯著高于對照組 (t=3.46,P<0.01),而CPZ干預組大鼠肺組織中α-SMA表達與模型組相比下降 (t=-2.11,P<0.05);與對照組比較,模型組大鼠肺組織中Ⅰ型膠原蛋白表達升高 (t=5.61,P<0.01),而CPZ干預組大鼠肺組織中Ⅰ型膠原蛋白表達較模型組降低 (t=-2.33,P<0.05)。見圖5。

圖5 蛋白質印跡檢測各組大鼠肺組織中α-平滑肌肌動蛋白及Ⅰ型膠原蛋白表達水平 A:電泳圖;B:柱狀圖
2.4 肺組織中羥脯氨酸含量 與對照組比較,模型組大鼠肺組織中羥脯氨酸含量明顯增加 (t=11.75,P<0.01),CPZ干預組大鼠肺組織中羥脯氨酸含量較模型組降低 (t=-4.81,P<0.01)。見表2。
表2 各組大鼠肺組織中羥脯氨酸含量 (±s)
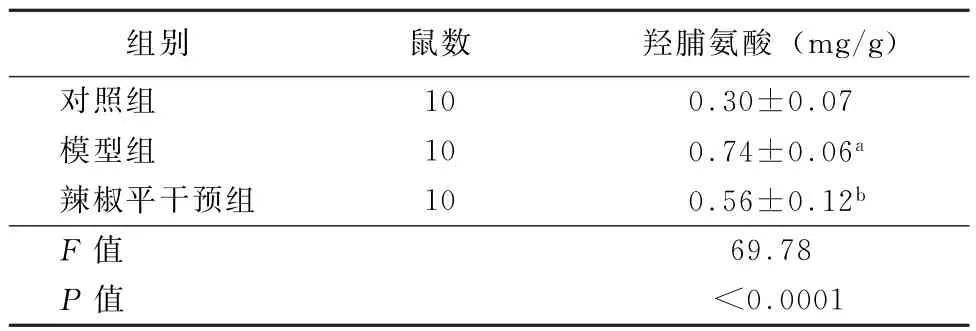
表2 各組大鼠肺組織中羥脯氨酸含量 (±s)
注:與對照組比較,a P<0.01;與模型組比較,b P<0.01
組別 鼠數 羥脯氨酸 (mg/g)對照組 10 0.30±0.07模型組 10 0.74±0.06a辣椒平干預組 10 0.56±0.12b F值 69.78 P值 <0.0001
2.5 肺組織中TRPV1的表達 免疫組織化學結果顯示,與對照組比較,模型組TRPV1表達水平顯著增加 (t=9.31,P<0.01),利用CPZ抑制TRPV1后,大鼠肺纖維化明顯改善 (圖6、7)。蛋白質印跡檢測也呈現相似的趨勢 (圖8)。

圖6 免疫組織化學檢測各組大鼠肺組織中TRPV1表達水平 ×200 A:對照組;B:模型組;C:辣椒平干預組

圖7 各組大鼠肺組織中TRPV1表達水平
2.6 BALF中TGF-β1水平 結果顯示,與對照組相比,模型組大鼠BALF中TGF-β1明顯增加(t=15.16,P<0.01);與模型組比較,CPZ干預組BALF中TGF-β1水平下降 (t=-8.29,P<0.05)。見表3。
3 討論
肺纖維化特征性病變是細胞損傷后進一步組織重塑導致的肺泡結構破壞,肺組織細胞外基質過度沉積所致的纖維化變性[11]。IPF是最常見的肺纖維化類型,是一種進行性、致死性疾病,5年生存率僅為20%[12]。1982年Osler提出胃酸反流和哮喘之間的聯系后,胃酸反流被認為是多種呼吸系統疾病的危險因素[13]。越來越多的研究發現,IPF可能與長期誤吸胃內容物有關,并通過食管p H值監測證實,IPF患者GERD發病率遠高于健康人[14-16]。

圖8 蛋白質印跡檢測各組大鼠肺組織中TRPV1表達水平 A:電泳圖;B:柱狀圖
表3 各組大鼠BALF中TGF-β1水平 (±s)

表3 各組大鼠BALF中TGF-β1水平 (±s)
注:TGF-β1為轉化生長因子β1;與對照組比較,a P<0.01;與模型組比較,b P<0.05
組別 鼠數 TGF-β1(ng/L)對照組 10 175.03±45.00模型組 10 609.10±81.75a辣椒平干預組 10 371.70±59.96b F值 115.20 P值 <0.000 1
本實驗通過向大鼠氣道內注入胃液,模擬胃食管反流引起大鼠誤吸胃液的模型,發現連續8周灌注胃液的模型組大鼠肺泡結構紊亂,肺泡壁增厚,肺泡炎評分明顯高于對照組,Masson染色發現模型組大鼠肺組織細胞外大量膠原沉積,通過Szapiel法量化大鼠肺組織纖維化程度,誤吸胃液的模型組大鼠肺纖維化評分顯著高于對照組。當成纖維細胞轉化為肌成纖維細胞時,便可分泌α-SMA。本研究對纖維化的標記物α-SMA及Ⅰ型膠原蛋白進行了檢測,通過蛋白質印跡檢測發現,誤吸胃液的模型組大鼠α-SMA及Ⅰ型膠原蛋白顯著高于對照組[17]。此外,羥脯氨酸是膠原蛋白的主要成分之一,反映組織膠原代謝情況。本研究通過檢測各組大鼠肺組織中羥脯氨酸含量發現,模型組大鼠肺組織中羥脯氨酸含量明顯高于對照組。這些結果均表明,誤吸胃液導致大鼠發生肺纖維化。
目前認為,胃酸反流主要通過酸性物質的直接損傷和激活迷走神經介導的反射引起呼吸系統疾病[13]。已有文獻報道[18],TRPV1參與了胃食管反流通過神經反射引起的氣道神經源性炎癥,但TRPV1是否參與到誤吸反流物直接損傷肺組織引起肺纖維化的過程,尚不清楚。早在1998年,Tominaga等[19]證實,細胞外低p H值可激活TRPV1離子通道,提示誤吸到肺部的酸性胃內容物可能通過激活TRPV1促進肺纖維化發生。本實驗發現,長期誤吸酸性胃液的大鼠不但發生了肺纖維化,免疫組織化學和蛋白質印跡結果顯示其肺組織內TRPV1表達水平高于對照組,利用CPZ阻斷TRPV1后,誤吸胃液的大鼠肺組織中α-SMA、Ⅰ型膠原蛋白及羥脯氨酸含量較模型組顯著降低,肺纖維化程度明顯改善,這表明TRPV1參與了誤吸胃液導致的肺纖維化發生過程。
TGF-β1是關鍵的促纖維化因子,TGF-β1通過磷酸化其下游的Smad2/3信號通路,觸發促纖維化基因的過度表達,參與心、肝、腎、肺等多種器官的纖維化過程[11]。有文獻報道IPF患者氣道上皮細胞和成纖維細胞中TGF-β增加[20],本研究結果與既往研究一致。酶聯免疫吸附試驗方法檢測各組大鼠BALF中TGF-β1發現,與對照組相比,氣管內注入胃液的模型組大鼠BALF中TGF-β1水平顯著增加,而腹腔注射CPZ抑制TRPV1后,大鼠BALF中TGF-β1下降。這些結果均表明,TRPV1的激活在誤吸胃液引起大鼠肺纖維化過程中起促進作用,而使用TRPV1抑制劑CPZ可顯著改善大鼠肺纖維化。
本研究首次提出了TRPV1在誤吸胃液所致肺纖維化過程中的重要作用,提示TRPV1可能為合并胃食管反流的IPF患者提供新的治療靶點。
利益沖突所有作者均聲明不存在利益沖突

