五味子蜂花粉不同萃取物對小鼠肝臟脂質過氧化及DNA氧化損傷的作用
陳思南,王心怡,李夢婷,何亮亮,王齊蕾,王郭嬌,王衛東,曹 煒,程 妮,*
(1.西北大學食品科學與工程學院,陜西 西安 710069;2.陜西省康泰萊生物醫藥工程有限公司,陜西 西安 710075)
蜂花粉是指蜜蜂采集顯花植物的花粉,并向其中加入花蜜和自身分泌物混合而成的不規則扁圓形團狀物[1]。由于其含有豐富的蛋白質、不飽和脂肪酸、多糖、維生素、酚類等,被譽為“天然營養庫”。這些對健康有益的生物活性物質使得蜂花粉有抗氧化、抗癌、降低膽固醇和增強免疫等生理保健功能,近年來對其抗氧化、保肝、抗癌等作用的研究已成為熱潮[2-6]。
五味子(Schisandra chinensis)是一種藥用植物,在各國藥典中被廣泛使用,其作為一種傳統中藥已有數千年臨床診療歷史[7-8]。五味子蜂花粉產量大、分布廣、抗氧化活性強,因此有一定的研究價值。本課題組前期研究發現,五味子蜂花粉粗提物含有豐富的酚類化合物,對四氯化碳引起的小鼠肝損傷有顯著的保護作用。為了探究五味子蜂花粉酚類物質組成,明確其中高抗氧化活性酚類物質的分布,本研究采用不同極性的溶劑對其粗提物進行萃取,測定不同萃取物的總酚、總黃酮含量和Fe2+絡合能力、還原力及清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力,探討其對小鼠肝臟脂質過氧化的抑制作用及對質粒DNA氧化損傷的保護作用,旨在為五味子蜂花粉高抗氧化活性酚類物質的分離純化提供依據。
1 材料與方法
1.1 材料與試劑
五味子蜂花粉由陜西老蜂農生物科技有限責任公司提供。C57BL6小鼠:雄性,體質量18~22 g,由西安交通大學醫學院提供。實驗動物生產許可證號:SCXK(陜)2018-001;使用許可證號:SYXK(陜)2015-002。
沒食子酸、蘆丁、DPPH、乙二胺四乙酸二鈉(ethylene diamine tetraacetic acid based sodium salt,Na2EDTA)、水溶性VE(Trolox)、三吡啶基三嗪(2,4,6-tri(2-pyridyl)-S-triazine,TPTZ)、牛血清白蛋白、鐵試劑(FerroZine) 美國Sigma公司;pBR322質粒DNA 日本Takara生物醫藥公司;瓊脂糖 美國Bio-Rad公司;甲醇(色譜級) 德國Merck公司;其他試劑均為國產分析純。
1.2 儀器與設備
U3000高效液相色譜(high performance liquid chromatography,HPLC)儀 美國Thermo Fisher公司;R-1050Ex旋轉蒸發儀 鄭州長城科工貿有限公司;CP224C電子分析天平 奧豪斯儀器(上海)有限公司;L5S紫外-可見分光光度計 上海儀電分析儀器有限公司;DYY-8D電泳儀 北京六一生物科技有限公司;UVP Gelstudio touch凝膠成像儀 德國耶拿分析儀器股份公司;HH-501超級恒溫水浴鍋 天津市鑫博得儀器有限公司。
1.3 方法
1.3.1 五味子蜂花粉不同萃取物的提取與分離
將5 kg五味子蜂花粉粉碎后加入30 倍體積的體積分數75%乙醇溶液浸泡24 h,取上清液,剩余殘渣重復以上操作1 次,合并兩次提取液進行過濾,40 ℃旋轉蒸發濃縮至無醇味。提取物中加入適量蒸餾水進行分散,形成均一懸濁液,依次加入石油醚、乙酸乙酯、正丁醇進行萃取。將得到的不同極性萃取液40 ℃濃縮至浸膏,置于-4 ℃冰箱中保存備用。分別得到石油醚層萃取物228.41 g,乙酸乙酯層萃取物12.0 g,正丁醇層萃取物175.2 g。
1.3.2 HPLC分析五味子蜂花粉不同萃取物活性成分
ZORBAX SB-C18硅烷色譜柱(250 mm×4.6 mm,5 μm);流動相A:甲醇、流動相B:0.1%(體積分數,下同)甲酸;梯度洗脫程序為:0 min,5%流動相A;10 min,15%流動相A;20 min,15%流動相A;25 min,17%流動相A;30 min,30%流動相A;50 min,40%流動相A;60 min,55%流動相A;70 min,80%流動相A;75 min,85%流動相A;78 min,10%流動相A;85 min,5%流動相A;流速為1.0 mL/min;二極管陣列檢測器;檢測波長分別為254、280、290、324 nm;柱溫為30 ℃。
1.3.3 總酚含量的測定
參照Zhou Juan等[9]的方法,使用Folin-Ciocalteu法測定五味子蜂花粉不同萃取物的總酚含量。將已分離的五味子蜂花粉正丁醇萃取物、乙酸乙酯萃取物、石油醚萃取物分別配制成質量濃度為1.0 mg/mL的待測樣液,準確移取0.2 mL不同萃取物待測液,加入1 mL Folin-Ciocalteu顯色劑,混勻后加入5 mL 1 mol/L Na2CO3溶液,用蒸餾水定容至10 mL,混合均勻,在室溫條件下避光放置1 h,于760 nm波長處測吸光度。總酚含量表示為每100 g浸膏相當于沒食子酸的質量。
1.3.4 總黃酮含量的測定
參照Blasa等[10]的方法并稍作修改。準確移取質量濃度為1.0 mg/mL不同萃取物待測液1.0 mL,分別加入5%(質量分數,下同)NaNO2溶液0.4 mL,搖勻,室溫放置6 min。加入10% Al(NO3)3溶液0.4 mL,搖勻放置6 min。加入4% NaOH溶液4 mL,再用80%甲醇溶液定容至10 mL,搖勻,室溫下靜置15 min,于510 nm波長處測定吸光度。總黃酮含量表示為每100 g浸膏相當于蘆丁的質量。
1.3.5 對Fe2+絡合能力的測定
在Singh等[11]的方法上加以改進。準確移取質量濃度為1.0 mg/mL的不同萃取物待測液0.2 mL,加入1 mmol/L FeSO4溶液0.1 mL和1 mmol/L鐵試劑0.3 mL,并用甲醇定容至3.0 mL,混勻,反應10 min后在562 nm波長處測吸光度。以不加樣品溶液為參比,Na2EDTA為陽性對照,Fe2+絡合能力表示為每克浸膏相當于Na2EDTA的質量。
1.3.6 還原力的測定
參照Benzie等[12]的方法。將正丁醇、乙酸乙酯、石油醚萃取物分別配制成質量濃度為0.01、0.1、1.0 mg/mL的待測樣液,分別向試管中加入1.0 mL待測樣液,再加入TPTZ工作液(包括300 mmol/L pH 3.6醋酸鹽緩沖液25.0 mL、10 mmol/L TPTZ溶液2.5 mL、20 mmol/L FeCl3溶液2.5 mL)4.0 mL,混勻,于37 ℃恒溫水浴10 min后在593 nm波長處測定吸光度。以Trolox為標準品,還原力表示為每毫克浸膏相當于Trolox的質量。
1.3.7 DPPH自由基清除能力的測定
對Rodrigo等[13]的方法進行改進。將DPPH標準品配制成0.04 mg/mL甲醇溶液,于棕色具塞試管中分別加入不同質量濃度待測樣液0.6 mL,再加入上述DPPH溶液5.0 mL,混勻,避光反應1 h,于517 nm波長處測吸光度。根據公式(1)計算DPPH自由基清除率。
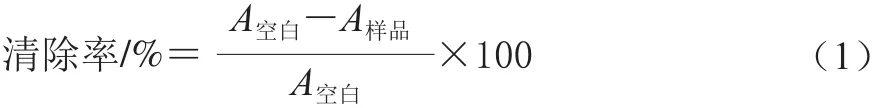
式中:A空白為以甲醇代替樣品吸光度;A樣品為樣品組吸光度。
分別計算不同萃取物溶液半抑制濃度(half maximal inhibitory concentration,IC50)。
1.3.8 對·OH誘導的pBR322質粒DNA氧化損傷保護作用的測定
參考Yeung等[14]的方法進行測定。實驗組加入1 μL DNA、1 μL 1.0 mmol/L FeSO4(誘導劑)、1 μL體積分數1% H2O2、4 μL 1 mg/mL樣品溶液、50 mmol/L pH 7.0磷酸鹽緩沖液定容至15 μL,模型組不加樣品溶液,正常組不加FeSO4和H2O2。混勻,37 ℃溫育30 min,加入1 μL Goldenview染色,采用瓊脂糖凝膠電泳分離法檢測DNA條帶。電泳時間90 min,電壓50 V。結果采用凝膠呈像儀拍照,用Quantity One軟件分析電泳各條帶的OD值,軟件自動計算對應條帶曲線下面積,從而計算DNA雙鏈與開鏈的比例。
1.3.9 抑制小鼠肝臟脂質過氧化能力的測定
頸椎脫臼法處死小鼠,取出肝臟用冰生理鹽水洗去血漬并瀝干,制成質量分數10%肝勻漿。3 000 r/min離心15 min,取上清液稀釋10 倍體積得質量分數1%肝勻漿待用。
參考曹煒等[15]的方法并稍加改進。樣品管取1.0 mL 1%肝勻漿上清液,再加入不同體積的樣品溶液,混勻,加入200 μL 6 mmol/L FeSO4溶液和80 μL 60 mmol/L H2O2溶液作為誘導劑,以磷酸鹽緩沖液補足2.0 mL。模型管不加樣品溶液,空白管不加誘導劑,然后將空白管、模型管和樣品管一同置于37 ℃溫浴1 h,每10 min振搖一次。溫浴完成后冰浴10 min以終止反應。向各管加入質量分數1%三氯乙酸1.0 mL和0.8%硫代巴比妥酸1 mL,混勻,置于100 ℃沸水浴15 min,立即用自來水冷卻,6 000 r/min離心10 min,取上清液于532 nm波長處測吸光度。按公式(2)計算抑制率。

式中:A模型、A空白、A樣品分別為模型管、空白管、樣品管吸光度。
1.4 數據統計與分析
實驗結果均表示為3 次測定的 ±s。利用SAS 8.1軟件對實驗數據進行方差分析,P<0.05為差異顯著。采用Origin 8.0軟件作圖。
2 結果與分析
2.1 五味子蜂花粉不同萃取物HPLC分析結果
HPLC法可以定性評價混合物中抗氧化成分的相對強弱[16-17],Almaraz-Abarca等[18]通過HPLC分析了不同植物源花粉的酚類成分,而對于五味子蜂花粉不同萃取物酚類分布的研究較少。由圖1可知,不同萃取物峰數量、保留時間、響應值存在極大差異。正丁醇萃取物峰數量較少,各峰的保留時間主要在50~60 min,響應值高;主要為極性較強的物質,雖種類較少,但含量較高。乙酸乙酯萃取物峰數量多,在各時間段都有大量的峰,40 min和60 min左右峰數量最多且有較高響應值,但明顯小于正丁醇萃取物,表明乙酸乙酯萃取物所含物質種類很多,但含量不高。石油醚萃取物的峰數量較少且響應值極小,大多出現在15~25 min。比較3 種萃取物,正丁醇萃取物的峰保留時間主要為60 min左右,且響應值明顯高于乙酸乙酯和石油醚萃取物。
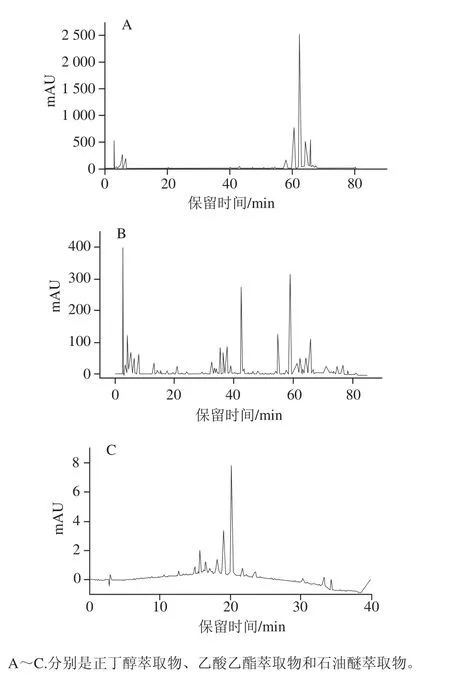
圖1 五味子蜂花粉不同萃取物HPLC圖Fig. 1 HPLC of different solvent extracts from S. chinensis bee pollen
2.2 總酚含量測定結果

表1 五味子蜂花粉不同萃取物總酚、總黃酮含量、Fe2+絡合能力及抗氧化能力Table 1 Contents of total phenols and total flavonoids and Fe2+-chelating capacity as well as antioxidant activity of different solvent extracts from S. chinensis bee pollen
如表1所示,五味子蜂花粉不同萃取物總酚含量存在顯著差異(P<0.05),正丁醇萃取物中總酚含量最高,達到26.11 g/100 g,乙酸乙酯萃取物次之,石油醚萃取物總酚含量最低,只有3.01 g/100 g,不足正丁醇萃取物的12%。Huang Haibo等[19]測得五味子蜂花粉粗提物總酚含量為5.29 g/100 g,遠低于本研究中正丁醇萃取物,可見五味子蜂花粉中的酚類物質集中分布于正丁醇萃取物中,在乙酸乙酯和石油醚萃取物中只有少量分布。
2.3 總黃酮含量測定結果
如表1所示,正丁醇萃取物中總黃酮含量最高,達到27.90 g/100 g,石油醚萃取物中總黃酮含量最低,只有2.85 g/100 g;不同萃取物中總黃酮含量存在顯著差異(P<0.05),正丁醇萃取物約是乙酸乙酯萃取物的3 倍、石油醚萃取物的10 倍。Huang Haibo等[19]在研究五味子蜂花粉保肝護腎作用時測得其粗提物中總黃酮含量為3.03 g/100 g,介于本研究正丁醇萃取物和石油醚萃取物之間。在五味子蜂花粉不同萃取物中總黃酮含量排序為:正丁醇萃取物>乙酸乙酯萃取物>石油醚萃取物,與其總酚含量排序相同。
2.4 Fe2+絡合能力測定結果
Fe2+能夠催化Fenton反應的進行,生成·OH,對機體產生氧化應激。酚類物質能與Fe2+絡合,阻止Fenton反應的發生,實現抗氧化作用[20]。如表1所示,每克正丁醇萃取物的絡合能力相當于137.47 mg Na2EDTA;各萃取物均有較高的絡合能力,其中正丁醇萃取物的絡合能力顯著高于乙酸乙酯和石油醚萃取物(P<0.05),約是其2 倍;而乙酸乙酯萃取物與石油醚萃取物無顯著性差異,可見在正丁醇萃取物中大量存在的酚類化合物可以絡合Fe2+,有較強的抗氧化作用。
2.5 還原力測定結果
還原力是指某種物質提供電子與活潑自由基反應后轉化為較為穩定的物質,能夠不再讓自由基鏈式反應繼續進行,從而阻止自由基對人體的傷害[21-22]。樣品的還原力越強,其抗氧化性就越強,表示其越能供應電子,將Fe3+還原為Fe2+,并與自由基反應生成更穩定的物質。如表1所示,正丁醇萃取物的還原力最高,每毫克該提取物的還原力相當于0.79 mg Trolox,約是乙酸乙酯萃取物(相當于0.32 mg Trolox)的2.5 倍,石油醚萃取物最低。可見總酚和總黃酮含量越高,還原力就越強。已有多項研究證實還原力與總酚酸含量有較強相關性[23]。
2.6 DPPH自由基清除能力測定結果
DPPH自由基是一種穩定的有機自由基,其溶液呈深紫色,在517 nm波長處有強吸收,當與抗氧化劑共存時,DPPH自由基與抗氧化劑提供的氫離子相結合,使體系顏色由紫色變為淡黃色,吸光度降低并達到穩定(AH+DPPH自由基→DPPH-H+A·(A為抗氧化劑))[24]。在質量濃度為0.01~100 mg/mL時,正丁醇萃取物DPPH自由基清除率從3.66%增加至94.16%,乙酸乙酯萃取物最高,達56.30%,而石油醚萃取物增長緩慢。如表1所示,正丁醇和乙酸乙酯萃取物清除DPPH自由基的IC50較低(分別為0.07 mg/mL和0.55 mg/mL),即二者清除DPPH自由基能力相近,顯著低于IC50為30.34 mg/mL的石油醚萃取物,尤其是正丁醇萃取物,其DPPH自由基清除能力是石油醚萃取物的400多倍。
2.7 對·OH引起的質粒DNA氧化損傷的保護作用
當氧化應激的誘導劑Fe2+和H2O2混合后,Fenton反應(Fe2++H2O2→Fe3++·OH+-OH)立即發生。其產物·OH能夠對DNA產生攻擊作用,導致超螺旋結構斷裂[25-26]。樣品中的酚類物質能夠通過絡合Fe2+或者清除H2O2,阻止Fenton反應的發生,從而避免DNA損傷。此外酚類物質也能通過直接清除Fenton反應的產物·OH保護DNA。由圖2和表2可見,五味子蜂花粉不同萃取物對·OH引起的質粒DNA氧化損傷均有保護作用。正常質粒DNA在電泳條件下有92.12%是完整的雙鏈DNA,模型組在誘導劑的作用下96.69%的雙鏈DNA被損傷為開鏈狀態。而在最終質量濃度0.27 mg/mL不同蜂花粉萃取物的作用下,開鏈DNA的比例分別降至8.04%、35.56%、47.93%,表明0.27 mg/mL正丁醇萃取物能夠完全保護DNA,防止其受到氧化損傷。乙酸乙酯和石油醚萃取物對DNA氧化損傷均具有一定的保護作用。已有研究證實花粉提取物對DNA氧化應激損傷具有保護作用,Cheng Ni等[27]研究的山里紅蜂花粉粗提物在質量濃度為2.67 mg/mL時質粒DNA損傷比例降至40%左右,可見3 個不同五味子蜂花粉萃取物對·OH引起的質粒DNA損傷的保護作用明顯優于山里紅蜂花粉粗提物。
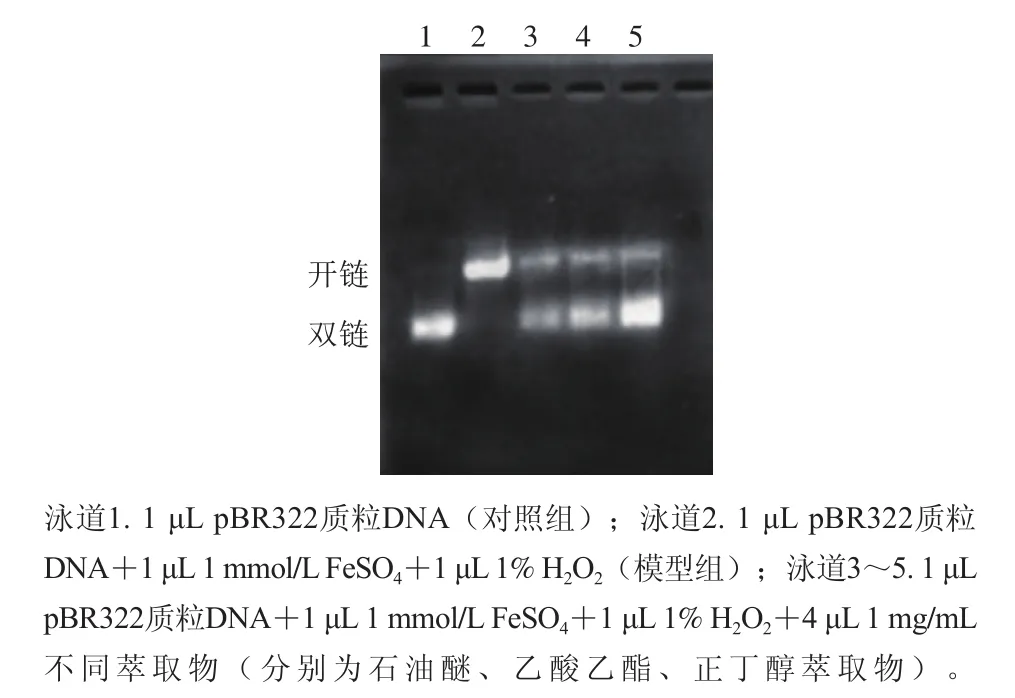
圖2 五味子蜂花粉不同萃取物對·OH引起pBR322質粒DNA斷裂的保護作用Fig. 2 Protective effects of different solvent extracts from S. chinensis bee pollen on hydroxyl radical-mediated pBR322 DNA damage

表2 五味子蜂花粉不同萃取物對·OH引起pBR322質粒DNA斷裂的保護作用Table 2 Protective effects of different solvent extracts from S. chinensis bee pollen on hydroxyl radical-mediated pBR322 DNA damage
2.8 抑制小鼠肝臟脂質過氧化測定結果
在自由基和一些氧化引發劑的作用下,不飽和脂肪酸生成自由基中間產物,進一步形成脂質過氧化物,脂質過氧化反應的終產物是丙二醛,與硫代巴比妥酸反應產生紅色物質,并可通過比色法進行定量分析。因此,丙二醛的含量可以作為脂質過氧化的指標[28-30]。五味子蜂花粉中含有豐富的酚類化合物,其提取物有較強的抗氧化活性,對急性肝毒性具有顯著的保護作用。其保肝作用可能與其自由基清除、增加抗氧化活性和抑制脂質過氧化有關[31]。由圖3可知,不同萃取物對丙二醛的生成均有抑制作用,隨著質量濃度的增加,抑制率也相應升高。正丁醇和乙酸乙酯萃取物的抑制作用較明顯,在質量濃度為0.2 mg/mL時二者分別達到85.5%和80.1%,石油醚萃取物的抑制率隨質量濃度增加而迅速增大,在0.2 mg/mL時接近60%。3 個部位對小鼠肝組織脂質過氧化的抑制率排序為:正丁醇萃取物>乙酸乙酯萃取物>石油醚萃取物。
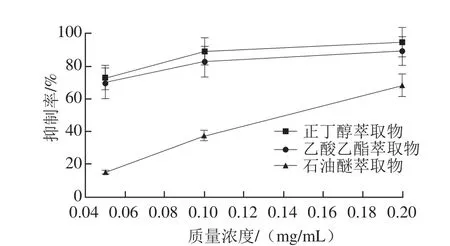
圖3 五味子花粉不同萃取物對脂質過氧化的抑制率Fig. 3 Inhibition percentage of lipid peroxidation by different solvent extracts from S. chinensis bee pollen
3 結 論
本實驗研究了五味子蜂花粉不同萃取物體外抗氧化活性及對小鼠肝臟脂質過氧化的抑制作用和對·OH引起的質粒DNA氧化損傷的保護作用。結果表明,五味子蜂花粉不同極性萃取物的抗氧化活性存在顯著差異,正丁醇萃取物的總酚、總黃酮含量最高,體外抗氧化活性最強,其對小鼠肝臟脂質過氧化的抑制效果及對·OH介導的質粒DNA氧化損傷的保護作用也最強,乙酸乙酯萃取物次之,石油醚萃取物最弱。HPLC分析結果表明,雖然正丁醇萃取物中活性物質種類較少,但含量極高。雖然石油醚層的萃取率最高,但其抗氧化活性最差;正丁醇層的萃取率低于石油醚層,高于乙酸乙酯層。因此,正丁醇萃取物可以作為五味子蜂花粉高抗氧化活性酚類化合物分離純化的基礎。本研究可為新資源食品和新型抗氧化功能食品的開發提供參考依據。

