莫莫格濕地石油污染土壤中耐鹽堿石油烴降解細(xì)菌的降解特性研究
3
(1.長春理工大學(xué) 生命科學(xué)技術(shù)學(xué)院,吉林 長春 130022;2.興安盟農(nóng)牧業(yè)科學(xué)院,內(nèi)蒙古 烏蘭浩特 137400;3.中國科學(xué)院 東北地理與農(nóng)業(yè)生態(tài)研究所,吉林 長春 130102;4.科爾沁右翼前旗農(nóng)牧業(yè)和科學(xué)技術(shù)局農(nóng)業(yè)技術(shù)推廣中心,內(nèi)蒙古 科右前旗 137423)
0 引 言
在石油開采、貯運(yùn)及使用過程中,操作不當(dāng)會引起石油泄漏,對生態(tài)環(huán)境造成嚴(yán)重破壞,甚至威脅人類健康[1]。由石油所引起污染的問題已經(jīng)越來越廣泛被當(dāng)今國際社會所關(guān)注。2011年6月,中國蓬萊19-3油田溢油事故造成海洋及土壤大面積污染,水體、土壤結(jié)構(gòu)的破壞導(dǎo)致動植物生存受到威脅[2];2017年1月,印度恩諾爾港口附近兩艘油輪相撞,約392.8 t重質(zhì)原油泄漏,破壞了海洋生態(tài),并嚴(yán)重影響了海洋生物的生存[3]。中國作為世界第五大石油開采國,由石油所引起的污染問題亟待解決[4]。吉林省西部莫莫格濕地地下蘊(yùn)藏著豐富的石油資源,該濕地內(nèi)吉林油田英臺采油廠所設(shè)立的400多口采油井在使用及操作過程中對濕地土壤造成了嚴(yán)重污染,致使優(yōu)勢植物苔草、小葉章大面積退化,棲息鳥類數(shù)量減少[5]。
當(dāng)石油污染程度超過濕地生態(tài)系統(tǒng)的自我修復(fù)能力,那么緩慢的修復(fù)過程將再一次受到阻礙。在石油污染治理的探索過程中,Oh等[6]利用超聲波法去除淤泥中的多環(huán)芳烴;于一雷等[7]利用植物原位修復(fù)的方法,通過種植堿蓬治理被石油污染的土壤;Tian等[8]利用凝膠珠與根系復(fù)合作用去除土壤中的多環(huán)芳烴。但物理修復(fù)與化學(xué)修復(fù)方法由于前期投入大、復(fù)合材料回收難等問題,在實際修復(fù)過程中難以應(yīng)用。生物修復(fù)是利用生物自凈功能與強(qiáng)化生物凈化功能對污染場地中的污染物進(jìn)行降解的過程,具有成本低,操作簡便,不產(chǎn)生二次污染等優(yōu)點(diǎn)[9-10]。國內(nèi)外學(xué)者在菌株篩選上做了大量工作,許多細(xì)菌、真菌及藻類都有降解多環(huán)芳烴的能力[11],常見的微生物有假單胞菌屬(Pseudomonas)、芽孢桿菌屬(Bacillus)、紅球菌屬(Rhodococcus)、不動桿菌屬(Acinetobacter)和微球菌屬(Micrococcus)等[12-13]。莫莫格濕地石油污染區(qū)的土壤往往具有鹽堿化特征,通常情況下環(huán)境因子(包括鹽濃度、pH、溫度及污染物濃度等)對微生物的代謝活動和生理功能影響較大,因此明確菌株對不同環(huán)境影響因子的響應(yīng)是利用該菌株對石油烴污染進(jìn)行生物修復(fù)的必要前提[14]。
本研究以石油中重要組分之一的多環(huán)芳烴—菲(Phenanthrene,Phe)為唯一碳源,輔以鹽堿脅迫條件[15],從莫莫格濕地石油污染土壤中篩選分離出一株在鹽堿環(huán)境下對Phe具有降解能力的鹽單胞菌(Holomonas)S1-8菌株,并對篩選的Holomonassp.S1-8菌株進(jìn)行降解條件優(yōu)化及降解能力測定,探討其在鹽堿脅迫下的降解動力學(xué)特征。結(jié)果表明菌株S1-8對鹽堿環(huán)境具有良好的適應(yīng)性,在生物修復(fù)被石油污染的鹽堿土壤中具有潛在的應(yīng)用前景。
1 材料與方法
1.1 研究區(qū)
本研究中土壤樣本來源于吉林油田分公司英臺采油廠,位于莫莫格國家自然保護(hù)區(qū)境內(nèi),地處嫩江、洮兒河和呼爾達(dá)河交叉地帶。莫莫格國家級自然保護(hù)區(qū)(45°42′25″~46°18′0″N,123°27′0″~124°4′33″E)位于吉林省西部,總面積14.4萬hm2,其中濕地面積占全區(qū)總面積的80%以上,莫莫格濕地是我國重要的候鳥繁殖地與跨國遷徙鳥類的停歇地,是我國主要的鹽堿土地分布地之一。
1.2 采樣點(diǎn)設(shè)置及樣品采集
在莫莫格濕地內(nèi)吉林油田主要產(chǎn)油區(qū)(該區(qū)為石油污染較為嚴(yán)重的區(qū)域)隨機(jī)設(shè)置一個采樣點(diǎn)(45°55′N,123°55′E)。在采樣點(diǎn),去除土壤表面雜物后采集0~20 cm深度土壤樣本,將土樣裝入無菌密封袋內(nèi)帶回實驗室。
1.3 實驗試劑
試劑盒:Axygen細(xì)菌基因組DNA小量制備試劑盒、Axygen PCR試劑盒(康寧生命科學(xué)有限公司)和菲(分析純AR,上海麥克林生化科技有限公司)。
磷酸鹽緩沖液:pH 7.2、NaCl (8.0 g·L-1)、KCl (0.2 g·L-1)、Na2HPO4(3.4 g·L-1)和KH2PO4(0.2 g·L-1)。
LB培養(yǎng)基:NaCl(10.0 g·L-1)、胰蛋白胨(10.0 g·L-1)和酵母提取物(5.0 g·L-1)(Oxoid, Thermo Fisher Scientific)。
無機(jī)礦物鹽培養(yǎng)基:Na2HPO4·12H2O (17.9 g·L-1)、NaH2PO4·2H2O (7.8 g·L-1)、(NH4)2SO4(5.0 g·L-1)、KCl (5.0 g·L-1)、ZnSO4·7H2O(0.1 g·L-1)、MnCl2·4H2O(0.03 g·L-1)、CoCl2·6H2O(0.2 g·L-1)、CuCl2·2H2O(0.01 g·L-1)、NiCl2·6H2O(0.02 g·L-1)、NaMoO4·2H2O(0.03 g·L-1)、FeSO4·7H2O(0.2 g·L-1)和H3BO3(0.3 g·L-1)(國藥集團(tuán)化學(xué)試劑有限公司)。
Agilent氣相色譜(6890)-質(zhì)譜(7000)聯(lián)用儀。
1.4 實驗方法
1.4.1 土壤理化性質(zhì)。土樣風(fēng)干后過2 mm篩子備用。土壤pH用pH計法[16];土壤Na+采用火焰光度法測定。
1.4.2 菌株的篩選。取10 g新鮮土壤樣本,90 mL無菌生理鹽水,置于滅菌三角瓶內(nèi),在搖床中30 ℃ 170 rpm震蕩15 min后,靜置,取1 mL上清液加入到20 mL以Phe為唯一碳源且含5% NaCl、pH 8.0的無機(jī)礦物培養(yǎng)基中,170 rpm,30 ℃培養(yǎng)7 d,篩選出能夠降解Phe的耐鹽堿菌株。
1.4.3 菌株鑒定及菌懸液制備。在LB固體培養(yǎng)基上稀釋涂平板并劃線與細(xì)菌掃描電鏡樣品的制備[17]。
1.4.4 菌株分子生物學(xué)鑒定。PCR擴(kuò)增菲降解菌株16S rRNA基因及其PCR產(chǎn)物測序分析。菲降解菌株DNA擴(kuò)增通用引物為p27f (5′-AGAGTTTGATCCTGGCTCAG-3′)和p1492r (5′-ACGGHTACCTTGTTTACGA-CTT-3′),在包含2 μL 2×Eassy Taq PCR SuperMix (TransGen Biotech 2×Easy Taq PCR SuperMix,CA)、2 μL PCR引物(27F and 1492R)及1 μL DNA 模板的50 μL PCR反應(yīng)體系中,采用細(xì)菌PCR反應(yīng)條件進(jìn)行擴(kuò)增(預(yù)變性:94 ℃下5 min;該擴(kuò)增程序進(jìn)行30次循環(huán):變性94 ℃下45 s,退火55 ℃下45 s,延伸72 ℃下60 s;最終延伸:72 ℃下10 min,4 ℃下保溫,終止流程),進(jìn)行PCR擴(kuò)增。將純化后的PCR產(chǎn)物使用Sanger測序法進(jìn)行雙端測序(上海生工生物技術(shù)有限公司)。測序結(jié)果與GenBank中已有的16S rRNA基因序列進(jìn)行BLAST(http://www.ncbi.nlm.nih.gov/blast)比對。
1.4.5 不同培養(yǎng)條件下菌株對Phe的降解效率研究。下列所有實驗中菌懸液的制備按照此標(biāo)準(zhǔn):在無菌條件下將篩選得到的菌株接種到LB液體培養(yǎng)基中培養(yǎng)過夜,離心收集菌體,并用無菌生理鹽水反復(fù)洗滌3次,經(jīng)無機(jī)礦物鹽培養(yǎng)基重懸后,將菌懸液調(diào)至所需濃度備用。
不同取樣時間和鹽濃度條件下菲降解菌株對Phe的降解效率及其降解動力學(xué)研究。由于篩選菌株的土樣Na+含量較高,本研究中設(shè)置7個不同鹽濃度(0、2%、5%、10%、15%、20%和30%的NaCl)培養(yǎng)條件,研究菲降解菌對Phe的降解能力。按5%的接種量接種到20 mL初始添加濃度為50 mg·L-1Phe的無機(jī)礦物鹽培養(yǎng)基中,使培養(yǎng)基中菌液初始添加濃度OD600為0.2,分別在不同鹽濃度條件下30 ℃震蕩培養(yǎng)15 d;在培養(yǎng)1 d、3 d、5 d、7 d、10 d和15 d時,檢測不同培養(yǎng)時間下培養(yǎng)液中Phe的殘留量,最終計算出菲降解菌在不同培養(yǎng)時間對Phe的降解率;根據(jù)Phe降解率研究其在不同鹽濃度條件下的降解動力學(xué)。本研究中降解實驗均設(shè)立3組平行。
不同pH條件下菲降解菌對Phe的降解效率。利用HCl或NaOH調(diào)節(jié)最適生長的鹽濃度培養(yǎng)液的pH,在6個不同pH梯度(6.0、7.0、8.0、9.0、10.0和11.0)且Phe的初始添加濃度為50 mg·L-1的無機(jī)礦物鹽培養(yǎng)基中接入菌液,使細(xì)菌初始添加濃度OD600為0.2,30 ℃震蕩培養(yǎng)15 d,研究菲降解菌在不同pH條件下對Phe的降解能力。
不同溫度條件下菲降解菌對Phe的降解效率。在最適生長的鹽濃度和pH的無機(jī)礦物鹽培養(yǎng)液中接入菌液,使培養(yǎng)基中細(xì)菌初始添加濃度OD600為0.2,在5個不同溫度(15 ℃、20 ℃、25 ℃、30 ℃和35 ℃)且Phe的初始添加濃度為50 mg·L-1條件下,震蕩培養(yǎng)15 d,研究菲降解菌在不同培養(yǎng)溫度條件下對Phe的降解能力。
不同Phe初始濃度條件下菲降解菌對Phe的降解效率。確定最適生長的鹽濃度、pH和溫度的條件下,在5個不同Phe初始添加濃度(25、50、100、150和200 mg·L-1)的無機(jī)礦物鹽培養(yǎng)液中接入菌液,使培養(yǎng)基中菌液初始添加終濃度OD600為0.2,30 ℃震蕩培養(yǎng)15 d,研究菲降解菌在Phe不同初始添加濃度條件下對Phe的降解能力。
1.4.6 溶液中Phe的提取與定量分析。殘留Phe的提取。將培養(yǎng)基全部轉(zhuǎn)入分液漏斗后,用10 mL正己烷分3次清洗三角瓶并將正己烷全部轉(zhuǎn)至分液漏斗中,將分液漏斗置于分液漏斗振蕩器上,270 rpm充分震蕩10 min,靜置,將培養(yǎng)基中剩余Phe萃取至有機(jī)相中,收集有機(jī)相。取有機(jī)相溶液過0.22 μm尼龍濾膜,將濾液用色譜純正己烷稀釋10倍,待測。
GC-MS檢測。配制Phe濃度分別為1 mg·L-1、3 mg·L-1、5 mg·L-1、7 mg·L-1、10 mg·L-1和15 mg·L-1的正己烷標(biāo)準(zhǔn)樣品,利用Agilent氣相色譜-質(zhì)譜聯(lián)用儀(GC-MS),設(shè)置樣品檢測條件后進(jìn)行實際樣品的檢測,根據(jù)標(biāo)準(zhǔn)樣品的濃度與積分峰面積制作標(biāo)準(zhǔn)曲線[18]。
在動力學(xué)的研究中,生物降解的過程是單反應(yīng)物反應(yīng)體系,故選擇一級動力學(xué)模型進(jìn)行降解動力學(xué)的研究[19]。研究表明,微生物降解動力學(xué)可以用Logistic模型、零級及一級反應(yīng)模型等多種模型來描述,當(dāng)污染物初始濃度較高時,一級反應(yīng)模型能夠較好的模擬微生物降解動力學(xué)過程[20]。在Phe作為唯一碳源的無機(jī)礦物鹽培養(yǎng)基中,菲降解菌生長過程中對NaCl濃度的敏感影響著一系列的反應(yīng),本研究采用Langmuir-Hinshelwoood模型來描述在不同鹽濃度條件下S1-8降解Phe的動力學(xué)。一級動力學(xué)方程為:
lnC=-kt+lnC0
式中:k表示一級動力學(xué)速率常數(shù)(d-1);C為t(d)時刻Phe濃度(mg·L-1);C0為初始Phe濃度(mg·L-1)。
1.4.7 數(shù)據(jù)統(tǒng)計分析。將16S rRNA基因序列比對結(jié)果,用MEGA 6.0軟件構(gòu)建菲降解菌株系統(tǒng)發(fā)育樹。用Microsoft Excel 2010版繪制標(biāo)準(zhǔn)曲線,并計算Phe降解率。用Origin 8.0軟件繪制Phe降解率曲線并研究Phe降解動力學(xué)模型。
2 結(jié)果與討論
2.1 耐鹽堿Phe降解菌株的分離、篩選與鑒定結(jié)果
本研究采集土壤樣本的pH為8.51,Na+含量為21.3 g·kg-1。利用Phe為唯一碳源,輔以鹽堿脅迫對土壤樣品中的微生物進(jìn)行富集培養(yǎng),并對富集的微生物進(jìn)行分離和純化,最終篩選到一株耐鹽堿的菲降解細(xì)菌,命名為S1-8。圖1為菌株S1-8在LB固體培養(yǎng)基上的菌落形態(tài)(圖1a)及掃描電鏡照片(圖1b)。結(jié)果表明:菌落形態(tài)為圓形,表面光滑且邊緣整齊,微微凸起(圖1a);細(xì)菌呈桿狀且表面光滑(圖1b)。

圖1 鹽單胞菌S1-8在LB培養(yǎng)基上的菌落形態(tài)圖(a)和掃描電鏡圖片(b)Fig.1 Morphological properties of Halomonas sp.S1-8 by the observation of LB agar plate (a) and scanning electron microscopy(b)
經(jīng)PCR擴(kuò)增獲得菌株S1-8 16S rRNA基因片段,約為1 500 bp。將獲得的序列在NCBI網(wǎng)站上進(jìn)行BLAST比對,結(jié)果顯示S1-8與Halomonasvariabilis(HTG7AY204638.1)的相似度最高(99%),表明該菌為Halomonas菌屬。選取12株Halomonas代表菌株作為參考菌株,采用鄰接法構(gòu)建S1-8的系統(tǒng)發(fā)育樹(圖2),結(jié)合細(xì)菌形態(tài)并分析其系統(tǒng)發(fā)育樹,明確該菌株屬于鹽單胞菌屬(Halomonas),故將其命名為Halomonassp.S1-8 (NCBI注冊號為MK326897)。
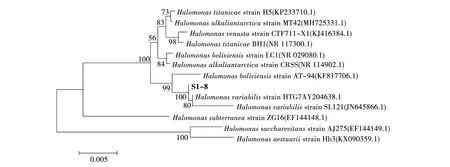
圖2 利用鄰接法構(gòu)建菌株S1-8的系統(tǒng)發(fā)育樹Fig.2 Phylogenetic tree of the S1-8 strain constructed by Neighbor-joining method
2.2 菌株培養(yǎng)條件優(yōu)化及降解能力測定
2.2.1 鹽濃度對菌株S1-8降解Phe效率的影響。如圖3所示,S1-8在Phe降解過程中,NaCl濃度顯著影響其對Phe的降解過程。當(dāng)NaCl濃度低于5%時, Phe的降解率與鹽濃度呈正相關(guān)關(guān)系,隨著鹽度的升高,各個時期Phe的降解速率增加,降解率增大,同時結(jié)果表明在鹽濃度為5%的條件下培養(yǎng)15 d后,Phe的降解率最高,達(dá)到74%;當(dāng)鹽濃度高于5%,隨著鹽濃度由10%增加至30%,S1-8各個時期的降解率明顯下降,菌株的降解效果隨著鹽度的增加受到了明顯的抑制,在鹽度為30%條件下,Phe的降解率降低至41%。該實驗結(jié)果表明,菌株S1-8對鹽濃度具有較廣的適應(yīng)范圍,并在試驗鹽濃度條件下均可有效發(fā)揮其對Phe的降解功能,但降解能力受鹽度高低的影響。周海燕[21]在研究中發(fā)現(xiàn),嗜鹽菌株TSL5-1、TSL5-2耐鹽范圍較廣,在0.5%~19.5%鹽度范圍內(nèi)均對芘具有降解能力,但其最適降解鹽度僅為3%~5%,且微生物在生長過程中,通常對鹽的耐受性不高,鹽濃度較低時,微生物生長速率與鹽濃度呈正相關(guān)關(guān)系,但當(dāng)鹽濃度超過一定限度,微生物生長則變得較為緩慢,甚至死亡。苗朝華[22]在研究中發(fā)現(xiàn)對鹽度適應(yīng)范圍較廣的中度嗜鹽菌黃河鹽單胞菌,能夠在鹽含量為0.5%~25%的LB培養(yǎng)基中生長,并對其復(fù)雜的鹽適應(yīng)機(jī)制進(jìn)行探究。張海榮等[23]在石油污染鹽堿土壤中篩選得到10株耐鹽堿石油烴降解菌,菌株對鹽濃度的耐受濃度均在5%左右,當(dāng)鹽濃度高于11%時菌株的生長活性呈下降趨勢,因此過高的鹽濃度對菌株的生長具有一定的抑制作用。在鹽單胞菌的研究中,研究者們發(fā)現(xiàn)該種屬細(xì)菌的不同菌株對鹽濃度具有較廣的適應(yīng)范圍,在適宜的鹽度范圍內(nèi),鹽度對其生理代謝功能影響較小,超過最適鹽度,其生理活性會隨著鹽度的增加而降低。
2.2.2 pH對菌株S1-8降解Phe效率的影響。pH是微生物生長代謝的主要影響因素之一,環(huán)境pH對微生物的生物活性有很大的影響,同時微生物對pH適應(yīng)范圍廣,在一定程度上說明微生物對環(huán)境適應(yīng)能力更強(qiáng)[24]。因此,研究菌株最適生長的pH在微生物生長代謝中至關(guān)重要。李丹丹等[25]在莫莫格石油污染土壤中分離出的假單胞菌,在偏酸性pH 6.5時對石油烴降解率最高。從圖4中可以看出,S1-8 在無機(jī)礦物鹽培養(yǎng)基的pH為6.0~11.0時均具有對Phe的降解能力。pH為6.0時,培養(yǎng)15 d后Phe的降解率達(dá)到55%,隨著pH增加,菌株S1-8對Phe的降解率也在增加,直至pH達(dá)到8.0時,菌株15 d內(nèi)對Phe的降解率達(dá)到峰值,約為74%。隨著pH的繼續(xù)提高, S1-8對Phe的降解能力顯著下降,但當(dāng)pH達(dá)到10.0以上時,pH對菌株降解Phe能力的影響差異不顯著。上述結(jié)果說明菌株S1-8具有較強(qiáng)的環(huán)境適應(yīng)能力且在弱堿性環(huán)境中可獲得對Phe的最高降解率,但在弱酸和強(qiáng)堿環(huán)境中S1-8對Phe的降解率相對較低。
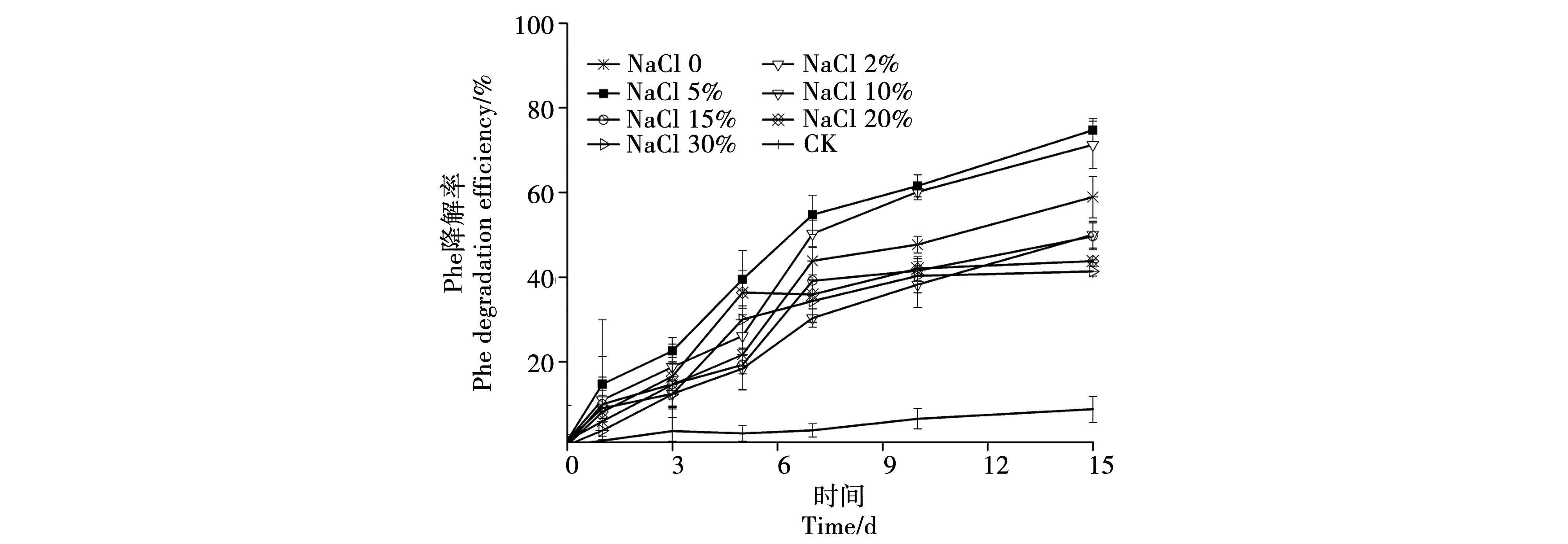
注:溫度:30 ℃;Phe初始濃度:50 mg·L-1;pH 8.0;菌液初始添加OD600=0.2。Note:Temperature: 30 ℃;Initial concentrations of Phe:50 mg·L-1;pH 8.0;OD600=0.2.圖3 S1-8在不同鹽濃度下各時間點(diǎn)對Phe的降解效率Fig.3 Degradation efficiency of S1-8 for Phe at different incubation time under different salt concentrations
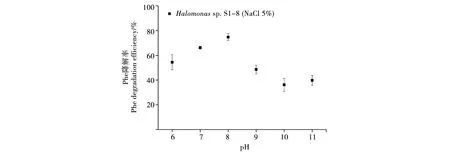
注:溫度:30 ℃;Phe初始濃度:50 mg·L-1;鹽濃度:5%;菌液初始添加OD600=0.2。Note:Temperature: 30 ℃;Initial concentrations of Phe:50 mg·L-1;Salt concentration: 5%;OD600=0.2.圖4 S1-8在不同pH條件下培養(yǎng)15 d后對Phe的降解效率Fig.4 Degradation efficiency of S1-8 for Phe after incubation for 15 days under different pH
2.2.3 溫度對菌株S1-8降解Phe效率的影響。溫度也是影響微生物活性的重要因素之一,Phe的降解效果間接地受到了溫度的影響[26]。本研究中,S1-8菌株在鹽濃度為5%,pH為8.0的條件下,選擇15 ℃、20 ℃、25 ℃、30 ℃和35 ℃這5個溫度條件培養(yǎng)15 d后,結(jié)果如圖5所示,S1-8能夠在溫度為15 ℃~35 ℃環(huán)境中生長,尤其是在30 ℃培養(yǎng)條件下,Phe最終降解率約為74%;該菌株在常溫條件下篩選分離獲得,在15 ℃和20 ℃時,由于培養(yǎng)溫度較低,菌株的降解能力并不突出,可能該菌株對低溫較為敏感,對降解率的影響較大;當(dāng)在25 ℃和35 ℃溫度條件下培養(yǎng)15 d,降解效率分別達(dá)到51%和48%,說明在25 ℃~35 ℃為菌株適宜生長的溫度區(qū)間,在該溫度區(qū)間下S1-8對Phe的降解能力較高。
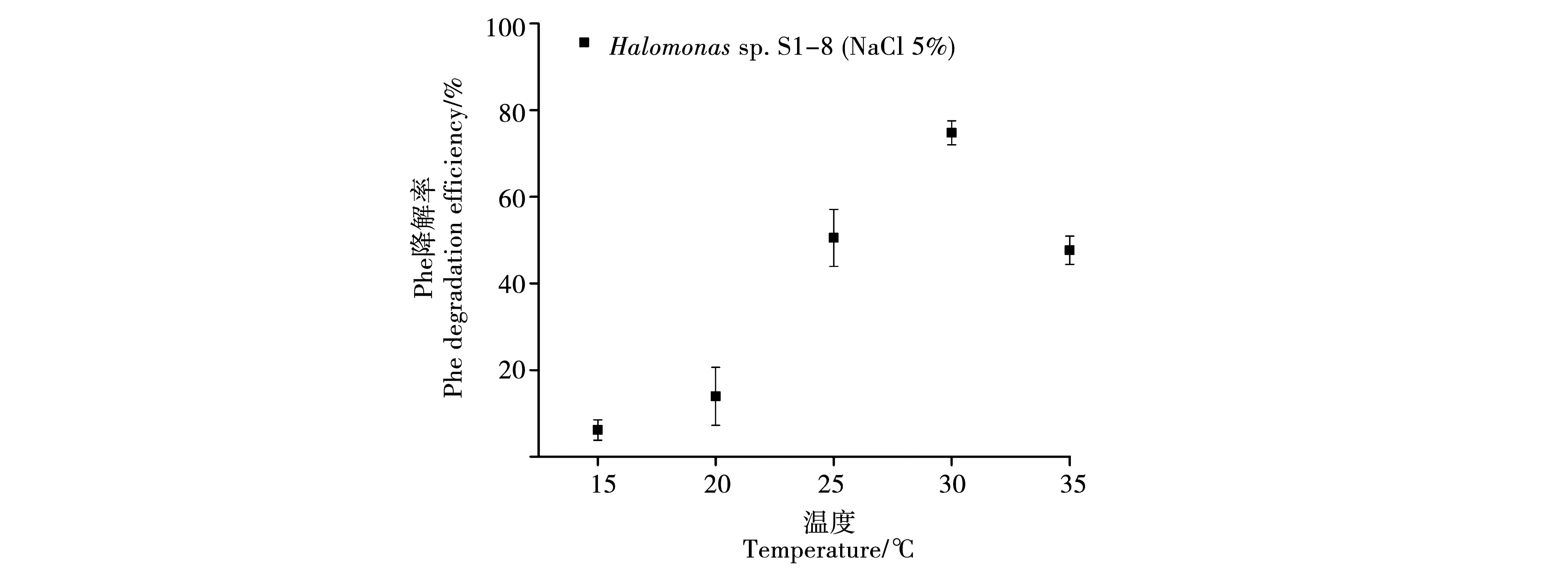
注: Phe初始濃度:50 mg·L-1;pH 8.0;鹽濃度:5%;菌液初始添加OD600=0.2。Note:Initial concentrations of Phe: 50 mg·L-1;pH 8.0; Salt concentration: 5%; OD600=0.2.圖5 S1-8在不同溫度下培養(yǎng)15 d對Phe的降解效率Fig.5 Degradation efficiency of S1-8 for Phe after incubation for 15 days under different temperature
2.2.4 Phe初始濃度對菌株S1-8降解Phe效率的影響。不同Phe初始濃度對微生物降解Phe的效率影響很大。當(dāng)Phe初始濃度較低時,有利于微生物對多環(huán)芳烴的降解;而當(dāng)Phe初始濃度較高時,微生物對多環(huán)芳烴的降解能力降低,高濃度的Phe使細(xì)胞代謝受到抑制,對微生物的生長產(chǎn)生抑制作用,從而降低了微生物對Phe的降解能力。當(dāng)Phe初始添加量為25 mg·L-1、50 mg·L-1時,由于低濃度的Phe對菌株無明顯的抑制效果,菌株可以較好地發(fā)揮降解功能,其降解效率較高。隨著Phe初始添加量增加至100 mg·L-1,Phe對菌株的脅迫增強(qiáng),Phe的降解率呈現(xiàn)下降趨勢;當(dāng)Phe初始濃度增加至150~200 mg·L-1時,高濃度的Phe對菌體抑制更加嚴(yán)重,降解率進(jìn)一步降低。隨著Phe初始濃度的提高其降解率由最高74%降至7%。這和宋立超[27]的研究結(jié)果具有一致性,即在Phe初始濃度達(dá)到75 mg·L-1時降解率急劇下降。由此可見,底物濃度過高會對微生物降解Phe產(chǎn)生阻礙作用。一方面,由于Phe具有較強(qiáng)的疏水作用,高濃度Phe不利于微生物對溶解氧的獲取,影響微生物對Phe的代謝作用;另一面,高濃度Phe及其中間代謝產(chǎn)物可能會對微生物可產(chǎn)生一定的毒害作用。因此,盡管菌株S1-8對Phe具有一定的濃度耐受性,但其耐受程度是有限的,而事實上,除了Phe泄露區(qū)或石油泄漏核心區(qū),很少有環(huán)境中有極高濃度的Phe存在,因此,大多數(shù)的菲降解菌仍可發(fā)揮其功能。
2.3 不同鹽濃度條件下菌株S1-8的降解動力學(xué)
在pH 8.0的堿性環(huán)境中,輔以不同鹽濃度脅迫,菌株S1-8對Phe的降解擬合線性圖如圖7所示,由圖可看到擬合的一級降解模型較好,可以很好地反映菌株在不同鹽濃度條件下的降解能力。由表1擬合參數(shù)可知,在20%、30%高鹽濃度條件下,由于微生物對Phe的利用受到抑制,使S1-8對Phe的降解率顯著降低,在這兩個鹽濃度條件下R2較低;其余5個鹽濃度條件下的R2均在0.92之上,說明該方程可較好地擬合菌株S1-8在不同鹽濃度條件下的對Phe的降解過程,為菌株S1-8生物降解Phe的工程化應(yīng)用等方面的研究起到重要的指導(dǎo)作用。
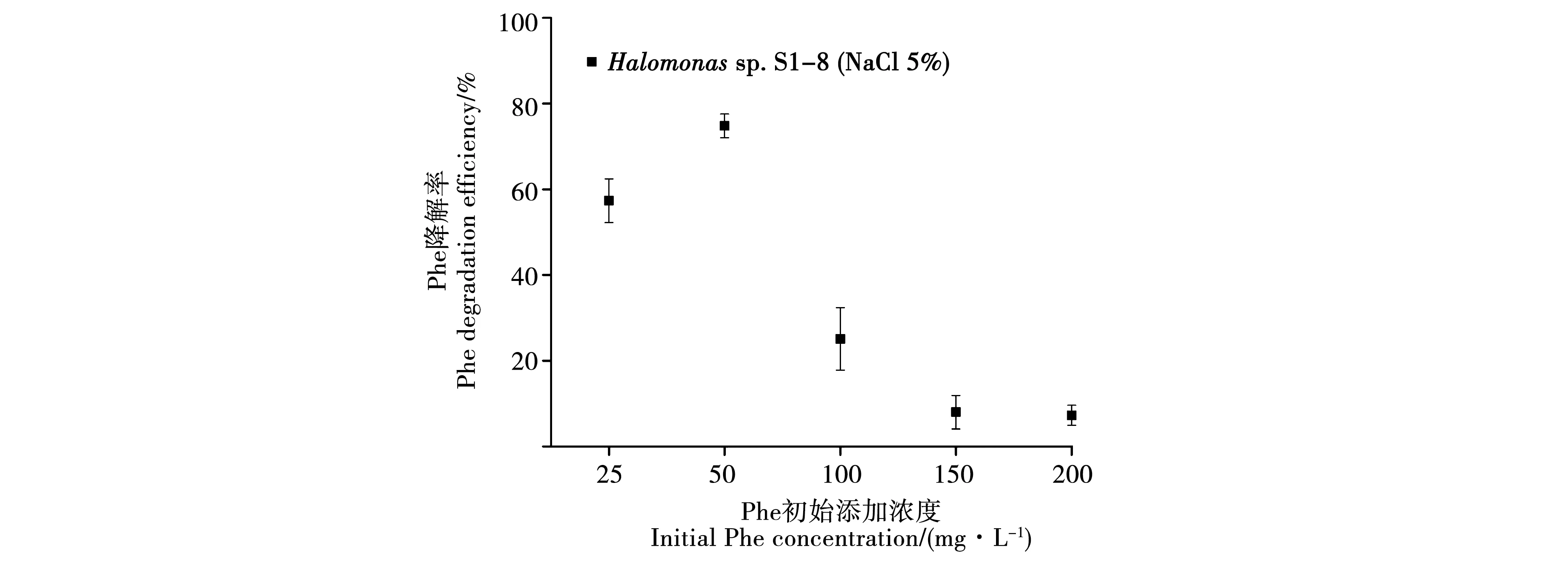
注:溫度:30 ℃;鹽濃度:5%;pH 8.0;菌液初始添加OD600=0.2。Note: Temperature: 30 ℃; Salt concentration: 5%;pH 8.0; OD600=0.2.圖6 S1-8在不同Phe初始濃度條件下培養(yǎng)15 d對Phe的降解效率Fig.6 Degradation efficiency of S1-8 for Phe after incubation for 15 days under different initial concentrations of Phe
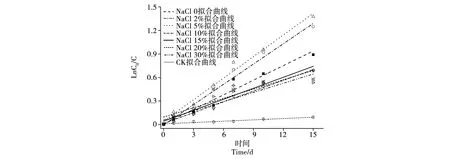
圖7 菌株S1-8降解Phe的準(zhǔn)一級動力學(xué)擬合曲線Fig.7 Curves of the first-order kinetics of Phe biodegradation by strain S1-8
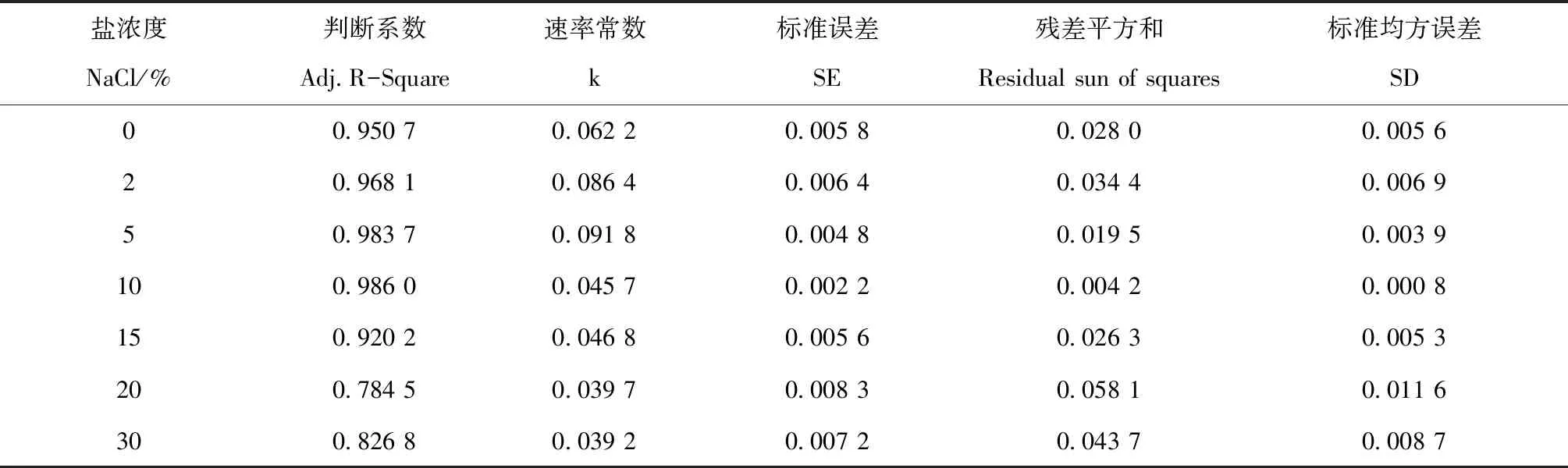
鹽濃度NaCl/%判斷系數(shù)Adj.R-Square速率常數(shù)k標(biāo)準(zhǔn)誤差SE殘差平方和Residual sun of squares標(biāo)準(zhǔn)均方誤差SD00.950 70.062 20.005 80.028 00.005 620.968 10.086 40.006 40.034 40.006 950.983 70.091 80.004 80.019 50.003 9100.986 00.045 70.002 20.004 20.000 8150.920 20.046 80.005 60.026 30.005 3200.784 50.039 70.008 30.058 10.011 6300.826 80.039 20.007 20.043 70.008 7
3 結(jié) 論
本研究中耐鹽堿Phe降解菌篩選分離自莫莫格濕地被石油污染的土壤,確定該石油烴降解菌為鹽單胞菌,將其命名為Halomonassp.S1-8。菌株S1-8對鹽濃度及環(huán)境酸堿度具有較廣的適應(yīng)范圍,分別為鹽度0~30%和pH 6.0~11.0。在初始鹽濃度為5% ,pH為8.0,培養(yǎng)溫度為30℃條件下,菌株S1-8對Phe的降解達(dá)到較為理想的效果,且該降解過程符合一級動力學(xué)模型。菌株S1-8最適生長的鹽濃度及酸堿環(huán)境均接近于莫莫格濕地石油污染土壤的化學(xué)指標(biāo),將該地區(qū)土壤中篩選分離獲得的土著菌株應(yīng)用于石油污染土壤的原位修復(fù),亦能夠更好地發(fā)揮菌株對石油污染物的降解特性。Halomonassp.S1-8是一株性能優(yōu)良的可用于莫莫格濕地石油污染土壤修復(fù)的土著菌株。

