核酸適配體在食源性致病菌檢測中應用的研究進展
胡金強,黃潤娜,王 一,趙衛東,高 輝,姜春鵬,耿 堯,景建洲,董彩文,王章存
(1.鄭州輕工業學院,食品與生物工程學院,河南鄭州 450000; 2.河南省食品安全國際聯合實驗室,河南鄭州 450000; 3.食品生產與安全河南省協同創新中心,河南鄭州 450000; 4.河南省冷鏈食品質量安全控制重點實驗室,河南鄭州 450000)
近年來,國內外食品安全事件層出不窮,食源性致病菌在全世界廣泛分布并每年造成成千上萬例人類疾病。據WHO公布的信息,全球每年發生食源性疾病達數10億起。美國疾病控制與預防中心估計,每年約有4800萬例食源性疾病患者,其中12.8萬人入院治療,3000人死亡[1]。據報道,2018年4月,美國農業部(USDA)宣布召回得克薩斯州標準肉制品公司生產的約5.3萬磅可能受沙門氏菌污染的生牛肉產品[2];同月,美國食品與藥物管理局(FDA)宣布,美國北卡羅來納州海德縣一家養雞場自愿召回2.07億枚懷疑被沙門氏菌污染的雞蛋[3]。在我國,威脅食品安全的最大問題同樣是致病微生物引起的食品污染。據國家衛計委通報,2015年度,我國微生物性食物中毒人數高達3181人,占全年食物中毒總人數的53.7%,為食物中毒人數之最[4]。以上數據表明,食源性致病菌污染已成為食品安全的首要隱患,是世界頭號食品安全問題,迫切需要建立快速、靈敏、特異、高效的檢測技術對食源性致病菌進行預防、控制以及風險評估。
目前針對食品中致病菌檢測,主要采用傳統(改進)培養鑒定技術[5]、PCR及其衍生技術[6-8]以及免疫學檢測技術[9]等手段。然而,傳統檢測技術檢測周期長、靈敏度不高、樣品處理繁瑣;PCR及其衍生技術使用的儀器昂貴、檢測易出現假陽性結果;免疫學檢測技術存在抗體制備周期長、成本高等缺陷,已不能滿足食品安全對食源性致病菌進行快速、靈敏、特異檢測的需求[10]。
核酸適配體是一段能特異性識別并結合靶分子的15~40個堿基寡核苷酸片段[11]。核酸適配體的概念在1990年由Ellington和Szostak[12]最早提出并命名,同年,Tuerk與Gold[13]首次提出這種新的體外篩選與擴增核酸的方法-指數富集配體系統進化技術(System aticevolution ofligandsby exponential enrichment,SELEX),并且利用該技術篩選出可與T4 DNA聚合酶特異性結合的隨機寡核苷酸。迄今為止,已有200多種靶物質的核酸適配體得到篩選[14]。核酸適配體可有效識別如生物大分子[15]、細菌[16]、細胞[17]、小分子[18]、病毒[19]等各種目標物,具有篩選周期短、高親和性、高特異性以及適用范圍廣泛等技術優勢,已在重金屬與抗生素檢測[20]、藥物篩選[21]、物質分離與純化以及疾病診斷與治療[22-23]以及食源性致病菌檢測[24]等領域得到廣泛應用。本文主要從核酸適配體的篩選技術分類以及在食源性致病菌檢測中的應用等方面進行簡要概述。
1 適配體的篩選技術分類
目前,根據篩選過程中是否涉及序列擴增富集,適配體篩選技術主要可分為SELEX和Non-SELEX兩大類。
1.1 SELEX篩選適配體
當前,多數適配體采用SELEX技術進行篩選。SELEX主要包括毛細管電泳-SELEX(Capillary electrophoresis SELEX)、親和層析-SELEX、全細胞-SELEX、磁珠-SELEX、微流控-SELEX等方法。核酸適配體篩選過程主要包括4個步驟:a.建立文庫:人工合成一個含核酸序列數大約為1013~1015的單鏈隨機寡核苷酸文庫;b.孵育:將靶標與建立的文庫在一定條件下孵育,形成適配體-靶標復合物;c.分離:孵育后,通過離心、濾膜過濾等分離方法使與靶標結合力強與未結合(結合力弱)的核酸序列進行分離;d.擴增:分離后的DNA或RNA序列經PCR(RT-PCR)進行擴增,擴增產物經分離與純化,制備次級文庫,進行下一輪篩選。經數輪篩選后可得到高親和力與高特異性的適配體[25]。針對食源性致病菌適配體的SELEX篩選主要采用全細胞-SELEX、磁珠-SELEX、親和層析-SELEX等技術方法。
全細胞-SELEX是以全細胞作為靶物質,在一定程度上拓寬了SELEX篩選靶標范圍,而且避免了靶標的純化過程。磁珠-SELEX具有球形展示面,便于靶標展示以及具有便捷的磁性分離特性。親和層析-SELEX篩選技術不僅具有成本低、重復性等特點,而且可用來研究靶分子的結合位點。
1.2 Non-SELEX篩選適配體
Non-SELEX由Berezovski等[26]首次提出并應用于h-RAS蛋白適配體篩選,與SELEX不同的是,Non-SELEX是以縮短篩選周期為目的的高效篩選方法,不需要進行PCR等核酸序列擴增步驟,經過2~3次分離、分析篩選步驟后直接可得到適配體序列。Kim等[34]利用平衡混合物的非平衡毛細管電泳篩選方法經3輪Non-SELEX篩選便得到了能特異性結合大腸桿菌O55∶B5脂多糖的適配體。常規SELEX篩選技術通常需要經過8~15輪篩選,篩選周期為1~3個月,與之相比,Non-SELEX篩選技術可在幾天甚至幾小時內完成適配體篩選全過程,極大地縮短了篩選周期。然而,Non-SELEX篩選技術需要利用毛細電泳儀進行篩選,有一定局限性,多用于大分子物質的適配體篩選。
截止目前,通過SELEX與Non-SELEX已篩選適用于大腸桿菌[27-34]、沙門氏菌[35-44]、金黃色葡萄球菌[45-52]、副溶血弧菌[41,53-54]、單核增生李斯特菌[55-56]、蠟樣芽孢桿菌[57]、志賀氏菌[58-59]以及銅綠假單胞菌[60]等諸多食源性致病菌適配體(表1)。此類適配體可直接用于構建基于適配體的快速、靈敏、特異的食源性致病菌檢測技術。
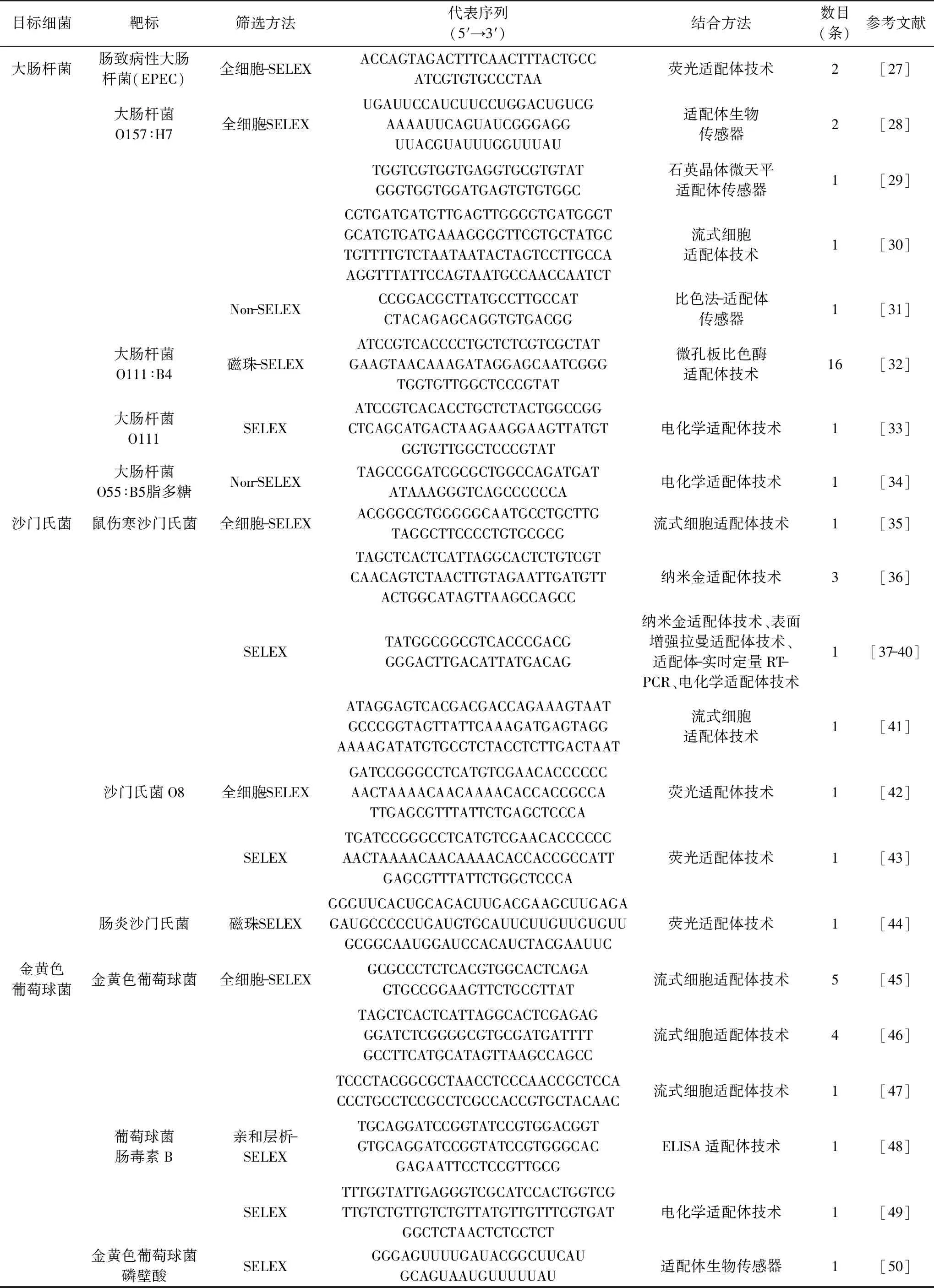
表1 食源性致病菌檢測相關適配體Table 1 Aptamers for the detection of foodborne pathogens
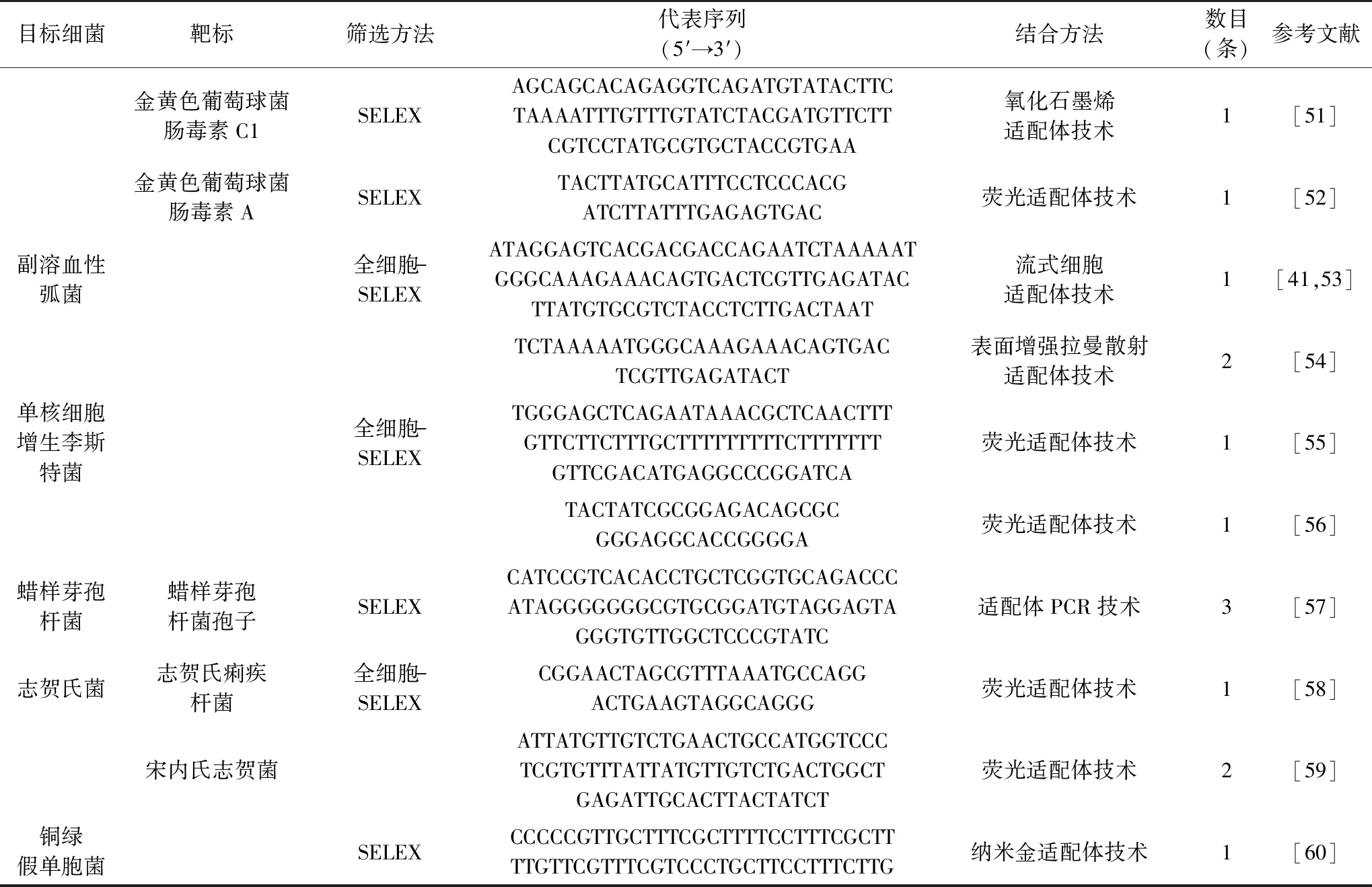
續表
2 適配體在食源性致病菌檢測中的應用
2.1 納米金適配體技術
納米金為直徑在1~100 nm之間的納米材料。納米金由于簡便的制備方法、良好的生物相容性、優異的催化活性、獨特的物理與光學性質等優點,已成為當前的研究熱點[61]。適配體與納米金技術結合可構建高靈敏度、高特異性快速檢測技術,適配體與納米金在溶液中結合,當靶目標存在時,適配體作為識別與捕獲因子特異性地結合目標菌,引起納米金狀態發生改變。基于狀態變化,可對靶目標進行定性與定量分析。目前,納米金適配體技術已應用于銅綠假單胞菌[60]和鼠傷寒沙門氏菌等食源性致病菌[37]的檢測。將銅綠假單胞菌的適配體與超順磁性氧化鐵納米粒子共價結合建立方法,在加入目標菌后通過測量自旋-自旋弛豫時間(T2)的增加可以對靶物質進行定量測定,已應用于雞肉與飲用水樣品中銅綠假單胞菌檢測,該方法可以在40 min內完成檢測,檢測限為50 CFU/mL[60],該方法具有靈敏度高,操作簡捷,反應迅速和良好選擇性等優點,可實現對復雜食品基質中的銅綠假單胞菌進行快速檢測,然而缺點是儀器昂貴,不適合現場檢測。此外,可將適配體作為識別與捕獲元素,結合納米金標銀增強信號放大技術,可實現對鼠傷寒沙門氏菌的可視化檢測。在最佳條件下,菌液濃度為101~106CFU/mL(R2=0.9913)時,鼠傷寒沙門氏菌濃度與信號強度呈線性相關,檢測限為7 CFU/mL[37],該方法檢測結果與傳統檢測法一致,可對實際食品樣品中的鼠傷寒沙門氏菌進行靈敏、快速、直觀的檢測。適配體結合靶分子的高親和力和特異性,確保了該檢測技術的高靈敏度與高特異性,可滿足食源性致病菌的快速檢測要求,未來可向多重檢測方向發展。
2.2 熒光適配體技術
熒光檢測具有靈敏度高、選擇性強、定量精準等優點,與核酸適配體技術結合更能發揮技術優勢[62]。適配體與熒光標記技術結合,是基于適配體與靶物質作用后發生熒光強度改變以檢測食源性致病菌,利用熒光基團或淬滅基團修飾適配體,加入目標菌后適配體構象發生改變引起熒光信號差異。近年來,熒光適配體技術已用于沙門氏菌O8[43]、單核細胞增生李斯特菌[56]、金黃色葡萄球菌[63]和宋內氏志賀氏菌[59]等食源性致病菌的快速、靈敏、特異性檢測。建立單核細胞增生李斯特菌熒光適配體技術,首先,應用全細胞-SELEX技術篩選出與靶細菌結合效果最好的熒光修飾適配體A15,然后將生物素化的適配體A15固定在微孔板上形成夾心型結構捕獲靶標,適配體與細菌親和形成的復合物與羧基熒光素(FAM)標記的適配體A15結合,并用SpectraMax M5分光光度計測定熒光強度,檢測限為75 CFU/mL[56],該方法具有良好的檢測單核細胞增生李斯特菌生長的能力,研究還證實,適配體的靶分子非常廣泛并且可以用不同表位捕獲靶標。Maeng等[63]根據RNA適配體熒光強度的變化,開發了檢測金黃色葡萄球菌等致病菌的檢測系統,將篩選出的RNA適配體通過硫醇基團固定在銀膜上,RNA適配體捕獲的細菌可通過添加適配體-dT-FAM后發射熒光量的增加而被檢測到。該方法操作簡捷、快速、特異性強。宋內氏志賀氏菌的熒光適配體檢測技術建立,通過使用全細胞-SELEX技術篩選得到最優適配體SS-3與SS-4,然后在5′端分別以5′-胺修飾的SS-4與Cy5標記的SS-3合成捕獲探針與檢測探針來檢測與鑒別宋內氏志賀氏菌,檢測限為103cells/mL[59],研究表明,建立的熒光適配體傳感器平臺可特異性檢測多種食物中的宋內氏志賀氏菌。
綜上所述,熒光適配體技術已在多種致病菌檢測中得到應用,此外,對該技術的研究一方面有利于質量控制和食品安全,對開發其它致病菌的快速、靈敏檢測方法具有重要意義;另一方面,這種方法未來可向多種病原菌同時檢測的便攜式檢測方向發展,具有良好的應用前景。
2.3 電化學適配體技術
電化學檢測方法具有操作簡便、成本低廉、靈敏度高、儀器簡單,適用于便攜式設備等優點[40]。適配體與電化學技術結合,是將適配體與電化學活性傳感元件固定在電極上,加入靶物質后,適配體與靶物質結合導致電極表面修飾物結構改變,通過檢測電化學信號或電流變化進行定性與定量檢測。當前,電化學適配體技術已用于檢測大腸桿菌O111[33]、大腸桿菌O55∶B5[34]、葡萄球菌腸毒素B[49]和金黃色葡萄球菌[64]等食源性致病菌及其毒素。建立檢測大腸桿菌O111的電化學適配體生物傳感器技術,需先將捕獲探針通過Au-硫醇錨定在電極表面上,適配體因與捕獲探針雜交被固定在金電極表面,當目標菌存在時,適配體會識別、結合目標菌并脫離捕獲探針,捕獲探針與生物素化檢測探針結合后留在電極表面,加入識別元件鏈霉抗堿性磷酸酶后產生電化學信號,該技術可在3.5 h內可實現對目標致病菌的精確定量,對牛奶樣品中目標菌的檢測限為305 CFU/mL[33],是一種特異性強、準確性高、靈敏、快速的檢測技術。利用電化學法拉第阻抗理論開發了檢測牛奶中葡萄球菌腸毒素B(staphylococcal enterotoxin B,SEB)的無標記、簡便的電化學適配體生物傳感器技術,當樣品中存在SEB時,由于適配體對SEB有高特異性與親和性,使SEB組裝在金電極表面上,阻止[Fe(CN)6]3-/4-進入電極表面進行有效電子轉移,得到[Fe(CN)6]3-/4-的大法拉第阻抗反應;當在樣品中不存在SEB時,只有適配體與巰基己醇(MCH)組裝在電極表面上,導致有效的電子轉移,產生小法拉第阻抗反應。結果顯示,在0.5~500 ng/mL范圍內,Ret與SEB的濃度對數呈線性關系,檢出限為0.17 ng/mL(S/N=3)[49],該檢測技術與ELISA商品化試劑盒檢測結果一致,具有良好的適用性與可靠性。Abbaspour等[64]設計了一種基于雙適配體的電化學夾心傳感器測定法檢測金黃色葡萄球菌,固定在磁珠表面上的初級適配體捕獲金黃色葡萄球菌,與銀納米顆粒綴合的次級適配體提供限定的電化學特性,顯著提高了檢測的靈敏度,應用釋放的Ag+離子進行差示脈沖陽極溶出伏安(DPV)信號的測量,以對金黃色葡萄球菌進行定性與定量檢測。該方法靈敏度高,對適配體常規檢測方法無法檢測的微量細菌的檢測提供了新方法。
電化學適配體技術既可進行有標記的檢測也可進行無標記的簡單檢測。相比于其他技術,電化學適配體傳感器技術更易于實現小型化檢測,具有檢測成本低、靈敏度高、響應快、設計方便且適用性強、檢測限低等特點,已成為食品中病原微生物檢測的有力工具。
2.4 流式細胞適配體技術
流式細胞術(Flow cytometry,FCM),是應用流式細胞儀對單個細胞或微粒進行多參數定量分析與分選的檢測技術,具有快速、靈敏、精確以及便于操作等突出優點[65]。適配體與流式細胞術結合,是對適配體進行熒光標記后,應用流式細胞儀通過熒光分析對靶物質進行定性與定量檢測。應用流式細胞術,以熒光標記的核酸適配體為識別分子,構建的檢測與鑒別金黃色葡萄球菌的新技術特異性強、操作簡捷,40 min即可從濃度為108~109CFU/mL混合菌液中準確鑒別金黃色葡萄球菌[47]。Duan等[53]采用流式細胞儀對FAM標記的副溶血弧菌適配體進行特異性與親和力分析,篩選出最佳適配體,并在之后建立同時檢測副溶血性弧菌與鼠傷寒沙門氏菌的流式細胞適配體技術,該技術應用量子點分別標記副溶血性弧菌與鼠傷寒沙門氏菌適配體,量子點-適配體復合物與副溶血弧菌結合后顯示出綠色熒光,與鼠傷寒沙門氏菌結合后顯示為橙色熒光,采用流式細胞術通過熒光分析進行定性與定量檢測,兩種細菌的檢測限均為5×103CFU/mL,可在蝦樣品中對目標菌進行特異性定量檢測[41]。該方法具有檢測速度快、特異性強、分析全面等技術優點。
食品樣本往往存在多種微生物污染,實現食源性致病菌的高通量鑒別是未來檢測發展趨勢。流式細胞術可通過多種適配體同時使用,實現食源性致病菌的多重檢測。然而該方法涉及的流式細胞儀價格昂貴、熒光染料成本較高、樣品前處理繁瑣,目前僅適用于實驗室的基礎研究,工業化應用不多。
2.5 表面增強拉曼散射適配體技術
表面增強拉曼散射(surface-enhanced Raman scattering,SERS)技術以其極高的靈敏度、熒光背景低、對檢測樣品無損等優勢,廣泛應用于化學工業分析、生物分析以及醫學檢測等諸多領域[66]。利用適配體與表面增強拉曼技術結合可構建便捷、靈敏、特異的傳感器。建立檢測副溶血弧菌的表面增強拉曼適配體傳感器,需合成SiO2@Au核殼納米粒子(NPs)并制備有效的SERS基底,在靶標存在時,固定在SiO2@Au核殼NPs表面的適配體1(apt 1)與花青染料3(Cy3)修飾的適配體2(apt 2),形成了SiO2@Au-apt 1-target-apt 2-Cy3三明治樣復合物。在最佳條件下,SERS信號與菌液濃度10~106CFU/mL線性相關,檢測限為10 CFU/mL[54],該方法靈敏度高,選擇性強,可實現對細菌的直接檢測,無需提取病原基因組,對實際樣品的檢測與標準平板法檢測結果一致,符合率高。Ravindranath等[67]將抗鼠傷寒沙門氏菌、抗金黃色葡萄球菌以及抗大腸桿菌O157∶H7抗體分別用金(Au)、銀(Ag)和銀金核殼納米粒子進行功能化標記,應用拉曼與紫外-可見吸收光譜同時檢測三種不同的病原體。該平臺可特異性捕獲靶細菌以及從細菌混合物中檢測特定病原體,該方法可在30 min內檢測雞尾酒中多種病原體的存在,檢測限為102~103CFU/mL。建立的新技術可實現致病菌的高通量檢測,并具有可擴展到多種應用潛力,為其他適配體新技術的開發提供理論指導。Li等[38]提出了一種基于表面增強拉曼散射快速靈敏檢測鼠傷寒沙門氏菌的適配體傳感器,互補DNA(cDNA)和靶標與適配體競爭結合,導致適配體構象發生改變,分散的金納米棒(GNRs)和SERS“熱點”形成的等離子體耦合導致拉曼光譜極大增強,以對氨基苯硫酚(PATP)作為拉曼活性信號分子,在菌液濃度為56~56×107CFU/mL范圍內,檢測信號與菌液含量呈線性相關,檢測限為9 CFU/mL。該方法已用于牛奶樣品中鼠傷寒沙門氏菌的檢測。表面增強拉曼散射適配體技術具有較寬的線性范圍以及極低的檢出限,是檢測食源性致病菌檢測中極具發展前景的技術手段。隨著納米技術的進步,更多靈敏的、可重復性的SERS基底將被制備,未來可實現商業化。此外,便攜式拉曼光譜儀的設計與使用有利于實現食源性致病菌的現場快速分析。
綜上,基于適配體的檢測技術在食源性致病菌檢測得到廣泛應用,這些技術具有高特異性與較高的靈敏度,可對食品中的致病菌進行快速、高效的檢測。然而,該技術方法也具有一定的缺陷性,例如,使用儀器昂貴、樣品前處理復雜等。因此,研究者可根據研究需求以及實驗條件選擇合適的適配體檢測技術(見表2)。

表2 適配體技術對比Table 2 Comparison between aptamer technologies
3 結語與展望
核酸適配體具有特異性強、穩定性好、靈敏度高、親和力強、易于修飾等特點,能夠識別多種目標物,與納米金、熒光、電化學、流式、表面增強拉曼等技術相結合,可進一步提高檢測的靈敏度,降低檢測成本,縮短檢測時間,因此在食源性致病菌檢測中得到廣泛應用。然而,適配體技術在食源性致病菌檢測相關技術依然存在適配體篩選效率低,高通量與多重同時檢測關鍵技術欠缺,相關儀器設備體型龐大、價格昂貴等瓶頸,難以滿足現場快速檢測需求。
核酸適配體技術可從如下幾個方面進行深入研究。應用石墨烯SELEX、細胞芯片SELEX以及高保真SELEX等新型SELEX篩選技術進一步提高適配體篩選效率與質量;將適配體與核酸新型重組酶聚合酶擴增技術、環介導等溫擴增技術等相結合,大幅降低病原菌檢測限以及檢測速度;研究適配體與微流控芯片相結合技術,實現食源性致病菌的高通量、自動化檢測;探索適配體與側流層析技術結合方法,對病原微生物實現可視化檢測;將適配體與ELISA技術等結合,并實現對大規模食品中的病原菌進行快速分析,降低檢測成本;將適配體與熒光技術結合并借助智能手機實現便攜式一體化檢測。綜上所述,核酸適配體在食源性致病菌監測、風險評估以及控制等方面具有廣闊的應用前景。

