褐藻膠降解酶產生菌的篩選與鑒定
李 倩,李悝悝,張付云*
(1.大連海洋大學 食品科學與工程學院,遼寧 大連 116023;2.中國科學院 大連化學物理研究所 天然產物與糖工程研究組大連市糖類農用制劑工程研究中心,遼寧 大連 116023)
褐藻膠又稱藻酸、海藻酸鈉,是一些大型藻類的細胞壁、細胞間質的主要組成成分[1]。褐藻膠是由β-D-甘露糖醛酸(β-D-mannuronate,M)和α-L-古洛糖醛酸(α-L-guluronate,G)兩種糖醛酸殘基通過β-1,4糖苷鍵相互連接而成的線性高分子聚合物[2]。依據海藻種類、藻體組織部位、生態環境、季節等的不同,M和G單體的含量比也具有差異[3]。褐藻膠及其衍生物的獨特理化性質,如良好的凝膠特性和穩定性,使其被廣泛應用于食品、紡織和化工等領域[4]。但天然褐藻膠為分子質量較大的高聚物,黏度高、難溶于水,限制了褐藻膠的應用。褐藻膠寡糖作為一種功能性寡糖,不僅解決了天然褐藻膠應用上的瓶頸問題,且其具有多種生物活性,如免疫調節[5]、抗凝血、抗高血脂[6]、抗氧化[7-9]等,也可以作為一種植物生長調節劑,應用于綠色農業[10-11]。因此,如何有效獲得褐藻膠的降解產物——褐藻寡糖勢在必行。
目前,褐藻寡糖的制備方法有物理法、化學法和生物酶法[2]。常用的物理法包括輻射、熱降解和超聲等,但此類方法不能將天然褐藻膠完全降解,且操作繁瑣、價格昂貴,容易造成資源浪費。化學法以酸降解為主,但該方法降解條件難以控制,耗時長且產物品質較差,可能對褐藻膠還原端造成一定程度的破壞,進而影響降解產物即褐藻寡糖的生物活性;同時大量化學試劑的應用造成環境污染。生物酶法是采用褐藻膠降解酶通過β-消去反應斷裂褐藻膠的糖苷鍵,產生的新還原端為飽和糖醛酸鹽,該方法專一性強、效率高、反應溫和、可控性強,不會對環境造成污染,且能為后續研究寡糖活性化學結構提供信息,并滿足不同用途的需要[12],故酶法降解逐步成為優先選擇的方法。
褐藻膠降解酶來源廣泛[13],在細菌、真菌中均有發現[14],其中,海洋來源的微生物是褐藻膠裂解酶的重要來源。由于現階段報道的微生物來源的褐藻膠降解酶中,仍然存在酶活力低、作用位點單一等缺點[15-16]。因此,篩選能夠降解褐藻膠的新菌株,對發掘具有潛在產業化價值的褐藻膠裂解酶具有重要意義。本研究從大連長興島采集的腐爛海帶樣品中,篩選能夠降解褐藻膠的菌株,并通過形態觀察、生理生化試驗及分子生物學技術對其進行鑒定,豐富褐藻膠降解酶新菌種資源,為褐藻膠降解的深入研究及酶法制備褐藻膠寡糖產品奠定了基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
腐爛海帶:采自遼寧省大連市長興島海域。
1.1.2 培養基
無機鹽溶液:NaCl 5 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,CaCl20.2 g/L,FeSO4·7H2O 0.02 g/L,去離子水配制。
分離培養基:在1 L無機鹽溶液中加入褐藻酸鈉7 g,(NH4)SO45 g,瓊脂20 g。
產酶發酵培養基:在1 L無機鹽溶液中加入褐藻酸鈉10 g,蛋白胨5 g,酵母粉1 g。
以上培養基均在121℃條件下高壓蒸汽滅菌20 min。
1.1.3 試劑
細菌基因組抽提試劑盒:上海碧云天生物技術有限公司;BM5000脫氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京博邁德科技發展有限公司;聚合酶鏈式反應(polymerase chain reaction,PCR)所用試劑:寶生物工程(大連)有限公司;褐藻膠(分析純):上海阿拉丁生化科技股份有限公司;HBI細菌生理生化鑒定條:青島海博生物技術有限公司;革蘭氏染色試劑盒:北京索萊寶生物科技有限公司;其他所有試劑均為國產分析純。
1.2 儀器與設備
ML104/02電子天平:梅特勒-托利多國際貿易(上海)有限公司;YXQ-LS-50sII立式壓力蒸汽滅菌鍋、SPX-250B恒溫培養箱:上海博迅實業有限公司;MS-S磁力攪拌器:大連元博科學器材有限公司;QHZ-98A全溫振蕩培養箱:太倉市華美生化儀器廠;Hybaid型PCR儀:美國Thermo Fisher Scientific公司;CR-22E高速冷凍離心機:日本HITACHI公司;DYY-6C型電泳儀:北京市六一儀器廠;Multiskan Ascent酶標儀:芬蘭Labsystems公司;IX73型顯微鏡、FV1000MPE雙光子共聚焦顯微鏡:日本Olympus公司;GelDoc-It型凝膠成像儀:美國UVP公司。
1.3 實驗方法
1.3.1 菌株的分離純化
稱取樣品10g于裝有90 mL無菌水及轉子的三角瓶中,于磁力攪拌器上600 r/min條件下攪拌10 min,待樣品充分分散后,靜置10 min,轉移至超凈臺,取上清液制備10倍系列稀釋樣品勻液,稀釋度為10-1~10-9。分別取各梯度稀釋液0.2 mL涂布于以褐藻酸鈉為唯一碳源的分離培養基平板,于30℃恒溫培養箱中倒置培養2~4 d,挑取顏色及菌落形態不一的菌株進行多次劃線,分離純化。
1.3.2 產褐藻膠降解酶菌株的篩選
挑取單菌落分別接種于裝有7.5 mL產酶發酵培養基的50 mL離心管中,于37℃、150 r/min條件下培養12 h,作為種子液備用。以2%(V/V)的接種量將種子液接種于裝有50 mL產酶發酵培養基的250 mL的三角瓶中,于37℃、150 r/min條件下培養24 h,測定褐藻膠降解酶活力,篩選褐藻膠降解酶活力高的菌株。
1.3.3 褐藻膠降解酶活力測定
采用3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)法[17]測定褐藻膠降解酶活力。以OD540nm值(y)為縱坐標,葡萄糖含量(x)為橫縱標,繪制葡萄糖標準曲線。葡萄糖標準曲線回歸方程為y=5.194x-0.026 7,相關系數R2=0.999 3,線性關系良好,可用于褐藻膠降解酶活力的測定。
發酵液經12 000 r/min離心5 min,上清液即為粗酶液。取500 μL粗酶液與500 μL 0.3%褐藻膠于37℃水浴鍋中反應1 h,然后于沸水浴中加熱10 min終止反應,12 000 r/min離心2 min,取400 μL上清液加入300 μL DNS試劑,沸水浴加熱10 min后立即冷卻,加無菌水定容至1.5 mL,取200 μL于波長540 nm處測定吸光度值。以沸水浴10 min高溫進行滅活的酶作為對照組,每組實驗設定3個平行。根據葡萄糖標準曲線回歸方程計算出還原糖含量,從而計算出酶活力大小。
酶活力單位定義:每分鐘催化褐藻膠產生1 μmol還原糖(以葡萄糖計)所需要的酶量為1個酶活力單位(U/L)。
1.3.4 菌株的鑒定
形態觀察:將篩選菌株劃線于分離培養基平板上,30℃倒置培養24 h,肉眼觀察單菌落形態。然后挑取單菌落于油鏡下觀察其顯微形態,并進行革蘭氏染色觀察。
生理生化試驗:采用HBI細菌生理生化鑒定條對菌株的生理生化特征進行測定,觀察并記錄實驗結果。
分子生物學鑒定:利用細菌基因組抽提試劑盒提取篩選菌株的基因組DNA,以其為模板,利用16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′)[18]進行PCR擴增。PCR擴增體系:10×PCR 緩沖液10 μL,基因組1.5 μL,10 μmoL/L通用引物各4 μL,脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture8μL,r Taq酶1μL,雙蒸水(ddH2O)補充至100 μL,混勻。PCR擴增條件:94℃預變性2 min;94℃變性30 s,55℃退火30 s,72℃延伸1 min 30 s,共進行30個循環;72℃再延伸5 min。PCR擴增產物經瓊脂糖凝膠電泳檢測正確后,切膠回收,送至北京六合華大基因科技有限公司進行測序。將測序結果與EZBioCloud數據庫中模式菌株的核酸序列進行比對分析,選取親緣關系相近的模式菌株,通過MEGA5.0軟件[19]中的鄰接(neighbor-joining,NJ)法構建系統發育樹后進行分析。
2 結果與分析
2.1 產褐藻膠降解酶菌株的篩選
以褐藻膠為唯一碳源,共篩選到8株能夠穩定生長的菌株,編號為E6-1、E6-2、E5、E8、F3、F1、E10、F4。將其分別轉接于發酵培養基,采用DNS法對菌株降解褐藻膠的能力進行測定,結果見圖1。
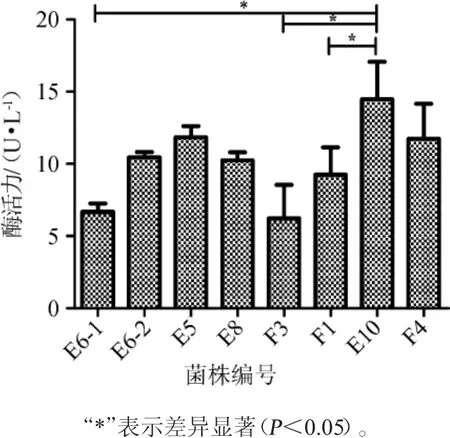
圖1 不同菌株降解褐藻膠能力的比較Fig.1 Comparison of alginate degradation ability between different strains
由圖1可知,篩選得到的8株菌株均具有降解褐藻膠的能力。其中,菌株E-10所產褐藻膠降解酶活力最高,為14U/L,其褐藻膠降解酶活力顯著高于菌株E6-1(6 U/L)、F1(9 U/L)和菌株F3(6 U/L)(P<0.05);其次為菌株E5(11 U/L);菌株F3的褐藻膠降解酶活力最低,為6 U/L。LANGE B等[20]研究表明,克雷伯氏菌來源的褐藻膠降解酶作用底物為多聚葡萄糖醛酸組成的褐藻膠,特異性斷裂G-G之間的糖苷鍵,本文中所使用的底物為G和M交替連接組成的褐藻膠,故此可能為E6-1和F3酶活力較低的原因。現在,通過基因重組或酶的定向進化技術已經實現對酶的改造和酶活力的提升[21-22],本研究所篩選獲得的菌株E-10雖活性較低,但是作為一種新的產酶菌株,可通過上述生物技術對其進一步研究以拓寬褐藻膠降解酶酶源。因此,篩選菌株E-10進行深入研究。
2.2 菌株鑒定
2.2.1 形態學鑒定
菌株E-10在分離培養基上的菌落形態見圖2A、細胞形態見圖2B,細胞經革蘭氏染色后的細胞形態見圖2C。
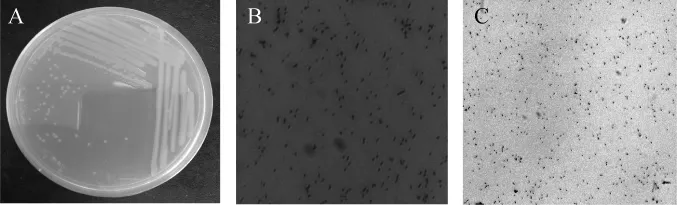
圖2 菌株E-10的菌落(A)和細胞(B和C)形態Fig.2 Colonial(A)and cell(B and C)morphology of strain E-10
由圖2A可知,菌株E-10的菌落呈圓形,邊緣整齊,初始生長表面光滑透明、濕潤,后期菌落表面呈乳白色半透明,且有干粉狀物質位于菌落表面;由圖2B可知,菌株E-10的細胞為短小棒狀;由圖2C可知,菌株E-10經革蘭氏染色后為紫色,說明菌株E-10為革蘭氏陽性菌。
2.2.2 生理生化試驗結果
根據《細菌系統鑒定手冊》[23],對菌株E-10的生理生化特征進行測定,結果見表1。

表1 菌株E-10的生理生化特征Table 1 Physiological and biochemical characteristics of strain E-10
由表1可知,明膠試驗呈陽性,說明菌株E-10具有運動性;菌株E-10產鳥氨酸脫羧酶;能利用D-甘露醇、水楊苷、木糖、麥芽糖以及七葉苷;不產苯丙氨酸酶、尿素酶和脂酶;西蒙氏枸櫞酸鹽、吲哚試驗呈陰性。結合形態觀察結果,初步判定菌株E-10為萊茵海默氏菌屬(Rheinheimera)。
2.2.3 分子生物學鑒定
菌株E-10的16S rDNA PCR擴增產物經瓊脂糖凝膠電泳檢測,結果見圖3。
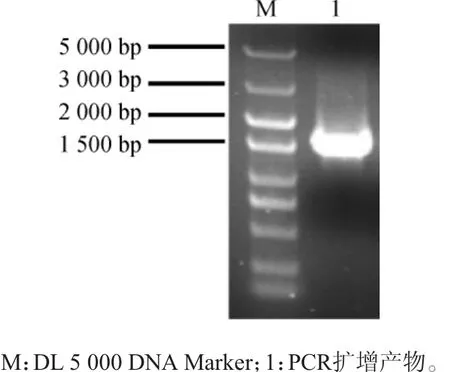
圖3 菌株E-10 16S rDNA PCR擴增產物瓊脂糖凝膠電泳結果Fig.3 Agarose gel electrophoresis result of 16S rDNA PCR amplification product of strain E-10
由圖3可知,PCR擴增產物的堿基長度約為1 500 bp,與目的基因的堿基長度一致,且條帶較為完整,說明PCR擴增成功。
菌株E-10 16S rDNA序列與EZBioCloud數據庫中模式菌株的核苷酸序列進行比對發現,菌株E-10的16S rDNA基因序列與萊茵海默氏菌屬(Rheinheimera)的相似度較高,與水萊茵海默氏菌(Rheinheimeraaquimaris)SW-353(EF076757)、日本粳稻萊茵海默氏菌(Rheinheimerajaponica)KMM 9513(LC004727)、太平洋萊茵海默氏菌(Rheinheimerapacifica)KMM1406(AB073132)、明岑貝格萊茵海默氏菌(Rheinheimera muenzenbergensis)E49(JQ922424)的相似度分別為99.93%、98.51%、98.50%、98.43%。為了進一步確定菌株E-10的分類地位,選取相似度較高的模式菌株,采用MEGA 5.0軟件中的NJ法構建系統發育樹,結果見圖4。

圖4 基于16S rDNA序列菌株E-10的系統發育樹Fig.4 Phylogenetic tree of strain E-10 based on 16S rDNA sequences
由圖4可知,菌株E-10與水萊茵海默氏菌(Rheinheimera aquimaris)(EF076757)聚于同一分支,親緣關系最近,因此,將菌株E-10鑒定為一株水萊茵海默氏菌(Rheinheimera aquimaris)。
3 結論
本研究以褐藻膠為唯一碳源,從長興島采集的腐爛海帶中篩選得到能夠高效降解褐藻膠的菌株E-10,褐藻膠降解酶活力為14 U/L。通過形態觀察、生理生化試驗及分子生物學鑒定菌株E-10為水萊茵海默氏菌(Rheinheimera aquimaris)。首次報道了萊茵海默氏菌具有降解褐藻膠的能力,此菌株的篩選和鑒定豐富了褐藻膠降解酶新微生物酶源,對發掘具有潛在產業化價值的褐藻膠降解酶具有重要意義。

