雙酚A誘導(dǎo)下雙齒圍沙蠶實時熒光定量PCR內(nèi)參基因的篩選
薛圣倫,黃藝,孫嘉,楊大佐,周一兵,趙歡,*
1. 大連海洋大學(xué),遼寧省海洋生物資源恢復(fù)與生境修復(fù)重點實驗室,大連 116023 2. 大連海洋大學(xué),農(nóng)業(yè)農(nóng)村部北方海水增養(yǎng)殖重點實驗室,大連 116023
雙酚A(bisphenol A, BPA)又稱為二苯酚丙烷,是一種重要的有機化工原料。塑料中添加BPA可以提升原料的透明度、耐用性和韌性,特別是可以防止酸對金屬內(nèi)壁的腐蝕,因此BPA作為添加劑廣泛應(yīng)用于金屬罐頭的樹脂內(nèi)膜,牙套塑封劑和嬰兒奶瓶等塑料產(chǎn)品。每年全世界約有2 700萬噸含BPA的塑料生產(chǎn),而我國BPA的消耗量為206 000 t·a-1[1]。BPA在高溫條件下極易從塑料制品中溢出,這使得環(huán)境中BPA污染相當(dāng)普遍。鄧旭修和黃會[2]的研究表明我國渤海海域的BPA含量最高可達到20.1 μg·L-1,而在黃浦江水體中BPA濃度為170~3.52×103ng·L-1[3]。國外水體中的BPA污染也有報道,Belfroid等[4]調(diào)查顯示荷蘭河口中的BPA濃度為11.0~330 ng·L-1,韓國西瓦湖表層水中的BPA濃度為13.0~50.4 ng·L-1[5]。早在1936年,Dodds和Lawson[6]就已發(fā)現(xiàn)BPA具有雌激素活性,可通過與雌激素受體結(jié)合或影響細胞信號傳導(dǎo)途徑等其他方式模仿或干擾內(nèi)源性雌激素作用,發(fā)揮雌激素樣效應(yīng)。任文娟等[7]研究發(fā)現(xiàn)BPA及其類似物可以使斑馬魚(Brachydaniorerio)卵的孵化率顯著降低,并造成胚胎發(fā)育畸形。同時郭依晨等[8]研究發(fā)現(xiàn),雙酚A不僅會導(dǎo)致斑馬魚發(fā)育過程中畸形率的上升,還會造成幼體運動量減少,趨光性減弱,推測雙酚A在幼體發(fā)育階段具有發(fā)育毒性。此外,Gentil等[9]發(fā)現(xiàn)10-9mol·L-1濃度BPA誘導(dǎo)可以抑制斑馬魚甲狀腺激素受體的轉(zhuǎn)錄,干擾斑馬魚甲狀腺一些特定基因的表達。已經(jīng)有研究均表明BPA可以干擾機體內(nèi)源性激素作用,引起動物生殖器官畸變,神經(jīng)系統(tǒng)和免疫系統(tǒng)功能出現(xiàn)紊亂,因此關(guān)于BPA對生物體的毒性效應(yīng)機制備受關(guān)注。
在研究毒性效應(yīng)時,目前常用實時熒光定量PCR技術(shù)(Real-time quantitative reverse transcription polymerase chain reaction, qRT-PCR)對目的基因的表達進行定量分析。實時熒光定量PCR技術(shù)通過熒光信號對PCR過程中DNA的累積速率進行檢測,從而減小檢測最終產(chǎn)物濃度時有較大變異系數(shù)的問題[10]。實時熒光定量PCR分為相對定量和絕對定量2種方法,雖然絕對定量法可以更為準(zhǔn)確地測定反應(yīng)過程中DNA含量,但是由于實驗操作較為復(fù)雜且較容易污染,因此目前應(yīng)用比較普遍的是相對定量法。在進行相對實時熒光定量PCR時,需要選擇表達相對穩(wěn)定的基因作為內(nèi)參基因,對目的基因的表達進行矯正和標(biāo)準(zhǔn)化。但是越來越多的研究發(fā)現(xiàn),穩(wěn)定表達的內(nèi)參基因幾乎不存在,在實驗過程中操作差異或是物種差異等因素會引起內(nèi)參基因表達發(fā)生變化,從而影響目標(biāo)基因表達的準(zhǔn)確性[11-13]。牟政強等[14]在菲律賓蛤仔(Ruditapesphilippinarum)內(nèi)參基因的篩選中發(fā)現(xiàn),在發(fā)育過程中Actin的表達不穩(wěn)定,而在成體不同組織中Tub的穩(wěn)定性最差,表明在同一物種的不同發(fā)育時期或不同組織器官中其內(nèi)參基因的表達會存在差異。張麗莉等[15]發(fā)現(xiàn)雜色鮑(Haliotisdiversicolor)在甲狀腺激素受體(TR)干擾下不同內(nèi)參基因表達存在較大差異,其中Actin和RPS9的表達最為穩(wěn)定。Xu等[16]研究表明急性氨鹽誘導(dǎo)下,中國沿海長蛸(Octopusminor)不同組織內(nèi)內(nèi)參基因的表達也存在較大差異,其中Actin在誘導(dǎo)前后表達差異較大。上述報道說明同一物種在外界環(huán)境變化和內(nèi)在生長過程中不同內(nèi)參基因的表達穩(wěn)定性存在明顯差異,因此為了保證反應(yīng)目標(biāo)基因表達的準(zhǔn)確性,在利用相對實時熒光定量PCR開展實驗之前,進行內(nèi)參基因的篩選非常有必要。
雙齒圍沙蠶(Perinereisaibuhitensis)是一類廣泛分布在我國海岸帶的底棲無脊椎動物,該物種的沉積食性使得其極易接觸沉積物中的污染物。近年來對多毛類的研究表明,部分多毛類包括雙齒圍沙蠶在內(nèi)對污染物具有很強的耐受性[17]。對于沙蠶通過何種機理降低有害污染物在其體內(nèi)的毒性這一科學(xué)問題目前已引起學(xué)者的廣泛關(guān)注。Chen等[18]利用實時熒光定量PCR證明雙齒圍沙蠶體內(nèi)CYP4基因表達的變化與石油烴污染濃度存在明顯的劑量誘導(dǎo)效應(yīng),Yang等[19]發(fā)現(xiàn)重金屬Cd和Cu單一及復(fù)合誘導(dǎo)下沙蠶體內(nèi)金屬蛋白II(metalloprotein II, MPII)基因表達會明顯升高。鑒于內(nèi)參基因在不同污染物脅迫下表達的穩(wěn)定性存在差異,本研究開展BPA誘導(dǎo)下雙齒圍沙蠶內(nèi)參基因的篩選,為了進一步開展BPA對雙齒圍沙蠶的分子毒性效應(yīng)研究提供重要的數(shù)據(jù)支撐。
1 材料與方法(Materials and methods)
1.1 實驗材料
實驗動物雙齒圍沙蠶(P.aibuhitensis)采自大連金州養(yǎng)殖場,篩選出其中活力較好、大小適中(3±0.5) g的完整個體運回實驗室,在實驗室條件下先暫養(yǎng)14 d,每24 h更換一次海水。暫養(yǎng)的海水為大連黑石礁海域的沙濾海水,水溫(16±0.5) ℃,鹽度31~32,pH 8.25±0.1,并且其中投喂海泥等餌料。
實驗所用的BPA和二甲基亞砜(dimethyl sulfoxide, DMSO)均購于北京索萊寶公司,屬分析純。
1.2 毒性實驗
參照中華人民共和國國家海水水質(zhì)標(biāo)準(zhǔn)(GB 3097—1997)及已有黃渤海BPA濃度文獻報道[2,20],實驗共設(shè)2個BPA濃度組,分別為10 μg·L-1和50 μg·L-1,另設(shè)置一個海水空白對照組。先稱取0.1 g BPA粉末,定容于100 mL DMSO中,制備儲備溶液(1 g·L-1),在進行實驗前,添加不同體積儲備液至海水中,配制成設(shè)置濃度。在進行實驗前3天沙蠶停止投喂餌料。實驗在2.5 L的燒杯中進行,選擇活躍和中等大小的沙蠶放入燒杯中,每個燒杯放置20尾沙蠶,每個濃度設(shè)置3個重復(fù)。在毒性實驗期間,不進行餌料投喂,水溫和注氧與暫養(yǎng)期保持一致,并每隔24 h更換一次毒液。分別在12 h、24 h、48 h、72 h、96 h時取樣。在每個燒杯中隨機選取3尾沙蠶,剪取體壁后迅速置于-80 ℃冷凍保存?zhèn)溆谩?/p>
1.3 RNA提取及cDNA合成
稱取0.1 mg組織樣品按照Trizol(TaKaRa, 大連)試劑盒說明書提取樣品的總RNA,利用1%的瓊脂糖凝膠電泳檢測其完整性,利用NanoDrop 2000(Thermo Scientific, 美國)測定RNA的濃度。
RNA反轉(zhuǎn)錄成cDNA采用EraserPrimeScriptTMRT reagent Kit (TaKaRa, 大連)試劑盒,反應(yīng)分為去除基因組DNA和反轉(zhuǎn)錄兩步,反應(yīng)體系總共20 μL,包括PrimeScript RT Enzyme Mix I 1.0 μL;RT Primer Mix 1.0 μL;5 × PrimeScript Buffer2 4.0 μL;RNase Free ddH2O 3.0 μL;總RNA 1 μL;去除gDNA的反應(yīng)液10 μL。反轉(zhuǎn)錄條件為37 ℃反應(yīng)15 min,85 ℃反應(yīng)5 s,產(chǎn)物于-20 ℃保存?zhèn)溆谩?/p>
1.4 引物設(shè)計
根據(jù)實驗室前期構(gòu)建的雙齒圍沙蠶轉(zhuǎn)錄組庫,篩選肌動蛋白(beta-actin, Actin)、微管蛋白(beta-tubulin, Tub)、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、核糖體蛋白5(ribosomal protein L5, RPL5)、琥珀酸脫氫酶(succinate dehydrogenase complex flavoprotein subunit, ASDHA),組蛋白(Histone Cluster 1 H2A Family Member A, HH2A)6個表達量較為穩(wěn)定且常用的內(nèi)參基因作為備選管家基因。利用Primer5.0設(shè)計引物并交由大連寶生物技術(shù)有限公司合成,引物信息見表1。
1.5 實時熒光定量PCR
實驗采用TB?Premix Ex TaqTMII(Tli RNaseH Plus)試劑盒(TaKaRa, 大連)進行實時熒光定量PCR,實時熒光定量PCR反應(yīng)體系共20 μL,包括模板cDNA 2 μL,正、反向引物(濃度為1 μmol)各0.8 μL,TB?Premix Ex TaqTMII(Tli RNaseH Plus)10 μL,ROX Reference Dye II 0.4 μL,ddH2O 6.0 μL。反應(yīng)在ABI 7500 PCR儀上進行,PCR反應(yīng)包括40個循環(huán),反應(yīng)條件以Actin為例:95 ℃、預(yù)變性30 s,然后95 ℃、5 s,退火溫度為60 ℃,30 s進行40個循環(huán)。其他內(nèi)參基因的退火溫度參見表1。反應(yīng)結(jié)束后觀察溶解曲線,發(fā)現(xiàn)每個內(nèi)參基因產(chǎn)物均為單一峰值,表明產(chǎn)物單一,將PCR產(chǎn)物送去寶生物公司進行測序驗證。
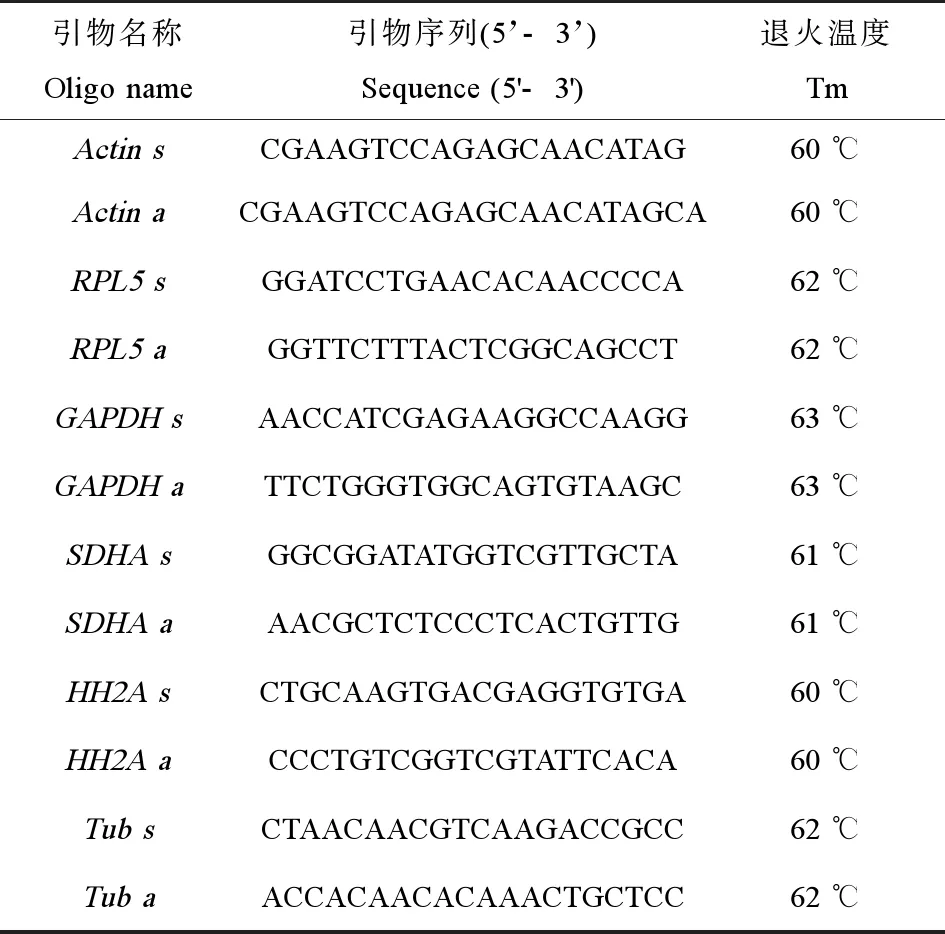
表1 內(nèi)參基因的引物序列信息Table 1 Primer sequences for reference gene
1.6 數(shù)據(jù)分析
利用2ΔCt進行數(shù)值計算[21-22],用GeNorm、Normfinder和Bestkeeper軟件分別來分析基因的表達穩(wěn)定性。最后采用平均加權(quán)賦值法,綜合分值越小的基因判定為越穩(wěn)定。
2 結(jié)果(Results)
2.1 RNA質(zhì)量檢測
1%瓊脂糖凝膠電泳檢測結(jié)果表明提取的RNA具有5S、18S、28S三條條帶,其中28S與18S的條帶亮度比大約為2:1,且條帶清晰(圖1),總RNA樣品經(jīng)過微量核酸定量儀檢測,結(jié)果顯示OD260/OD280值均在1.8~2.0之間,說明提取的總RNA質(zhì)量良好,可以用于后續(xù)實時熒光定量實驗。
2.2 內(nèi)參基因的表達水平分析
熒光定量PCR中,Ct值的大小表示基因表達的豐度,Ct值越小,代表該基因的表達水平越高。圖2顯示6對內(nèi)參基因Ct值,對比本實驗不同濃度BPA誘導(dǎo)下沙蠶6對內(nèi)參基因Ct值的大小,從大到小依次為RPL5>Tub>HH2A>SDHA>GAPDH>Actin。其中的Actin的Ct平均值最小,且波動最小,在14.58至18.58之間波動,表明該基因表達水平最高;而RPL5 Ct平均值最大,在24.96至28.07之間波動,表明該基因表達水平最低。Ct值波動范圍最大的為GAPDH,在16.24至18.89之間波動。
2.3 內(nèi)參基因的穩(wěn)定性分析
2.3.1 Bestkeeper軟件分析結(jié)果
Bestkeeper軟件直接對基因表達的Ct進行分析,以標(biāo)準(zhǔn)差(SD)和調(diào)節(jié)系數(shù)(±x-fold)為衡量標(biāo)準(zhǔn),評判基因表達的穩(wěn)定性。將BPA誘導(dǎo)后的雙齒圍沙蠶體內(nèi)6對內(nèi)參基因Ct值帶入Bestkeeper軟件進行分析,結(jié)果如表2所示,可以看出除GADPH的SD(±Cq)值大于1,其余5個候選內(nèi)參基因的值均小于1。SD數(shù)值越小表示基因表達越穩(wěn)定,如若大于1,則說明該基因不能穩(wěn)定表達。根據(jù)軟件默認(rèn)標(biāo)準(zhǔn)可知,除GADPH外其他基因均符合作為內(nèi)參基因的標(biāo)準(zhǔn),其中表達最穩(wěn)定的是Actin和RPL5。
2.3.2 GeNorm軟件分析結(jié)果
GeNorm軟件對內(nèi)參基因的2ΔCt值進行分析,計算出基因表達量的平均穩(wěn)定值M,M值越小越穩(wěn)定,M值若大于1.5,則說明該基因不能穩(wěn)定表達。
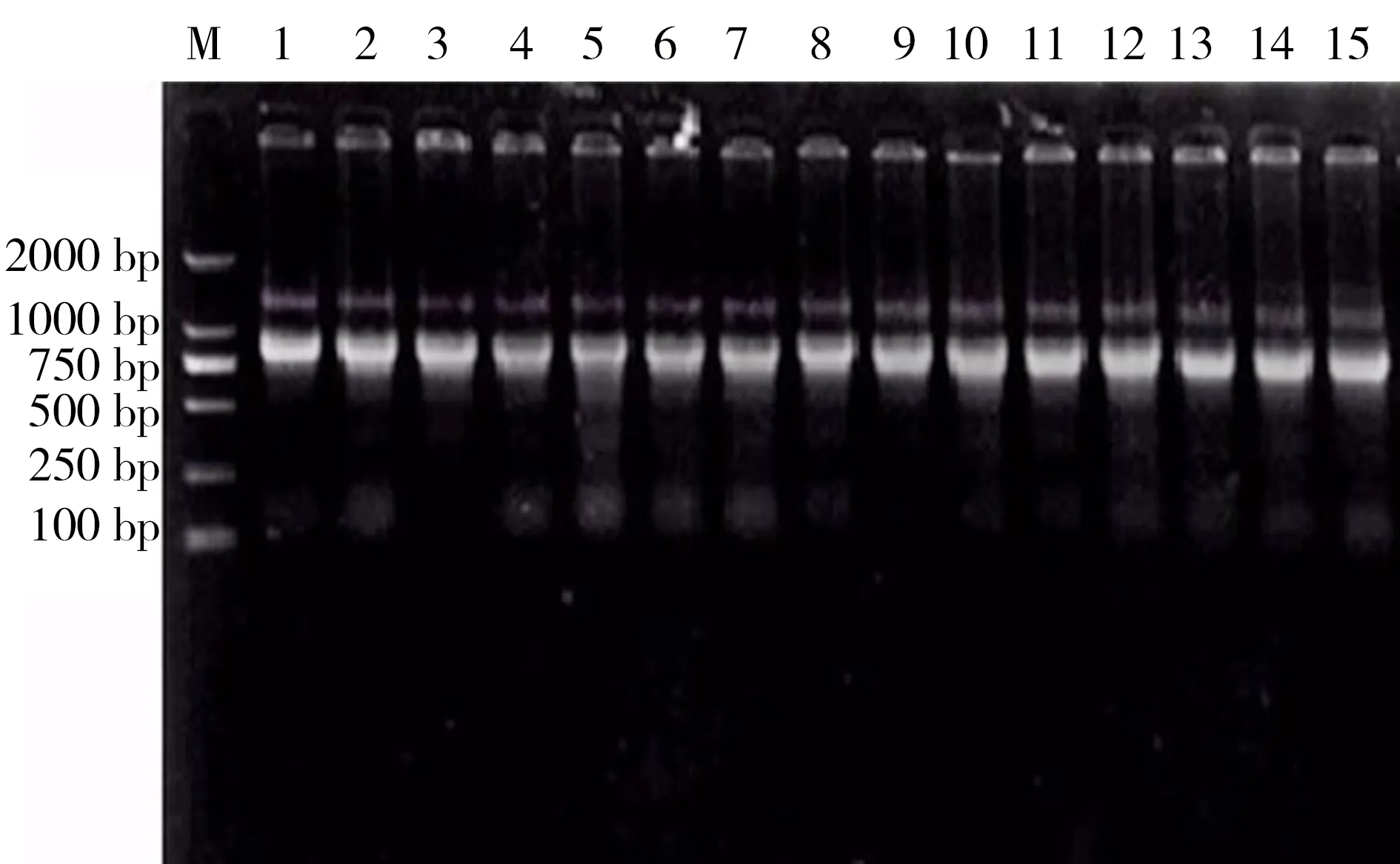
圖1 雙齒圍沙蠶總RNA注:M為DL2000 DNA Marker;1~15為海水對照組RNA提取結(jié)果。Fig. 1 Total RNA of P. aibuhitensisNote: M, DL2000 DNA Marker; 1-15, The results of extraction of total RNA in control group.
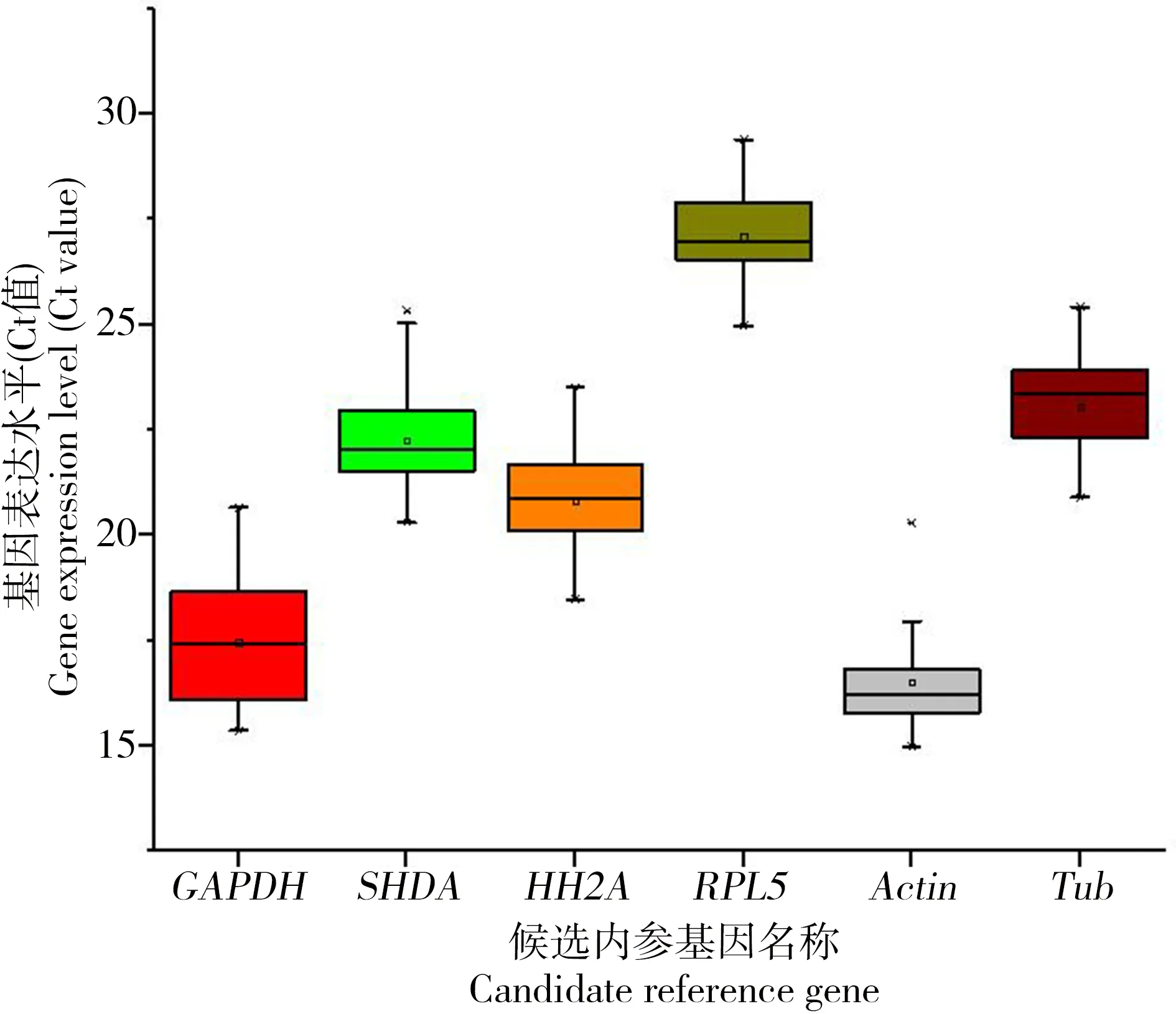
圖2 雙齒圍沙蠶實時定量PCR分析中各候選基因的表達水平注:圖中數(shù)據(jù)為平均值±標(biāo)準(zhǔn)誤。Fig. 2 Expression levels of candidate reference genes in P. aibuhitensisNote: Data in the figure are mean ± SE.
如圖3中所示,本實驗中6對內(nèi)參基因的M值從大到小分別為GAPDH(1.24)>HH2A(1.17)>Tub(1.01)>Actin(0.94)>RPL5(0.87)>SDHA(0.86),均小于1.5,表明6個內(nèi)參基因都可以穩(wěn)定表達,其中RPL5和SDHA是較為穩(wěn)定的2組內(nèi)參基因。除此之外,GeNorm軟件還可通過計算候選內(nèi)參基因的配對差異值(pairwise variations)Vn/n+1分析最適內(nèi)參基因數(shù)。在本實驗中Vn/n+1都大于0.15,但是V5/6最小為0.193(圖4),表明6個內(nèi)參基因數(shù)可以篩選出較為穩(wěn)定的內(nèi)參基因。
2.3.3 Normfinder軟件分析
Normfinder主要利用組內(nèi)方差和組間方差對內(nèi)參基因表達的穩(wěn)定值(stability value)進行分析。基因表達穩(wěn)定值越大,說明基因的穩(wěn)定性越差。本實驗分析結(jié)果如圖5所示,可以看出6個內(nèi)參基因表達穩(wěn)定性數(shù)值從大到小依次為Actin>SDHA>RPL5>Tub>HH2A>GAPDH,表明Actin的穩(wěn)定性最好,GAPDH的穩(wěn)定性最差。
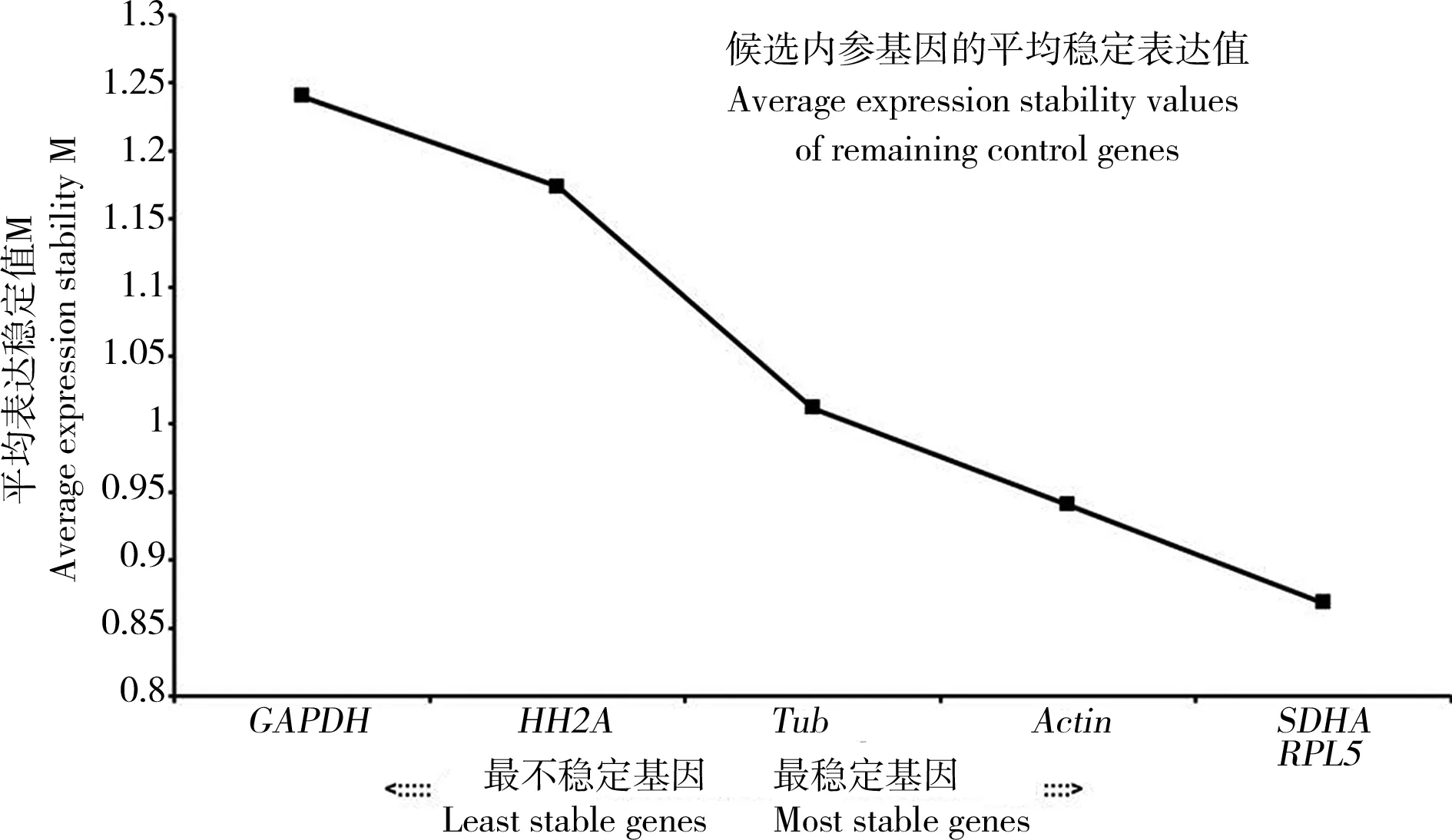
圖3 GeNorm軟件分析下雙酚A(BPA)誘導(dǎo)下雙齒圍沙蠶各內(nèi)參基因的表達穩(wěn)定值(M)Fig. 3 Expression stability values (M) of reference genes exposed to bisphenol A (BPA) in P. aibuhitensis analyzed by GeNorm software
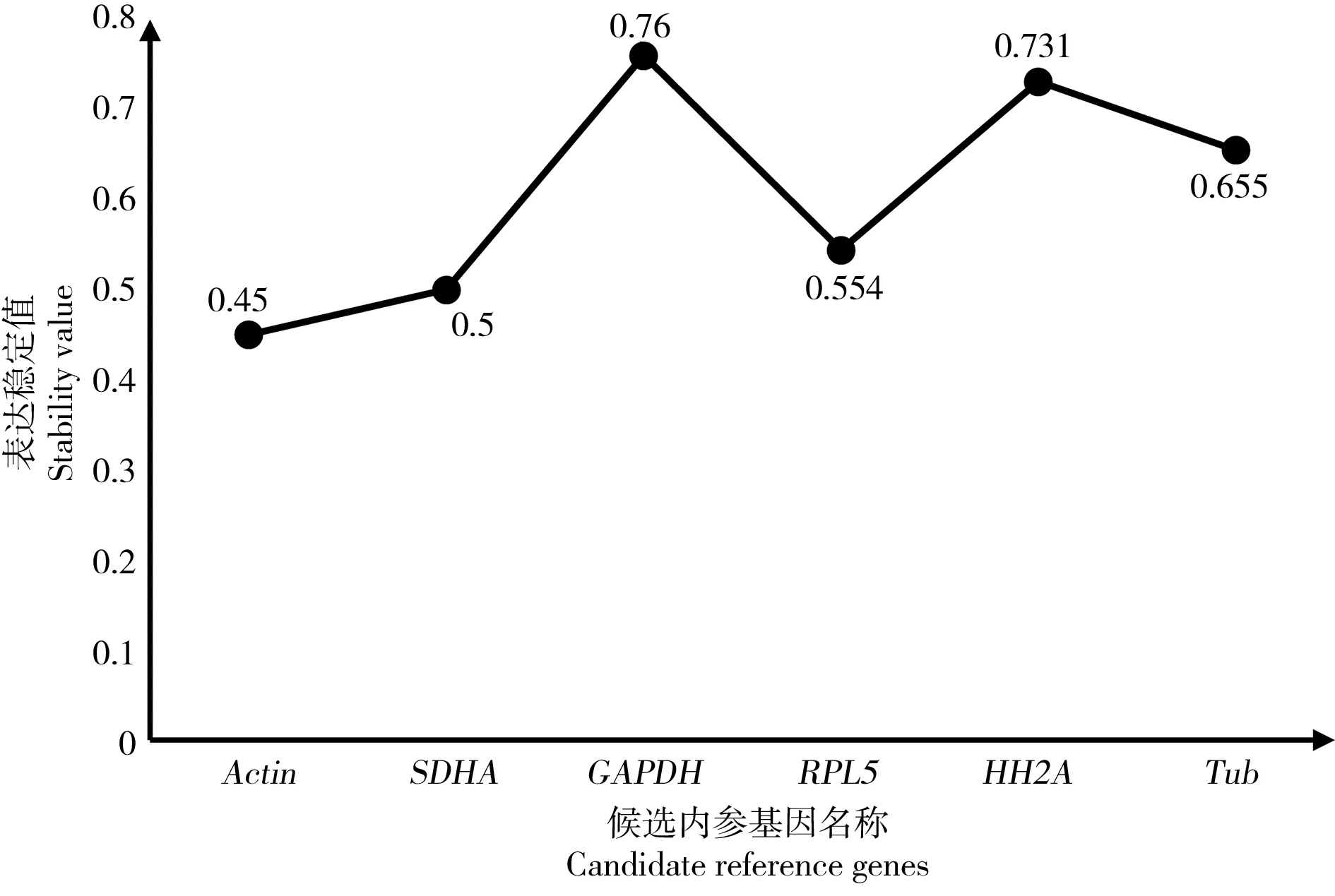
圖5 Normfinder軟件分析BPA誘導(dǎo)下雙齒圍沙蠶各內(nèi)參基因的表達穩(wěn)定值Fig. 5 Expression stability values of reference genes in P. aibuhitensis after exposure to BPA analyzed by Normfinder software

表2 Bestkeeper分析BPA誘導(dǎo)下雙齒圍沙蠶內(nèi)參基因表達穩(wěn)定性Table 2 The expression stability of reference genes under BPA exposure in P. aibuhitensis by Bestkeeper software
2.3.4 綜合分析
根據(jù)3種軟件給出的排名計算幾何平均數(shù),將所選6個基因進行綜合排名,結(jié)果如表3所示。可以看出Actin、SDHA和RPL5雖在不同軟件中排名各有不同,但穩(wěn)定性都較好。而Tub、HH2A和GAPDH的穩(wěn)定性較差。經(jīng)過計算平均值可以得出這6種候選內(nèi)參基因的穩(wěn)定性由高到低排名是Actin>SDHA>RPL5>Tub>HH2A>GAPDH。
3 討論(Discussion)
隨著分子生物學(xué)技術(shù)的發(fā)展,實時熒光定量PCR(qRT-PCR)憑借其較好的精確性和靈敏性在研究基因表達方面得到廣泛的應(yīng)用。在進行qRT-PCR的時候,為了獲得更為可靠的結(jié)果,不僅要控制實驗設(shè)計和操作過程中的誤差,更要選擇合適的內(nèi)參基因[23]。理想條件下的內(nèi)參基因需要有以下特點:1)在同一物種的不同發(fā)育階段和不同的組織器官中的表達量不存在顯著差異[24];2)不受內(nèi)源或者外源性因素的影響,在誘導(dǎo)條件下表達穩(wěn)定;3)所選取的內(nèi)參基因與目的基因的表達水平相近;4)選擇的內(nèi)參基因不存在假基因(pseudo gene),從而避免基因組DNA的擴增[25]。但是在實際實驗過程中,符合以上所有條件的內(nèi)參基因基本不存在,在選取內(nèi)參基因的時候僅根據(jù)文獻來篩選是遠遠不夠,還應(yīng)該在特定的測試條件下仔細分析和評估選定內(nèi)參基因的穩(wěn)定性。目前常用的內(nèi)參基因包括Actin、Tub、EF1α、GADPH以及HH2A等,其中Actin是最為常用的內(nèi)參基因。曹滕飛等[26]在對氨態(tài)氮誘導(dǎo)下的成體菲律賓蛤仔鰓組織中內(nèi)參基因的研究時發(fā)現(xiàn),在18SrRNA、Actin、Tub、EF1α、Ub和CyPA6個候選內(nèi)參基因中,表達最穩(wěn)定基因是EF1α,Actin的表達也比較穩(wěn)定,沒有出現(xiàn)較大的差異,說明在同一組織器官中,Actin在誘導(dǎo)前后的表達量差異不大。張麗莉等[15]的研究顯示,雜色鮑在變態(tài)過程及幼蟲甲狀腺激素受體(TR)干擾下,Actin的表達量均有較高和穩(wěn)定的水平,因此Actin可以作為研究雜色鮑發(fā)育和甲狀腺激素受體干擾時的內(nèi)參基因。徐建波等[27]亦對雜色鮑的變態(tài)過程中3個階段的幼蟲進行內(nèi)參基因的分析,發(fā)現(xiàn)Actin的表達十分穩(wěn)定,在RNAi條件下,Actin的穩(wěn)定性僅次于RPS9,更進一步的驗證了Actin在雜色鮑變態(tài)過程中可以當(dāng)作內(nèi)參基因使用。除此之外,Zheng等[28]在對牙鲆(Paralichthysolivaceu)的內(nèi)參基因研究也證明了Actin作為通用內(nèi)參基因的穩(wěn)定性很高。本實驗室之前的研究發(fā)現(xiàn),無論在銅、鎘等無機重金屬,還是在石油烴和溴氰菊酯等有機污染物的脅迫下,雙齒圍沙蠶Actin的表達都相對穩(wěn)定[18-19]。在本實驗結(jié)果,Bestkeeper和Normfinder軟件分析發(fā)現(xiàn),Actin是最穩(wěn)定的內(nèi)參基因,而在GeNorm軟件中獲得的最穩(wěn)定的內(nèi)參基因是SDHA,Actin僅排在第3位。雖然不同軟件算法存在少許差異,從表3可以看到Actin的穩(wěn)定性排名在3種軟件的分析結(jié)果中均為位于前三,說明Actin不論是在表達豐度上還是表達的穩(wěn)定性上都是最好的。雖然SDHA的穩(wěn)定性排名也較高,但是其在雙齒圍沙蠶體內(nèi)的表達量沒有Actin高,因此推薦Actin作為雙齒圍沙蠶的通用內(nèi)參基因。

表3 BPA誘導(dǎo)下雙齒圍沙蠶候選內(nèi)參基因表達穩(wěn)定性排名Table 3 Ranks of the candidate reference genes for qRT-PCR in P. aibuhitensis under BPA exposure
然而在一些特定的條件下,Actin的表達量同樣不穩(wěn)定。如Xu等[16]證實在急性氨脅迫下,中國沿海長蛸中Actin的表達穩(wěn)定性較差,同時其表達量也存在較大差異。Zhong等[29]發(fā)現(xiàn),Actin的表達量在缺氧條件下波動很大,同時還指出GAPDH亦不適合在缺氧條件作為內(nèi)參基因使用。徐安定等[30]研究發(fā)現(xiàn)在缺氧條件下腦星形膠質(zhì)細胞中Actin的表達量明顯下降,而GAPDH表達卻是明顯升高的;由于Actin為肌動蛋白,在低氧的條件下其表達會受到一定程度的抑制,而GAPDH作為糖酵解的關(guān)鍵酶,在缺氧條件下表達量會顯著升高。因此在缺氧以及影響機體氧代謝的條件下這2個內(nèi)參基因不適合作為內(nèi)參基因。在本實驗中,GAPDH表達量很高僅次于Actin,但其表達穩(wěn)定性在3個軟件評估時均為最不穩(wěn)定,特別在Bestkeeper軟件分析時,其SD值大于1,故不推薦其作為內(nèi)參基因使用。
本實驗同時利用GeNorm軟件進行最適內(nèi)參基因數(shù)Vn/n+1的分析。當(dāng)Vn/n+1<0.15時說明無需引入更多對內(nèi)參。在本實驗中,雖然可以看到V5/6值最小,但是三組Vn/n+1值均大于0.15,這表明繼續(xù)引入更多的內(nèi)參基因有可能會降低標(biāo)準(zhǔn)化因子的配對差異值,還需要進一步實驗驗證。
綜上所述,本研究使用了目前最常見的3種內(nèi)參基因穩(wěn)定性評價軟件Bestkeeper、GeNorm和Normfinder對BPA誘導(dǎo)下雙齒圍沙蠶的6個候選內(nèi)參基因進行穩(wěn)定性分析。通過綜合表達的穩(wěn)定性和表達量的差異分析來看,Actin不僅在表達豐度還是穩(wěn)定性上都較好,推薦作為內(nèi)參基因使用。本研究將為探究雙酚A對海洋無脊椎動物沙蠶的分子毒性機制提供一定的數(shù)據(jù)支持。

