乳源鋅螯合肽酶解制備及其螯合特性分析
鄺小賢,張敏婕,何冠浩,盧迪勛,譚俊豪,康夢,劉飛,方祥,曹庸,苗建銀*
1(華南農業大學 食品學院,廣東 廣州,510642)2(廣東省功能食品活性物重點實驗室,廣東 廣州,510642) 3(東北農業大學 食品學院,黑龍江 哈爾濱,150030)4(廣州綠萃生物科技有限公司,廣東 廣州,510665)
自1979年發現了具有類嗎啡活性的短肽[1]以來,酪蛋白來源的生物活性肽研究進展迅速,日趨成為乳品領域研究的焦點[2-4]。酪蛋白占牛乳蛋白總量的78.8%[5],其中含有人體必需的8種氨基酸。經不同的酶水解可得到具有不同生物活性[6]的酪蛋白肽,是不同氨基酸的混和物。與游離氨基酸相比,這些小分子多肽更易被機體較快地吸收利用,而且它們具有的多種特殊生理功能也十分有價值,如免疫調節、延緩衰老、促進礦物質吸收[7]等。
人體中元素鋅含量占體重的0.002%,是重要的微量金屬元素之一,是機體內近2 000種轉錄因子的必需組成部分。在人類酶中,鋅與超過300種代謝酶的活性有關[8]。因此細胞中的鋅直接調節著這些酶的活性,在機體代謝中有重要作用[9]。然而,由于人體內的吸收代謝種種因素限制而造成的鋅缺乏,已成為我國及許多發展中國家的公共衛生問題[10]。缺鋅最常見的癥狀是味覺減退、厭食、人體細胞免疫功能低下,以及消瘦、下肢浮腫、皮膚潰瘍和生長延遲[11]。近年來,利用鋅肽螯合技術提高鋅的吸收成為研究熱點[12-13],因為螯合物結構為Zn2+嵌合在2個肽分子中,肽分子像“蟹鉗”一樣鉗著Zn2+,形成穩定的螯合結構,利用可以直接通過腸黏膜細胞進入血液的小肽帶著Zn2+一起進入機體進而促進人體吸收。機體通過合成蛋白質的中間產物肽鋅復合物,在提高鋅離子吸收效率的同時,也減少了許多生化過程及能量消耗,具有較高的生物學效價[14],為促鋅吸收活性物質的研究提供基礎。
水解酪蛋白的方法主要有3種:物理法,化學法,酶解法。物理水解一般有加熱和高溫兩種,其中HUSTINX等[15-16]對加熱法水解酪蛋白進行了探討。而化學水解主要是利用酸、堿進行水解,楊葉昆等[17]用鹽酸對酪蛋白的水解實驗中,酪蛋白的水解度約為75%。當前應用最為普遍的方法是酶解法[18],因酶解法的條件溫和,水解過程易于控制,水解產生的副反應小,水解產物氨基酸組成更接近原料,是水解酪蛋白的最佳方法[19]。人體消化道中酪蛋白的酶解常以胰蛋白酶為主,為模擬腸道消化機理,本研究將以胰蛋白酶進行實驗,優化胰蛋白酶對酪蛋白酶解程度以達到最佳促鋅吸收效果。
綜上,本文以牛乳酪蛋白為原料,以胰蛋白酶為水解酶進行水解工藝的研究,通過單因素實驗和正交試驗獲得酶解的最佳工藝條件,旨在得到含有最強活性的促鋅吸收蛋白肽,并對酶解物的分子質量分布及氨基酸組成進行分析,同時通過紫外掃描、傅里葉變換紅外光譜技術對肽鋅復合物的螯合特性進行研究。本研究可為乳源鋅螯合肽作為補鋅劑的開發和應用提供技術支持和參考。
1 材料與方法
1.1 材料與試劑
酪蛋白,廣州綠萃生物科技有限公司;胰蛋白酶(酶活力1.3×106U/g),諾維信(中國)生物技術有限公司;乙酸鋅(分析純),天津市福晨化學試劑廠;乙二胺四乙酸二鈉(分析純),天津市大茂化學試劑廠;其余試劑為國產分析純。
1.2 儀器與設備
pH計,賽多利斯科學儀器(北京)有限公司;HH-4數顯恒溫水浴鍋,金壇市華城海龍實驗儀器廠;HZS-H水浴振蕩器,哈爾濱市東聯電子科技開發有限公司;UV-3010紫外-可見光譜儀,日本日立公司;Vertex70傅立葉變換紅外光譜儀,布魯克公司;LC-10ATVP高效液相色譜儀,日本島津儀器有限公司;JA2003電子天平,上海舜宇恒平科學儀器有限公司;DHG-9070電熱恒溫鼓風烘干箱,上海齊欣科學儀器有限公司。
1.3 試驗方法
1.3.1 牛乳酪蛋白酶解物制備
稱取牛乳酪蛋白于5 mL離心管,調節pH,按預定加酶量加入胰蛋白酶,設定預定溫度后在水浴鍋中振蕩酶解。所得酶解物經90 ℃加熱10 min滅酶,冷卻至室溫,精確調pH至4.6,使未酶解的酪蛋白沉淀,隨后4 000 r/min離心20 min,取上清液即得牛乳酪蛋白酶解物。
1.3.2 單因素試驗
1.3.2.1 酶解時間對鋅螯合活性的影響
在加酶量0.5%(質量分數),底物質量濃度60 g/L,pH 8.0,酶解溫度50 ℃條件下分別酶解1、2、3、4、5、6 h, 滅酶、離心,測定離心上清液鋅螯合活性。
1.3.2.2 加酶量對鋅螯合活性的影響
調節pH至8.0,底物質量濃度60 g/L,分別按質量分數0.3%、0.5%、0.7%、0.9%加入酶,50 ℃條件下酶解3 h,滅酶、離心,測定離心上清液鋅螯合活性。
1.3.2.3 底物濃度對鋅螯合活性的影響
調節pH至8.0,加酶量0.5%,底物質量濃度分別為40、60、80、100 g/L的酶解體系于50 ℃條件下酶解3 h,滅酶、離心,測定離心上清液鋅螯合活性。
1.3.2.4 溫度對鋅螯合活性的影響
調節pH至8.0,加酶量為0.5%,底物質量濃度60 g/L,分別在40、45、50、55 ℃下酶解3 h,滅酶、離心,測定離心上清液鋅螯合活性。
1.3.2.5 酶解pH對鋅螯合活性的影響
在加酶量0.5%,底物質量濃度60 g/L,pH分別為7.5、8.0、8.5、9.0,酶解溫度50 ℃條件下酶解3 h,滅酶、離心,測定離心上清液鋅螯合活性。
1.3.3 正交試驗
以酶解物鋅螯合活性為評價指標,在單因素試驗基礎上選取底物濃度、酶解溫度、酶解pH、加酶量為試驗因素,選用L9(34)正交表進行4因素3水平正交實驗優化,確定胰蛋白酶酶解牛乳酪蛋白制備鋅螯合肽的最佳條件。
1.3.4 鋅螯合活性測定
1.3.4.1 肽鋅復合物制備
根據本課題組螯合條件優化結果,取3 mL 0.05 mol/L 的Zn2+溶液(乙酸鋅溶液)于50 mL離心管中,加入3 mL牛乳酪蛋白酶解物,將混合液調pH至5.0。47 ℃振蕩水浴80 min,加入5倍體積無水乙醇混勻以便去除游離鋅。混合物4 000 r/min離心20 min, 所得沉淀用20 mL無水乙醇再次混勻清洗,4 000 r/min 離心20 min,沉淀即肽鋅復合物。隨后在55 ℃烘箱干燥至恒重。
1.3.4.2 鋅螯合率測定
采用乙二胺四乙酸滴定法。將在步驟1.3.4.1獲得的每份肽鋅復合物稱量后,加入10 mL NH3-NH4Cl緩沖溶液溶解,后滴入2滴鉻黑T指示劑,用0.01 mol/L的乙二胺四乙酸二鈉滴定,溶液由紫色變為淡藍色停止滴定,記錄消耗乙二胺四乙酸二鈉的體積,按公式(1)、(2)計算鋅的螯合率:
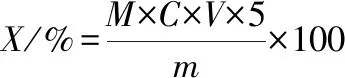
(1)
式中,X,肽鋅復合物含鋅量,%;M為鋅的摩爾質量,g/mol;C,乙二胺四乙酸二鈉的濃度,mol/L;V,滴定乙二胺四乙酸二鈉的體積,mL;m,稱取肽鋅復合物的質量,g。
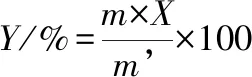
(2)
式中,Y,鋅的螯合率,%;X,肽鋅復合物含鋅量,%;m,肽鋅復合物的質量,g;m’,鋅的投入量,g。
1.3.5 肽相對分子質量分布測定
待測樣品溶液經0.45 μm微孔過濾膜過濾后上TSKgel G2000色譜柱,以胰島素(MW5808)、桿菌肽(MW1422)、甘氨酸-甘氨酸-酪氨酸-精氨酸(MW451)、甘氨酸-甘氨酸-甘氨酸(MW=189)為標準品,測定樣品的相對分子質量分布。高效液相色譜條件:島津高效液相色譜儀(配紫外檢測器);色譜柱為TSKgel G2000 SWXL(300 mm×7.8 mm);流動相為V(乙腈)∶V(水)∶V(三氟乙酸)=20∶80∶0.1;檢測波長為220 nm;流速為0.5 mL/min;柱溫為室溫。
1.3.6 氨基酸組成分析
參照GB 5009.124—2016食品安全國家標準對樣品中氨基酸進行測定分析。
1.3.7 紫外掃描分析
用去離子水將鋅螯合肽酶解物及肽鋅復合物分別配制成10 g/L溶液,采用全自動紫外掃描儀分別進行全波長掃描,掃描200~400 nm,分析小肽進行螯合反應前后其吸光度的變化情況,以去離子水作為空白調零。
1.3.8 傅里葉變換紅外光譜分析[20]
分別取鋅螯合肽酶解物以及肽鋅復合物樣品經提純后,除去樣品中的游離水或結晶水,將固體樣品2 mg和干燥的光譜純KBr 200 mg放入瑪瑙研缽中,混合研磨均勻(在紅外燈下進行),使其粒度在2.5 μm以下,裝入壓片模具,抽氣加壓,壓力約為60 MPa,維持5 min。卸掉壓力得到透明的薄片,放入島津紅外光譜儀進行掃描分析,在400~4 000 cm-1測定其紅外吸收光譜。
2 結果與分析
2.1 單因素試驗
2.1.1 酶解時間對鋅螯合活性的影響
酶解時間對牛乳酪蛋白酶解物鋅螯合率的影響如圖1所示。
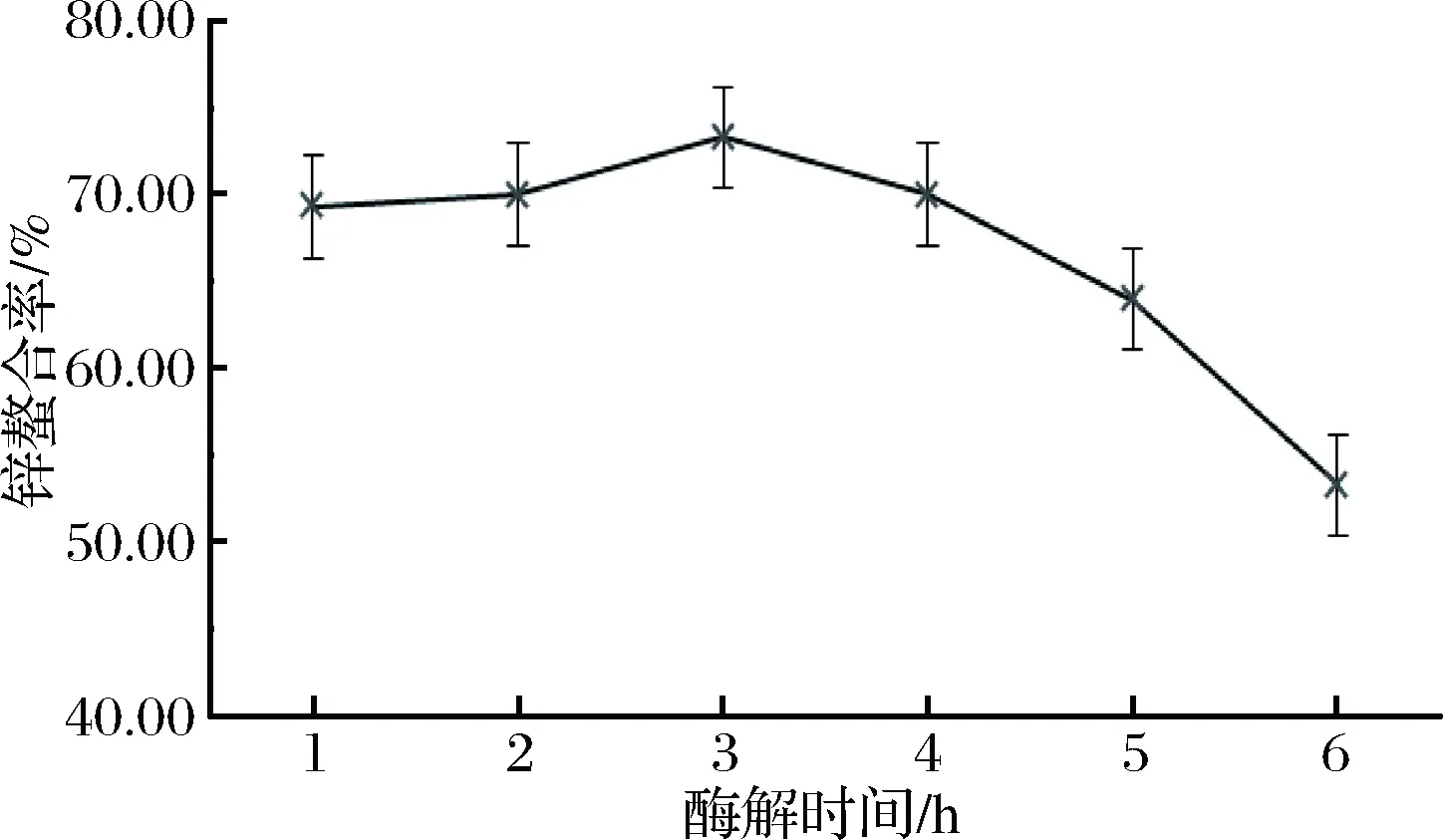
圖1 酶解時間對牛乳酪蛋白酶解物鋅螯合率的影響Fig.1 Effect of enzymatic hydrolysis time on zinc chelation rate of casein hydrolysate
在1~3 h,鋅螯合率隨酶解時間的延長緩慢增長,當酶解時間為3 h時,酶解物鋅螯合率達到最大值73.30%。隨著酶解時間繼續延長,鋅螯合率急速下降。因此可知,酶解時間適當,酶解程度適中時,酶解物鋅螯合率更高,而當酶解時間越長,酶解物鋅螯合率反而降低。所以選取3 h為酶解最適時間。
2.1.2 pH值對鋅螯合活性的影響
在其他因素不變的條件下,圖2表示在不同的酶解pH下測定pH值對牛乳酪蛋白酶解物鋅螯合率的影響。由圖2可知,隨pH的增大,牛乳酪蛋白酶解物鋅螯合率的總趨勢逐漸增高。在pH=8.0時,鋅螯合率達到最大值74.50%。當pH增大時,鋅螯合率有所下降并波動。因此,選取pH=8.0為酶解的最適pH。

圖2 酶解pH對牛乳酪蛋白酶解物鋅螯合率的影響Fig.2 Effect of pH on zinc chelation rate of casein hydrolysate
2.1.3 酶解溫度對鋅螯合活性的影響
不同酶解溫度對酶解物鋅螯合率的影響見圖3。可以看出,酶解溫度在50 ℃時,鋅螯合率出現峰值,鋅螯合率為83.79%,繼續升高溫度至55 ℃,鋅螯合率下降較快。原因可能是酶解溫度高于50 ℃時,升溫對酶活力有抑制作用,影響酶解效果。最終確定50 ℃為該酶解實驗的最適溫度。

圖3 酶解溫度對牛乳酪蛋白酶解物鋅螯合率的影響Fig.3 Effect of temperature on zinc chelation rate of casein hydrolysate
2.1.4 底物質量濃度對鋅螯合活性的影響
不同底物質量濃度對酪蛋白酶解物鋅螯合率的影響如圖4。可以看出,當底物質量濃度為40 g/L時,酶解物鋅螯合率較低,增加為60 g/L時,鋅螯合率達到最大值為79.14%。繼續增加到80 g/L以后,酶解物鋅螯合率趨于平穩。因此,確定最優酶解底物質量濃度是60 g/L。
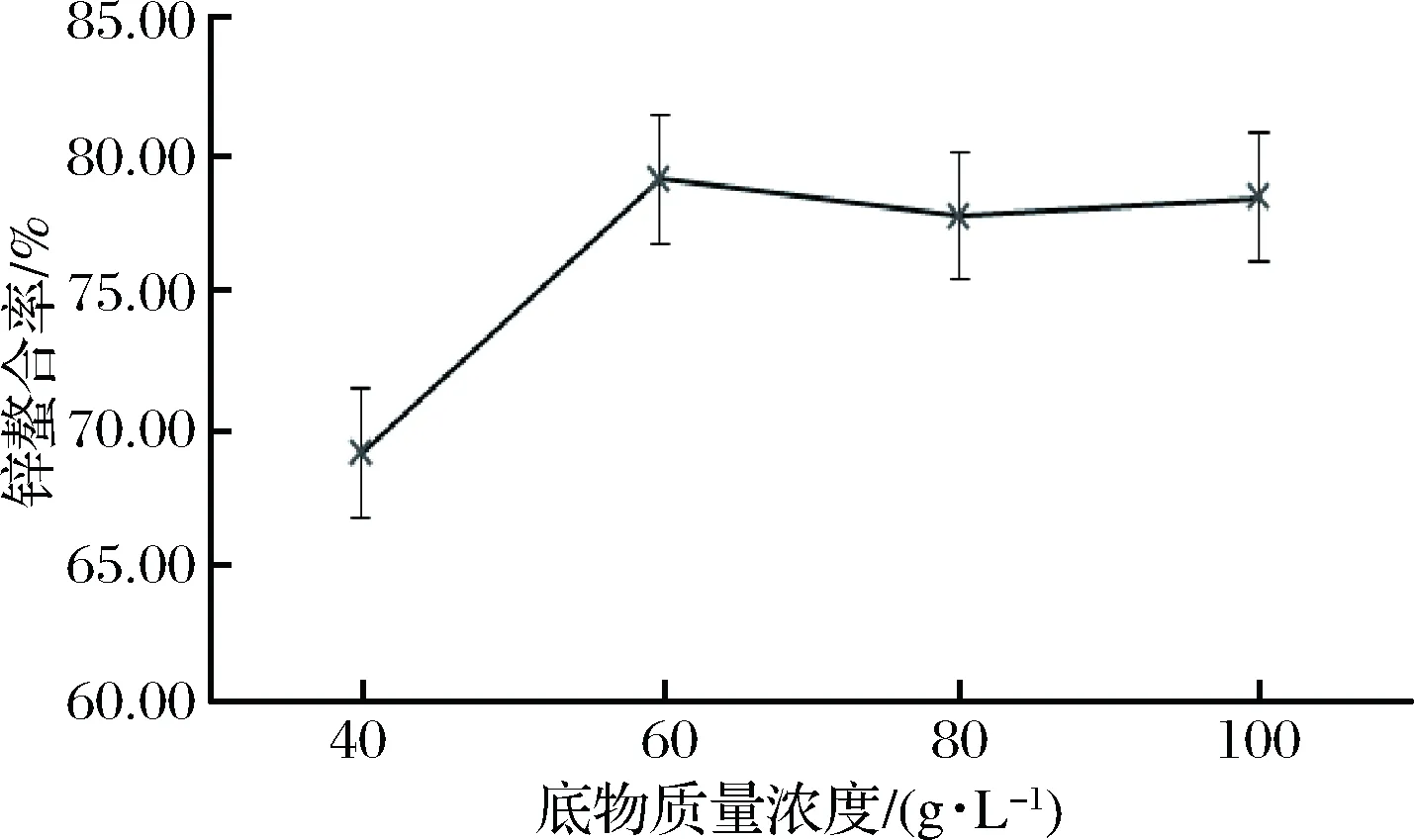
圖4 底物質量濃度對牛乳酪蛋白酶解物鋅螯合率的影響Fig.4 Effect of substrate concentration on zinc chelation rate of casein hydrolysate
2.1.5 加酶量對鋅螯合活性的影響
圖5表示了不同加酶量對酪蛋白酶解物鋅螯合率的影響。一般而言,在底物濃度充足的情況下,加酶量越多,酶解效果越好。可以看出加酶量為0.5%時,酶解物鋅螯合率最高,繼續增加胰蛋白酶用量,鋅螯合率反而下降,原因可能是酶解過于徹底,分子質量小的分子肽螯合活性低。綜合實驗效果和經濟考慮,加酶量為0.5%時最為合適。

圖5 加酶量對牛乳酪蛋白酶解物鋅螯合率的影響Fig.5 Effect of enzyme content on zinc chelation rate of casein hydrolysate
2.2 正交優化試驗
在單因素試驗基礎上,以底物濃度、酶解溫度、酶解pH、加酶量為試驗因素,設置3個不同的水平,如表1所示。

表1 影響胰蛋白酶酶解酪蛋白因素的 正交試驗水平設計Table 1 Orthogonal design of factors affecting casein Hydrolysis by trypsin
選用L9(34)正交表,安排9組試驗。以酶解物鋅螯合率為評定指標,確定胰蛋白酶酶解牛乳酪蛋白的最佳條件組合和各條件影響效果排序。
由表2中R值可知,試驗中加酶量對牛乳酪蛋白酶解物鋅螯合率影響最大,其次為酶解pH,而影響最小為酶解溫度。這4個因素的主次關系是加酶量>酶解pH>底物質量濃度>酶解溫度。胰蛋白酶水解牛乳酪蛋白的最佳工藝組合為A2B3C3D3,即:底物質量濃度70 g/L,初始pH 8.5,溫度50 ℃,加酶量為0.60%。為驗證正交試驗優選工藝條件,將優選組合進行驗證試驗。酶解時間均采取3 h。通過試驗得出鋅螯合率為87.78%。該優選結果為胰蛋白酶水解牛乳酪蛋白的最佳工藝條件,即酪蛋白質量濃度70 g/L, 加酶量0.60%,初始酶解pH 8.5,于50 ℃下酶解3 h,最終水解產物中鋅螯合率達到實驗組中的最大值,87.78%。
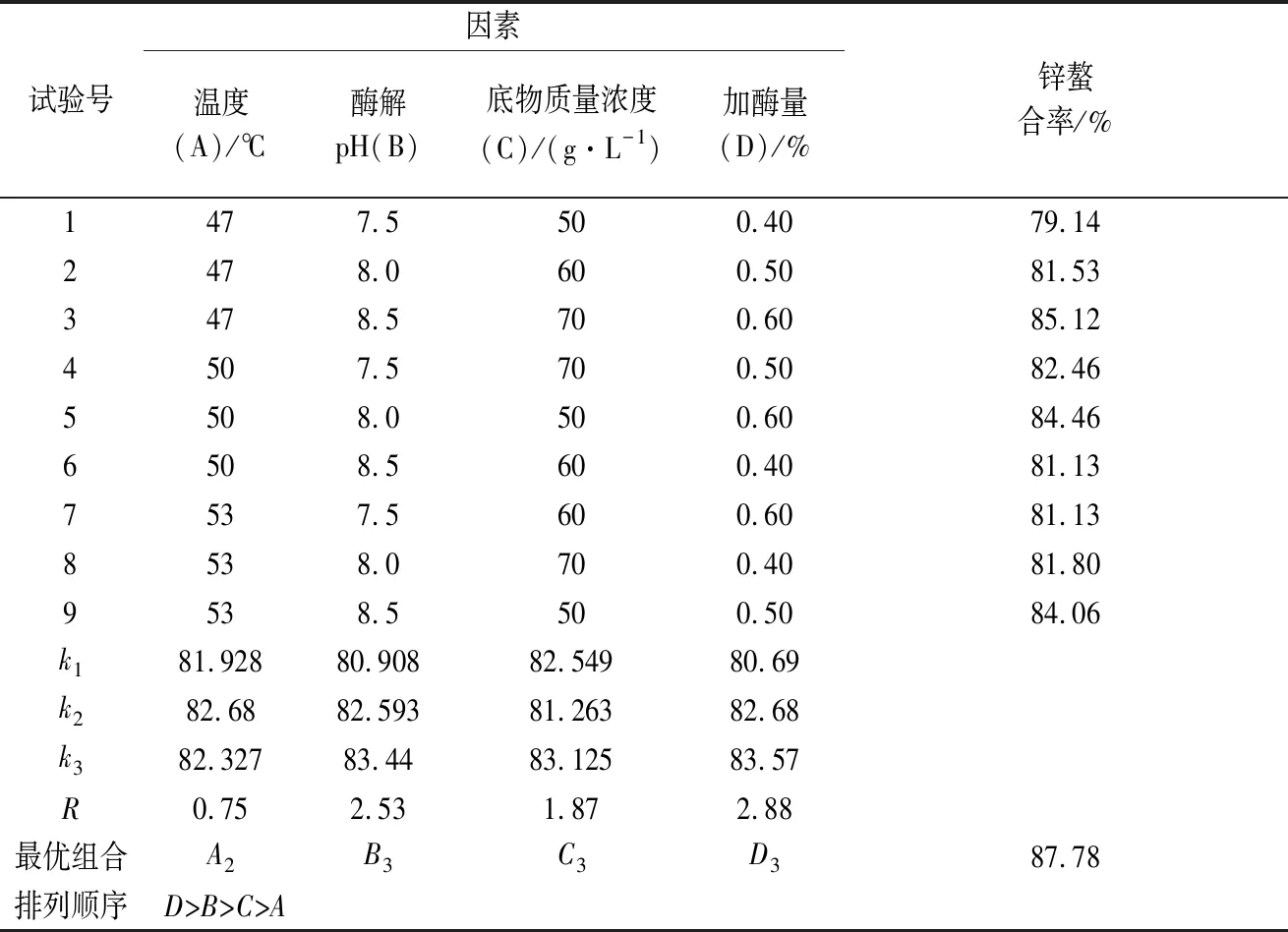
表2 胰蛋白酶水解牛乳酪蛋白的正交優化試驗結果Table 2 Results of orthogonal optimization test on hydrolysis of casein from milk by trypsin
2.3 牛乳酪蛋白酶解物分子質量分布
表3為在最優組合條件下酶解后,利用高效凝膠過濾色譜法檢測的牛乳酪蛋白酶解物的分子質量結果。根據結果可知,分子質量>3 000 Da的肽類僅占4.53%,而分子質量<1 000 Da的小分子肽占65.26%,分子質量<500 Da的酪蛋白酶解物占了39.47%, 按照氨基酸平均相對分子質量為137 Da計算,酶解物主要由八肽以下的小分子肽段構成,并且四肽至八肽所占比例最高。可知牛乳酪蛋白酶解充分,大部分酶解物分子質量較小。表3可表明,酪蛋白酶解物作為螯合反應的蛋白源較好,因肽的分子質量越小越容易與金屬離子反應形成水溶性螯合物[21-22],推測因分子質量小可以暴露多肽內部的活性基團[23]或肽鏈的空間位阻小。

表3 牛乳酪蛋白酶解物分子質量分布Table 3 Molecular weight distribution of casein hydrolysates in milk
2.4 牛乳酪蛋白酶解物氨基酸組成分析
肽的金屬離子螯合能力與肽的氨基酸組成、羧基和酸性氨基酸的側鏈氨基等有關[24]。由表4可知,乳源酪蛋白酶解物的氨基酸總量為84.21%(質量分數)。其中,谷氨酸含量最多,達到了17.26%,其次為脯氨酸9.33%,賴氨酸、亮氨酸等含量也較高。從酶解物的氨基酸含量可以發現,除苯丙氨酸含量稍低外,其他氨基酸基本接近人體必需氨基酸比例,具有較高營養價值。
表4 牛乳酪蛋白酶解物中多肽的氨基酸測定結果 單位:%

注:酸水解處理樣品中色氨酸全破壞,胱氨酸、蛋氨酸被部分破壞,檢測結果會不準。檢測結果為氨基酸質量分數。
已有研究[24]表明,組氨酸(His)、賴氨酸(Lys)和脯氨酸(Pro)等有較高的金屬螯合活性。STORCKSDIECK等[25]研究表明,當蛋白質或肽中富含谷氨酸(Glu)時,易與金屬離子結合,因谷氨酸的γ-COO-[26]易與金屬離子結合。同時研究[20]表明,金屬離子(Cu2+,Zn2+,Ni2+)易與肽或蛋白質表面的組氨酸咪唑基結合,且組氨酸殘基越多,肽的鋅螯合率越大。而CHEN和PARK等分離出的金屬螯合生物活性肽中均含有組氨酸[27-28],本實驗酪蛋白酶解物中也含一定量組氨酸。總之,本實驗測定結果在一定程度上驗證了以上研究,谷氨酸、賴氨酸、脯氨酸有較高含量,其中如谷氨酸結構中含有2個羧基,與Zn2+有較好的螯合能力。
2.5 紫外掃描分析
據ZHANG等[29]的研究,在螯合物中過渡金屬離子因會吸收紫外區的某一部分波長的光而發生電子的躍遷,配體內部也可能因吸收紫外光而發生躍遷。而螯合物中的配合體內部電子的躍遷與游離配位體內部電子的躍遷時要求的能量不相同,即吸收光的波長會發生相應改變,所以可以利用紫外光譜掃描方法反映不同條件下的鋅的螯合情況。
由圖6可知,鋅螯合肽酶解物和肽鋅復合物同濃度的紫外吸收光譜圖顯示的吸收波長及強弱有所不同,在螯合后肽鋅復合物的紫外吸收光譜發生了藍移,峰強度變小,可能因為鋅螯合肽配位后電子云向Zn2+移動,使得多肽中某些氨基酸的共扼效應強度降低[30]:肽鋅復合物在200~250 nm波長處的吸收均比鋅螯合肽酶解物的弱,可能是Zn2+與羰基(C=O)產生了絡合作用,影響了羰基(C=O)n→δ*的電子躍遷所導致[20];在250~300 nm波長處的鋅螯合肽酶解物有一個很強的吸收峰,而肽鋅復合物此處吸收很弱,且趨于平緩,可能是Zn2+與配體(N—C—O)絡合后,影響了配體(N—C—O)δ→δ*的電子躍遷所導致[20]。肽鋅復合物在300 nm波長處后的吸收逐漸穩定,與鋅螯合肽相比較,肽鋅復合物的紫外譜圖發生了明顯變化,說明有鋅螯合肽與Zn2+有螯合反應的跡象。因為乙酸鋅的吸收峰在196.7 nm[31],而在300~400 nm波長沒有吸收峰,進一步確認有螯合物的生成,綜合比較與大豆多肽鋅螯合鹽的結果[31]較為相似,可得出肽鋅復合物是一種不同于鋅的新物質。
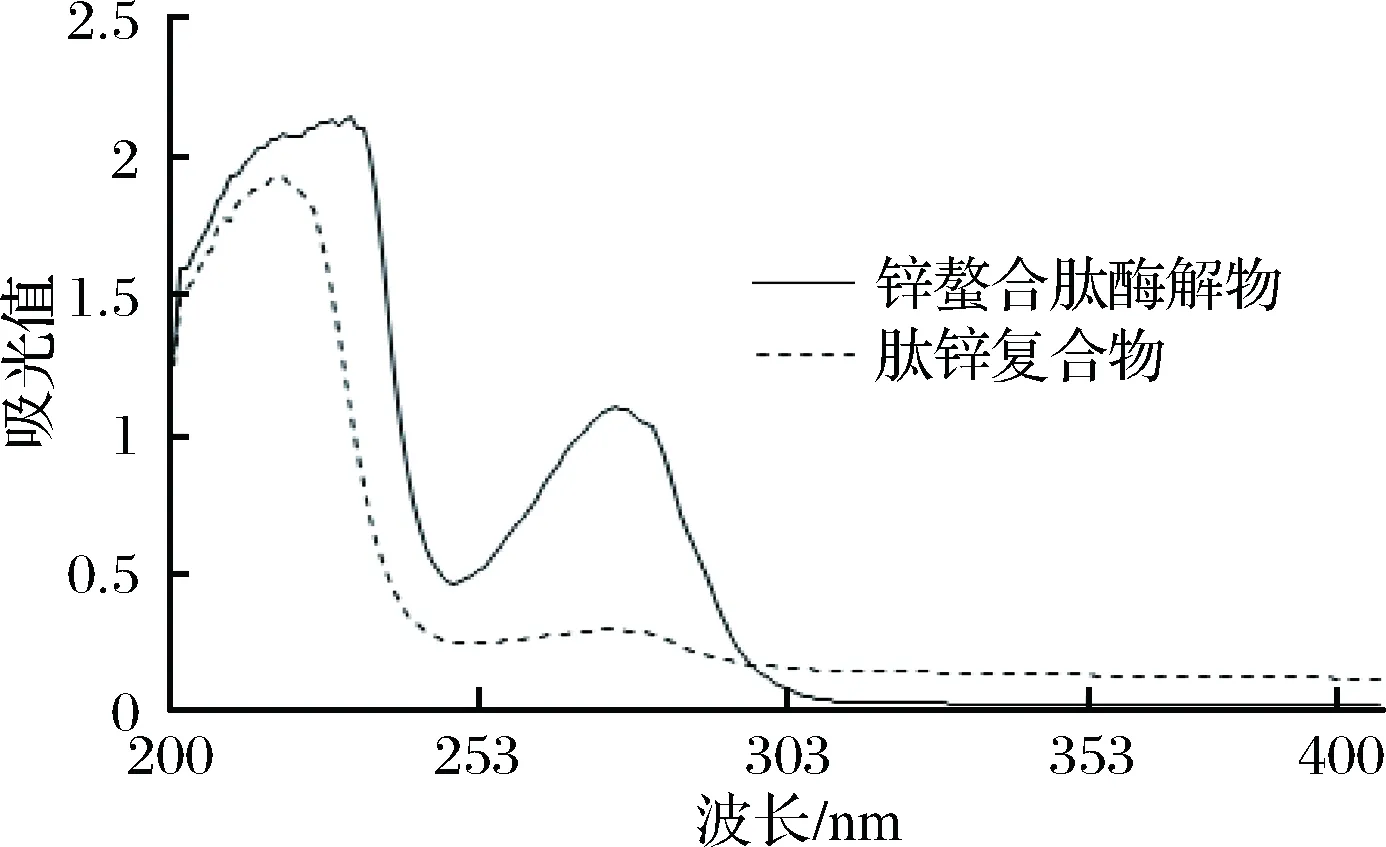
圖6 紫外吸收光譜圖Fig.6 UV spectra of Zinc chelating peptidase and Zinc peptide complex
2.6 傅里葉變換紅外光譜分析
肽鋅復合物與鋅螯合肽酶解物譜圖對比,一些主要的吸收峰發生明顯的位移,強弱也發生了相應的變化。如圖7所示,鋅螯合肽酶解物在3 297.96 cm-1處出現寬吸收峰,同時在指紋區922.47 cm-1處有O—H彎曲振動的吸收峰,推測有—COOH存在;而肽鋅復合物在3 300.5 cm-1處出現寬吸收峰,但總體變窄,且955~915 cm-1沒有吸收峰,說明肽鋅復合物中無裸露—COOH結構,—COOH可能與鋅離子形成了配位鍵,這與周亮和張智[22,32]的研究結果接近;而且,羧基離子反對稱振動于1 650 cm-1附近,羧基離子的對稱振動于1 400 cm-1附近,這兩處均有較強吸收峰。
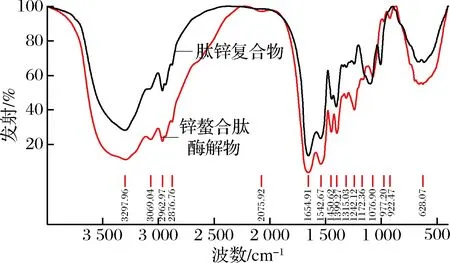
圖7 傅里葉變換紅外光譜圖Fig.7 FT-IR spectra of zinc chelating peptidase and peptide zinc complex
反對稱振動是判斷—COO-鍵共價程度的量度,而反對稱振動與對稱振動的差值γΔυ是羧基離子與金屬離子配位方式的有力判據[33],推測羧基可能也以共價建的方式與鋅離子結合。在譜圖中,—NH的吸收峰由3 297.96 cm-1移至3 300.05 cm-1,說明在螯合過程中,肽的—NH發生變化,其透射率明顯降低,推測Zn原子替代了H原子[34],這與玄依凡[24]的研究相似。肽鋅復合物在3 069.04 cm-1處NH4+吸收峰消失,而1 097.91 cm-1處出現了Zn—NH2吸收峰,說明—NH2已與Zn2+結合[35]。肽鋅復合物在1 097.91 cm-1處出現C—N鍵強吸收峰,可能這是氮原子的共用電子對對鋅作用而使C—N鍵偶極性的增強[22]。綜上所述,配合物以內鹽形式存在,Zn2+與O、N原子形成了配位鍵,即形成螯合物。
3 結論
(1)胰蛋白酶酶解牛乳酪蛋白制備鋅螯合肽最佳工藝為:底物質量濃度70 g/L,加酶量0.60%,初始pH 8.5,酶解溫度50 ℃,酶解時間3 h,在此條件下酶解物鋅螯合率為87.78%。
(2)根據最優酶解條件下酶解物的分子質量分布檢測結果,分子質量<1 000 Da的分子肽占65.26%,表明酪蛋白酶解物較大部分是小分子肽,而人體能夠更好地吸收小分子肽,因此肽鋅復合物中Zn2+能夠隨著小分子肽進入機體,更易于其吸收。根據酶解物的氨基酸組成測定發現,酶解物中的氨基酸富含易于與鋅螯合的谷氨酸等,有較強的鋅螯合能力,既補充了必需氨基酸又提高了鋅的生物利用率,是補鋅的較佳形式。
(3)通過紅外光譜、紫外掃描的測定分析,發現酪蛋白酶解物與肽鋅復合物的區別主要是一些吸收峰發生變化,配合物以內鹽形式存在,Zn2+與O、N原子形成了配位鍵;鋅肽螯合反應前后分子肽的吸收峰發生改變,表明分子肽與Zn2+確實發生了反應形成新的物質;因此本研究的肽鋅復合物為功能食品提供了一種新的功能制劑,具有一定的市場優勢和前景。

