左半肝切除術中應用Pringle法聯合左肝靜脈阻斷的臨床體會
胡朝輝,陳 熙,羅 華
(綿陽市中心醫院,四川 綿陽,621000)
控制出血是肝切除術成功的關鍵。術中大出血不但會延長手術時間,增加輸血率,導致腹腔鏡手術中轉開腹,還與術后并發癥及腫瘤復發密切相關[1]。盡管控制中心靜脈壓[2]、使用精細化的切肝器械可減少術中出血,但各種肝血流阻斷技術的合理應用仍是肝切除術中必不可少的組成部分。肝血流阻斷技術主要包括全入肝血流阻斷及肝靜脈阻斷。全入肝血流阻斷以Pringle法為代表,此法簡單、易行,效果確切,是肝切除術中最常用的方法[3]。肝靜脈阻斷目前仍存有爭議,部分學者認為肝靜脈阻斷可能加重肝實質淤血,在肝切除過程中導致更多出血[4]。其次,肝靜脈解剖過程中可能導致大出血及空氣栓塞。左肝靜脈位置表淺,顯露相對容易。因此本研究納入行左半肝切除的肝癌患者為研究對象,探討Pringle法聯合左肝靜脈阻斷在開腹與腹腔鏡肝切除術中的應用價值。
1 資料與方法
1.1 臨床資料 采用回顧性病例對照研究方法。收集2015年1月至2018年12月于我院行左半肝切除的139例肝細胞癌患者,其中男104例,女35例;平均(57.2±12.5)歲。71例術中采用Pringle法聯合左肝靜脈阻斷(觀察組),68例采用單純Pringle法阻斷(對照組)。比較兩組患者術前資料、手術相關指標、術后并發癥及術后住院時間。139例患者中,62例行開腹切除術,77例行腹腔鏡左半肝切除,將患者分為兩個亞組,分別對比開腹與腹腔鏡手術中觀察組與對照組術中、術后相關指標。分組情況見圖1。患者及家屬術前簽署手術知情同意書。
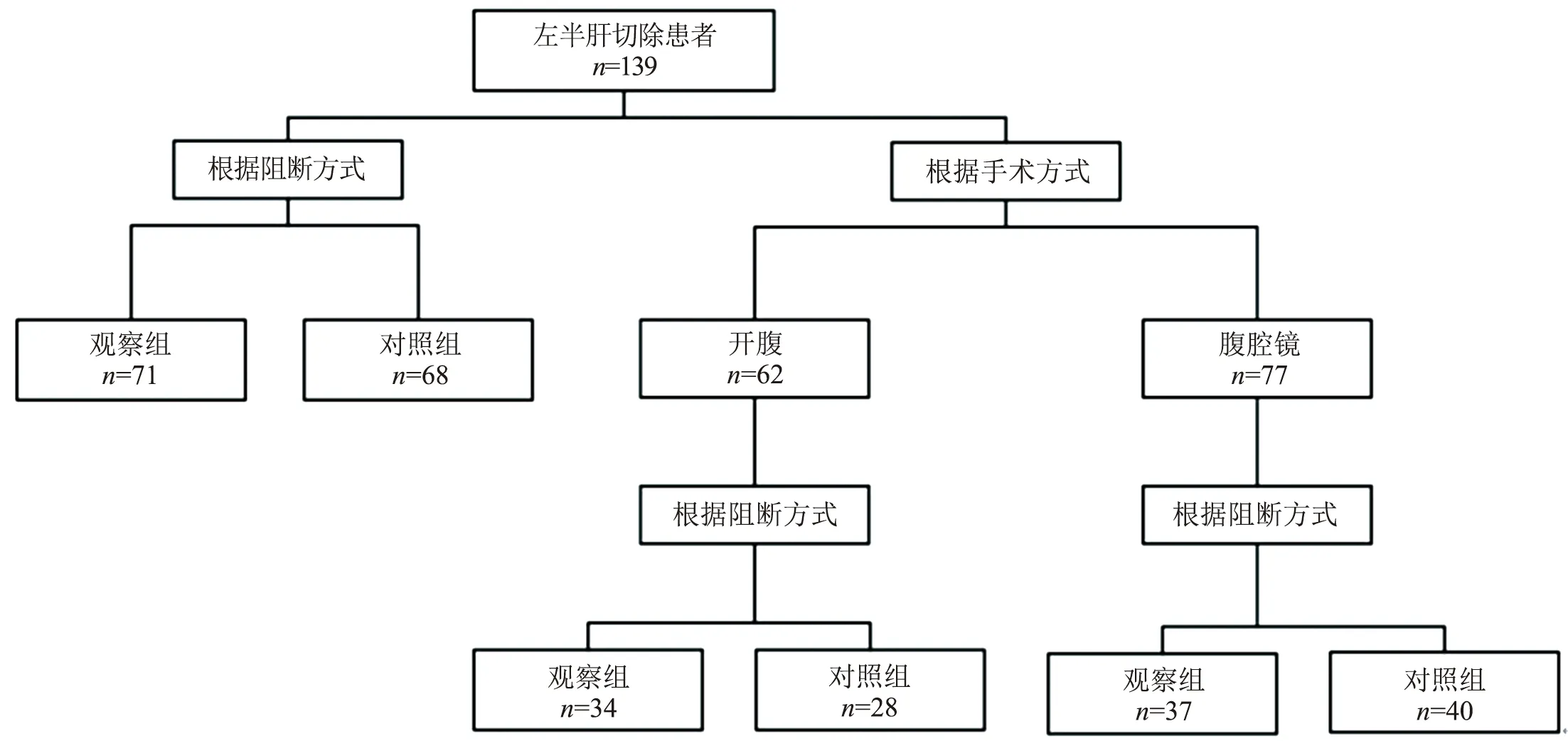
圖1 具體分組情況
1.2 納入與排除標準 納入標準:(1)腹腔鏡或開腹肝切除;(2)Child-Pugh評分A~B級;(3)術后病理學檢查證實為肝細胞性肝癌;(4)無肺、骨等遠處轉移;(5)臨床資料完善。排除標準:(1)Child-Pugh評分C級;(2)臨床資料缺失。
1.3 手術方法 開腹肝切除采用反“L”形切口。腹腔鏡肝切除采用五孔法,氣腹壓力維持在14~15 mmHg。超聲刀離斷肝圓韌帶、鐮狀韌帶、左冠狀韌帶及左三角韌帶、肝胃韌帶,觀察組患者將左外葉向右側掀起,于左肝靜脈根部離斷Arantius管,可容易地顯露肝左靜脈根部,用直角鉗分離出左肝靜脈,7號絲線結扎左肝靜脈[5],見圖2。兩組患者第一肝門套入尿管,以備阻斷,阻斷采用間斷Pringle法阻斷入肝血流,每次阻斷15 min,開放5 min,見圖3。中心靜脈壓維持在5 mmH2O以下,術中超聲定位下劃定左半肝切除邊界,見圖4。用超聲刀、LigaSure離斷肝臟實質,如遇較粗大管道,可用鈦夾或Hem-o-lok夾閉,見圖5。左肝蒂用切割閉合器離斷,見圖6。左肝靜脈根部采用切割閉合器或Hem-o-lok離斷,見圖7。肝臟斷面使用百克鉗止血,生理鹽水反復沖洗,確認無出血、膽漏,見圖8。斷面常規覆蓋可吸收止血紗,見圖9。根據術中情況決定是否放置腹腔引流管。
1.4 術后管理 術后治療包括抗感染、保肝、維持內環境穩定、營養支持等。術后第1天可進流質食物。術后第2天、第5天、第7天常規復查血常規、肝功、腎功等指標。拔除腹腔引流管前常規復查腹部超聲。肝功能基本恢復,無殘留、感染,可進流質飲食、大小便通暢后,即可出院。
1.5 觀察指標 手術時間、術中失血量、肝門阻斷時間由麻醉醫師負責統計。手術開始至肝切除開始的時間定義為T1,切肝開始至左肝完全離斷定義為T2,手術開始至關腹完成定義為T3。術中失血量為吸引瓶中液體總量減去沖洗用水,術中紗布中含有的血量不納入失血量計算。術后肝功能不全的認定采用Balzan等提出的術后第5天血清TBIL仍然高于50 μmol/L和(或)凝血酶原活度低于50%,且排除膽道損傷[6]。術后膽漏診斷標準按國際肝臟外科學組的診斷標準:術后第3天腹腔引流管中總膽紅素水平大于血清總膽紅素水平3倍[7]。

圖2 7號絲線結扎左肝靜脈 圖3 第一肝門套入尿管阻斷
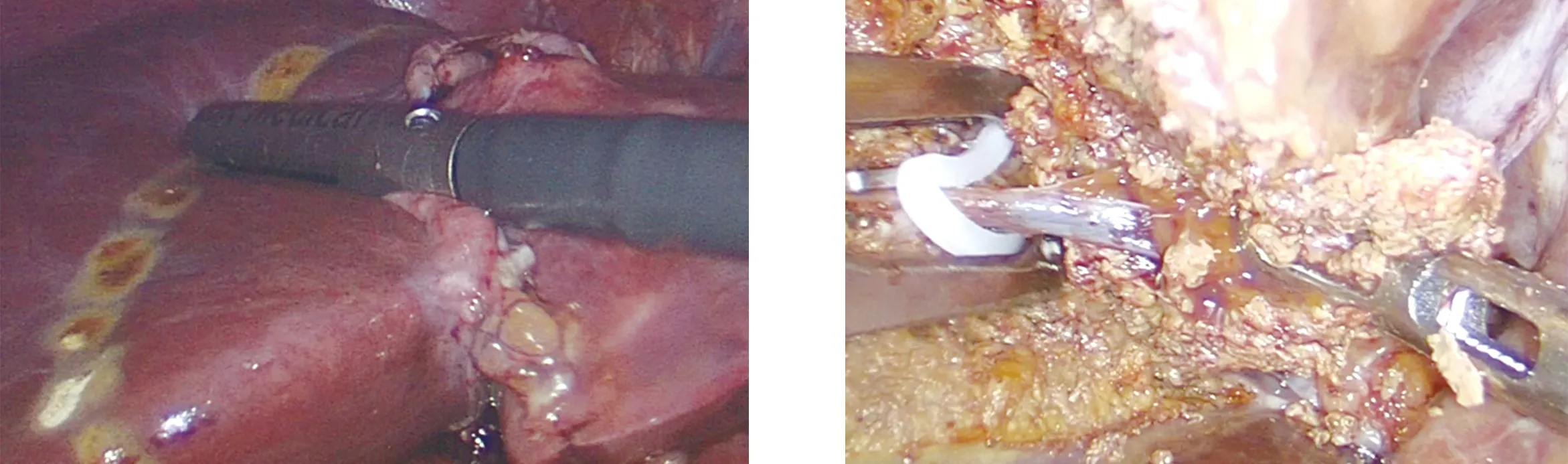
圖4 術中超聲輔助下劃定肝切除邊界 圖5 肝實質離斷

圖6 左肝蒂使用切割閉合器離斷 圖7 左肝靜脈采用Hem-o-lok離斷

圖8 左肝斷面 圖9 左肝斷面常規覆蓋可吸收止血紗

2 結 果
2.1 觀察組與對照組臨床資料的比較 兩組患者性別、年齡、乙肝病毒感染、BMI、術前血紅蛋白、肝功能指標、既往手術史及Ishak評分差異無統計學意義(P>0.05),具有可比性。見表1。

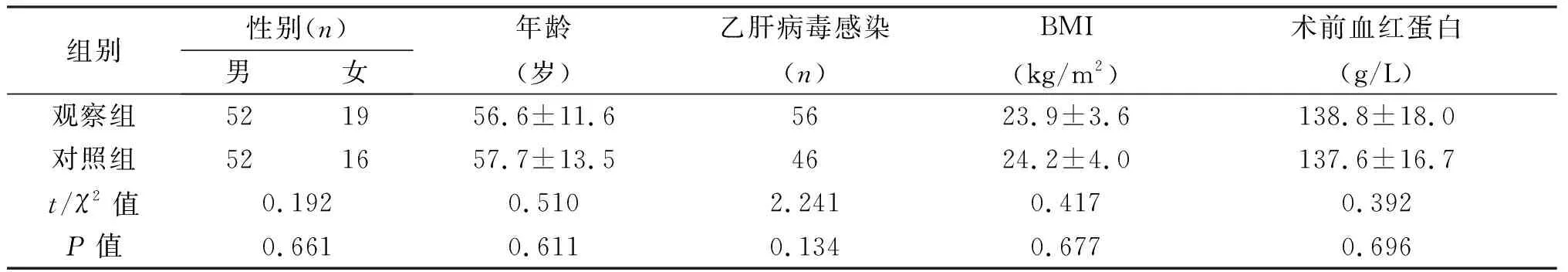
組別性別(n)男女年齡(歲)乙肝病毒感染(n)BMI(kg/m2)術前血紅蛋白(g/L)觀察組521956.6±11.65623.9±3.6138.8±18.0對照組521657.7±13.54624.2±4.0 137.6±16.7t/χ2值0.1920.5102.2410.4170.392P值0.6610.6110.1340.6770.696
續表1
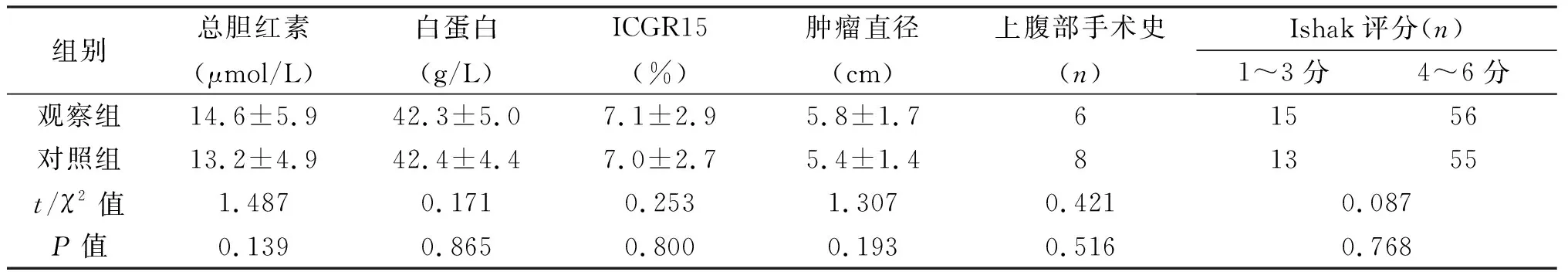
組別總膽紅素(μmol/L)白蛋白(g/L)ICGR15(%)腫瘤直徑(cm)上腹部手術史(n)Ishak評分(n)1~3分4~6分觀察組14.6±5.942.3±5.07.1±2.95.8±1.761556對照組13.2±4.942.4±4.47.0±2.75.4±1.481355t/χ2值1.4870.1710.2531.3070.4210.087P值0.1390.8650.8000.1930.5160.768
2.2 觀察組與對照組術中及術后情況的比較 兩組患者手術時間(T1、T2、T3)、術中出血量、術中輸血、肝門阻斷時間、術后并發癥發生率、術后住院時間差異無統計學意義。觀察組在解剖左肝靜脈過程中6例發生左肝靜脈破裂,予以縫合止血;腹腔鏡肝切除患者無一例中轉開腹。兩組肝功能不全患者均通過保肝、糾正凝血、維持內環境穩定等治療治愈。7例患者發生膽漏,均經保守治療或超聲引導下穿刺引流治愈。3例腹腔出血,1例再次腹腔鏡下止血,術中見斷面小血管出血,縫合止血治愈;2例通過補液、止血藥物等保守治療治愈。無死亡病例。見表2。

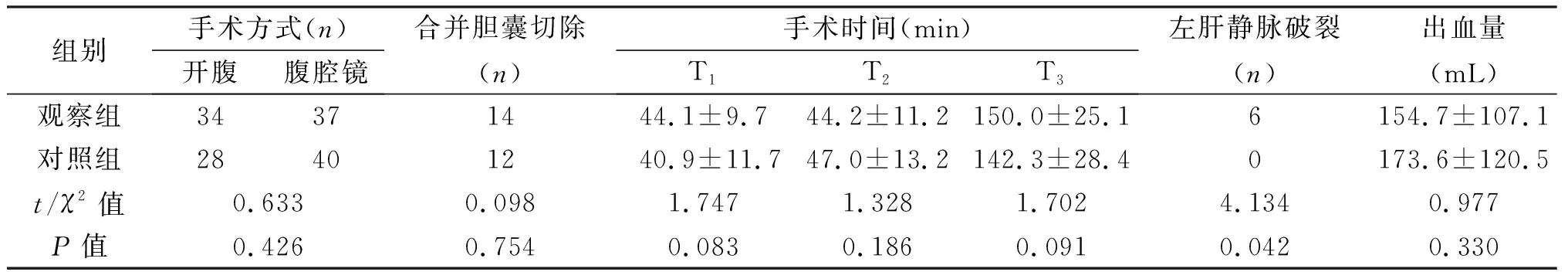
組別手術方式(n)開腹腹腔鏡合并膽囊切除(n)手術時間(min)T1T2T3左肝靜脈破裂(n)出血量(mL)觀察組34371444.1±9.744.2±11.2150.0±25.16154.7±107.1對照組28401240.9±11.747.0±13.2142.3±28.40173.6±120.5t/χ2值0.6330.0981.7471.3281.7024.1340.977P值0.4260.7540.0830.1860.0910.0420.330
續表2

組別輸血例數(n)阻斷時間(min)并發癥(n)肝功能不全出血膽漏切口感染合計住院時間(d)觀察組328.2±7.852421310.9±2.8對照組330.1±6.951311011.1±2.8t/χ2值0.0001.5320.3270.455P值1.0000.1280.5680.650
2.3 亞組分析
2.3.1 開腹手術中觀察組與對照組手術指標的比較 觀察組術中出血量少于對照組,差異有統計學意義;兩組手術時間、輸血例數、阻斷時間、術后并發癥、住院時間差異均無統計學意義。見表3。
2.3.2 腹腔鏡手術時觀察組與對照組手術指標的比較 觀察組T1、T3時間長于對照組,差異有統計學意義。兩組T2時間、術中出血量、輸血例數、阻斷時間、術后并發癥、住院時間差異均無統計學意義。見表4。
3 討 論
離斷與控制出血是肝切除過程中的核心環節。眾所周知,肝臟是雙重血供器官,與其他專科手術相比,更容易發生術中大出血,難以控制的出血是肝切除的難題,也是限制腹腔鏡肝切除向基層醫院進一步推廣的重要原因。我國是乙肝高發地區,大部分肝癌患者合并乙肝肝硬化。據報道[8],我國肝癌合并肝硬化發生率高達84.0%,進一步增加了肝切除的難度。近年,隨著對肝臟解剖結構認識的加深及高能量器械的使用,肝切除術中出血明顯減少,但對于大范圍肝切除術,阻斷仍是必不可少的[9-10]。
表3 開腹肝切除時觀察組與對照組手術指標的比較(n=62)

組別合并膽囊切除(n)手術時間(min)T1T2T3左肝靜脈破裂(n)出血量(mL)輸血(n)觀察組752.6±4.947.4±12.8160.6±25.64169.9±91.01對照組552.3±7.152.1±12.7162.3±30.50233.6±118.92t/χ2值0.0730.1781.4700.2431.8422.3910.030P值0.7860.8590.1470.8090.1750.0200.863
續表3

組別阻斷時間(min)并發癥(n)肝功能不全出血膽漏切口感染合計住院時間(d)觀察組27.3±7.71122612.5±2.3對照組28.0±7.62021513.0±1.9t/χ2值0.3650.030-0.0000.0000.0000.916P值0.7160.8631.000*1.0001.0001.0000.363
T1手術開始至切肝開始;T2切肝時間;T3手術總時間;*采用Fisher確切概率法
表4 腹腔鏡肝切除時觀察組與對照組指標的比較(n=77)
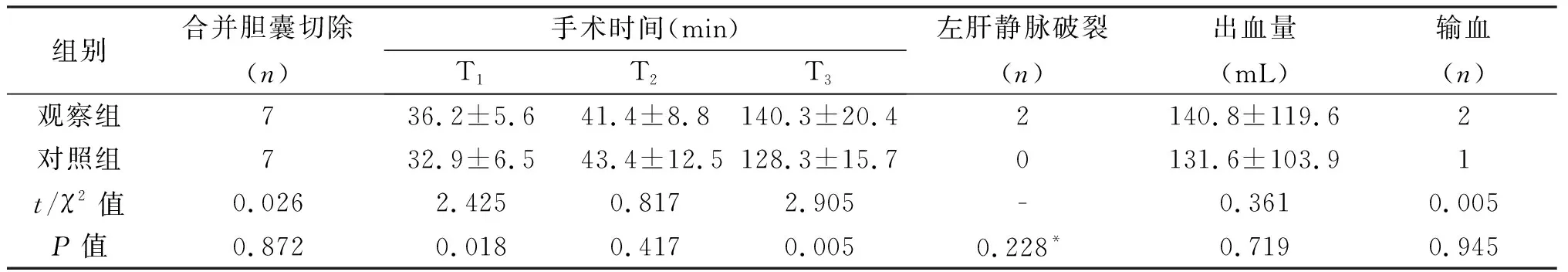
組別合并膽囊切除(n)手術時間(min)T1T2T3左肝靜脈破裂(n)出血量(mL)輸血(n)觀察組736.2±5.641.4±8.8140.3±20.42140.8±119.62對照組732.9±6.543.4±12.5128.3±15.70131.6±103.91t/χ2值0.0262.4250.8172.905-0.3610.005P值0.8720.0180.4170.0050.228*0.7190.945
續表4

組別阻斷時間(min)并發癥(n)肝功能不全出血膽漏合計住院時間(d)觀察組28.9±8.041279.4±2.4對照組31.5±6.031159.8±2.5t/χ2值1.6070.012-0.0050.6020.665P值0.1120.6141.000*0.9450.4380.508
T1手術開始至切肝開始;T2切肝時間;T3手術總時間;*采用Fisher確切概率法
全入肝血流阻斷法由Pringle于1908年首次提出,也稱Pringle法,是通過阻斷帶收緊壓迫肝十二指腸韌帶,從而完全阻斷入肝動脈及門靜脈血流。Pringle法可減少肝實質離斷過程中的出血,加快切肝速度[4]。Pringle法已廣泛應用于腹腔鏡肝切除術,我們常選用15 cm長的8號橡膠導尿管繞肝十二指腸韌帶收緊后,用Hem-o-lok夾閉固定。如果肝十二指腸內結締組織較少,收緊導尿管后可墊小塊紗布條,以減少Hem-o-lok對肝十二指腸內組織的機械損傷。如需停止肝門血流阻斷,用超聲刀離斷Hem-o-lok結扎夾或采用去夾鉗松開Hem-o-lok即可。整個操作在腹腔內完成,無需將阻斷帶引出體外操作。Pringle法由于同時阻斷了保留側肝臟血流,可能使肝組織受到不必要的缺血再灌注損傷,尤其合并肝硬化等肝臟基礎疾病的患者,有引發或加重術后肝功能障礙的可能。再者,長時間的入肝血流阻斷可造成門靜脈回流受阻,誘發胃腸道的淤血性損傷[11]。但我們的經驗是,與不使用Pringle法引發的術中大出血相比,阻斷肝門帶來的副反應顯然對患者的影響相對輕微。
Pringle阻斷技術應用后肝靜脈出血成為肝切除過程中出血的主要來源[12]。由于肝靜脈血管壁薄且有很多篩孔,出血時難以鉗夾或電凝止血,且有時由于角度問題難以縫合,導致出血控制不理想,手術創面不清晰,手術時間延長[13]。聯合肝靜脈血流阻斷似乎是理想的選擇,不但可進一步減少肝斷面出血保持術野清晰,而且可避免空氣栓塞、術中器械擠壓導致的腫瘤細胞沿肝靜脈轉移的風險。由于右肝靜脈及中肝靜脈位置較深,臨床中分離出右肝或中肝靜脈進行單獨阻斷的實例較少。左肝靜脈位置相對表淺,因此左半肝切除時,較多術者習慣在切肝前對左肝靜脈進行解剖并結扎或離斷。本研究結果表明,開腹手術中,左肝預先處理左肝靜脈的確可減少術中出血量,且不增加手術時間;但術中有損傷左肝靜脈的可能。本研究中,開腹手術中發生左肝靜脈損傷4例,腹腔鏡手術發生2例,均妥善縫合,未造成腹腔鏡中轉開腹及其他嚴重后果。大部分患者左肝靜脈與中肝靜脈為共干結構,且匯合部位常位于肝臟實質,對于顯露困難的患者,我們的經驗是不強行分離左肝靜脈,而是使用血管縫合線對2段肝臟相應區域進行縫扎,達到阻斷目的。
本研究結果提示,在腹腔鏡肝切除過程中預先處理左肝靜脈無法達到減少術中出血的目的,反而延長了手術開始至肝切除開始的時間及手術總時間。原因可能是腹腔鏡下分離左肝靜脈較開腹手術困難,一旦發生出血,縫合困難,手術時間增加。此外,腹腔鏡手術由于視野放大,肝實質離斷過程的操作更加精細,發生管道誤傷的幾率較低,同時,有氣腹壓力的參與,減少了腹腔內的血流[14],再配合Pringle法及低中心靜脈壓,斷面滲血減少,顯露更加清晰,超聲刀、LigaSure等能量設備止血效果更好,無需特殊處理肝靜脈。
近年,腹腔鏡肝切除得到飛速發展,具有創傷小、術中出血少、住院時間短等優勢,得到大部分學者的認可[15]。在大型醫療中心,腹腔鏡左半肝切除是治療左肝癌的首選術式,在目前先進的肝臟外科理念及技術下,腹腔鏡左半肝切除出血較少,控制性降壓、肝下下腔靜脈阻斷技術的應用均能很好地減少出血。切肝前分離左肝靜脈不但延長了手術時間,同時增加了左肝靜脈損傷的風險,然而并不能很好地起到減少出血的作用。因此我們認為,腹腔鏡肝切除時分離左肝靜脈進行阻斷并非必要。

