翹嘴鲌Sox9基因的克隆及CpG島甲基化與基因表達的關系
賈永義 鄭建波 顧志敏 陳立僑 羅 琛 遲美麗 劉士力蔣文枰 程 順
(1. 華東師范大學生命科學學院, 上海 200241; 2. 浙江省淡水水產研究所, 湖州 313001;3. 浙江大學生命科學學院, 杭州 310058)
Sox基因是編碼一類具有高度保守HMG盒(High mobility group)序列特征的轉錄調控因子[1],伴隨著物種多倍化進程中導致的基因組復制和分裂結果, 目前已克隆到該家族30多個成員[2]。Sox家族成員在早期胚胎至成體的各個發育階段都發揮著重要作用, 如參與神經系統發育、器官再生、細胞命運決定、血細胞生成、晶狀體發育等眾多生物學過程[3,4]。其中Sox9基因作為重要的一員, 已被證明與脊椎動物性別決定直接相關, 因而受到了廣泛的關注與研究[5]。魚類有著最為復雜的性別決定類型, 這也為研究性別分化機制提供了理想的動物模型。迄今為止, 在斑馬魚(Danio rerio)、黃鱔(Monopterus albus)、青鳉(Oryzias latipes)、鯉(Cyprinus carpio)、虹鱒(Oncorhynchus mykiss)等魚類品系中展開的相關研究都證實Sox9在魚類性別控制方面具有重要作用[6]。
近年來, 越來越多的研究表明表觀遺傳調控在性別決定中有著不可或缺的作用, 特別是性別相關基因啟動子區域的CpG島DNA甲基化修飾[7—9]。海鱸(Lateolabrax japonicus)中發現在發育早期高溫處理能使Cyp19a1a基因啟動子區域的甲基化水平增強, 從而抑制了該基因的表達, 引導其向雄性分化[7]。Wen等[10]在日本牙鲆(Paralichthys olivaceus)中的研究證明性別相關基因dmrt1和cyp19a啟動子CpG甲基化修飾模式與2個基因的表達水平呈負相關, 提示表觀遺傳調控可以決定牙鲆的性腺分化。同樣的, 性別決定相關基因Sox9啟動子或調控區域的甲基化修飾作為一種關鍵的因子可以直接影響下游基因的表達, 進而實現性別的決定與分化[11]。
翹嘴鲌(Culter alburnusBasilewsky)在分類上隸屬鯉科、鲌亞科、鲌屬, 近年來由于人工養殖和繁殖技術的不斷成熟與推廣, 現已成為長江三角洲地區的主要名特養殖品種[12]。多年的養殖經驗顯示翹嘴鲌雌魚比雄魚的個體大、生長速度快, 有著明顯的性別異形特征[13,14]。但目前我們對于翹嘴鲌的性別決定類型以及相關的調控基因都不清楚,因此探索、闡明翹嘴鲌性別決定與分化的作用機制, 發展翹嘴鲌全雌育種技術, 對于提高翹嘴鲌養殖產業的發展具有重要意義和應用價值。本研究首次克隆了翹嘴鲌性別相關基因Sox9的全長cDNA及近端啟動子序列, 同時進行了序列分析和蛋白質結構預測; 隨后采用實時定量PCR技術檢測了該基因在成體各組織中的表達水平; 最后分析了該基因在不同性腺組織啟動子區域CpG島甲基化的修飾狀態。這些結果為深入研究翹嘴鲌性別相關基因及性別決定機制提供線索和新的思路, 為進一步探索翹嘴鲌Sox9基因的生物學功能研究提供重要依據, 同樣也有助于發展翹嘴鲌性別控制育種和單性養殖技術。
1 材料與方法
1.1 實驗材料
本研究使用的翹嘴鲌實驗材料取自浙江省淡水水產研究所八里店綜合試驗基地。各成體組織:腦、肝、腎、脾、心臟、肌肉、眼、卵巢、精巢樣品經液氮速凍后保存于-80℃, 直至后續RNA或基因組DNA提取。
1.2 翹嘴鲌基因組DNA、總RNA的提取及cDNA第一鏈合成
選用實驗室改良的酚氯仿抽提法分離翹嘴鲌精巢和卵巢的基因組DNA, 按照Total RNA Extractor (Trizol)試劑盒(生工生物工程 上海)說明書步驟進行各成體組織總RNA的提取。最后將提取的所有核酸產物經瓊脂糖電泳檢測和濃度測定, 并置于冰箱用于后續的實驗。以提取的總RNA為模板, 在HiFiScript cDNA第一鏈合成試劑盒(康為 北京)作用下合成cDNA的第一條鏈。具體操作按照試劑盒說明書進行。
1.3 翹嘴鲌Sox9編碼區的克隆及cDNA末端擴增
從GenBank中下載多個已發表魚類物種Sox9基因mRNA序列并進行比較分析, 它們都含有一段編碼HMG盒結構域的保守區域, 隨即在該區域設計了簡并引物sox9-F和sox9-R (表1)。PCR反應體系為50 μL, 包含10×Ex-TaqBuffer 5 μL、dNTP(2.5 mmol/L) 4 μL、正反向引物(2.5 μmol/L)各4 μL、Ex-Taq0.5 μL及補足ddH2O至50 μL。擴增條件: 94℃預變性5min; 94℃ 30s, 55℃ 30s, 72℃1min, 32個循環; 72℃延伸7min, 最后4℃保存。PCR產物經膠回收后連接至pMD18-T克隆載體進行測序, 序列結果通過與同源基因比對確認其為目的片段。隨后在已獲編碼區序列基礎上分別設計正反向特異性巢式引物GSPF1、GSPF2和GSPR1、GSPR2 (表1)并參照SMARTerTMRACE (Clontech Japan)試劑盒說明書進行cDNA末端擴增, 最終獲得Sox9a和Sox9b兩個翹嘴鲌旁系同源基因的cDNA全長, 并且提交至GenBank (登錄號: MG694537和MG694536)。本部分實驗所用試劑均購自日本TaKaRa公司, 引物合成及測序委托上海生工生物工程公司。

表1 用于翹嘴鲌Sox9基因克隆、表達分析和甲基化檢測的引物Tab. 1 Primers used for cloning, expression and methylation analysis of Sox9 in C. alburnus
1.4 氨基酸預測、比對及進化樹分析
使用JELLYFISH軟件推測了Sox9a和Sox9b基因編碼的氨基酸序列, 隨后用DNAMAN軟件對這兩個同源基因編碼的氨基酸序列進行了比對, 利用在線軟件Motif Scan (https://myhits.isb-sib.ch/cgibin/motif_scan)和SWISS-MODEL (https://swissmodel.expasy.org/)進行了蛋白質二級結構和三級結構預測。同時將預測的結果分別與其他物種進行同源性分析, 使用MEGA 5.0軟件的Neighbor-joining方法構建了系統進化樹。
1.5 Sox9a、Sox9b在翹嘴鲌成體不同組織中的表達特征分析
利用熒光實時定量PCR (qRT-PCR)的方法檢測了翹嘴鲌不同成體組織的mRNA轉錄水平, 根據克隆獲得的Sox9a和Sox9bcDNA序列分別設計實時定量引物對RT-sox9a-F和RT-sox9a-R、RT-sox9b-F和RT-sox9b-R (表1), 并以ef-1α作為內參基因。熒光定量RT-PCR實驗首先將各組織RNA在去基因組逆轉錄試劑盒(ABM加拿大)作用下合成cDNA第一鏈, 隨后選用EvaGreen 2× qPCR MasterMix試劑盒(ABM加拿大)構建PCR反應體系。實時定量PCR反應及后續信息在LightCycler 480 System (Roche瑞士)上進行。由于定量反應非常敏感, 我們對每個反應設定了3個平行, 最后采用2-ΔΔCt法計算表達量并使用GraphPad Prism 5軟件獲得直方圖。
1.6 Sox9a近端啟動子擴增、CpG島預測及DNA甲基化修飾檢測
根據已知的Sox9amRNA序列設計了兩條特異性引物GSP-AS1、GSP-AS2, 按照GenomeWalker?Universal Kit (CloneTech, 日本)試劑盒說明書通過染色體步查法擴增到未知的近端啟動子區域。隨后, 我們直接將翹嘴鲌Sox9a啟動子原始序列輸入于在線軟件MethPrimer (http://www.urogene.org/methprimer/), 進行序列提交命令后, 軟件預測到CpG島的所在區域以及甲基化分析引物對BSP-F和BSP-R (表1)。根據CpGenomeTMDNA Modification Kit (Chemicon, USA)說明書對翹嘴鲌性腺組織基因組DNA進行重亞硫酸氫鹽修飾處理, 隨后進行甲基化特異性擴增。
2 結果
2.1 翹嘴鲌Sox9基因的cDNA克隆
用sox9-F和sox9-R簡并引物通過RT-PCR方法擴增獲得了一段長度為212 bp的核苷酸片段, 經測序并借助NCBI網站中Blast功能進行同源性分析,結果顯示其為斑馬魚、鯉等物種的同源片段, 從而確定此片段為翹嘴鲌Sox9基因的部分cDNA序列。
隨后用SMARTerTMRACE試劑盒進行5′和3′-RACE擴增獲得了翹嘴鲌Sox9 cDNA的完整序列。與其他魚類品系一樣, 翹嘴鲌Sox9具有2個同源基因, 分別為Sox9a、Sox9b。Sox9a全長1642 bp, 包括191 bp的5′非編碼區(5′-UTR)、1377 bp的開放閱讀框(ORF)和74 bp的3′非編碼區(3′-UTR), 編碼458個氨基酸;Sox9b全長1673 bp, 包括212 bp的5′非編碼區(5′-UTR)、1371 bp的開放閱讀框(ORF)和90 bp的3′非編碼區(3′-UTR), 編碼456個氨基酸。2個同源基因都具有進化上高度保守的HMG盒結構域,目前已將序列提交至GenBank (登錄號: MG694537和MG694536)。
2.2 翹嘴鲌轉錄因子Sox9a和Sox9b氨基酸序列比對及蛋白結構預測
運用DNAMAN軟件對翹嘴鲌轉錄因子Sox9a和Sox9b的氨基酸序列進行了比對分析, 兩者相似度達到73.95%, 但編碼HMG盒區域極其保守。利用在線軟件Motif Scan分子結構預測工具對翹嘴鲌Sox9a和Sox9b的蛋白質二級結構進行了分析, 結果顯示兩者除了高度保守的HMG盒結構域外, 分別還有2個核定位信號。利用SWISS-MODEL在線工具為Sox9的三維結構建模, 翹嘴鲌Sox9a和Sox9b與人4euw.1.A的一致性高達98.81%, 其中Sox9a含有多個α螺旋及無規則卷曲結構, 在約90—170個氨基酸處形成空穴, 與預測的二級保守結構域HMG-box有重疊, 推測該部位為其活性部位。Sox9b同樣含有多個螺旋結構, 同時在90—180個氨基酸處出現更大的彎曲, 空穴則壓縮得更小, 使其三維結構呈現餅鐺狀, 推測其與Sox9b功能趨異有關。
2.3 不同物種Sox9基因氨基酸序列聚類分析
從GenBank數據庫中下載了不同脊椎動物已發表的Sox9蛋白編碼序列, 利用MEGA 5.0軟件的鄰接法(Neighbor-joining)對翹嘴鲌Sox9a、Sox9b氨基酸序列與其他物種的Sox9氨基酸序列構建了系統進化樹(圖1)。在分子系統樹中, 所有魚類聚為一支, 與其他較高等脊椎動物關系較遠(除了非洲爪蟾)。其中翹嘴鲌Sox9a與羅非魚Sox9a發生聚類,較其他物種具有最接近的親緣關系, 而翹嘴鲌Sox9b形成單獨的一支。總體而言, 該基因的系統進化關系與其所在物種的進化地位仍保持一致。
2.4 翹嘴鲌Sox9a和Sox9b在各個組織中的差異表達
運用實時熒光定量PCR技術對2個同源基因Sox9a和Sox9b的mRNA表達水平進行了檢測, 結果顯示兩者在翹嘴鲌不同組織中的表達豐度具有明顯的組織差異性和特異性。Sox9a在腦和精巢中表達量最高, 其次是肌肉、鰭條、眼睛和卵巢, 在腎臟、脾臟、肝臟中相對較低;Sox9b只在腦、鰭條、眼睛和精巢中檢測到一定水平的表達, 其余組織中幾乎不表達(圖2)。
2.5 翹嘴鲌Sox9a啟動子區域CpG島甲基化分析
實時定量分析結果顯示翹嘴鲌雄性特異性基因Sox9a在精巢組織中的表達量遠高于卵巢組織,為了解這類兩性特異性差異表達的潛在機制, 我們檢測了精巢和卵巢中Sox9a基因差異表達是否涉及DNA甲基化水平的差異修飾。通過染色體步查法獲得的部分啟動子序列提交至在線工具MethPrimer進行CpG島預測, 結果表明近端啟動子附近存在符合標準的CpG島, 包含9個CG二核苷酸位點(圖3A)。隨即我們通過重亞硫酸氫鹽DNA測序方法分析了翹嘴鲌性腺組織Sox9a啟動子CpG島甲基化修飾模式, 結果顯示在精巢中CG位點幾乎不發生甲基化, 然而卵巢中高度甲基化(圖3B)。這個結果表明Sox9a在性腺組織中的表達豐度與DNA甲基化修飾程度正好呈負相關, 提示在翹嘴鲌性腺發育過程中性別相關基因啟動子CpG島差異甲基化修飾涉及下游基因的異形表達。
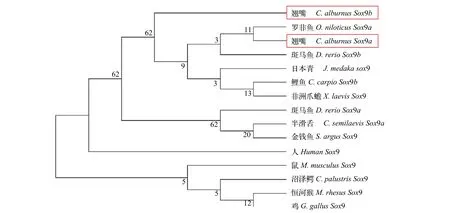
圖1 采用Neighbor Joining方法構建的不同物種Sox9蛋白系統進化樹Fig. 1 Phylogenetic tree of Sox9 protein generated with Neighbor Joining method
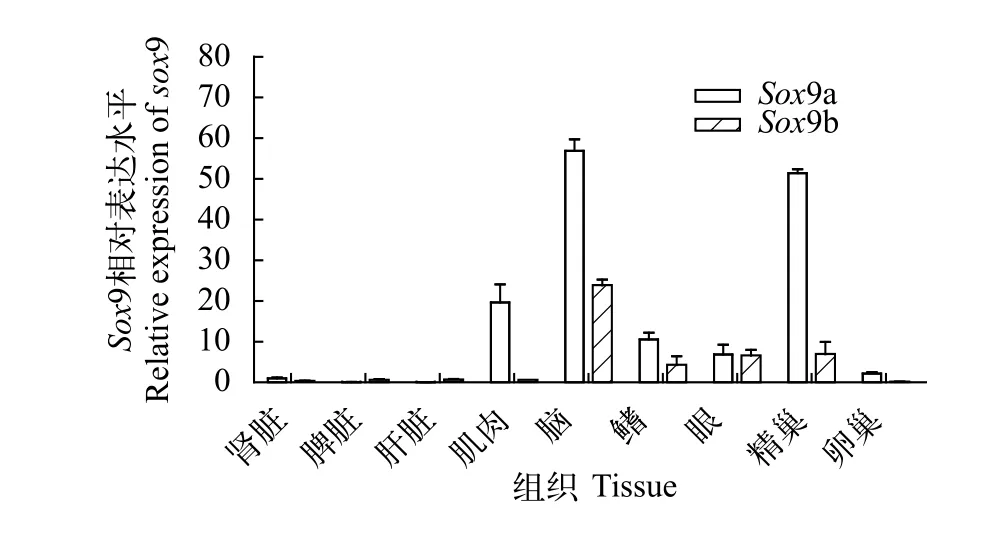
圖2 Sox9基因在翹嘴鲌成魚組織中的表達分析Fig. 2 The relative expression of Sox9 in the various tissues of C.alburnus
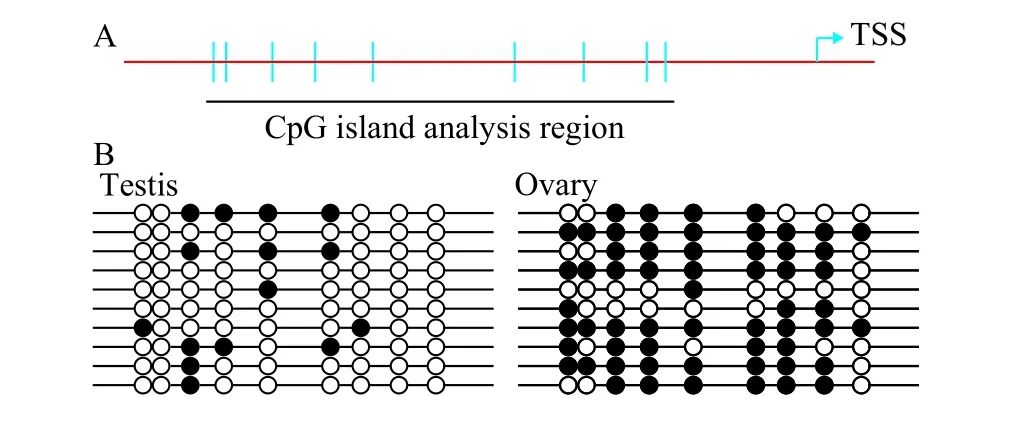
圖3 翹嘴鲌Sox9a基因啟動子CpG島甲基化分析Fig. 3 Promoter CpG island methylation analysis of Sox9a in C.alburnus
3 討論
3.1 翹嘴鲌Sox9基因序列克隆及特征分析
為了解Sox9基因在翹嘴鲌性腺分化中的作用,本研究利用RT-PCR、RACE及染色體步查等分子克隆方法獲得了翹嘴鲌Sox9基因全長和近端啟動子序列。不同于高等哺乳動物, 低等脊椎動物在進化過程會產生基因加倍現象, 類似于其他魚類品系,翹嘴鲌Sox9也存在2個旁系同源基因:Sox9a和Sox9b, 但其中涉及的分子機制較為復雜[15]。氨基酸序列分析表明Sox9a和Sox9b有著Sox家族蛋白都存在的高度保守HMG盒結構域, 然而兩者的三維結構預測顯示出一定程度上的不一致性, 提示其在功能作用中的差異。根據氨基酸序列進行同源性分析表明翹嘴鲌Sox9a與羅非魚Sox9a發生聚類, 較其他物種具有最接近的親緣關系, 而翹嘴鲌Sox9b形成單獨的一支, 但總體而言該基因的系統進化關系與其所在物種的進化地位仍保持一致, 意味著Sox9基因在功能上的保守性。因此, 在魚類中克隆并深入研究Sox9基因, 對于揭示脊椎動物Sox基因的進化歷程以及研究其性別決定機制具有重要的理論和實踐意義。
3.2 翹嘴鲌Sox9a和Sox9b基因的表達特征
為了揭示Sox9a和Sox9b基因在翹嘴鲌各成體組織中的表達情況, 本研究利用實時熒光定量技術對這2個同源基因的mRNA表達水平進行了檢測,結果顯示Sox9a在腦和精巢中表達量最高, 其次是肌肉、鰭條、眼睛和卵巢, 在腎臟、脾臟、肝臟中相對較低, 這與Sox9基因在金錢魚[16]、虹鱒[17]、西伯利亞鱘(Acipenser baeri)[18]等物種中的表達情況相似。翹嘴鲌Sox9a基因的表達模式表明其主要功能體現于神經系統發育和雄性性別分化, 同時在其他組織中也有不同程度的表達, 顯示其功能的廣泛性。基因組研究發現在魚類等低等脊椎動物中, 基因復制后的重復基因有著不同的命運, 主要包括選擇性丟失或協同進化產生新的功能, 而Sox9b只在腦、鰭條、眼睛和精巢中檢測到一定水平的表達,這個結果說明該基因明顯面臨功能上的丟失。
3.3 DNA甲基化在翹嘴鲌性腺分化過程中的作用
魚類性別決定方式最為復雜, 其主要由內在的基因調控, 但同時又會受到其他非遺傳因子的影響。近年來, 關于表觀遺傳修飾對于魚類性別決定調控的研究越來越多, 特別是靶基因啟動子或調控區域的CpG島甲基化作用。DNA甲基化修飾能改變基因表達活性, 并且在細胞分裂后, 以半保留復制的方式將這種修飾式樣傳遞到子細胞[19], 因此深入研究表觀遺傳機制在魚類性別決定中的作用具有十分重要的意義。本研究通過分析翹嘴鲌近端啟動子區域鑒定到一個CpG島, 對不同性腺組織的甲基化檢測表明翹嘴鲌精巢和卵巢確實存在差異的修飾式樣, 且正好與基因的表達水平呈負相關。這個結果初步表明翹嘴鲌很可能通過DNA甲基化修飾依賴型機制調控下游基因二態性表達, 進而引導性腺分化。已知性別決定涉及到復雜的分子作用網絡以及信號級聯, 目前的研究大多局限于單基因甲基化狀態的分析, 因此未來仍需大量的、全基因組水平的甲基化分析來解答眾多關鍵性問題。

