依澤替米貝對非酒精性脂肪肝病細胞模型脂質沉積和凋亡的影響及其與自噬關系的研究
宋 琪,吳鵬波,譚詩云
(武漢大學人民醫院消化內科 消化系統疾病湖北省重點實驗室,武漢 430060)
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是西方國家慢性肝病最常見的病因,預計也將于2030年成為肝移植最常見的指征[1]。自2001年以來,NAFLD已成為世界上慢性肝病的主要病因,由其病程進展可分為單純性肝脂肪變、非酒精性脂肪肝炎及肝纖維化[2],其發病機制復雜多樣,包括胰島素抵抗、脂肪細胞激素分泌、腸道微生態改變、營養因素和遺傳因素等[3-5]。肥胖、胰島素抵抗、2型糖尿病和血脂異常是NAFLD最重要的危險因素[6]。在全球范圍內的成年人中,NAFLD的發病率已高達20%~40%[7]。
依澤替米貝(ezetimibe,Eze)作為一類新型的選擇性膽固醇吸收抑制劑,已有多篇文獻報道了它聯合他汀類藥物對血清膽固醇水平的降低作用[8-10]。Patel等[11]的研究也表明Eze可改善伴有肝功能損害的NAFLD患者血清膽固醇及肝功能水平。體內研究發現Eze可抑制腸道和肝臟的膽固醇吸收靶點NPC1L1(Niemann-Pick C1-Like 1),從而降低食物中膽固醇的吸收、降低肝脂肪含量及改善肝臟胰島素敏感性等,進而起到治療NAFLD的作用[12]。
自噬,即細胞自我消化,是細胞內的溶酶體降解細胞內受損的細胞器、未折疊的蛋白質和細胞內的病原體的代謝過程[13-14]。Lee等[15]研究表明,Eze可通過激活Nrf2對高脂飲食誘導的非酒精性脂肪肝炎小鼠起到一定的治療作用,而這個過程與自噬相關蛋白p62密切相關。本實驗以油酸(oleic acid,OA)誘導HepG2細胞為體外模型[16],探討Eze對NAFLD細胞模型脂質沉積和凋亡的影響及其與自噬的關系,為Eze治療NAFLD提供實驗依據。
1 資料與方法
1.1一般資料
1.1.1細胞株和試劑 人肝癌細胞株HepG2由武漢大學中南醫院贈送。Eze購于上海阿拉丁生物公司(產品編號:E126609);Gibco DMEM/H(Dulbecco′s modified eagle medium/high glucose)培養液購自美國賽默飛世爾公司,NQBB胎牛血清購自澳大利亞Bolise Co.,Ltd.公司;細胞計數試劑盒-8(cell counting kit-8,CCK-8)試劑盒、蘇木精染液、Alexa Fluor 488標記山羊抗兔IgG、辣根過氧化物酶標記山羊抗兔IgG、膜聯蛋白-異硫氰酸熒光素/碘化丙啶(annexin V-fluorescein isothiocyanate/propidium iodide annexin,V-FITC/PI)凋亡檢測試劑盒和辣根過氧化物酶標記山羊抗兔IgG購自上海碧云天生物公司;油紅O、β-肌動蛋白(β-actin)購于北京索萊寶科技有限公司,OA購于美國Sigma公司(貨號:O1383);Beclin-1和微管相關蛋白1輕鏈3(microtubule-associated protein 1 light 3,LC3)抗體購于美國Cell Signaling Technology公司;質粒購于上海海吉浩格生物科技有限公司;Annexin V-FITC/PI凋亡檢測試劑盒購于北京康為世紀有限公司。
1.1.2儀器 THERMOHeracellVIOS 160i/250i CO2培養箱(德國Thermo Scientific公司),Bio-Rad imark全自動酶標儀,Bio-Rad凝膠成像系統ChemiDocTMXRS+,OLYMPUS IX71顯微鏡,OLYMPUS BX53顯微鏡,Bio-Rad電泳儀,流式細胞儀BD FACS Calibur。
1.2方法
1.2.1細胞培養 從液氮罐中取出HepG2細胞凍存管,置于37 ℃恒溫水浴中于1~2 min內迅速解凍,以離心半徑8 cm,1 000 r/min離心4 min后去除凍存液,并用含10%胎牛血清(fetal bovine serum,FBS)的DMEM完全培養基重懸后移至細胞培養瓶中,置于37 ℃、含5% CO2的細胞培養箱中培養。隔日換液,3~5 d后傳代,取處于對數生長期的細胞進行實驗。
1.2.2CCK-8實驗 取對數生長期的HepG2細胞,用完全培養基調整細胞濃度為5×104/mL,接種于96孔板中,每孔加入100 μL細胞懸液置于培養箱中培養。次日按照每組3個復孔及培養板順序進行分組給藥,分為空白對照組、OA組(OA濃度為0.6 mmol/L)、Eze低濃度組(Eze濃度為10 μmol/L)、Eze中濃度組(Eze濃度為20 μmol/L)、Eze高濃度組(Eze濃度為40 μmol/L),藥物處理36 h后,每孔加入10 μL CCK-8溶液,孵育1 h用酶標儀在 450 nm測定吸光度。增殖率=A實驗組/A空白組×100%。
1.2.3油紅O染色 取對數生長期的HepG2細胞,將細胞濃度調整為5×104/mL,接種于24孔板中,每孔加入1 mL細胞懸液進行培養。次日按照是否加入OA、Eze和氯喹(chloroquine,CQ)及培養板順序進行分組給藥,分為空白對照組、OA組、OA+Eze組及OA+Eze+CQ組,其中各藥物濃度分別為OA濃度為0.6 mmol/L,Eze濃度為20 μmol/L,CQ濃度為20 μmol/L。藥物處理24 h后,每孔用磷酸鹽緩沖液(phosphate buffer saline,PBS)洗滌3次,4%多聚甲醛固定30 min,再次用PBS洗滌3次,每孔加入500 μL油紅O染液(提前用雙蒸水以2∶3比例稀釋0.5%油紅O溶液,混勻后靜置30 min,并用直徑為0.22 μm的微孔濾膜過濾),于37 ℃水浴箱中染色1 h,用75%乙醇洗滌5 s后以蘇木精染核,甘油明膠封片,倒置顯微鏡下觀察脂滴沉積情況。
1.2.4Western blot檢測Beclin-1和LC3表達水平 取對數生長期的細胞接種于6孔板中,每孔加入2 mL完全培養基進行培養。次日分組給藥(分組同油紅O染色),藥物處理24 h后提取細胞蛋白,并用BCA蛋白濃度試劑盒測定蛋白濃度,根據測得濃度調整上樣量,將蛋白樣品加入十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,后經電泳、轉膜、封閉,Tris-HCl+Tween-20緩沖鹽溶液清洗3次(每次5 min),在一抗溶液中4 ℃孵育過夜,Tris-HCl+Tween-20緩沖鹽溶液清洗3次(每次15 min)后于二抗中37 ℃孵育1 h,TBST清洗3次(每次15 min),用ECL化學發光液浸潤1 min,于凝膠成像系統中掃描成像并計算灰度值。
1.2.5細胞凋亡實驗(Annexin V-FITC/PI雙染) 將對數生長期的細胞用胰酶消化后重懸于完全培養基中,然后接種于6孔板中進行培養。次日分組給藥(分組同油紅O染色),24 h后,用胰酶消化細胞并洗滌3次,用結合緩沖液重新懸浮細胞,加入5 μL Annexin V/FITC 和10 μL濃度為20 μg/mL的PI溶液,混勻后于室溫避光孵育15 min,后在反應管中加400 μL PBS,流式細胞儀檢測細胞凋亡情況。
1.2.6免疫熒光染色 將對數生長期的HepG2細胞按照每孔2.5×104個細胞接種于24孔板中,接種前與24孔板內放置無菌細胞爬片,每孔加入1 mL完全培養基,置于細胞培養箱中培養。次日分組給藥(分組同油紅O染色),24 h后進行細胞固定和封閉,操作步驟如下:將細胞用PBS洗滌3次,4%多聚甲醛固定30 min,再次用PBS洗滌3次,免疫熒光通透液通透5 min,PBS洗滌3次,用山羊血清封片30 min。然后加入一抗,4 ℃孵育過夜,PBS洗滌3次,加入Alexa Fluor 488標記山羊抗兔IgG,PBS洗滌3次,用4′,6-二脒基-2-苯基吲哚染核5 min,PBS洗滌3次,取出細胞爬片,抗熒光淬滅劑封片,在正置顯微鏡下以495 nm為激發波長觀察細胞LC3表達情況。

2 結 果
2.1Eze對HepG2細胞增殖活性的影響 OA組、Eze低濃度組、Eze中濃度組、Eze高濃度組細胞增殖率分別為(0.829±0.048)%、(0.845±0.105)%、(0.864±0.086)%、(0.796±0.109)%,各組比較差異無統計學意義(F=0.202,P=0.892)。
2.2油紅O染色結果 OA+影響Eze組脂滴含量明顯低于OA組,加入自噬抑制劑CQ后,OA+Eze+CQ組脂滴含量明顯高于OA+Eze組,Eze對OA造模的HepG2細胞內脂滴含量的影響見圖1。
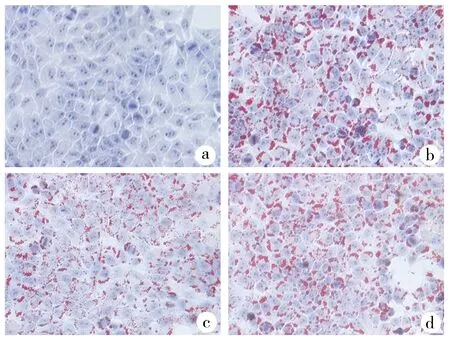
a:CON;b:OA;c:OA+Eze;d:OA+Eze+CQ
2.3Eze對HepG2細胞Beclin-1和LC3表達的影響 各組HepG2細胞Beclin-1和LC3表達水平比較差異有統計學意義(P<0.05),其中OA+Eze組Beclin-1/β-actin和LC3Ⅱ/β-actin表達高于OA組(P<0.05),OA+Eze+CQ組Beclin-1/β-actin低于OA+Eze組(P<0.05),OA+Eze+CQ組LC3Ⅱ/β-actin高于OA+Eze組(P<0.05),見表1。Eze對HepG2細胞Beclin-1和LC3表達水平的影響,見圖2。
表1 各組HepG2細胞Beclin-1和LC3表達水平的比較
CON:空白對照;OA:油酸;Eze:依澤替米貝;CQ:氯喹;Beclin 1:Beclin-1蛋白;LC3:微管相關蛋白1輕鏈3;β-actin:β-肌動蛋白;a與OA組比較,P<0.05;b與OA+Eze組比較,P<0.05
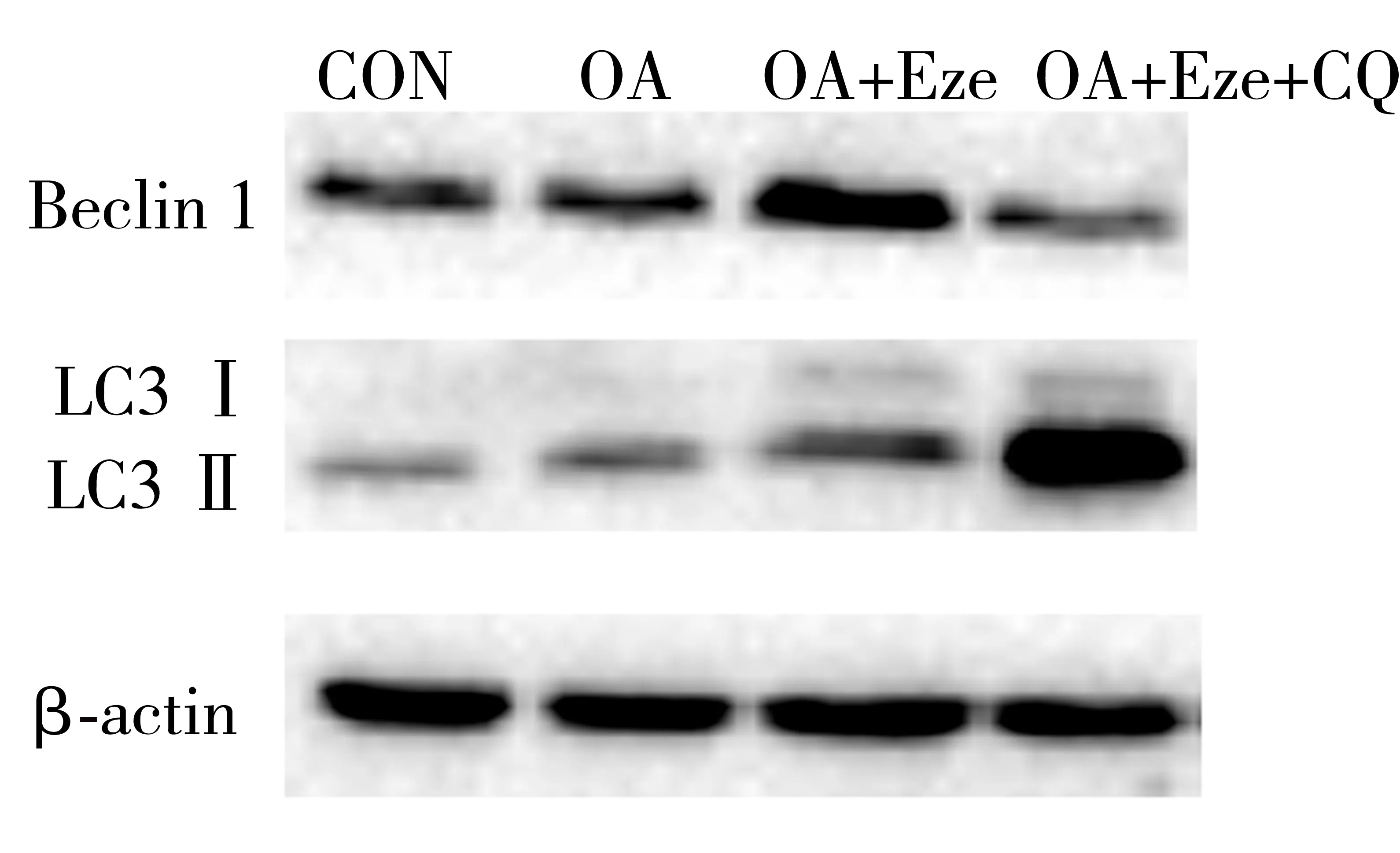
CON:空白對照;OA:油酸;Eze:依澤替米貝;CQ:氯喹;Beclin 1:Beclin-1蛋白;LC3:微管相關蛋白1輕鏈3;β-actin:β肌動蛋白
圖2 Eze對HepG2細胞Beclin-1和LC3表達水平的影響
2.4細胞凋亡實驗檢測結果 空白對照組、OA組、OA+Eze組、OA+Eze+CQ組細胞凋亡率分別為(0.820±0.083)%、(2.777±0.114)%、(1.673±0.094)%、(5.710±0.109)%,各組比較差異有統計學意義(F=109.397,P<0.05)。OA組細胞凋亡率高于空白對照組(P<0.05),OA+Eze組細胞凋亡率低于OA組(P<0.05);OA+Eze+CQ組細胞凋亡率高于OA+Eze組(P<0.05)。Eze對OA造模的HepG2細胞凋亡率的影響,見圖3。
2.5免疫熒光染色結果 與空白對照組比較,OA組LC3表達水平無明顯變化,加入Eze后,Eze+OA組LC3表達水平相較于OA組均升高,加入CQ后,LC3表達水平相較于Eze+OA組升高,Eze對油酸造模的HepG2細胞LC3表達水平的影響見圖4。
3 討 論
近年來NAFLD發病率不斷增高,卻仍缺乏安全有效的治療藥物,本研究致力于在細胞水平上探討Eze對NAFLD的治療作用及其機制。通過OA造模,模擬出NAFLD的細胞模型,從油紅O染色的結果可以看出,Eze可顯著降低細胞模型中脂滴含量,這與Patel等[11]的研究結果一致,提示Eze可改善NAFLD時肝細胞內脂質沉積。而在加入自噬抑制劑CQ時,其改善脂質沉積的效果降低,提示其改善脂質沉積的機制與自噬有一定的相關性。
CQ作為一種傳統的抗瘧藥,近年來多項研究表明對多種晚期腫瘤具有一定的治療效果[17-20],其抗腫瘤作用正是通過阻礙自噬實現的[21]。CQ含有的疏水性弱堿基,在其擴散到溶酶體后被捕獲并質子化,導致溶酶體內pH值上升,從而阻礙自噬體和溶酶體結合成自噬溶酶體進而降解的過程,在自噬晚期阻礙自噬的發生、發展[22]。LC3Ⅱ及Beclin-1作為普遍承認的自噬相關蛋白,LC3Ⅱ/β-actin及Beclin-1水平的增高提示自噬水平升高[23]。CQ對自噬的阻礙作用表現在LC3Ⅱ/β-actin水平的增高及Beclin-1水平的降低。Western blot的結果提示,相對于OA組,加入Eze后細胞自噬水平明顯升高,加入Eze和CQ后細胞自噬水平降低,表明Eze可增強非酒精性脂肪肝細胞的自噬,而自噬抑制劑CQ表現出對自噬的顯著抑制效果。同時,通過LC3B的免疫熒光染色檢測也與Western blot的結果一致,提示Eze可增強非酒精性脂肪肝細胞的自噬,加入CQ后自噬水平下降。
在NAFLD的初始階段,細胞內出現過多的脂質積聚和脂肪變性,進而通過氧化劑或細胞因子損傷肝細胞,使疾病進展為非酒精性脂肪肝炎[24-25]。促進自噬對肝細胞脂滴沉積減少可能與細胞自噬體的代謝功能相關,自噬體含有降解細胞器相關脂質和外源脂蛋白的脂肪酶,促進自噬有助于促進自噬體和溶酶體的融合及其脂質的分解[24]。Eze在升高細胞內自噬水平的同時降低了細胞內脂質沉積水平,且這種作用在加入自噬抑制劑CQ后被抑制,因此,推測Eze可通過增強NAFLD細胞模型自噬水平減少細胞內脂質沉積。

CON:空白對照;OA:油酸;Eze:依澤替米貝;CQ:氯喹;Beclin 1:Beclin-1蛋白;LC3:微管相關蛋白1輕鏈3;DAPI:4′,6-二脒基-2-苯基吲哚;MERGE:合并
本研究中,加入Eze可明顯改善OA誘導NAFLD細胞模型的細胞凋亡率,而加入自噬抑制劑CQ后,其凋亡水平又明顯增加,表明Eze可減輕NAFLD細胞模型的細胞凋亡率,自噬抑制劑CQ可在一定程度上逆轉這種效果。Schleicher等[26]研究表明細胞內脂質沉積減少后,脂肪變性狀態的細胞可以被逆轉成為健康細胞。在NAFLD中,細胞脂質沉積是導致細胞脂性凋亡的最主要原因[27],本研究中Eze既降低了細胞內脂質沉積水平,又減少了細胞的凋亡率,因此,推測Eze通過增強細胞自噬水平減少NAFLD細胞模型中的細胞凋亡。
綜上所述,Eze在增強細胞的自噬水平的同時,減輕細胞內脂質沉積并明顯減少細胞凋亡的發生,且這種效果在CQ顯著抑制自噬后被逆轉,因此,說明Eze可能通過增強非酒精性脂肪肝細胞的自噬水平降低NAFLD細胞模型脂質沉積和凋亡發生,因此可能對NAFLD具有一定的治療效果。

