玉米C型細胞質雄性不育花藥不同發(fā)育時期的轉錄組分析
薛亞東,楊露,楊慧麗,李冰,林亞楠,張懷勝,郭戰(zhàn)勇,湯繼華,2
?
玉米C型細胞質雄性不育花藥不同發(fā)育時期的轉錄組分析
薛亞東1,楊露1,楊慧麗1,李冰1,林亞楠1,張懷勝1,郭戰(zhàn)勇1,湯繼華1,2
(1河南農業(yè)大學農學院/省部共建小麥玉米作物學國家重點實驗室,鄭州 450002;2長江大學主要糧食作物產業(yè)化湖北省協(xié)同創(chuàng)新中心, 湖北荊州 434025)
【目的】通過分析玉米C型胞質雄性不育“三系”材料花藥不同發(fā)育時期的轉錄組數(shù)據(jù),以期闡明玉米C型胞質的不育和恢復機制,并解析不育基因與恢復基因之間相互作用的調控網絡,為玉米C型細胞質雄性不育在不育化制種中的利用提供理論依據(jù)。【方法】以中國玉米生產上的骨干自交系豫自87-1為背景的C型胞質不育系、保持系、恢復系為材料,通過對3種材料減數(shù)分裂的前期Ⅰ、中期Ⅰ及末期Ⅱ(四分體)時期的花藥進行轉錄組測序并利用hisat2、ballgown及DESeq2等工具進行生物信息學分析,尋找三系花藥不同時期、相同時期不同材料間以及發(fā)育時序中差異表達的基因,預測C型胞質不育機制與育性恢復的調控網絡;同時通過實時定量PCR對測序分析結果進行驗證;通過酶活測定驗證推測的C型胞質不育及恢復假說。【結果】所有材料的轉錄組測序共產生156.59 Gb的序列數(shù)據(jù),比對并組裝共得到53 035個基因;在恢復系與不育系、保持系與不育系以及“三系”花藥不同時期之間共篩選出非重復差異基因5 676個,其中發(fā)育階段差異基因4 705個,同時期材料間差異基因2 693個,發(fā)育時序差異基因135個。GO分子功能分析顯示ATP和DNA結合相關的基因和鋅離子結合基因得到高度富集;細胞組分中膜基本組分、核內及質膜內的基因得到富集;以DNA為模板的轉錄、轉錄調控、氧化還原及初級代謝等生物學過程中的基因得到富集。KEGG分析表明,差異基因主要富集于氧化磷酸化、碳代謝及糖酵解等能量代謝相關的途徑中。不育系相對保持系而言,多個與氧化磷酸化相關的基因下調表達,而恢復系中不但相應基因的表達水平得到恢復,而且同時協(xié)調調節(jié)了同一能量代謝途徑中的其他基因,定量分析顯示差異基因的表達差異及趨勢與轉錄組測序結果基本一致。ATP酶活結果表明不育系相比保持系,ATP酶活顯著降低,恢復系中由于恢復基因的作用其活性得到大幅恢復。【結論】玉米C型胞質不育基因引起基因表達變化可能發(fā)生在減數(shù)分裂中期Ⅰ之后,末期Ⅱ之前;玉米C型胞質不育的形成可能是由于不育基因引起的能量虧損所致,而恢復基因則通過能量補償促使育性得以恢復。
玉米;C型細胞質雄性不育;轉錄組;差異表達基因;調控網絡
0 引言
【研究意義】玉米是中國第一大糧食作物,常年播種面積333萬hm2以上,年用種量7.5億kg左右,需要制種23萬hm2左右(全國農業(yè)技術推廣服務中心 www.natesc.org.cn)。由于玉米種子生產多數(shù)采用人工去雄的方式,人工去雄的直接費用約6億元,導致種子生產成本增加,在一定程度上制約著中國種子企業(yè)的國際競爭力,而不育化制種是當前及今后種子企業(yè)提高競爭力的一個重要途徑。在玉米的質核互作不育類型中,C型細胞質雄性不育因其具有不育性穩(wěn)定、恢復徹底等特點,得到了玉米育種家及相關種子企業(yè)的高度關注。由于玉米C型胞質雄性不育及恢復機制目前仍不清楚,從而在一定程度上限制了其在種子生產上的大面積推廣應用。因此,明確玉米C型細胞質不育和恢復的分子機制及其調控網絡,將對玉米C型胞質雄性不育的應用具有一定的促進作用。【前人研究進展】植物尤其是作物中細胞質雄性不育材料是雜交種子生產的一種重要種質資源,同時也是研究核質互作的重要遺傳材料,因而得到了遺傳學家和育種家的廣泛關注。前人曾經對細胞質雄性不育開展了大量的研究,玉米T型細胞質的不育基因是第一個被鑒定的細胞質雄性不育基因[1]。水稻先后克隆了CMS-HL不育基因[2]、CMS-BT的不育基因[3]以及CMS-WA的不育基因[4]。油菜中應用較為廣泛的CMS-pol、CMS-nap與CMS-ogu 3種類型的細胞質雄性不育的不育基因、和已經克隆[5-7]。蘿卜、油菜、小麥等其他作物的細胞質雄性不育相關的部分基因也已被鑒定。目前,已經克隆的植物不育基因均與線粒體基因相關,且均為重組形成的嵌合基因。與之相應的恢復基因除玉米的[8]、水稻[9]和[10]、甜菜的[11]外,均為編碼PPR基序蛋白的基因[3,12-17]。根據(jù)已有的研究可將細胞質雄性不育機理歸納為3個假說:毒性假說、能量虧缺假說及細胞異常凋亡假說;其相應的恢復基因則通過轉錄后水平的編輯、剪接、多聚腺苷酸化、剪切等方式,或翻譯及翻譯后水平的修飾來補償或逆轉不育基因的危害,進而恢復植株的育性[18]。玉米C型細胞質雄性不育有2個重疊效應的恢復基因和[19],分別定位于第8染色體短臂和第5染色體長臂上[20]。玉米C型胞質線粒體基因組中具有多個區(qū)域重復并伴有重組,造成與線粒體呼吸鏈復合體相關基因具有多個拷貝,如、或形成嵌合基因,如,推測其中可能包含不育基因[21-22]。光學及電子顯微鏡觀察結果表明,C型胞質不育系小孢子的敗育發(fā)生在單核早期[23-24],而在二分體時期絨氈層細胞出現(xiàn)U氏小體異常[24],及至四分體絨氈層出現(xiàn)大量不規(guī)則液泡[23-24]。全基因組轉錄分析能夠鑒定到與育性恢復及不育相關的功能基因及其調控與代謝的網絡。已報道的雄性不育轉錄組分析結果表明,洋蔥細胞質雄性不育與線粒體氧化磷酸化有關[25],辣椒細胞質雄性不育主要涉及ATP合酶、NADH脫氫酶及細胞色素氧化酶[26]。對玉米C型胞質不育系與保持系的花粉母細胞時期及單核期花藥轉錄組分析發(fā)現(xiàn)MYB轉錄因子、氨基酸代謝和脂肪酸合成途徑可能對育性產生重要影響[27]。【本研究切入點】盡管前人確立了C型胞質花粉敗育時期以及分析了花粉母細胞時期與單核時期在不育系與保持系之間的差異基因,但C型胞質雄性不育的分子機制尚未解析;由于未能同時對同基因型的恢復系進行分析,無法全面解析不育與恢復可能的代謝和調控機制;而對于孢子體不育材料,在花粉敗育時期取樣,無法分析敗育形成的基因。【擬解決的關鍵問題】本研究擬通過細化取樣時期,比較玉米C型胞質三系材料在減數(shù)分裂前期Ⅰ、中期Ⅰ及四分體時期花藥的轉錄組數(shù)據(jù),在轉錄水平上分析玉米C型胞質雄性不育及恢復的機制,明確玉米C型胞質雄性不育發(fā)育過程中基因表達規(guī)律,以期為玉米C型雄性不育及恢復分子機制研究提供依據(jù),同時為恢復基因及不育基因的克隆及功能分析奠定基礎。
1 材料與方法
1.1 試驗材料
選用以優(yōu)良玉米自交系豫自87-1為背景構建的玉米細胞質雄性不育系CMS-Es87-1()、保持系N87-1()及恢復系CMS-Es87-1()為試驗材料。試驗材料于2016年春分期種植于河南農業(yè)大學科教園區(qū)。播種40 d后,參考Ma等[28]方法每隔2 d檢查玉米雄穗的花藥發(fā)育進程,待花藥發(fā)育至減數(shù)分裂時期將玉米整株取回實驗室。對雄穗局部區(qū)域進行三點(區(qū)域兩頭及中部)醋酸洋紅染色鏡檢,選取減數(shù)分裂前期(P1)、減數(shù)分裂中期Ⅰ(M1)及四分體時期(T2)的花藥,液氮速凍后-80℃保存?zhèn)溆谩C恳粋€材料每一個時期各取3個生物學重復進行轉錄組測序,每個生物學材料由多個植株的花藥組成,以消除個體及環(huán)境的差異。
1.2 花藥RNA提取
采用TRIzol(Invitrogen,Carlsbad,CA,USA)法提取玉米花藥總RNA。利用NanoDrop One檢測RNA濃度,用Agilent 2100檢測28S/18S以及RIN值,同時用1%瓊脂糖凝膠電泳檢測所提取RNA的質量及完整性。
1.3 轉錄組建庫及測序
利用Oligo(dT)磁珠富集每個玉米花藥樣品的mRNA(Illumina,San Diego,CA,USA),加入片段化緩沖液將mRNA隨機打斷成短片段。將打斷后的mRNA反轉錄成第一鏈cDNA,隨后合成第二鏈。利用QiaQuick PCR提取試劑盒純化后進行末端修復并在3'末端加上堿基A,并連接測序接頭。篩選大小在300—500 bp的片段進行PCR擴增。文庫經Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System質檢合格后用Illumina HiSeq 2500進行雙末端測序(北京貝瑞和康生物科技有限公司)。
1.4 序列分析
測序獲得的原始數(shù)據(jù)首先過濾掉低質量(Q<30)、接頭污染以及位置堿基N含量過高(>5%)的reads,得到clean reads用于后續(xù)分析。利用HiSat2軟件[29]將過濾后的數(shù)據(jù)比對到玉米參考基因組B73第四版上(B73 AGPv4,http://ensembl.gramene.org/Zea_mays/ Info/Index),用stringtie軟件[30]進行轉錄本拼接并進行基因表達量估算。基因表達值導入R軟件包DESeq2中進行差異基因分析[29]。padj小于0.05及表達差異大于2的基因認為是差異表達的基因(DEG)。根據(jù)NCBI的玉米基因注釋數(shù)據(jù)提取差異表達基因的功能信息,利用內部perl腳本從maizeGDB網站上獲取差異基因的GO注釋。從KAAS網站獲取差異表達基因的KEGG途徑,利用R軟件的clusterProfiler包進行差異基因的GO富集及代謝途徑的富集,并對線粒體相關途徑進行了分析[32]。
1.5 差異表達基因的半定量驗證
分別以87-1“三系”材料的減數(shù)分裂前期Ⅰ、四分體期和單核期的花藥總RNA為模板,反轉錄合成cDNA第一鏈。利用TB GreenTMPremix Ex TaqTMⅡ(TaKaRa)熒光定量試劑盒在CFX96實時定量PCR儀上對轉錄組數(shù)據(jù)差異表達的基因、、和進行定量分析。使用Primer3 plus在線設計所有qRT-PCR反應特異引物(表1)。cDNA反轉錄和qRT-PCR反應體系及反應程序按照PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)和TB GreenTM Premix Ex TaqTMⅡ(TaKaRa)試劑盒里的說明書的操作進行。每個試驗均設3次生物學重復和3次技術重復,利用(2-ΔΔCt)法[33]分析基因表達水平。

表1 差異基因表達分析所用引物
1.6 ATP酶活性測定
根據(jù)北京索萊寶科技有限公司(Solarbio)鈣鎂離子ATP酶檢測試劑盒說明書測定C型胞質雄性不育三系減數(shù)分裂前期花藥的ATP酶活性。稱取新鮮樣品約0.1 g,加入1 mL試劑一進行冰浴勻漿,9 200 r/min 4℃離心10 min,取上清置于冰上待測。按照手冊設置ATP酶酶促反應,水浴10 min,取上清液100 μL,分別加入定磷反應的對照管和測定管,加入定磷劑1 000 μL,混勻,40℃水浴10 min,冷卻至室溫后利用分光光度計于660 nm處比色。ATP酶活力(U·g-1)=7.5×(A測定管-A對照管)÷(A標準管-A空白管)÷W(樣本鮮重,g),計算鈣鎂離子ATP酶活性。每個材料測定3次。
2 結果
2.1 轉錄組測序與比對分析
為減少分期播種的環(huán)境影響及不同個體間的差異,同一時期至少混合3個不同播期材料及3個單株上的樣品用于RNA提取及后續(xù)測序分析。所測數(shù)據(jù)經過嚴格的質控后,產生5.6億對雙末端序列,共計156.59 Gb的序列數(shù)據(jù)(表2)。除樣品CrT23和CRT23外,Q30比例都超過了90%。PCA分析顯示三系前期各有一個樣品與相同時期的樣品差異較大,在后續(xù)比對分析中被剔除;其余不同樣品間差異明顯,不同樣品的生物學重復可聚類在一起。Hisat2比對到參考基因組的序列經過stringtie組裝,共得到53 035個Unigene,其中20 017(37.74%)個Unigene為B73基因組中未注釋的新基因。
2.2 差異表達基因分析
將差異基因定義為FDR(false discovery rate)<0.05且表達差異倍數(shù)在2倍以上的基因(圖1)。通過比較87-1三系不同時期及相同時期不同系間的表達譜,獲得在三系不同時期或同一材料不同時期之間的顯著性差異基因(表3)。87-1不育系在減數(shù)分裂中期Ⅰ與前期Ⅰ相比共有121個差異表達基因,其中48個基因個上調,73個基因下調;在四分體時期有329個基因相比中期Ⅰ表現(xiàn)為下調,而與前期Ⅰ相比,差異基因之間表現(xiàn)出顯著的變化。87-1保持系在不同發(fā)育時期之間差異表達基因的變化趨勢與不育系相似,但上調表達的基因數(shù)量更多。87-1恢復系在不同發(fā)育時期中差異基因數(shù)目的變化趨勢與保持系和不育系明顯不同,中期Ⅰ和前期Ⅰ的差異基因數(shù)量與四分體和中期Ⅰ間的差異數(shù)量相比變化不大。保持系與不育系的四分體時期出現(xiàn)大量差異表達基因(723上調/409下調),而恢復系與不育系相比在相同時期也有較多差異表達的基因。在87-1三系材料的整個發(fā)育時期中有135個基因均存在差異表達。
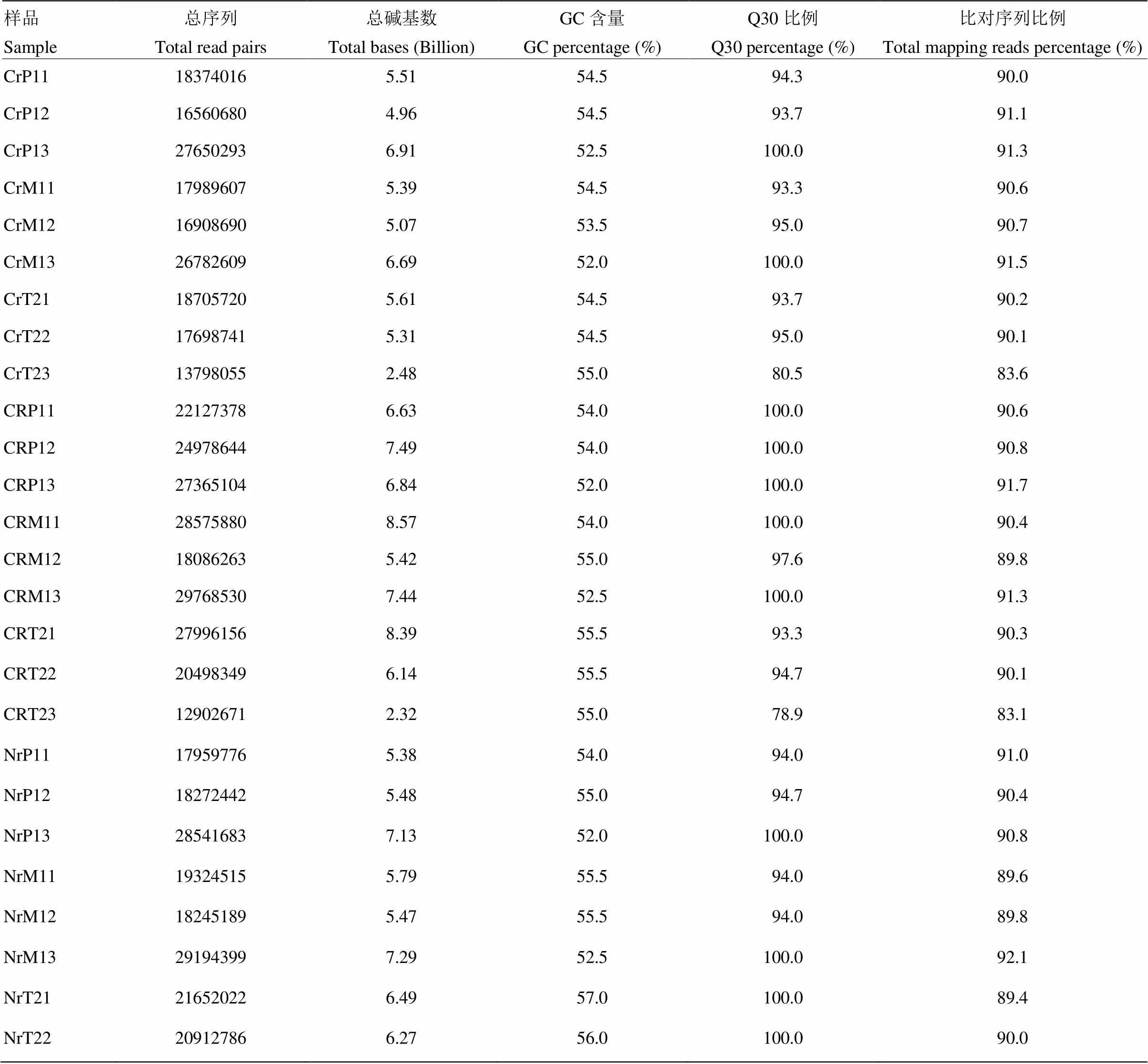
表2 測序數(shù)據(jù)統(tǒng)計分析
CR:恢復系;Cr:不育系;Nr:保持系;M1:中期Ⅰ;P1:前期Ⅰ;T2:四分體時期(末期Ⅱ);下同。樣品名最后一位數(shù)字:重復
CR: the restorer lines; Cr: the sterile lines; Nr: the maintainer lines; M1: Metaphase Ⅰ; P1: Prophase Ⅰ; T2: Telophase Ⅱ (tetrad); The same as below. the end digit in sample name: replications
2.3 差異表達基因GO功能分析
將時間軸差異分析結果及兩兩對比的結果取并集進行分析,共得到5 676個顯著的差異表達基因。通過GO分析,有4 273個基因獲得4 946個GO注釋條目,其中具有3個及以上Unigene的GO條目的基因有2 128個。差異表達基因富集在生物學過程中的有4 231個,細胞組分有4 082個,分子功能有4 085個。富集最多的前81個GO分類如圖2所示,細胞組分中富集基因最多的部位是膜的組分(integral component of membrane),其次是核內(nucleus)和質膜上(plasma membrane)的基因,而線粒體中也富集到較多的差異基因;分子功能中富集較多的3個亞類分別是ATP結合、DNA結合及鋅離子結合。與轉錄有關的基因在生物學過程中富集最多,其次還有響應刺激有關的基因以及氧化還原反應有關的基因。時間軸分析的差異基因多富集在與磷酸酶活性相關的GO條目中。87-1恢復系與不育系在減數(shù)分裂中期Ⅰ差異表達的基因多富集在花粉發(fā)育、配子體發(fā)育等生物學過程中。
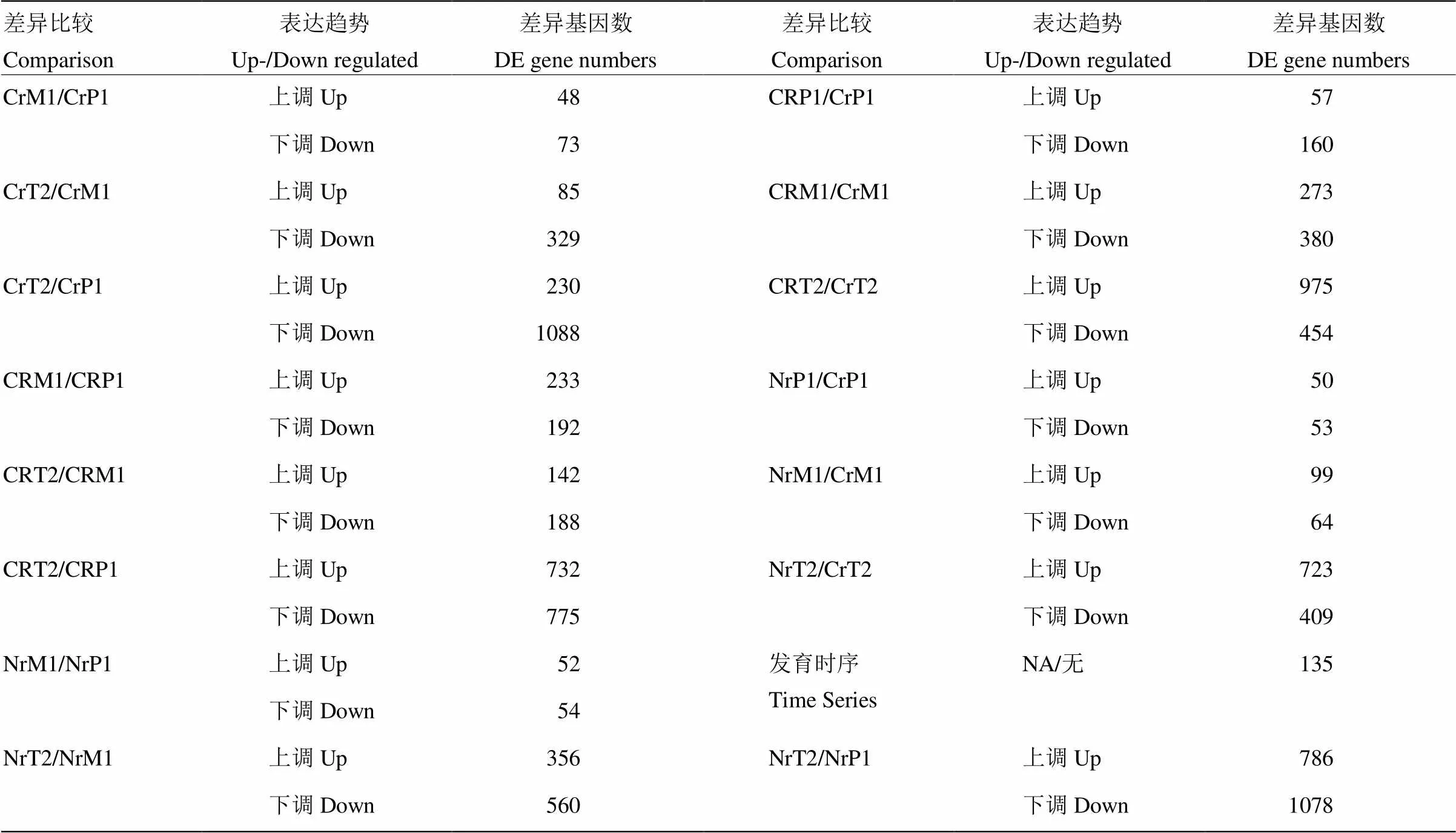
表3 差異基因統(tǒng)計分析
FDR < 0.05 and |log2FC| >= 1
2.4 差異表達基因的KEGG通路分析
通過對87-1三系不同時期兩兩對比及時間軸差異基因分別進行KEGG分析,共獲得37個不同的代謝通路(表4)。在兩兩對比分析中出現(xiàn)最多次數(shù)的途徑是角質、軟木脂和蠟質合成途徑,共出現(xiàn)12次;其次是輔酶Q及其他萜-醌合成、脂肪酸降解和苯丙烷合成途徑。在所有途徑中,富集基因最多的是碳代謝途徑,其次是糖酵解途徑和DNA復制途徑。
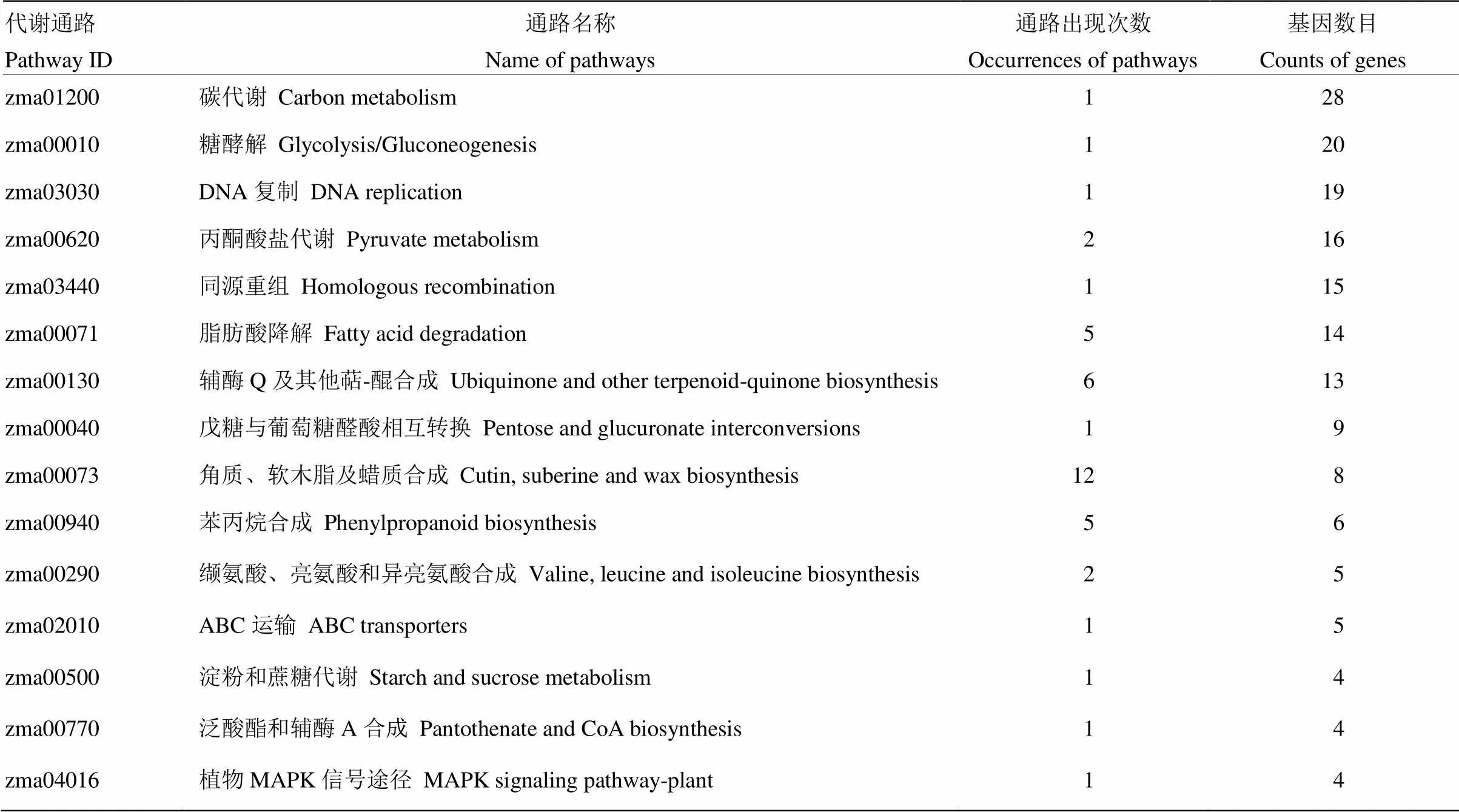
表4 差異表達基因數(shù)量最多的15個代謝通路
2.5 線粒體氧化磷酸化途徑相關基因的表達分析
線粒體是細胞的能量工廠,而細胞質雄性不育多與線粒體相關,尤其與線粒體內氧化磷酸化途徑相關[18,34-35]。玉米中共有187個基因與氧化磷酸化途徑有關(KEGG途徑zma00190)。將該基因集與差異表達基因取交集,共有13個基因在三系不同發(fā)育時期中表達呈顯著差異(表5),其中基因和在87-1保持系花藥不同發(fā)育時期持續(xù)上調表達,而在87-1不育系中表達則不存在差異;而在87-1恢復系的花藥不同發(fā)育時期的表達量與保持系相似(圖3-A和圖3-B)。87-1保持系與不育系的花藥從減數(shù)分裂前期到四分體時期的差異表達相比,有4個基因(、、和)顯著上調表達;在87-1恢復系中3個基因(、和)的表達趨勢與保持系相同,同時有另外3個基因(、和)的表達水平顯著提高(表5,圖3-C)。值得注意的是,基因在87-1三系的花藥發(fā)育時期的表達波動較大(圖3-D)。上述這些差異表達基因主要富集在氧化磷酸化途徑的復合體Ⅱ、復合體Ⅳ和復合體Ⅴ中(圖4)。
為驗證轉錄組中差異基因的表達結果,挑選了氧化磷酸化途徑中的4個差異表達基因(ComplexⅡ)、(ComplexⅣ)、(ComplexⅤ,F(xiàn)-type ATPase beta)和(ComplexⅤ,inorganic diphosphatase),以為內參基因,通過qRT-PCR技術分析它們在玉米C型胞質不育花藥不同發(fā)育階段的表達變化(圖5)。結果表明,隨著花藥的發(fā)育表達量逐漸下降,在減數(shù)分裂中期Ⅰ時恢復系的表達量約為不育系的2倍;在恢復系中表達趨勢與相同,在不育系及保持系中都是先下降再上升,且不育系單核期比中期Ⅰ上升了1倍多;恢復系和保持系中,和從中期Ⅰ到末期Ⅱ的表達趨勢相反,從末期Ⅱ到單核期表達趨勢相同;在三系材料末期Ⅱ中迅速上升,不育系上升了7倍多,但其表達量仍低于保持系和恢復系。qTR-PCR結果與轉錄組分析結果基本一致。
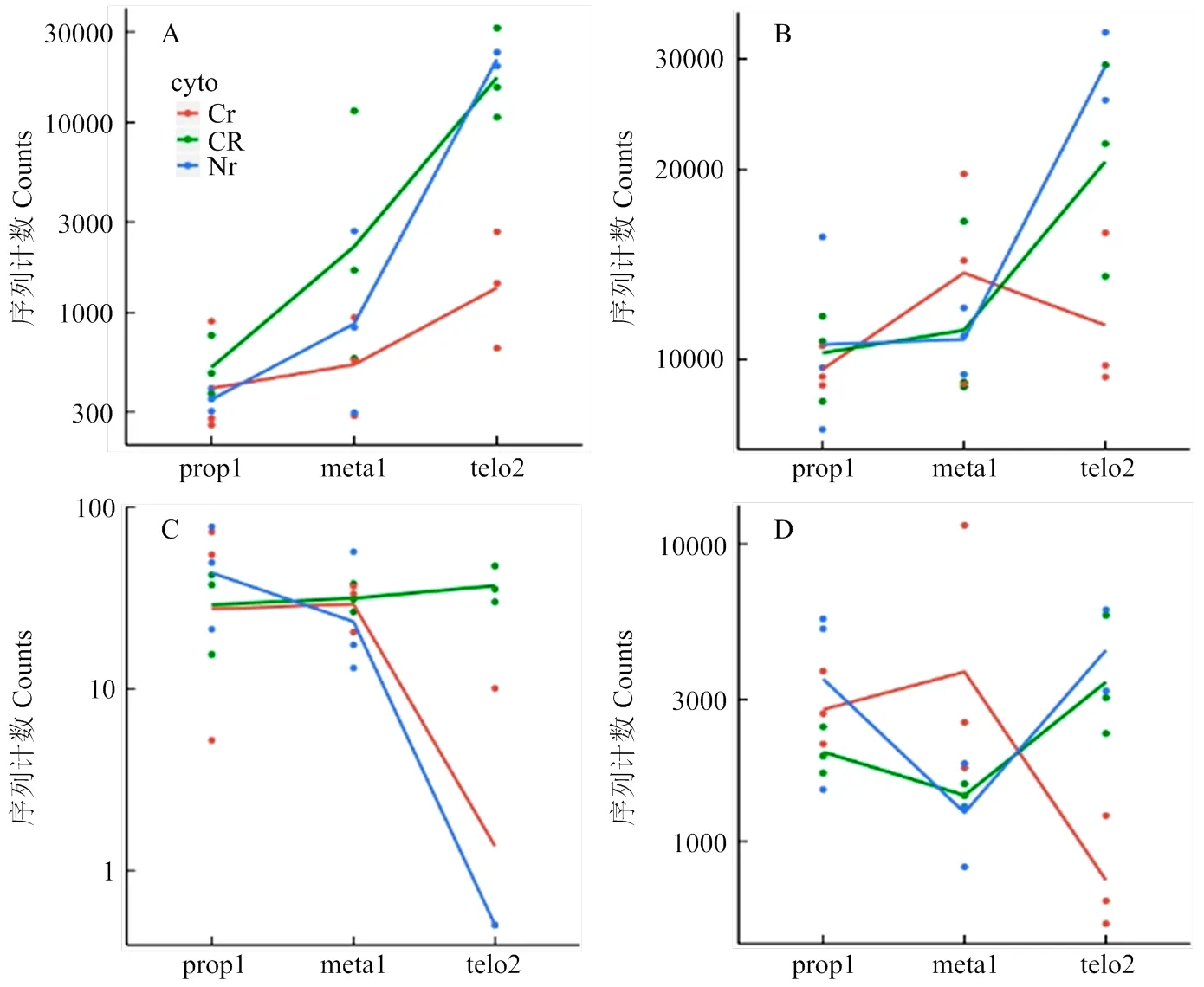
A:Zm00001d033552;B:Zm00001d043834;C:Zm00001d009222;D:Zm00001d037576
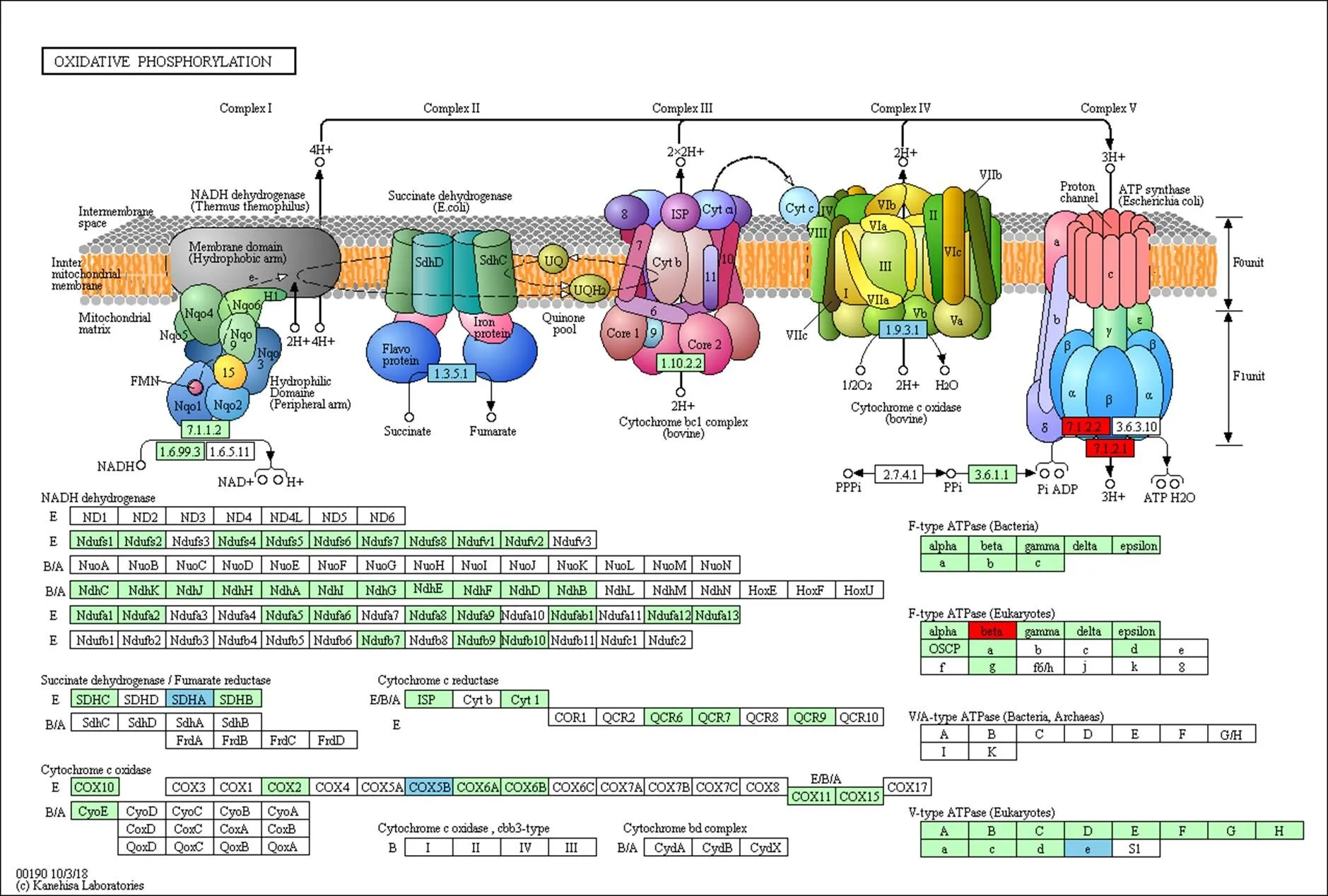
綠底框:物種特異的基因;紅底框:上調基因;天藍底框:下調基因
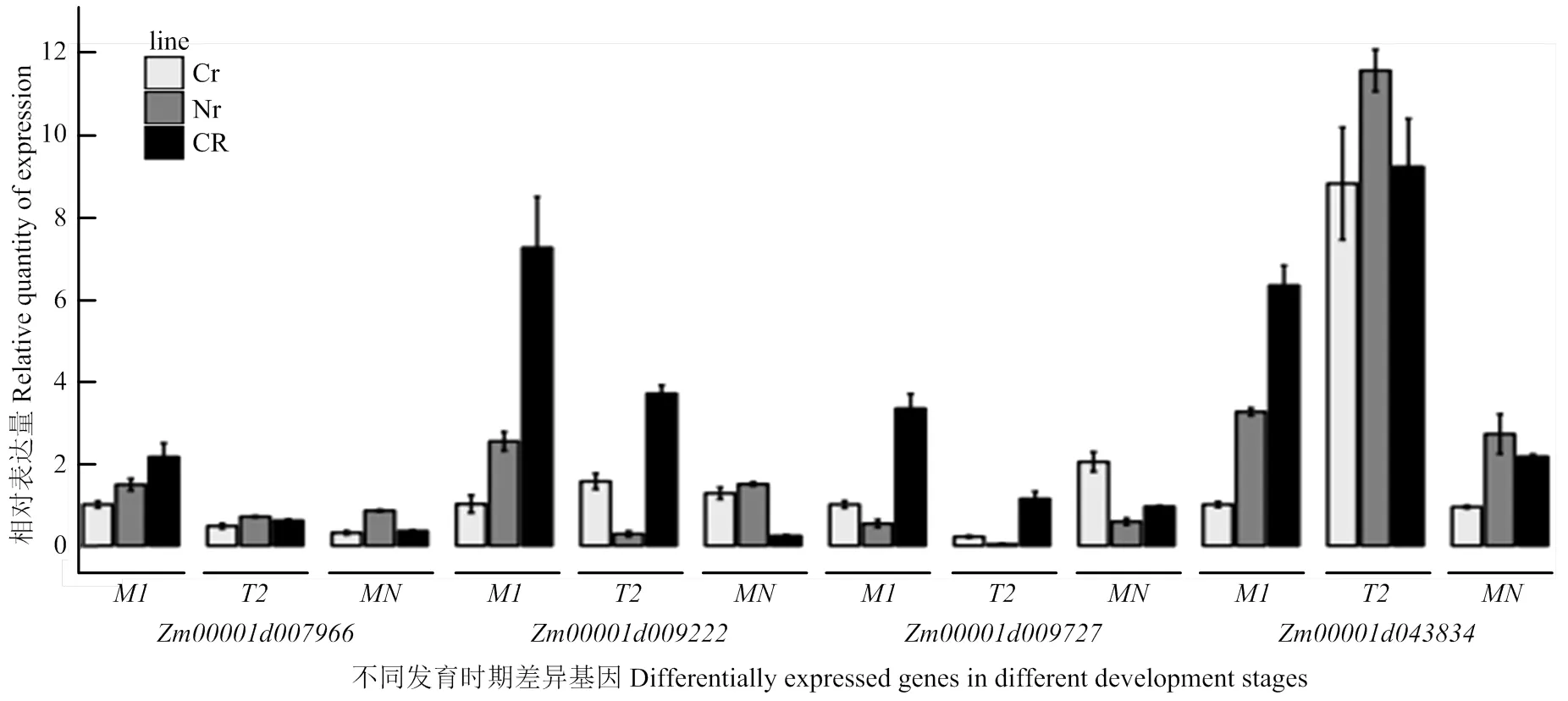
CR:恢復系;Cr:不育系;Nr:保持系,M1:中期1;T2:末期2(tetrad);MN:單核期
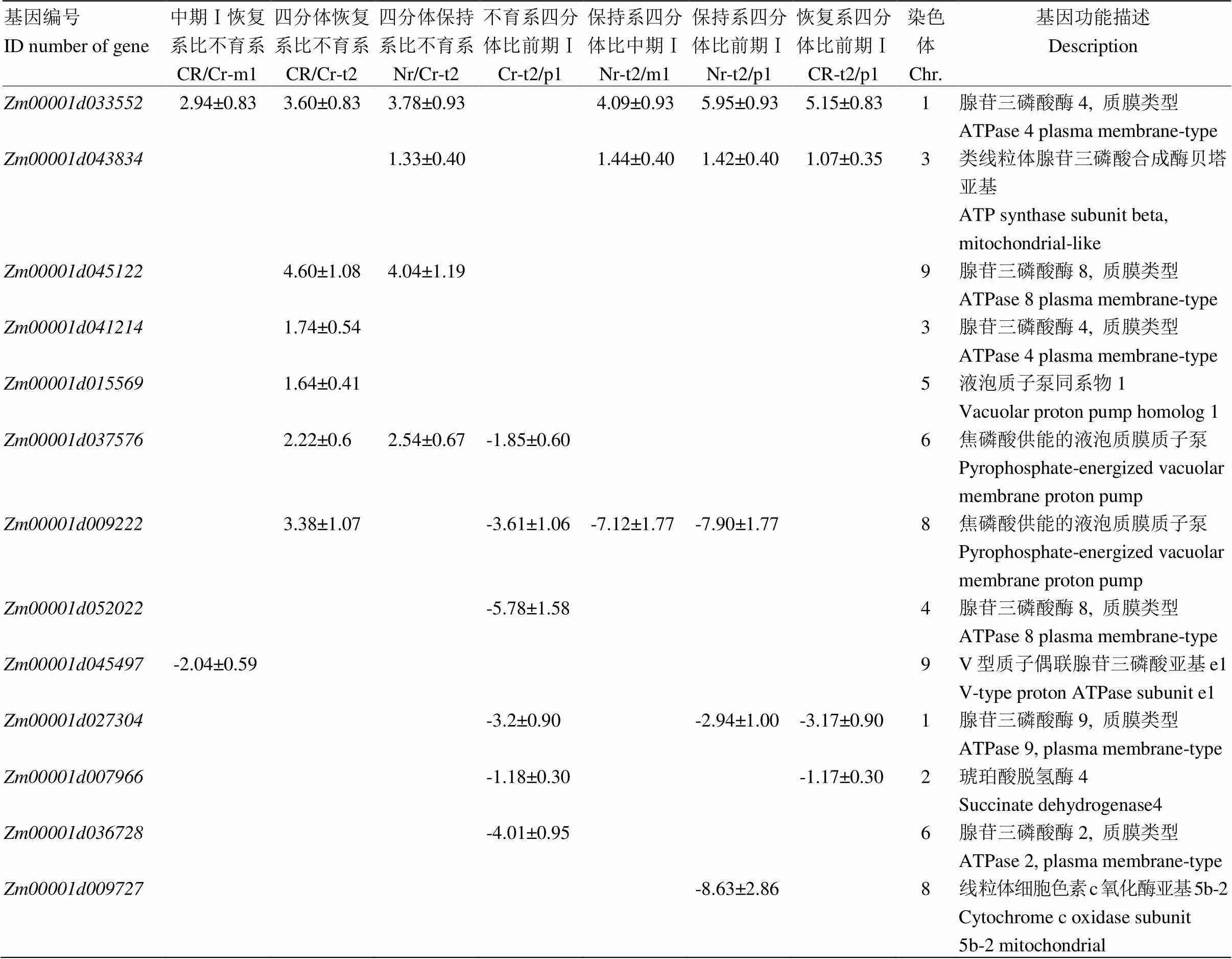
表5 線粒體氧化磷酸化途徑相關基因的表達差異
2.6 細胞色素P450基因的表達分析
細胞色素P450通過調節(jié)許多重要的細胞過程而影響植物的生長與發(fā)育,而一些P450基因參與合成植物激素如生長素、赤霉素、細胞分裂素等在植物開花成熟過程中發(fā)揮著重要的作用[36-37]。轉錄組分析不同時期保持系與不育系、恢復系與不育系的比較中發(fā)現(xiàn)12個細胞色素P450家族基因的表達存在顯著差異(表6)。在減數(shù)分裂前期,保持系中與比不育系的表達量要高得多(log2值分別為19.96和17.59),表明不育系中這兩個基因幾乎不表達或表達量極低;在恢復系中,的表達量恢復到保持系的水平。及至減數(shù)分裂中期Ⅰ,這兩個基因在不同材料的比較中沒有差異,同時保持系與不育系間未出現(xiàn)新的差異表達細胞色素P450家族基因;而在恢復系中新增3個上調及3個下調的細胞色素P450基因。在減數(shù)分裂末期2時,前期1的2個差異基因再次出現(xiàn)差異,且表達趨勢相同;而在不育系中下調的細胞色素基因在恢復系中都得到了恢復。
2.7 ATP酶活性變化
氧化磷酸化途徑是線粒體內重要的代謝途徑。玉米C型胞質不育線粒體基因組內發(fā)生重復或嵌合的基因(、和)均與該途徑相關,其中()位于復合體Ⅳ中,和()位于復合體Ⅴ中。重復的基因打破原有基因間的劑量比例[38-40],而嵌合基因又干擾了正常atp6的生成,并進一步干擾了復合體Ⅴ的功能行使[18],最終引起線粒體ATP酶的活性變化。對“三系”材料減數(shù)分裂期間花藥ATP酶活性測定結果顯示,不育系的ATP酶活性相較于保持系明顯低了1個酶活單位(圖6),而在恢復系中,ATP酶的活性不但得到恢復,并且比保持系提高了一個酶活單位。
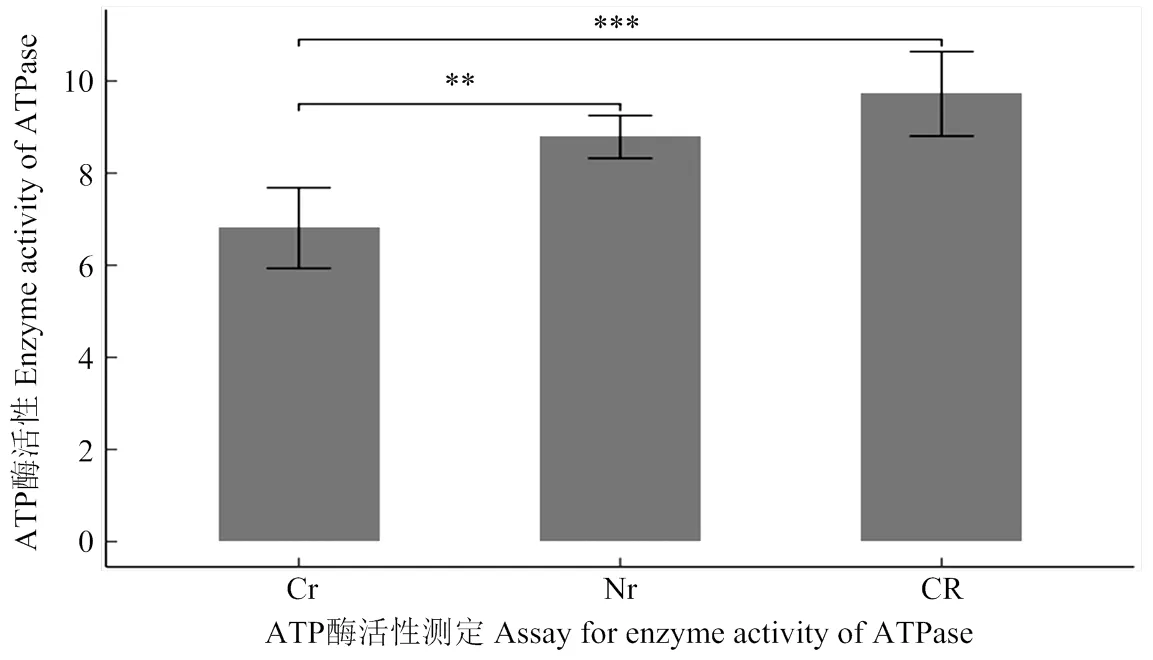
CR:恢復系;Cr:不育系;Nr:保持系;**表示0.01水平差異顯著;***表示0.001水平差異顯著
3 討論
3.1 玉米C型胞質雄性不育系敗育時期
Lee等[23]通過電鏡觀察發(fā)現(xiàn)玉米C型胞質雄性不育系的花藥在四分體時期出現(xiàn)差異,主要為絨氈層細胞出現(xiàn)大量小液泡(類型Ⅰ)或高度液泡化(類型Ⅱ),細胞器如線粒體等正常。進一步觀察發(fā)現(xiàn),不育系絨氈層細胞在二分體時期未觀察到U小體(Ubisch body),四分體時除出現(xiàn)液泡外,胞質的電子密度亦有降低,小孢子初期開始敗育[24]。本研究中發(fā)現(xiàn)87-1保持系與不育系在前期僅有103個差異表達基因;而87-1保持系與不育系相比前期Ⅰ至中期Ⅰ的差異表達基因也相對較少,而同一時期,保持系與不育系小孢子發(fā)育也沒有明顯區(qū)別,說明這些差異基因可能與后期的小孢子敗育無直接關系。87-1不育系的花藥從中期Ⅰ到四分體,以及不同材料的花藥四分體之間則存在大量的差異表達基因,而前人利用電鏡觀察到不育系敗育的表型相吻合[23-24],因此可以推測引起玉米C胞質雄性不育小孢子敗育的關鍵時期應在減數(shù)分裂中期Ⅰ到減數(shù)分裂后期Ⅱ之間,而這一階段正是玉米花藥絨氈層細胞二核化的高峰期[41]。Li等[27]曾經對玉米C型胞質雄性不育系及保持系的花粉母細胞及單核期進行了轉錄組測序,雖然鑒定到一些差異表達的基因,但是這些時期由于不是引起小孢子敗育的關鍵時期,鑒定到的差異表達基因可能與小孢子的后期敗育有關。為了篩選出與玉米C型胞質雄性不育小孢子敗育與恢復的關鍵基因,本研究選擇了減數(shù)分裂前期、減數(shù)分裂中期Ⅰ及四分體3個花藥發(fā)育的關鍵時期進行了轉錄組分析[23-24],并從差異不同時期差異基因的變化趨勢中推斷出基因表達改變的主要時期,為后續(xù)表達分析、分子鑒定的取樣提供了依據(jù)。
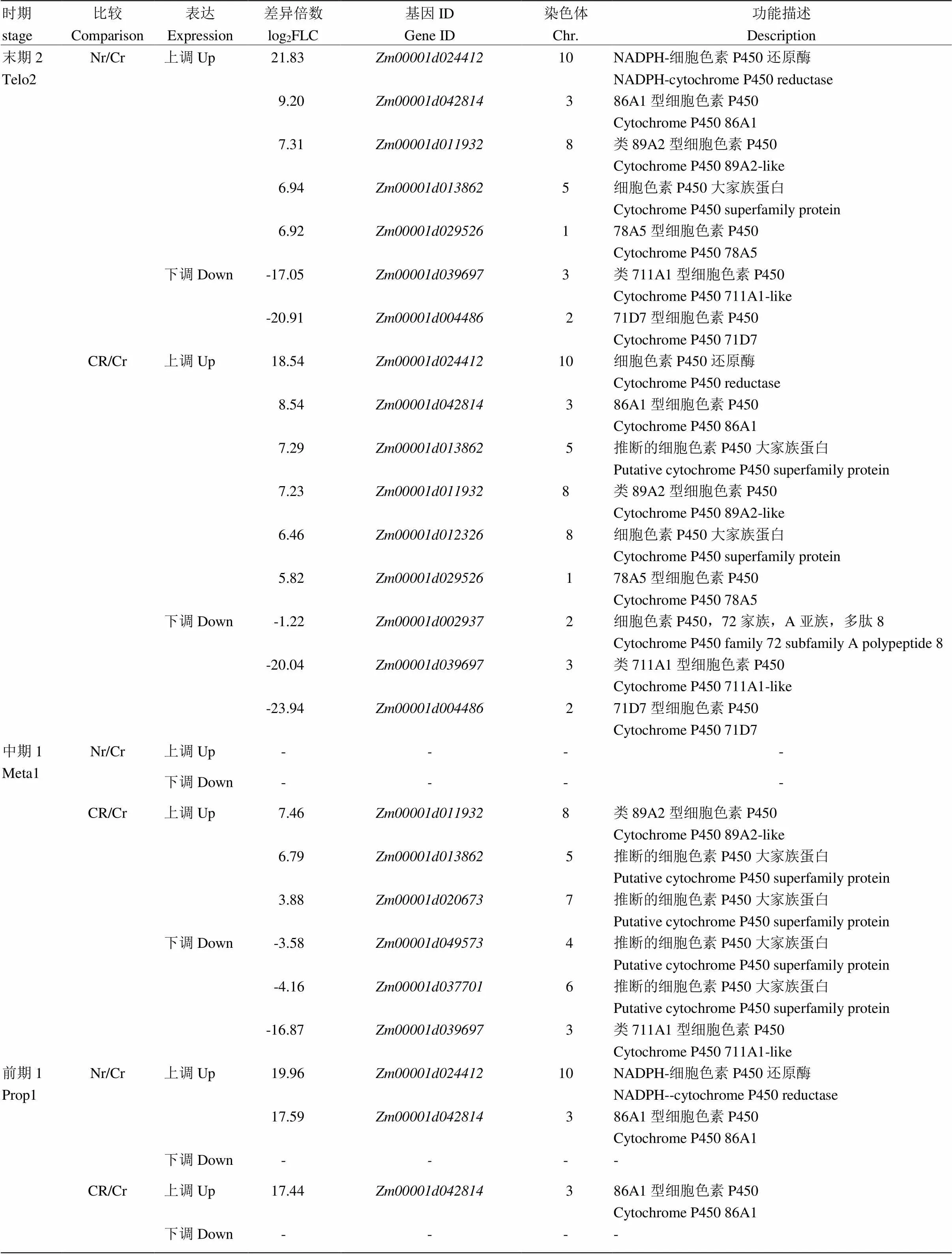
表6 細胞色素P450基因的表達
3.2 玉米C型胞質不育恢復系通過能量補償恢復育性
前人通過RNA雜交與C型胞質不育系和保持系的線粒體測序分析,發(fā)現(xiàn)玉米N胞質與C胞質的線粒體基因組在atp6、atp9和coxⅡ等基因序列間存在差異,其中C胞質線粒體中為嵌合體基因,和具有2個拷貝[21]。線粒體全基因組分析中也發(fā)現(xiàn)有其它的嵌合體基因,但與已知的線粒體基因均不同源[22]。盡管這3個基因可能與C胞質不育相關,迄今為止,尚沒有分子證據(jù)能證明其中的基因為不育基因。Chen等[18]總結了引起細胞質雄性不育的4個模型,分別是毒性假說、能量虧損假說、異常PCD假說及反向調節(jié)假說。本研究通過對線粒體基因進行分析,發(fā)現(xiàn)上述3個基因組間存在差異的基因在不育系與保持系及恢復系之間的差異表達無顯著差異(圖7)。由于及是氧化磷酸化途徑中復合體Ⅴ的組成部分,為復合體Ⅳ的成分,這些基因微小的表達差異也可引起能量供應的波動,進而造成花粉不育。轉錄組數(shù)據(jù)分析結果表明,氧化磷酸化相關基因在87-1不育系中表達較低,而在87-1保持系與恢復系中上調表達(圖4,紅框基因);而在87-1恢復系中同時還抑制了該途徑中另外幾個基因的表達(圖4,藍框基因),從而恢復線粒體的能量供求;ATP酶活性測定結果顯示ATP酶活性波動趨勢(圖6)與由轉錄組數(shù)據(jù)中相應基因的表達趨勢推導的結論一致。氧化磷酸化途徑復合體Ⅴ與ATP的合成直接有關,qRT-PCR分析顯示,復合體Ⅴ亞基基因在四分體時期達到高峰,且中期Ⅰ中恢復系和保持系中的表達量比不育系高出數(shù)倍(圖5)。據(jù)此推斷,玉米C型胞質雄性不育可能是由線粒體能量不足引起的,而恢復基因則可以對不育基因引起的能量虧損進行補償;同時恢復基因可能通過協(xié)調氧化磷酸化途徑中不同的復合體亞基,促進整個途徑中的反應有序運行,彌補不育基因的有害作用,進而恢復育性。
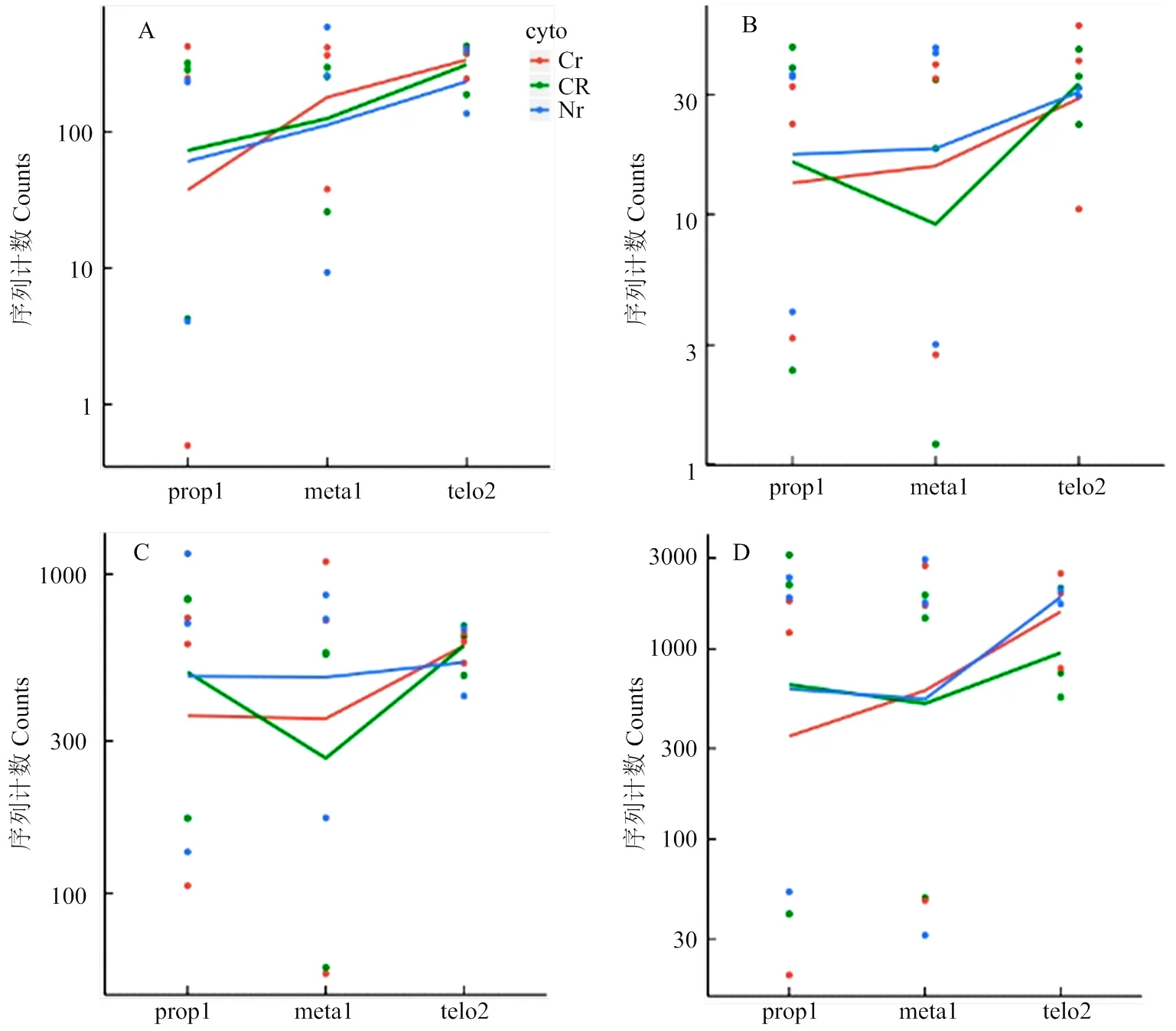
A:atp6c;B:atp9-1;C:cox2-1;D:nad4
3.3 細胞色素P450基因的調控與玉米C型胞質雄性不育相關
植物細胞色素P450基因家族參與多個代謝途徑,影響植物的生長發(fā)育及開花[37]。過表達的擬南芥植株與野生型相比具有更大的莢果、較短的雄蕊以及較低的育性等[42]。敲除的擬南芥具有更多的葉片[43]。而則參與擬南芥生殖發(fā)育[44]。水稻中與花藥角質的合成及花粉外壁的形成相關[45]。玉米核不育基因為細胞色素P450類基因[46]。前人研究表明細胞色素P450家族的基因與雄性器官的發(fā)育和育性有關。本研究發(fā)現(xiàn)減數(shù)分裂前期Ⅰ時不育系相比保持系,細胞色素P450基因與表達量極低,恢復系通過恢復其中一個細胞色素P450基因使得減數(shù)分裂正常向后進行。隨后恢復系中通過恢復更多的細胞色素P450基因并抑制該家族中不需要的基因保證絨氈層細胞的正常功能最終恢復花粉的育性。由此推測,不育基因可能影響到細胞色素P450基因的表達,而恢復基因通過早期恢復相應細胞色素P450基因的表達,進而級聯(lián)恢復后續(xù)發(fā)育所需的該家族基因,保證了細胞功能的正常行使,從而使育性得以恢復。
4 結論
玉米C型胞質不育形成的關鍵時期可能為減數(shù)分裂中期Ⅰ與減數(shù)分裂后期Ⅱ之間;玉米C型胞質不育機理可能是能量虧損假說,恢復基因通過直接或間接作用進行能量補償而恢復育性。
[1] Dewey R, Levings C S, Timothy D H. Novel recombinations in the maize mitochondrial genome produce a unique transcriptional unit in the texas male-sterile cytoplasm., 1986, 44(3): 439-449.
[2] Peng X, Wang K, Hu C, Zhu Y, Wang T, Yang J, Tong J, Li S, Zhu Y. The mitochondrial gene orfH79 plays a critical role in impairing both male gametophyte development and root growth in CMS-Honglian rice., 2010, 10(1): 125.
[3] Wang Z, Zou Y, Li X, Zhang Q, Chen L, Wu H, Su D, Chen Y, Guo J, Luo D, Long Y, Zhong Y, Liu Y G. Cytoplasmic male sterility of rice with Boro II cytoplasm is caused by a cytotoxic peptide and is restored by two related PPR motif genes via distinct modes of mRNA silencing., 2006, 18(3): 676-687.
[4] Luo D, Xu H, Liu Z, Guo J, Li H, Chen L, Fang C, Zhang Q, Bai M, Yao N, Wu H, Wu H, Ji C, Zheng H, Chen Y, Ye S, Li X, Zhao X, Li R, Liu Y G. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice., 2013, 45(5): 573-577.
[5] Singh M. Suppression of cytoplasmic male sterility by nuclear genes alters expression of a novel mitochondrial gene region., 1991, 3(12): 1349-1362.
[6] Brown G G. Unique aspects of cytoplasmic male sterility and fertility restoration in., 1999, 90(3): 351-356.
[7] Uyttewaal M, Arnal N, Quadrado M, Martin-Canadell A, Vrielynck N, Hiard S, Gherbi H, Bendahmane A, Budar F, Mireau H. Characterization ofpentatricopeptide repeat proteins encoded by the fertility restorer locus for Ogura cytoplasmic male sterility., 2008, 20(12): 3331-3345.
[8] Cui X, Wise R P, Schnable P S. Thenuclear restorer gene of male-sterile T-cytoplasm maize., 1996, 272(5266): 1334-1336.
[9] Fujii S, Toriyama K. Suppressed expression of retrograde- regulated male sterility restores pollen fertility in cytoplasmic male sterile rice plants., 2009, 106(23): 9513-9518.
[10] Itabashi E, Iwata N, Fujii S, Kazama T, Toriyama K. The fertility restorer gene,, for lead rice-type cytoplasmic male sterility of rice encodes a mitochondrial glycine-rich protein., 2011, 65(3): 359-367.
[11] Kitazaki K, Arakawa T, Matsunaga M, Yui-Kurino R, Matsuhira H, Mikami T, Kubo T. Post-translational mechanisms are associated with fertility restoration of cytoplasmic male sterility in sugar beet ()., 2015, 83(2): 290-299.
[12] Bentolila S, Alfonso A A, Hanson M R. A pentatricopeptide repeat-containing gene restores fertility to cytoplasmic male-sterile plants., 2002, 99(16): 10887-10892.
[13] Brown G G, Formanová N, Jin H, Wargachuk R, Dendy C, Patil P, Laforest M, Zhang J, Cheung W Y, Landry B S. The radishrestorer gene of Ogura cytoplasmic male sterility encodes a protein with multiple pentatricopeptide repeats., 2003, 35(2): 262-272.
[14] Koizuka N, Imai R, Fujimoto H, Hayakawa T, Kimura Y, Kohno-Murase J, Sakai T, Kawasaki S, Imamura J. Genetic characterization of a pentatricopeptide repeat protein gene,, that restores fertility in the cytoplasmic male-sterile Kosena radish., 2003, 34(4): 407-415.
[15] Hu J, Wang K, Huang W, Liu G, Gao Y, Wang J, Huang Q, Ji Y, Qin X, Wan L, Zhu R, Li S, Yang D, Zhu Y. The rice pentatricopeptide repeat proteinrestores fertility in Hong-Lian cytoplasmic male-sterile lines via a complex with the glycine-rich protein GRP162., 2012, 24(1): 109-122.
[16] Tang H, Luo D, Zhou D, Zhang Q, Tian D, Zheng X, Chen L, Liu Y G. The rice restorerfor wild-abortive cytoplasmic male sterility encodes a mitochondrial-localized PPR protein that functions in reduction of WA352 transcripts., 2014, 7(9): 1497-1500.
[17] Huang W, Yu C, Hu J, Wang L, Dan Z, Zhou W, He C, Zeng Y, Yao G, Qi J, Zhang Z, Zhu R, Chen X, Zhu Y. Pentatricopeptide-repeat family protein RF6 functions with hexokinase 6 to rescue rice cytoplasmic male sterility., 2015, 112(48): 14984-14989.
[18] Chen L, Liu Y G. Male sterility and fertility restoration in crops., 2014, 65(1): 579-606.
[19] 陳偉程, 羅福和, 季良越. 玉米C型胞質雄花不育的遺傳及其在生產上的應用. 作物學報, 1979, 5(4): 21-28.
Chen W C, Luo F H, Ji L Y. Some genetic aspects of the C-type cytoplasmic male-sterility in maize and its use in breeding., 1979, 5(4): 21-28. (in Chinese)
[20] 湯繼華, 劉宗華, 陳偉程, 胡彥民, 季洪強, 季良越. 玉米C型胞質不育恢復主基因SSR標記. 中國農業(yè)科學, 2001, 34(6): 592-596.
Tang J H, Liu Z H, Chen W C, Hu Y M, Ji H Q, Ji L Y. The SSR markers of the main restorer genes for CMS-C cytoplasmic male sterility in maize., 2001, 34(6): 592-596. (in Chinese)
[21] Dewey R E, Timothy D H, Levings C S. Chimeric mitochondrial genes expressed in the C male-sterile cytoplasm of maize., 1991, 20(6): 475-482.
[22] Allen J O, Fauron C M, Minx P, Roark L, Oddiraju S, Lin G N, Meyer L, Sun H, Kim K, Wang C, Du F, Xu D, Gibson M, Cifrese J, Clifton S W, Newton K J. Comparisons among two fertile and three male-sterile mitochondrial genomes of maize., 2007, 177(2): 1173-1192.
[23] Lee S L, Gracen V E, Earle E D. The cytology of pollen abortion in C-cytoplasmic male-sterile corn anthers., 1979, 66(6): 12.
[24] 陳偉程, 李桂珍. 玉米C型胞質雄性不育系花粉敗育的細胞學研究. 華北農學報, 1987, 2(1): 1-6.
Chen W C, Li G Z. A cytological study in pollen abortion in C-cytoplasmic male-sterile corn (, L.)., 1987, 2(1): 1-6. (in Chinese)
[25] Liu Q, Lan Y, Wen C, Zhao H, Wang J, Wang Y. Transcriptome sequencing analyses between the cytoplasmic male sterile line and its maintainer line in Welsh onion (L.)., 2016, 17(7): 1058.
[26] Liu C, Ma N, Wang P Y, Fu N, Shen H L. Transcriptome sequencing and De Novo analysis of a cytoplasmic male sterile line and its near-isogenic restorer line in Chili pepper (L.)., 2013, 8(6): e65209.
[27] Li C, Zhao Z, Liu Y, Liang B, Guan S, Lan H, Wang J, Lu Y, Cao M. Comparative transcriptome analysis of isonuclear-alloplasmic lines unmask key transcription factor genes and metabolic pathways involved in sterility of maize CMS-C., 2017, 5: e3408.
[28] Ma J, Skibbe D S, Fernandes J, Walbot V. Male reproductive development: gene expression profiling of maize anther and pollen ontogeny., 2008, 9(12): R181.
[29] Kim D, Langmead B, Salzberg S L. HISAT: a fast spliced aligner with low memory requirements., 2015, 12(4): 357-360.
[30] Pertea M, Pertea G M, Antonescu C M, Chang T C, Mendell J T, Salzberg S L. StringTie enables improved reconstruction of a transcriptome from RNA-seq reads., 2015, 33(3): 290-295.
[31] Love M I, Huber W, Anders S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2., 2014, 15(12): 550.
[32] Yu G, Wang L G, Han Y, He Q Y. ClusterProfiler: an R package for comparing biological themes among gene clusters., 2012, 16(5): 284-287.
[33] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCTmethod., 2001, 25(4): 402-408.
[34] Hu J, Huang W C, Huang Q, Qin X J, Yu C C, Wang L L, Li S Q, Zhu R S, Zhu Y G. Mitochondria and cytoplasmic male sterility in plants., 2014, 19(B): 282-288.
[35] Touzet P, Meyer E H. Cytoplasmic male sterility and mitochondrial metablolism in plants., 2014, 19(B): 166-171.
[36] Werck-Reichhart D, Feyereisen R. Cytochromes P450: a success story., 2000, 1(6): reviews3003.1-3003.9.
[37] Xu J, Wang X Y, Guo W Z. The cytochrome P450 superfmily: Key players in plant development and defense., 2015, 14(9): 1673-1686.
[38] Qian W F, Zhang J Z. Gene dosage and gene duplicability., 2008, 179(4): 2319-2324.
[39] Spadafora N, Perrotta L, Nieuwland J, Albani D, Bitonti B M, Herbert R J, Doonan J H, Marchbank A M, Siciliano I, Gr?nlund A L, Francis D, Rogers H J. Gene dosage effect of WEE1 on growth and morphogenesis fromexplants., 2012, 110(8): 1631-1639.
[40] Chang N, Sun Q Q, Li Y Q, Mu Y J, Hu J L, Feng Y, Liu X M, Gao H B. PDV2 has a dosage effect on chloroplast division in., 2017, 36(3): 471-480.
[41] Kelliher T, Walbot V. Emergence and patterning of the five cell types of theanther locule., 2011, 350(1): 32-49.
[42] Fang W, Wang Z, Cui R, Li J, Li Y. Maternal control of seed size by EOD3/CYP78A6 in., 2012, 70: 929-939.
[43] Wang J W, Schwab R, Czech B, Mica E, Weigel D. Dual effects of miR156-targeted SPL genes and CYP78A5/KLUH on plastochron length and organ size in., 2008, 20: 1231-1243.
[44] Sotelo-Silveira M, Cucinotta M, Chauvin A L, Chavez Montes R A, Colombo L, Marsch-Martinez N, de Folter S. Cytochrome P450 CYP78A9 is involved inreproductive development., 2013, 162: 779-799.
[45] Li H, Pinot F, Sauveplane V, Werck-Reichhart D, Diehl P, Schreiber L, Franke R, Zhang P, Chen L, Gao Y W, Liang W Q, Zhang D B. Cytochrome P450 family member CYP704B2 catalyzes the omega-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice., 2010, 22: 173-190.
[46] Djukanovic V, Smith J, Lowe K, Yang M Z, Gao H R, Jones S, Micholson M G, West A, Lape J, Bidney D, Falco S C, Jantz D, Lyznik L A. Male-sterile maize plants produced by targeted mutagenesis of the cytochrome P450-like gene (MS26) using a re-designed I-CreI homeing endonuclease., 2013, 76: 888-899.
Comparative transcriptome analysis among the three line of cytoplasmic male sterility in maize
XUE Yadong1, YANG Lu1, YANG Huili1, LI Bing1, LIN Yanan1, ZHANG Huaisheng1, GUO Zhanyong1, TANG Jihua1,2
(1College of Agronomy, Henan Agricultural University/Key Laboratory of Wheat and Maize Crops Science, Zhengzhou 450002;2Hubei Collaborative Innovation Center for Grain Industry, Yangtze University, Jingzhou 434025, Hubei)
【Objective】It is one of the most efficient ways to utilize cytoplasmic male sterile (CMS) lines in hybrid seed production, which could improve the purity of seeds, reduce the cost in creating hybrid seeds and enhance the competitiveness of Chinese seed companies. The comparative transcriptome analysis of the anthers at different development stages from the CMS line, the maintainer line and the restorer line (the three lines) were performed in order to understand the mechanism of sterility and restoration of CMS-C in maize, and also to elucidate the regulation network between the restorer gene and the sterile gene, which will provide the fundamental basis for the employment of maize CMS in hybrid seed production.【Method】The transcriptome sequencing was carried out on the anthers at the prophaseⅠ, the metaphaseⅠand the tetrad stage from the three lines based on the elite inbred line Yu87-1. Method of comparative analysis was used to deal with all the transcripts by the tools such as hisat2, ballgown and DESeq2, and to predict genes involved in the regulation network between the sterile gene and the restorer gene, between the different development stages and through the development time series. qRT-PCR was used to verify the differentially expressed genes. The activity of ATPase was quantified with by the spectrophotometric method for the verification of the putative hypothesis.【Result】Transcriptome sequencing totally produced 156.59 Gb sequence data. After mapping and assembling, 53035 Unigenes were obtained. A total of 5676 differentially expressed (DE) genes were identified from the pairwise comparisons (except for comparisons between the restorer lines and the maintainer lines) in the anthers at the different stages from the three lines. Of those, 4705 DE genes between the comparisons of the development stages, 2693 DE genes between the comparisons of the different lines and 135 DE genes related to the time series. The GO molecular functional analysis showed that the genes related to ATP binding, DNA binding and zinc ion binding were highly enriched, in cell component analysis, genes located in integral component of membrane, nucleus and plasma membrane were enriched, and in biological process, genes involved in DNA-templated transcription, regulation of transcription, oxidation-reduction process and primary metabolic process were enriched. KEGG pathway analysis indicated that the oxidative phosphorylation pathways, the carbon metabolism pathways and glycolysis pathways were mostly enriched. Compared to the maintainer lines, several genes involving in the oxidative phosphorylation pathways were significantly down-regulated in the sterile lines, while those down-regulated genes were recovered, besides other genes in the same pathways were also coordinately regulated. The expression trend determined by qRT-PCR on the selected DE genes was in accordance with that in the transcriptome data. The enzyme activity results show that the activity of ATPase in the sterile line was greatly reduced compared to the maintainer line, while in the restorer line, the activities the ATPase were restored due to the existence of the restorer gene.【Conclusion】The onset of the changes in the gene expression caused by the sterile gene in the anthers of CMS-C maize may happen after metaphaseⅠ and before telophase Ⅱ in meiosis before visible phenotype occurred. The energy deficiency model may account for the mechanism of the sterility in maize CMS-C, and the energy requirements were compensated by the restorer gene through direct or indirect manner.
; cytoplasmic male sterility; transcriptome; differentially expressed gene; regulation network
2018-12-10;
2019-02-14
國家自然科學基金(31471504)
薛亞東,E-mail:yadongxue@henau.edu.cn。通信作者湯繼華,Tel:0371-56990336;E-mail:tangjihua1@163.com
10.3864/j.issn.0578-1752.2019.08.002
(責任編輯 李莉)

