凍結步態帕金森病患者腦部結構fMRI:基于體素的形態學分析
陳靜勿,胡杉,謝新鳳,楊粵龍,吳曉玲,楊云竣,黃飚
凍結步態(freezing of gait,FOG)是帕金森病(Parkinson's disease,PD)晚期患者中常見的致殘性步態障礙。2010年在美國華盛頓舉辦的凍結步態研討會上將其定義為在準備行走時出現前進腳步的短暫性、偶發性缺乏或明顯減少,患者感到腳被粘在地面上不能行走[1]。因FOG易導致患者發生跌倒而造成骨折等并發癥,嚴重影響患者的生活質量和社會功能[2],所以FOG被認為是PD患者較嚴重的癥狀之一。目前對凍結步態的病理生理機制尚未明確,部分合并FOG的PD患者長期得不到正確有效的治療。左旋多巴胺類藥物能有效改善PD患者的運動障礙,如靜止性震顫、肌強直和運動遲緩等,但對FOG治療效果欠佳,多巴胺類藥物甚至會誘發或加重某些PD患者的FOG[3]。腦深部電刺激(deep brain stimulation,DBS)療法對FOG也無明顯改善作用。
越來越多的研究者認為PD-FOG不僅僅是單純的運動障礙,而是運動和認知兩大因素之間相互影響、相互作用所致,其中認知功能障礙可能起著主要作用。隨著MRI技術的發展,有較多的學者應用fMRI和DTI對PD-FOG患者進行研究,Tessitore等[4]應用fMRI中的獨立成份分析法分析PD-FOG患者的靜息態fMRI數據,發現所提取的5個神經網絡中,執行-注意(右側額中回和角回)網絡和視覺網絡(右頂枕回)功能連接下降;Fling等[5]應用DTI技術的研究結果亦顯示PD-FOG患者腳橋核與額葉皮質多個區域的連接減少,提示認知功能障礙可能與FOG的發生機制有關。但目前PD-FOG患者出現腦部區域灰質萎縮的相關區域尚不明確。目前應用基于體素形態學分析法(voxel-based morphometry,VBM)分析PD-FOG患者的國內研究較少,因此本研究應用VBM法來分析PD-FOG患者腦灰質的形態學,旨在進一步探討本病的病理生理機制。
材料與方法
1.臨床資料
搜集廣東省人民醫院2014年1月-2016年12月經臨床確診的38例帕金森病患者的病例資料,其中PD-FOG患者20例(男14例,女6例),PD-nFOG患者18例(男9例,女9例)。同時招募21例健康志愿者作為正常對照組(healthy controls,HCs),年齡、性別和受教育程度與PD組相匹配。所有被試為右利手。
所有患者經神經內科醫師參照1992年英國帕金森病協會腦庫臨床診斷標準明確診斷。凍結步態的評估采用凍結步態調查問卷評測法(New FOG-Questionnaire,NFOG-Q),NFOG-Q評分≥1認為有凍結步態同時結合患者在10米步行、轉彎和穿過狹窄門口的情況進行綜合評估。
所有患者進行相應的量表評分,包括統一帕金森病等級量表(unified Parkinson's disease rating scale,UPDRS)-III、簡易智能精神狀態量表(mini-mental state examination,MMSE)和H-Y分期(Hoehn & Yahr stage)。
排除標準:①腦部常規MRI檢查發現有顱腦的占位性病變、腦血管疾病或其它顱腦病變等;②頭部存在影響圖像質量的金屬異物,因運動偽影影響圖像質量,受試者因不能忍受檢查而導致檢查序列不全等;③具有嚴重的心、肝、肺和腎等臟器疾病引起的精神障礙,有長期嗜酒史,或者有甲狀腺功能異常等影響認識的相關疾病;④腦深部受刺激或極嚴重的靜止性震顫的患者;⑤有精神分裂等其它精神性疾病;⑥存在影響運動功能的骨骼、肌肉或關節疾病。
本研究經本院倫理委員會批準。所有PD患者及健康志愿者簽署了知情同意書,并由研究員告知本研究的目的、注意事項等相關內容。
2.檢查方法
所有患者在清晨(停用抗帕金森藥物12 h以上)行磁共振檢查。使用GE Signa Excite II HD 3.0T超導型磁共振成像系統和頭頸聯合線圈。所有患者行T1WI、T2WI、FLAIR及矢狀面三維T1WI掃描。矢狀面三維T1WI使用快速擾相梯度回波反轉恢復序列,掃描基線平行于前后聯合,掃描范圍自頂葉頂端至小腦半球下部。掃描參數:TR 8.4 ms,TE 3.3 ms,矩陣256×256,視野24 cm×24 cm,翻轉角13°,層厚1 mm,共獲得146幀圖像。
3.數據處理
所有數據處理均在Matlab(R2013a)平臺上進行。解剖像數據采用DPABI分析軟件進行自動化流程處理,主要流程如下:①圖像轉換,將所有受試者原始圖像數據的DICOM格式轉換成NIFTI圖像格式;②空間標準化,將每個被試轉換后圖像映射到MNI標準坐標系統中;③組織分割,將分割后的灰質圖像行體積調制為原始圖像的組織體積;④圖像平滑,采用8mm半高全寬高斯核對腦灰質圖像進行空間平滑。
4.統計學分析
使用SPM8軟件,對獲得的3組數據采用獨立樣本t檢驗進行比較,并同時以年齡、性別作為協變量輸入軟件內進行分析,將P<0.005(AlphaSim校正)且相連灰質腦區體積>80個體素為差異有統計學意義的腦區,得到統計參數圖,應用XjView軟件對有統計學意義的腦區進行顯示,并進一步提取相應腦區的相關信息,包括解剖位置、體素大小、Brodmann(BA)分區、蒙特利爾神經病學研究所(Montreal Neurological Institute,MNI)坐標及激活強度(用t檢驗統計值T表示)。
使用SPSS 20.0軟件,對3組受試者的臨床統計資料進行統計學分析。對三組間年齡、受教育程度的比較采用單因素方差分析(ANOVA分析),對性別差異的比較采用卡方檢驗;對PD-FOG組和PD-nFOG組間病程差異的比較采用兩獨立樣本t檢驗,對MMSE評分、H-Y分期和UPDRS-Ⅲ評分的比較采用獨立樣本非參數檢驗。以P<0.05為差異有統計學意義。
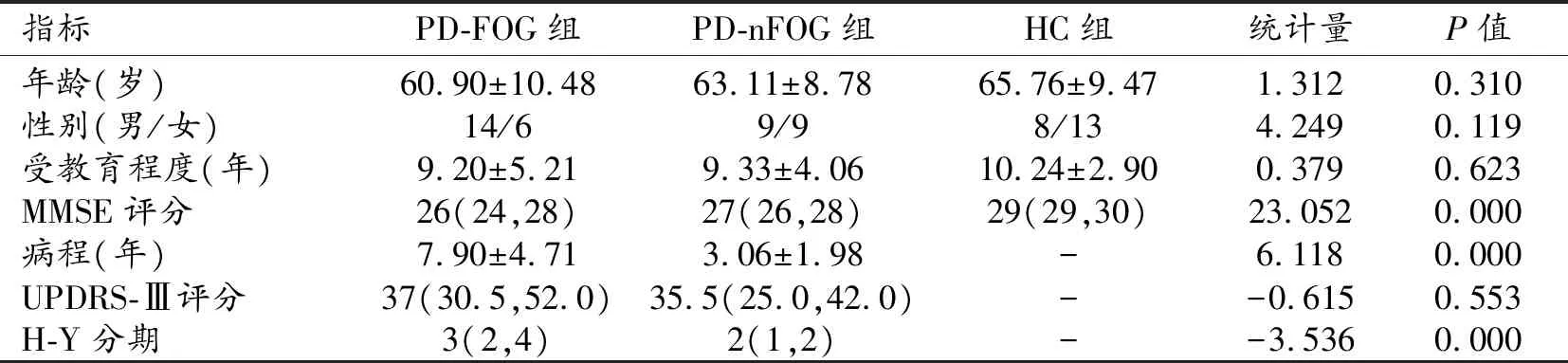
表1 三組受試者的基本臨床資料及比較
注:括號內為上下四分位數。
結 果
1.臨床資料分析結果
三組受試者的基本臨床資料及統計分析結果見表1。PD-FOG組、PD-nFOG組和HCs組中受試者的性別、年齡和受教育程度的差異均無統計學意義(P>0.05)。
三組間MMSE評分的差異有統計學意義(P<0.05);進一步兩兩比較,PD-FOG組與PD-nFOG組間MMSE評分的差異無統計學意義(P>0.05),而PD-FOG組與HCs組間、PD-nFOG組與HCs組間MMSE評分的差異均有統計學意義(P<0.05)。
PD-FOG組與PD-nFOG組間病程、H-Y分期的差異有統計學意義(P<0.05),而UPDRS-Ⅲ評分的差異無統計學意義(P>0.05)。
2.VBM分析結果
PD-FOG組較PD-nFOG組腦灰質體積減少的腦區及其分布特征見表2。與PD-nFOG組比較,PD-FOG組中腦灰質體積減少的腦區主要位于右額葉和右頂葉(圖1)。
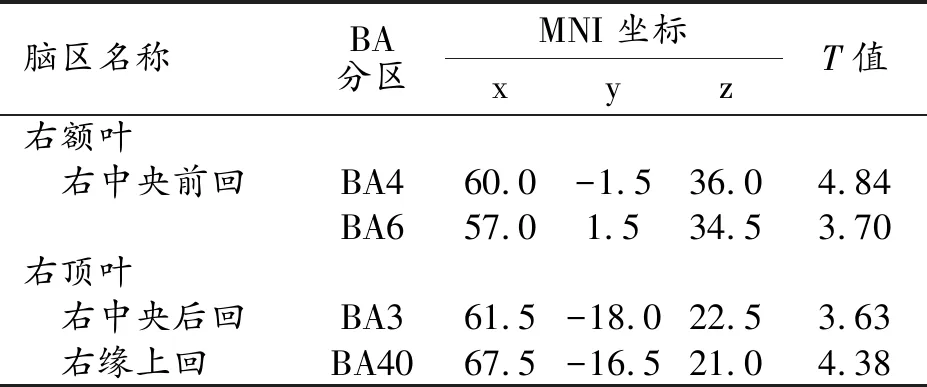
表2 PD-FOG組較PD-nFOG組腦灰質體積減少的腦區
PD-FOG組較HCs組腦灰質體積減少的腦區及其分布特征見表3。與HCs組比較,PD-FOG組中腦灰質體積減少的腦區主要位于左側小腦(山頂、山坡、小腦扁桃體和蚓結節)、右額葉和右頂葉(圖2)。
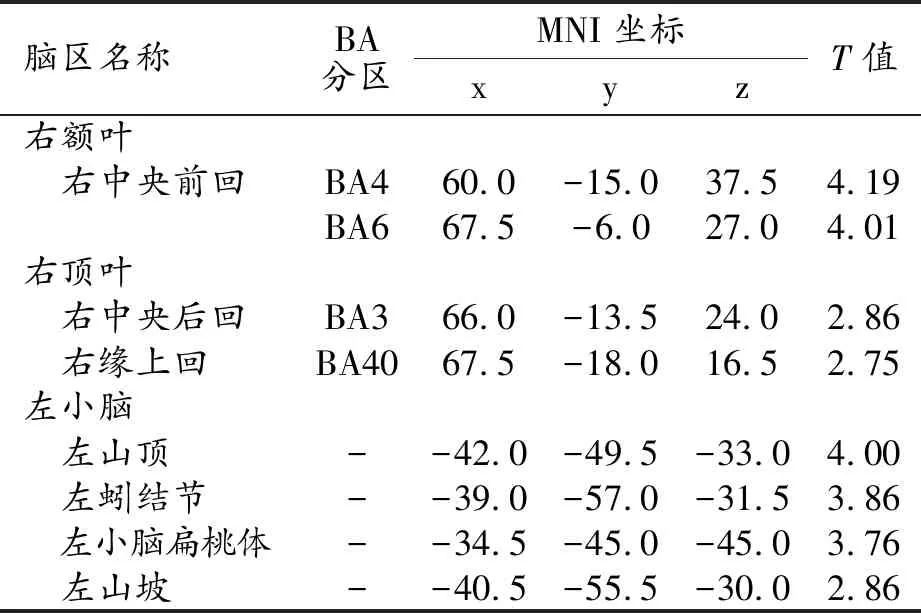
表3 PD-FOG組較HCs組腦灰質體積減少的腦區
討 論
本研究利用VBM技術研究PD-FOG、PD-nFOG患者和HCs的腦部灰質結構,發現與PD-nFOG患者比較,PD-FOG患者的額葉(BA4、BA6)和頂葉(BA3、BA40)皮質萎縮;與HCs患者比較,除上述提及的腦部區域外,PD-FOG患者的小腦灰質也存在萎縮。研究結果顯示PD-FOG患者出現了與認知功能相關的額葉結構改變,提示FOG的發生可能不僅僅是運動功能受損,也與PD患者的認知、執行功能受損相關,為PD-nFOG患者治療方法的確立提供了理論依據。
通常認為正常行走不僅僅是一種自主性運動,需要大腦網絡中的注意力、執行功能和視覺運動的整合[6-7]。這些大腦網絡的早期損傷與緩慢步態和步態失衡有關,任何一個環節出現障礙均可引起FOG。有研究者[8]認為PD患者步態障礙不但涉及皮質-基底節-丘腦-皮質等運動環路,還涉及到感覺認知系統,需要認知和注意功能對已破壞的運動環路進行補償,而感覺認知過程主要由額葉皮質完成,提示與認知相關的額葉功能損傷與FOG密切相關,可能是FOG形成的根本原因。本研究結果顯示,FOG患者額葉皮層萎縮,其中包括位于BA6的額葉中央前回的前端區皮層和輔助運動區,輔助運動區的功能多樣,與運動的計劃和學習以及認知功能的關系密切。本組結果進一步提示認知功能的損害與FOG的發生有著密切的聯系。
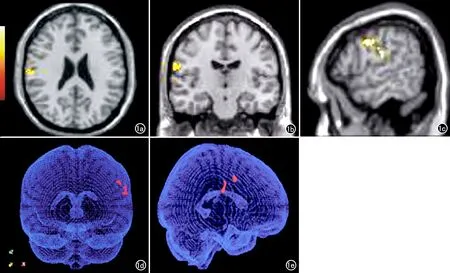
圖1 MR VBM圖像, 顯示PD-FOG組較PD-nFOG組腦灰質體積減少的腦區主要位于右額葉和右頂葉(呈紅色)。a)橫軸面圖像;b)冠狀面圖像;c)矢狀位圖像;d)三維圖像(上面觀);e)三維圖像(側面觀)。
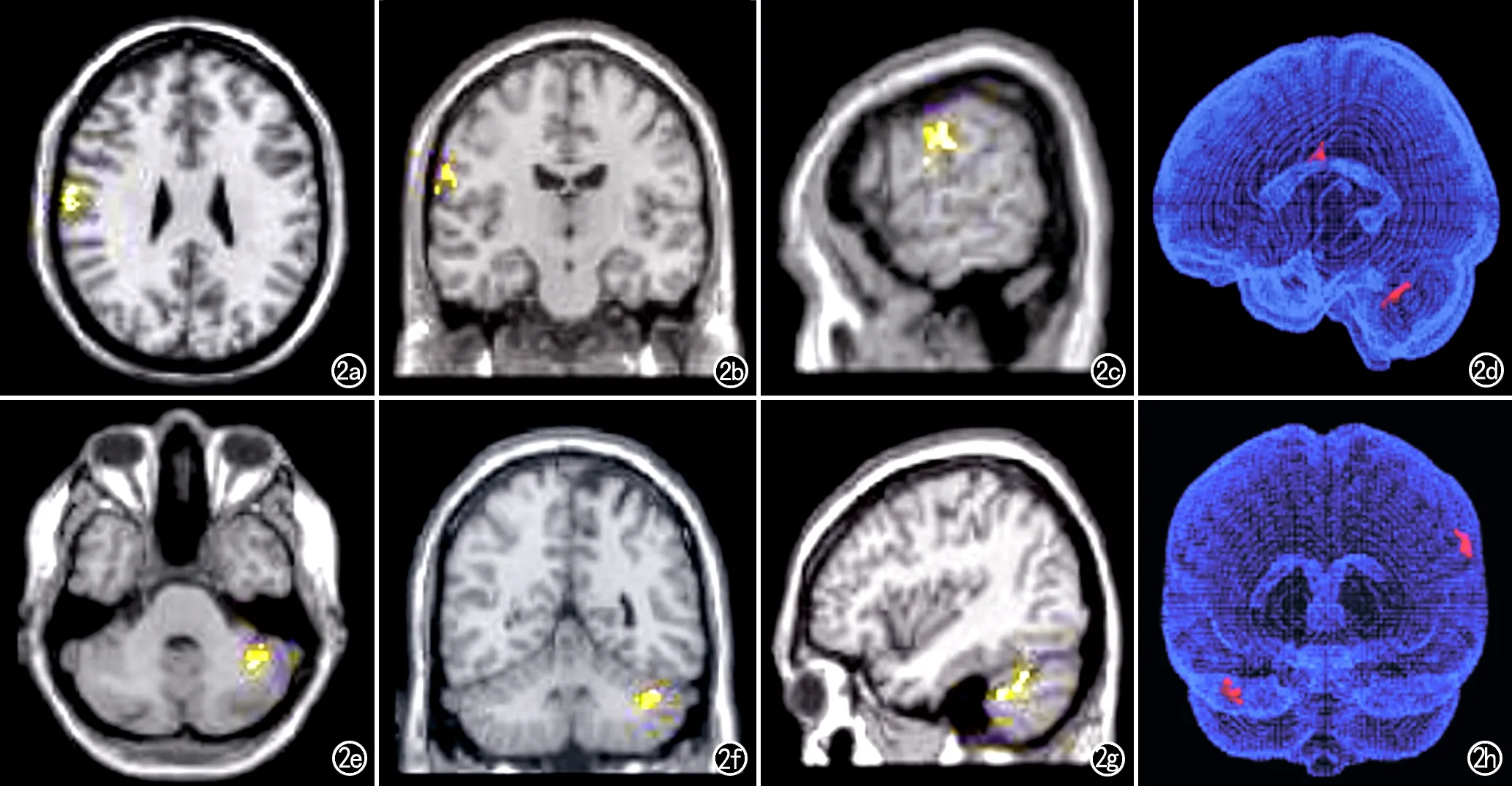
圖2 MR VBM圖像, 顯示PD-FOG組較HCs組腦灰質體積減少的腦區主要位于右額葉、右頂葉和左小腦(呈紅顏色)。a)橫軸面圖像;b)冠狀面圖像;c)矢狀面圖像;d)三維圖像(側面觀);e)橫軸面圖像;f)冠狀面圖像;g)矢狀面圖像;h)三維圖像(上面觀)。
筆者的研究團隊在以往的研究中利用fMRI局部功能一致性(ReHo)方法來研究靜息狀態下腦功能,結果顯示與PD-nFOG患者比較,PD-FOG組的左側輔助運動區(BA6)及左側額上回的腦功能活動性下降[9]。Jha等[10]通過神經心理學測試發現PD-FOG患者存在認知功能障礙,同時他們應用VBM方法研究大腦灰質體積的改變,發現PD-FOG患者中參與感覺認知功能的額葉體積發生了改變。同樣地,Kostic等[11]對17例PD-FOG和20例PD-nFOG患者及34例HCs的研究中發現,與PD-nFOG患者比較,PD-FOG患者的認知功能明顯受損,且額葉的執行能力下降;同時VBM法分析結果顯示,FOG的嚴重程度與額頂葉灰質萎縮有顯著相關性。本研究結果顯示,FOG患者中與步態有關的額葉皮層存在萎縮,與上述研究結果基本一致。額葉皮層在周圍環境改變時對控制步態模式有重要作用,因此當額葉區發生功能障礙時,將導致運動程序中注意力集中能力和執行程序能力出現下降,從而可能導致FOG的發生。
本研究結果顯示,PD-FOG患者的頂葉皮質有多處出現萎縮表現,涉及的區域主要為前頂葉區和緣上回。雖然目前大多數對PD-FOG患者腦部結構的研究中,顯示額葉功能障礙是導致FOG發生的重要機制,但亦有較多研究中發現了頂葉功能結構的改變。Li等[12]利用體素鏡像同倫功能連接方法(VMHC)分析21例PD-FOG和33例PD-nFOG患者及24例HCs的腦靜息態功能成像數據,發現與PD-FOG、HCs組比較,PD-FOG雙側頂下小葉的VMHC值降低,即自發性同步下降,提示雙側頂下小葉VMHC值的降低可能有助于鑒別PD-FOG與PD-nFOG患者。此外,Herman等[13]應用VBM對22例PD-FOG和22例PD-nFOG進行VBM分析,發現頂下小葉及角回有著明顯皮質萎縮,頂下小葉和角回在各種高級認知功能中發揮著重要作用,在動作執行過程中,頂下小葉被激活,進行時空信息的感知整合,頂下小葉的萎縮可能會使帕金森病患者出現步態失控,從而導致FOG。此外與Herman等[13]的研究結果相比,本研究新發現了緣上回灰質萎縮,緣上回(BA40)屬于次級體感皮層,是Wernicke區的一部分,主要功能是響應軀體刺激、完成結構區分任務,同時也能感知空間和肢體位置,因此其結構的損傷可能導致PD患者出現FOG。Gottlieb等[14]分析例相關的神經生理研究常規,提出頂葉皮質是連接知覺、動作和認知功能的橋梁,結合本研究結果,我們認為頂葉的異常也是PD-FOG患者重要的神經病理基礎之一。
Fling等[5]的研究結果支持FOG出現的是由于脊髓上運動神經網絡包括腦橋核、小腦、基底節和額葉執行皮質區功能障礙導致的,說明小腦可能也與FOG有關。本研究也發現PD-FOG患者小腦灰質體積異常減少。不少研究表明小腦在維持運動能力方面具有補償性作用[15-16]。小腦主要的功能是參與軀體平衡、控制姿勢與步態、調節肌張力以及精細運動的啟動、計劃和協調。小腦-丘腦-皮質環路是指來自齒狀核發出的纖維束交叉后至對側紅核,上行至丘腦,再傳至大腦皮質運動區及運動前區,參與椎體束及椎體外系的調節,可見小腦和SMA也是其重要組成部分之一。小腦-丘腦-皮質環路的某一部分出現功能障礙則導致運動及部分認知功能障礙。Wang等[17]應用fMRI對14例PD-FOG、16例PD-nFOG和16例HCs研究發現PD-FOG患者腳橋核的功能連接出現異常,主要是皮質-腦橋-小腦通路(雙側小腦、腦橋)和視覺顳葉區域受到損害。Schweder等[18]應用基于纖維束骨架的空間統計(tract-based spatial statistics,TBSS)技術研究發現腳橋核-小腦的連接性下降。此外一項VBM研究分析結果也顯示PD-FOG組小腦的灰質體積存在明顯的萎縮[10]。本研究結果顯示小腦(山頂、山坡、小腦扁桃體和蚓結節)灰質體積異常減少,提示FOG的發生與小腦結構的損傷也有關系。
有研究結果表明PD-FOG患者存在視覺空間功能的損害,負責視覺處理的枕顳葉腦功能網絡的連接性下降或皮質萎縮[10,17],但本研究沒有發現枕顳葉灰質結構的異常,這可能與樣本量小有關,今后將繼續收集PD-FOG患者大樣本數據,以期能得出更全面地分析結果。此外本研究是一項橫斷面研究,如能獲得縱向數據,則可以更加集中地對FOG患者進行分析,減少個體差異的混雜效應。
總之,本研究結果顯示PD-FOG患者不僅與運動相關的腦區中頂葉及小腦灰質的體積減少,而且與認知相關的額葉灰質的體積也有減少。提示盡管FOG的表現似為運動障礙,實際上FOG患者不僅是運動功能受損所致,而是運動和認知功能障礙相互影響、相互作用的結果。本研究結果有助于進一步深入了解揭示PD-FOG的神經病理學機制,為采用改善認知功能的治療方法來治療PD-FOG患者提供了理論依據。

