芍藥苷對慢性阻塞性肺疾病的療效分析
譚 丹 曾小琴 徐 偉 周人杰
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD),是一種以氣流持續(xù)受限、進(jìn)行性肺功能下降為主要特征的常見慢性呼吸系統(tǒng)疾病,其主要的臨床表現(xiàn)有咳嗽、咯痰、胸悶、氣喘,甚至呼吸困難等[1-2]。嚴(yán)重影響患者正常的工作、生活以及社交活動,甚至導(dǎo)致患者勞動力的喪失,使患者的生存質(zhì)量直線下降,危害人類的身心健康,給家庭和社會都造成了沉重的負(fù)擔(dān)。近年來,隨著全球人口老齡化的加劇,COPD的發(fā)病率及病死率呈逐年上升趨勢,其引發(fā)的經(jīng)濟(jì)負(fù)擔(dān)也隨之持續(xù)上升,預(yù)計到2020年,COPD將會占到世界排名前3位的死亡原因之一[3-5]。COPD的病理基礎(chǔ)為炎癥反復(fù)作用下,引起氣道重塑的不可逆性[6]。目前認(rèn)為,引起COPD發(fā)病最主要的危險因素是吸煙,因?yàn)橄銦熤械挠泻Τ煞忠约把踝杂苫蓳p傷氣管的上皮細(xì)胞、誘發(fā)肺內(nèi)發(fā)生炎性反應(yīng)等,從而進(jìn)一步導(dǎo)致COPD的發(fā)生[7]。
Toll樣受體(toll-like receptor, TLR),作為介導(dǎo)天然免疫的一類重要模式識別性受體,其介導(dǎo)的相關(guān)信號通路在炎癥發(fā)生、發(fā)展以及變化中均起著重要的作用[8-9]。不同的TLRs對應(yīng)識別與其相關(guān)的病原分子模式(pathogen-associated molecular pattern, PAMP),其中,TLR2主要為革蘭陽性菌受體,識別對應(yīng)配體,可進(jìn)行信號傳導(dǎo)并使核轉(zhuǎn)錄因子κB(nuclear factor-κB, NF-κB)活化,NF-κB活化后可啟動白細(xì)胞介素-1(interleukin-1, IL-1)、白細(xì)胞介素-8(interleukin-8, IL-8)、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)等一系列的前炎性反應(yīng)細(xì)胞因子發(fā)生轉(zhuǎn)錄表達(dá)[10]。目前,在西醫(yī)西藥中,尚缺乏能夠有效阻止該病病情發(fā)展的理想藥物和治療方案。研究表明芍藥苷(paeoniflorin, PF)具有抗炎、抗氧化等藥理作用,但芍藥苷在COPD領(lǐng)域中的研究卻尚未見文獻(xiàn)報道[11]。本文通過脂多糖聯(lián)合煙熏的方式建立COPD大鼠模型,觀察芍藥苷對COPD大鼠的作用,并探討其可能機(jī)制。
材料與方法
一、實(shí)驗(yàn)材料
72只SD雄性大鼠,體質(zhì)量180~220 g范圍內(nèi),均來自重慶醫(yī)科大學(xué)的SFP級實(shí)驗(yàn)動物中心,許可證編號為:SCXK(渝)2012-0001。芍藥苷:純度≥98%,批號20161203,成都曼思特生物科技股份有限公司;孟魯司特鈉:批號20160804,四川大冢制藥股份有限公司。脂多糖:批號092M3,美國Sigma 公司;五牛牌香煙:煙氣中一氧化碳(CO)含量為12 mg,焦油含量為11 mg,煙氣煙堿含量為0.8 mg川渝中煙工業(yè)有限公司。ELISA試劑盒:R&D公司(美國);成像系統(tǒng):HITMAS-30(日本)。
二、研究方法
將72只大鼠采用“隨機(jī)數(shù)字表法”隨機(jī)分為6組:正常對照組(A組),COPD模型組(B組),芍藥苷低、中、高劑量組(分別為C組、D組、E組),西藥組(F組)。其中,芍藥苷低、中、高組劑量分別為10、25、50 mg /kg;西藥組給予孟魯司特1.0 mg/kg[12]。將除正常對照組以外其余各組的大鼠全部放進(jìn)煙熏箱中,12只/箱,用透明膠帶,將2只大號漏勺的凹面朝內(nèi)進(jìn)行固定(注意:盡量不要遮住網(wǎng)眼),放置香煙(第1次放8支,之后每次放10支),再將香煙尾部用透明膠帶固定于漏勺的手柄位置,點(diǎn)燃香煙,將漏勺用筷子固定于煙熏箱頂部的活動門位置,隨后關(guān)閉活動門,箱內(nèi)大鼠被動吸煙,30 min/次[13]。造模周期共計52 d,第2~8天、第23~24天、第26~28天對各組大鼠均不做處理,以便大鼠體力恢復(fù)。其中,煙熏分為3階段:第1階段,每天煙熏1次(第9~22天和第29~36天);第2階段,每天煙熏2次(第37~44 天);第3階段,每天煙熏3次(第45~52天),煙熏時間、次數(shù)總計: 22 d每天1次,8 d每天2次,8 d每天3次。脂多糖氣道注射總計2次,分別為第1、25天,脂多糖注射具體步驟如下:先用10%水合氯醛腹腔注射麻醉大鼠,隨后仰位固定大鼠、備皮、消毒、沿縱向切開頸部皮膚、分離皮下的組織、將氣管暴露,四號針頭進(jìn)行氣管穿刺,緩慢注射0.1%的脂多糖200 μl。注射完畢后,立馬直立大鼠,將其左右旋轉(zhuǎn),以促使脂多糖可于肺中進(jìn)行均勻的分布,完畢后進(jìn)行皮膚縫合、消毒,最后放在溫暖鼠籠中待其清醒,清醒后再將其放回原鼠籠中。正常對照組第1、25天分別氣道注射等值生理鹽水且不予被動吸煙。造模成功后,于第2天開始給予相應(yīng)藥物劑量進(jìn)行灌胃,其中正常對照組給予等值生理鹽水,1次/d,連續(xù)給藥30 d。
在處死大鼠前,觀察并記錄各組大鼠毛發(fā)狀況、精神狀態(tài)等相關(guān)情況,并計算大鼠的體質(zhì)量增長量,體質(zhì)量增長量=處死前體質(zhì)量-初始體質(zhì)量。應(yīng)用肺功能檢測儀測定各組大鼠肺功能相關(guān)指標(biāo),肺順應(yīng)性(lungcompliance, CL)、第0.3秒的用力呼氣容積(forced expiratory volume 0.3%, FEV 0.3%)與用力肺活量(forced vital capacity, FVC)的比值、用力呼氣流量(maximum midexpiratory flow, MMEF)。
取各組的肺組織,分別提取其總蛋白,采用聚丙烯酰胺凝膠(10%)進(jìn)行電泳,結(jié)合說明書,進(jìn)行試驗(yàn),檢測TLR2和NF-κB的表達(dá),最后采用ECL試劑盒進(jìn)行顯影、成像[14]。每組實(shí)驗(yàn)均需重復(fù)3次。
按照ELISA試劑盒中說明書指示的相關(guān)操作步驟進(jìn)行,分別檢測血清和肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中IL-1、IL-6、IL-8、IL-1β、TNF-α的表達(dá)水平;肺組織中相關(guān)指標(biāo)的測定,先離心、得到上清液后,再按照試劑盒步驟進(jìn)行檢測。
三、統(tǒng)計學(xué)分析
結(jié) 果
一、各組大鼠的一般情況
正常對照組大鼠毛發(fā)光滑且白皙,活動正常,精神狀態(tài)較好,飲食較好,無咳嗽;COPD模型組大鼠毛發(fā)干燥且泛黃,活動較差,精神萎靡,飲食量減少,經(jīng)常性咳嗽;給藥組能明顯改善COPD模型組大鼠的上述不良情況。
二、各組大鼠體質(zhì)量增長情況
正常對照組大鼠體質(zhì)量增長(82.11±8.47)情況較好,模型組大鼠體質(zhì)量增長(43.22±5.35)明顯欠佳,與模型組相比,給藥組大鼠的增長情況有明顯地改善(P<0.05),見表1。
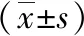
表1 各組大鼠體質(zhì)量增長情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
三、各組大鼠肺功能情況
與正常對照組相比,模型組大鼠CL、FEV0.3%/FVC、MMEF均明顯下降(P<0.05);與模型組相比,給藥組大鼠3項指標(biāo)均明顯升高(P<0.05),見表2。
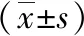
表2 各組大鼠肺功能情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
四、各組大鼠TLR2、NF-κB表達(dá)情況
與正常對照組相比,模型組大鼠TLR2、NF-κB表達(dá)水平均增加(P<0.05);與模型組相比,給藥組大鼠可抑制其表達(dá)(P<0.05),見表3,圖1。
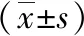
表3 各組大鼠肺組織TLR2、NF-κB蛋白表達(dá)情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
五、各組大鼠炎癥細(xì)胞因子表達(dá)情況
與正常對照組相比,模型組大鼠IL-1、IL-6、IL-8、IL-1β、TNF-α均明顯增加(P<0.05);與模型組相比,給藥組大鼠這幾項炎癥因子均明顯減少(P<0.05),見表4。
與正常對照組相比,模型組大鼠IL-1、IL-6、IL-8、IL-1β、TNF-α均明顯增加(P<0.05);與模型組相比,給藥組大鼠上述幾項炎癥因子均明顯減少(P<0.05),見表5。

圖1 各組大鼠TLR2和NF-κB表達(dá)的wb圖
與正常對照組相比,模型組大鼠IL-1、IL-6、IL-8、IL-1β、TNF-α均明顯增加(P<0.05);與模型組相比,給藥組大鼠上述幾項炎癥因子均明顯減少(P<0.05),見表6。
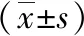
表4 各組大鼠血清中炎癥細(xì)胞因子表達(dá)情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
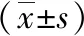
表5 各組大鼠BALF中炎癥細(xì)胞因子表達(dá)情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
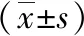
表6 各組大鼠肺組織中炎癥細(xì)胞因子表達(dá)情況
注:aP<0.05;bP<0.01,與模型組比較;cP<0.01,與正常對照組比較
討 論
COPD是呼吸內(nèi)科的常見疾病,可直接對患者肺部功能造成影響,造成患者發(fā)生咳嗽、氣短、咳痰等臨床癥狀,進(jìn)而累計全身,造成病情反反復(fù)復(fù),引起肺功能的不斷惡化,逐漸合并各種心肺等相關(guān)并發(fā)癥,嚴(yán)重影響患者的生活質(zhì)量,威脅人類的健康[15-16]。COPD具有起病較緩慢、病程較長、病情重等特點(diǎn),若不及時干預(yù)或干預(yù)不當(dāng),將誘發(fā)全身性炎癥,伴隨全身各大靶器官的損傷,極易導(dǎo)致呼吸衰竭等。由于COPD的高患病率及高致死率,給家庭和社會造成巨大的負(fù)擔(dān),預(yù)計到2020年,COPD將成為位居于世界疾病所造成經(jīng)濟(jì)負(fù)擔(dān)排名的第五位,且現(xiàn)COPD發(fā)病率正呈逐年上升趨勢,情況不容樂觀[17]。目前,COPD,這種以氣流被阻塞為特點(diǎn)的慢性支氣管炎及肺氣腫,其發(fā)病機(jī)制尚不完全明了,研究表明COPD是由多種炎癥細(xì)胞、因子一起參與的慢性氣管炎癥性疾病[18-19]。現(xiàn)今普遍認(rèn)為氣道、肺血管及肺實(shí)質(zhì)的慢性炎癥是COPD的特征性病理學(xué)改變,在COPD的發(fā)病中有著重要的意義。巨噬細(xì)胞、中性粒細(xì)胞、T淋巴細(xì)胞等激活后,可加速釋放IL-8、TNF-α等多種炎癥因子,其中,IL-1β和TNF-α作為眾多炎癥因子中較為重要的炎癥介質(zhì)前因子,可刺激IL-1、IL-6、IL-8等其他炎性介質(zhì)的分泌,這些炎癥遞質(zhì)可形成復(fù)雜的網(wǎng)絡(luò)系統(tǒng),進(jìn)一步不斷刺激分泌性的炎癥介質(zhì)滲出、中性粒細(xì)胞溶酶體的釋放和氧自由基的生成,再反饋的促進(jìn)單核巨噬細(xì)胞釋放TNF-α和IL-1等,而TNF-α在氣道炎癥形成時,可加速中性粒細(xì)胞活化的進(jìn)程,導(dǎo)致大量中性粒細(xì)胞沉積于氣道黏膜,進(jìn)而促使肺組織中的炎癥細(xì)胞發(fā)生聚集、浸潤,并造成在肺組織內(nèi)損傷和修復(fù)不斷反復(fù)地交替進(jìn)行,導(dǎo)致氣流不可逆性受限及肺泡壁損壞、肺組織纖維化及氣道結(jié)構(gòu)發(fā)生重塑[20-21]。此外,TNF-α的過度表達(dá)也會導(dǎo)致炎癥反應(yīng)發(fā)生時,患者肺組織損毀的進(jìn)一步加重[22]。而IL-1β、IL-1、IL-6、IL-8等指標(biāo),特別是IL-1β是在炎癥的初始到炎癥的持續(xù)進(jìn)程中都存在的炎性細(xì)胞因子。研究發(fā)現(xiàn),氣道中IL-1β也可反映患者氣道中是否存在固有炎癥,且IL-1β的表達(dá)在COPD的穩(wěn)定期及急性加重期表達(dá)更多[23]。同時,有研究顯示,IL-1β在COPD患者中表達(dá)增加也是造成患者病情進(jìn)一步加重的原因之一[24]。故想要緩解COPD癥狀,延緩COPD的進(jìn)程,抑制炎癥因子的釋放現(xiàn)已成為研究的熱點(diǎn)和方向。
TLRs作為一類新近發(fā)現(xiàn)的細(xì)胞表面受體,可感知病原體并可激活細(xì)胞從而產(chǎn)生非特異性免疫,它也是連接非特異性和特異性免疫的紐帶[25]。當(dāng)微生物突破機(jī)體的屏障時,TLRs可以識別微生物,并激活機(jī)體,產(chǎn)生免疫應(yīng)答。同時,在調(diào)控炎癥反應(yīng)方面,TLRs信號通路的作用也是受到公認(rèn)的。TLRs受到刺激后,可活化干擾素通路、NF-κB通路等。NF-κB作為免疫應(yīng)答中重要的蛋白調(diào)節(jié)因子,也有著非常重要的作用。
關(guān)于COPD的防治方式多種多樣,對于COPD的急性期,主要使用支氣管擴(kuò)張劑、抗生素和全身使用糖皮質(zhì)激素等進(jìn)行治療,而穩(wěn)定期的患者則采取長期使用支氣管擴(kuò)張劑和糖皮質(zhì)激素吸入進(jìn)行維持治療,但臨床提示效果不是很滿意。然而,相對于現(xiàn)代西醫(yī)西藥治療而言,中醫(yī)藥療效較為突出,有一定的優(yōu)勢。目前雖然對于COPD有不少中醫(yī)藥相關(guān)研究,但大多深度不夠,僅局限于探討下游零散的相關(guān)因子,對機(jī)制研究甚少[26]。芍藥屬于芍藥科植物,主要存在于溫帶地區(qū),是我國主要的藥材之一,主要的活性成分包括單貼苷類、鞣質(zhì)、酚類和一些黃酮、酸、烷、揮發(fā)油、氨基酸、蛋白質(zhì)等化合物,這些有效成分主要存在于芍藥苷中,其藥理作用多種多樣,應(yīng)用也比較廣泛。現(xiàn)中醫(yī)藥大量研究已證明芍藥苷具有抗炎、抗氧化等藥理學(xué)作用,但以往關(guān)于芍藥苷抗炎的研究主要涉及頸椎間盤、腎組織、腦組織等,也有對狼瘡小鼠肺損傷保護(hù)作用的研究,但對COPD的研究卻是一片空白。本實(shí)驗(yàn)采用煙熏+氣管內(nèi)給予LPS的方法建立大鼠COPD模型,以芍藥苷作為研究藥物,進(jìn)行了一系列初步探索。通過觀察大鼠一般情況、測定肺功能,發(fā)現(xiàn)芍藥苷可改善COPD大鼠毛發(fā)干燥、活動較差、精神萎靡、飲食量減少、經(jīng)常性咳嗽、體質(zhì)量增長欠佳等一般情況,還可提升大鼠肺順應(yīng)性(CL)、第0.3秒的用力呼氣容積和(FEV 0.3%)和用力肺活量(FVC)的比值、用力呼氣流量(MMEF),從而改善COPD大鼠的肺功能,對COPD大鼠肺功能具有一定的作用;同時,通過ELISA法檢測血清、肺泡灌洗液和肺組織中IL-1、IL-6、IL-8等炎癥細(xì)胞因子的表達(dá),結(jié)果與正常對照組相比,模型組大鼠IL-1、IL-6、IL-8、IL-1β、TNF-α均明顯增加(P<0.05),與模型組相比,給藥組大鼠這幾項炎癥因子均明顯減少,說明芍藥苷可緩解炎癥因子的釋放;通過Western blot檢測肺組織中TLR2和NF-κB的表達(dá),結(jié)果與正常對照組相比,模型組大鼠TLR2、NF-κB表達(dá)水平均增加(P<0.05),與模型組相比,給藥組大鼠可抑制其表達(dá),說明芍藥苷可抑制兩者的表達(dá)。通過以上實(shí)驗(yàn)結(jié)果推測,芍藥苷對COPD的作用可能是調(diào)控TLR2/NF-κB的通路。從而抑制下游炎癥因子釋放引起的。這為治療COPD提供了新的思路。但本實(shí)驗(yàn)研究也存在一定的不足,影響下游炎癥因子的通路很多,不止這一條,本實(shí)驗(yàn)只能初步說明芍藥苷對TLR2/NF-kB通路可能會有影響,故在后續(xù)研究中,尚需加入通路相關(guān)拮抗劑作進(jìn)一步深入研究。

