阻塞性睡眠呼吸暫停低通氣綜合征患者不同程度氧減指數與腎功能早期損害
龐 礴 李濤平 孫耕耘
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea hypopnea syndrome, OSAHS)是以睡眠時打鼾并伴有呼吸暫停和呼吸表淺,反復夜間低氧血癥、高碳酸血癥、覺醒和睡眠結構紊亂為主要表現和特征的慢性疾病,在慢性腎臟病中有較高的患病率[1]。早期腎功能損害起病隱匿,臨床表現不典型,易被忽略,目前關于OSAHS與早期腎功能損害的報道較少。氧減指數(oxygen desaturation index, ODI)反映了OSAHS患者夜間期間的間歇性低氧發生次數,并且與睡眠呼吸暫停指數(apnea hypopnea index, AHI)有較好的相關性[2]。本研究探討不同程度ODI的OSAHS患者是否存在早期腎功能損害。
資料與方法
一、研究對象
研究對象均來自南方醫科大學南方醫院睡眠醫學中心2014年1月至2015年12月診斷為OSAHS的患者共187例,根據多導睡眠(polysomnography, PSG)監測結果中ODI指數分為三組(輕度5≤ODI<15、中度15≤ODI<30、重度30≤ODI),記錄患者病史、體征及一般情況(性別、年齡等)。監測內容包括:腦電、眼電、下頜肌電、口鼻氣流、胸腹運動、經皮氧飽和度及心電、鼾聲、體位。根據美國睡眠醫學會(AASM)睡眠及相關事件判讀手冊分析睡眠報告。高血壓、糖尿病、冠心病的診斷分別采用2017年中國高血壓防治指南、2017中國2型糖尿病防治指南、2018中國冠心病診斷與治療指南診斷標準。所有對象經過嚴格篩選,排除泌尿系統疾病、前列腺疾病、未控制的高血壓、糖尿病、惡性腫瘤、血液系統疾病及其他可能影響腎臟功能的自身免疫性疾病等,妊娠、哺乳期及服用避孕藥的女性排除在本研究之外。所有受試者均簽署知情同意書。
二、研究方法
實驗者要求在晚上進入睡眠監測室,22:00前排出小便并進行PSG監測,監測大于7 h,次晨6:00臥位空腹抽取靜脈血、留取尿液送檢我院檢驗科采用全自動生化分析儀查血尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)、血清胱抑素C(serum cystine C, sCys-C)、血清β2微球蛋白(serum β2microglobulin, β2-MG)、超氧化物歧化酶(superoxide dismutase, SOD)、尿N-乙酰-β-D氨基葡萄糖苷(N-acetyl-β-d glucosamine, NAG)等指標。所有受試者睡前禁止大量飲水、飲濃茶、咖啡及應用利尿劑,排空夜間潴留尿液后,采集第一次晨尿檢測NAG,采用MPT-NAG法測定。試劑盒由合肥澤木生物科技有限公司提供,所有標本均嚴格按照試劑盒說明書操作。
三、統計學方法

結 果
一、患者一般資料比較
各組患者隨著ODI指數增高,男性比例有逐漸增高趨勢,中重度組患者男性比例明顯偏高,與輕度組患者比較有統計學差異(P<0.05);AHI指數、體重指數(BMI)及高血壓發病率隨著ODI指數升高呈明顯升高趨勢,中重度組與輕度組患者比較有統計學差異(P<0.05);各組患者年齡比例分析中,雖然中重度組患者年齡偏大,但各組比較無顯著統計學差異(P>0.05);基礎疾病統計發現各組患者糖尿病、冠心病發病率隨著ODI指數升高有升高趨勢,但組間比較無顯著統計學差異(P>0.05);各組間相關性分析發現,ODI指數與AHI、BMI、性別、高血壓發病率存在明顯正相關(r=0.832、0.257、0.578、0.381,P<0.05),見表1。
二、患者腎功能指標比較
各組患者指標分析中sCys-C、β2-MG、尿NAG隨著ODI指數升高有明顯升高趨勢,組間比較有統計學差異(P<0.05);SOD隨著ODI指數升高有下降趨勢,組間比較有統計學差異(P<0.05);BUN、Scr隨著ODI指數增高有升高趨勢,但各組間比較無明顯統計學差異(P>0.05);各組間相關性分析發現,ODI指數與sCys-C、β2-MG、尿NAG存在正相關(r=0.0.312、0.245、0.267,P<0.05);ODI指數與SOD呈負相關(r=-0.383,P<0.05),見表2。
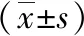
表1 各組臨床特征的統計描述及單因素分析比較結果
注:a與1組比較P<0.05;b與2組比較P<0.05
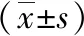
表2 各組患者ODI與生化檢驗結果
注:a與輕度組比較P<0.05;b與中度組比較P<0.05
討 論
OSAHS是一種常見的睡眠結構紊亂性疾病,可導致高血壓、腦血管疾病、2型糖尿病、脂代謝異常及肝腎功能損害等多種并發癥[3-4],流行病學調查顯示OSAHS的平均發病率在中年人群中達2%~4%[5]。目前OSAHS的診斷及嚴重程度的判定主要標準是AHI,但AHI需經多導睡眠監測獲取,而ODI為夜間平均每小時指尖血氧飽和度下降4%的次數,臨床上較容易獲取,與AHI一致性高,能有效的反映夜間間歇性低氧的發生次數[2,6- 7]。
從1990年到2010年的二十年間,全世界慢性腎臟疾病(chronic kidney disease, CKD)的死亡率增加了82%,OSAHS作為CKD的獨立致病因素,已經受到臨床醫師的注意[8-11]。早期腎功能損害起病隱匿容易被人忽略,許多患者由此進展為腎病終末期,嚴重影響了生活質量和壽命[3]。
對于OSAHS引起腎功能損害的機制,Sim等[12]研究報道OSAHS對腎臟功能的影響涉及濾過功能、重吸收功能和分泌功能等多方面。Mavanur等[13]報道,慢性間歇性缺氧通過刺激交感神經系統、內皮功能紊亂、氧化應激及炎癥反應引起腎損害。鐘旭等[14]研究報道,OSAHS夜間發生的間歇性缺氧刺激交感神經使其興奮性升高,進一步激活腎素-血管緊張素-醛固酮系統產生強大的縮血管作用,其收縮腎出球小動脈的作用強于入球小動脈,繼而引起缺血性腎損害和蛋白尿;反復低氧血癥,高碳酸血癥,可相繼引起肺動脈高壓,右心房壓力升高,中心靜脈壓升高,腎靜脈壓力升高,腎小球毛細血管靜脈壓升高,從而使腎小球基底膜的晶體結構發生可逆性改變,產生蛋白尿。
臨床上常用BUN、SCr評估腎小球濾過功能,但敏感性較差。一般認為當腎小球濾過率降至正常50%以下時,血清BUN才開始升高,而當腎小球濾過率降至正常的1/3以下時,SCr才會迅速升高,因此不能作為腎臟早期損害的指標[15]。sCys-C能自由通過腎小球濾過膜,并在近曲小管幾乎完全被重吸收和降解,可反映腎功能早期損害和腎小球濾過率迅速變化[16]。β2-MG也能自由通過腎小球濾過膜,當腎小球濾過功能下降時血β2-MG 升高,故血β2-MG 也是評價腎小球濾過功能的理想指標。NAG是細胞內溶酶體水解酶,來自于腎近曲小管上皮細胞溶酶體中,是腎小管損傷的敏感指標[17]。sCys-C、血β2-MG、NAG升高均可提示存在早期腎功能的損害。
有學者認為OSAHS患者由于慢性間歇性低氧所致的大量的氧自由基和炎癥反應會造成腎小球上皮足突融合,減小腎小球濾過膜的通透性,進而導致sCys-C濃度升高[18]。而國內外學者在研究中發現OSAHS患者sCys-C的平均水平明顯高于健康對照組,此外重度OSAHS組sCys-C濃度較輕、中度組明顯升高[19-21]。Zhang等[22]發現sCys-C濃度與AHI、低氧指數有正相關。而在對β2-MG的研究中,有學者發現,輕、中度OSAHS 組血清β2-MG 含量與健康對照組相比無顯著性差異,重度OSAHS 組血β2-MG 含量明顯升高[23],提示當腎小球濾過功能下降時,血β2-MG的升高早于血肌酐和尿素氮的升高,早于GFR的下降。同樣,相關研究表明OSAHS患者夜間發生的慢性間歇性低氧可破壞腎小管上皮細胞膜結構,使尿NAG水平明顯升高[24]。NAG在腎功能早期損傷時的敏感度、特異性、準確性分別為96.9%、90.2%、91.6%[25]。研究發現,OSAHS組患者尿NAG水平顯著高于健康組,OSAHS患者重度組尿NAG明顯高于輕、中度組,并且尿NAG濃度與AHI呈正相關,與MSaO2和LSaO2均呈負相關,聯合檢測尿NAG和尿α1-MG較單一指標陽性更高,可動態觀察腎小管間質病變過程[26-27]。慢性間歇性低氧可促使機體活性氧的產生增加,啟動炎癥級聯反應,分泌多種細胞因子、趨化因子及黏附分子,影響小血管緊張度的調節、血管的收縮及激素類產物的修飾,從而導致廣泛的血管內皮損傷、內皮功能不良[28],而SOD是反映機體抗氧化能力的客觀指標,其下降提示重度OSAHS患者處于氧化應激狀態。
本研究中發現隨著ODI程度的增加,BUN、SCr未有明顯升高,但sCys-C、β2-MG、NAG呈升高趨勢,且3組患者的差異有統計學意義,SOD隨著ODI指數升高有下降趨勢,重度OSAHS患者的sCys-C、β2-MG、NAG較輕、中度患者明顯升高,而SOD較輕、中度患者明顯降低,提示在BUN、SCr未出現異常時,重度OSAHS患者已發生了早期腎功能損害。其損害機制可能與慢性間歇性低氧誘發的氧化應激和炎癥反應有關。

