α-突觸核蛋白原纖維誘導的帕金森病小鼠模型的行為表型及病理特征
田靜,侯志東,任湘鵬
(溫州醫科大學附屬眼視光醫院 實驗室中心,浙江 溫州 325027)
帕金森病(Parkinson’s disease,PD)是第二大常見的進行性神經退行性疾病,其主要臨床表現為靜止性震顫、肌強直、運動遲緩和姿勢不穩等運動癥狀;典型的病理特征為中腦黑質致密區(substantia nigra pars compacta,SNpc)多巴胺(dopamine,DA)能神經元進行性變性缺失,殘存的DA能神經元胞質內出現路易小體(Lewy bodies,LBs),即α-突觸核蛋白(α-synuclein,αS)包涵體。目前PD的病因和發病機制尚不完全清楚,現有的臨床藥物只能緩解PD癥狀,不能有效地阻斷或延緩PD病理進程,其中一個重要的原因是缺乏闡明PD發病機制的理想動物模型。近年來學術界普遍認為αS異常聚集和病理傳播是PD發病的核心機制[1],具體表現為:αS編碼基因的遺傳多態性(如A53T突變)是導致家族性PD的重要原因[2],而錯誤折疊的αS聚集體是PD病理標志物LBs的主要成分[3],因此基于αS的PD動物模型成為研究熱點[4]。采用腦內注射重組αS原纖維,模擬胞外αS在神經元之間傳播擴散的朊病毒樣特性而建立的αS原纖維PD模型為研究PD的病理機制提供了嶄新的動物模型[5]。將錯構的αS原纖維直接注射至正常小鼠紋狀體腦區,發現αS可由紋狀體擴散到中腦SNpc區,導致DA能神經元變性丟失、運動和認知損傷等PD病理特征[6]。然而,αS原纖維在中腦SNpc區直接導致的DA能神經元病理變化及行為學表型尚不清楚。本研究利用小鼠腦內SNpc定位注射A53T突變型αS(A53T αS)原纖維的方法,建立PD小鼠模型,檢測模型小鼠的運動和認知行為學表型,并采用免疫組織化學染色法觀察模型小鼠腦內典型的病理特征,為進一步探索αS在PD中的病理機制提供實驗基礎。
1 材料和方法
1.1 材料
1.1.1 主要試劑:重組A53T αS蛋白[純度>95%,輝源生物科技(上海)有限公司],抗磷酸化α-突觸核蛋白(phosphorylated α-synuclein,pSyn)、抗酪氨酸羥化酶(tyrosine hydroxylase,TH)及小膠質細胞特異性蛋白(ionized calcium binding adapter molecule 1,IBA-1)單克隆抗體購自美國Abcam公司,ABC免疫組織化學檢測及DAB試劑盒購自德國Vector公司,其余生化試劑為國產分析純。
1.1.2 實驗動物:健康10~12周齡雄性C57BL/6小鼠20只,體質量22~26 g,購自上海斯萊克實驗動物公司,實驗動物許可證號:SYXK(滬)2017-0008,在溫州醫科大學眼視光學院動物房內飼養。室溫控制在(24±2)℃,濕度控制在(60±2)%,日光燈照明250~300 lux,擁有自動定時裝置的12h/12 h光照/黑暗環境。給予每籠小鼠充足的水糧,適當活動空間,小鼠能夠自由進水、攝食。所有動物的使用均遵照國家科學技術委員會于1988年頒布的《實驗動物管理條例》,并通過溫州醫科大學動物使用倫理委員會審核。
1.1.3 主要設備:腦立體定位儀(美國KOPF公司),手術顯微鏡及正置熒光顯微鏡(德國Zeiss公司),手術器械(深圳瑞沃德公司),微量注射器(美國Hamilton公司),超低溫冰箱及冷凍離心機(美國Thermo公司),冰凍切片機(德國Leica公司),曠場實驗箱及Y迷宮(上海優耳儀器科技有限公司),行為學視頻分析軟件(荷蘭Noldus公司),精密電子天平(Satorius BS124S,北京賽多利斯儀器系統有限公司),旋渦混合器(XW-80,上海醫科大學儀器廠),超純水器(UPWS-1-20T,杭州永潔達凈化科技有限公司),pH計(Delta 320,上海峰至儀器有限公司)。
1.2 方法
1.2.1 A53T αS原纖維制備及處理[7]:重組A53T αS用無菌PBS稀釋到5 mg/mL,37 ℃下以1000 r/min的轉速持續震蕩孵育,使A53T αS蛋白組裝成原纖維。將A53T αS稀釋至1 mg/mL,分裝100 μL/管,-80 ℃保存備用。低溫下用超聲破碎儀短暫超聲處理后用于腦立體定位注射。
1.2.2 動物分組:將20只雄性健康成年C57BL/6小鼠隨機分為2組,每組10只,模型組小鼠注射A53T αS原纖維,對照組注射無菌PBS。小鼠分籠飼養,每籠5只。
1.2.3 A53T αS原纖維PD小鼠模型的建立[7]:小鼠進行SNpc腦區的單次雙側立體定位注射造模。參照《小鼠腦立體定位圖譜》,SNpc腦區注射坐標定位為:前囟后(AP)-3.16 mm,旁開(ML)±1.25 mm,深度(DV)-4.00 mm。小鼠麻醉、固定,剪開頭皮暴露術野,進行SNpc定位及鉆孔,最后使用Hamilton微量注射器于SNpc坐標緩慢雙側注射5 μg A53T αS原纖維及無菌PBS。注射結束后,留針5 min后緩慢拔出針頭,并于顱骨表面撒少許青霉素粉末防止感染。術后將小鼠置于恒溫恢復器,待小鼠蘇醒后移至鼠籠常規飼養。造模時間為3個月。
1.2.4 行為學檢測[6-7]:行為學試驗前將小鼠提前運至行為學實驗室專用籠架適應3 h左右,以減輕動物應激和緊張情緒。曠場試驗中,將小鼠放于曠場實驗箱(40 cm×40 cm)中央,箱子的上方安裝有與行為學記錄分析系統相連接的攝像機,記錄小鼠在實驗箱中的運動軌跡。采集分析小鼠自由探索5 min內的總運動距離,反映小鼠的運動能力。懸掛試驗使用一個鋪有柔軟墊料的大鼠籠和籠蓋,固定籠蓋,高度定為25 cm以上。把小鼠放在籠蓋上,使其爪抓住籠蓋桿,翻轉籠蓋,使其四爪抓住蓋桿倒掛,迅速開始計時;小鼠從桿上掉下,結束計時,記錄懸掛持續時間,反映小鼠的肌力和平衡協調能力。每只小鼠重復3次,取最大值作為小鼠的測試結果,試驗時間不超過10 min。Y迷宮試驗中,標記Y迷宮三個臂分別為A、B、C,將小鼠置于A臂末端,讓小鼠在Y迷宮內自由探索5 min。記錄小鼠依次進臂的順序,統計正確的輪替次數(依次進入三個不同的臂)以及總的輪替次數,兩者比值即為自發交替正確率,作為評價小鼠工作記憶的指標。
1.2.5 免疫組織化學染色[7]:造模后的小鼠經過灌注取腦、固定及脫水等一系列預處理后進行SNpc區冠狀位冰凍切片,切片厚度30 μm,存放于4 ℃冰箱的冰凍保存液中備用。腦片室溫復溫漂洗,免疫染色抗體稀釋液1∶1000稀釋一抗(pSyn、TH及IBA-1抗體),室溫慢搖孵育過夜。用免疫染色抗體稀釋液1∶1000稀釋生物素標記二抗,室溫孵育1 h。用ABC復合物室溫孵育1 h后將腦片黏附到載玻片上,每張切片滴加新鮮配制的DAB顯色溶液,顯微鏡下觀察,控制染色時間5~20 min。蘇木素復染細胞核45 s后,切片室溫下晾干、梯度脫水、中性樹膠封片晾干后在顯微鏡下拍攝。
1.3 統計學處理方法 采用Image J軟件測量SNpc腦片中免疫組織化學染色圖片包含陽性信號的細胞百分比或陽性細胞數量,每只小鼠挑選3張腦片(前中后各一張),求其平均值。試驗數據采用SPSS16.0軟件進行統計分析,并以±s的形式表示。方差齊性檢驗采用Levene檢驗,2組樣本均數比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 A53T αS原纖維PD小鼠模型的行為學表型 曠場試驗中,模型組小鼠5 min內的總運動距離較對照組小鼠差異無統計學意義(P>0.05),表明模型組小鼠尚未出現運動功能的改變。懸掛試驗顯示模型組小鼠四爪抓桿持續時間較對照組顯著縮短,差異有統計學意義(P<0.05),提示模型組小鼠肌力和平衡協調能力下降。Y迷宮檢測表明模型組小鼠的自發轉換正確率與對照組比較,差異無統計學意義(P>0.05),表明模型組小鼠未出現工作記憶認知功能的改變。見表1。
表1 A53TαS原纖維PD小鼠模型的行為學表型(每組n=10,±s)
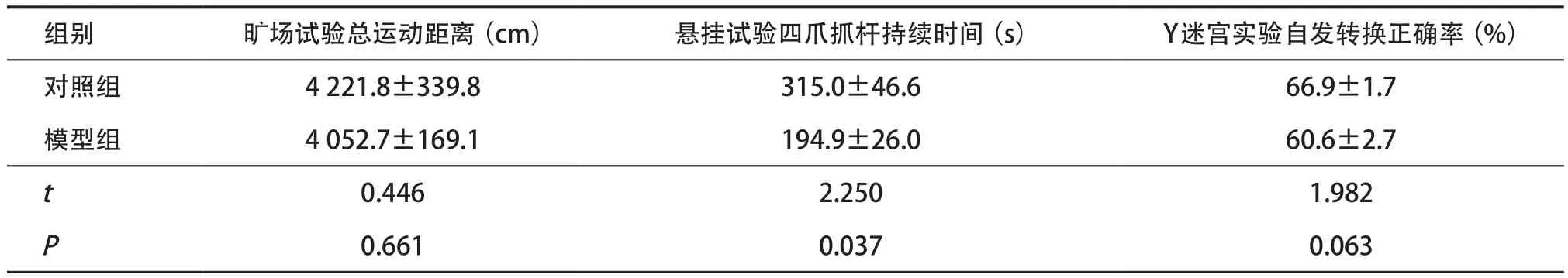
表1 A53TαS原纖維PD小鼠模型的行為學表型(每組n=10,±s)
組別 曠場試驗總運動距離(cm) 懸掛試驗四爪抓桿持續時間(s) Y迷宮實驗自發轉換正確率(%)對照組 4221.8±339.8 315.0±46.6 66.9±1.7模型組 4052.7±169.1 194.9±26.0 60.6±2.7 t 0.446 2.250 1.982 P 0.661 0.037 0.063
2.2 A53T αS原纖維PD小鼠模型的LBs病理分析
本研究以絲氨酸129位磷酸化的pSyn作為評估LBs包涵體的標記物。免疫組織化學染色顯示在SNpc腦區注射位點附近可以觀察到顯著的LBs包涵體病理改變(見圖1)。模型組小鼠SNpc腦區pSyn包涵體陽性的SNpc區細胞百分比為(35.60±3.93)%,顯著高于對照組的(4.22±0.27)%,差異有統計學意義(t=7.964,P<0.001)。
2.3 A53T αS原纖維PD小鼠模型的DA能神經元定量分析 免疫組織化學染色結果表明,SNpc腦區注射A53T αS導致TH陽性神經元的丟失(見圖2),模型組小鼠SNpc腦片中可清晰定量的TH陽性神經元數量為(59.78±4.23)個,顯著低于對照組的(87.13±3.71)個,差異有統計學意義(t=4.807,P<0.001)。
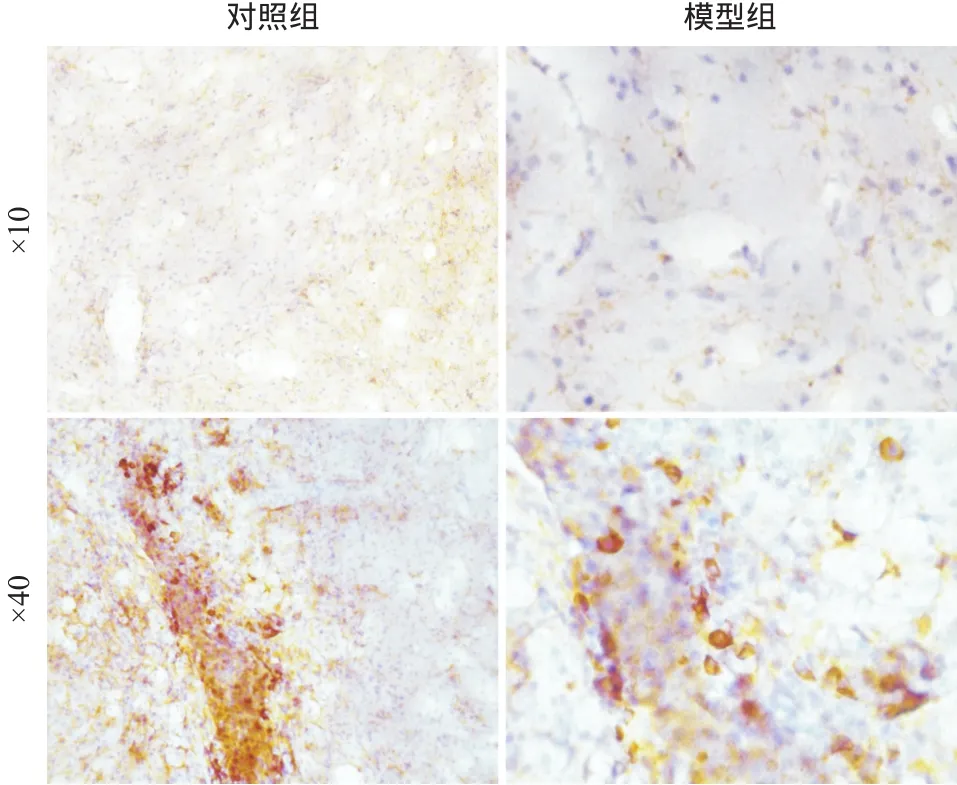
圖1 pSyn免疫組織化學染色圖
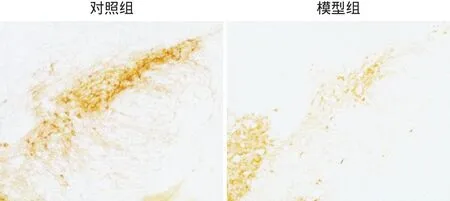
圖2 TH免疫組織化學染色圖(×10)
2.4 A53T αS原纖維PD小鼠模型的神經炎癥分析 IBA-1免疫組織化學染色結果顯示,SNpc腦區注射A53T αS導致小膠質細胞的過度激活,激活的小膠質細胞胞體增大、突起變短、細胞形態呈圓形或桿狀(見圖3)。模型組小鼠活化小膠質細胞相對數量(1.13±0.17)為對照組(2.78±0.23)的2.78倍,差異有統計學意義(t=5.685,P<0.001),提示模型組小鼠SNpc腦區存在過度的神經炎癥。
3 討論
以αS的異常聚集和擴散為分子標志的LBs腦內傳播是PD的病理標志,為解釋PD的運動及非運動癥狀提供了較好的理論模型,也為建立基于αS的PD動物模型提供了理論基礎[8]。現有的基于αS的PD動物模型中,αS轉基因小鼠PD模型可以較好地模擬腦內αS聚集及LBs傳播擴散的病理進程,但大部分轉基因動物中未發現SNpc區DA能神經元丟失這一典型病理標志[9]。重組腺相關病毒介導的αS過表達PD模型存在病毒載體純化要求高的難題,且在模擬PD病理進展上存在缺陷[10]。基于αS原纖維的PD病理傳播模型較好地克服了以上2種模型的不足,可全面模擬出PD主要病理特征。研究人員可通過向健康動物腦內直接注射包含αS病理的PD患者尸檢或老齡αS轉基因小鼠的腦組織勻漿[11],或將體外重組表達并純化的αS蛋白制備成原纖維后直接腦內注射造模[6]。這種基于αS原纖維的PD模型的原理是利用錯誤折疊的αS可在細胞間傳播,并觸發正常內源性αS由α螺旋向β折疊的構象轉變的特性,最終導致PD進行性神經退行性變的啟動和病理進展[12]。因此,基于αS原纖維的PD模型在研究αS病理傳播機制中具有獨特的優勢。
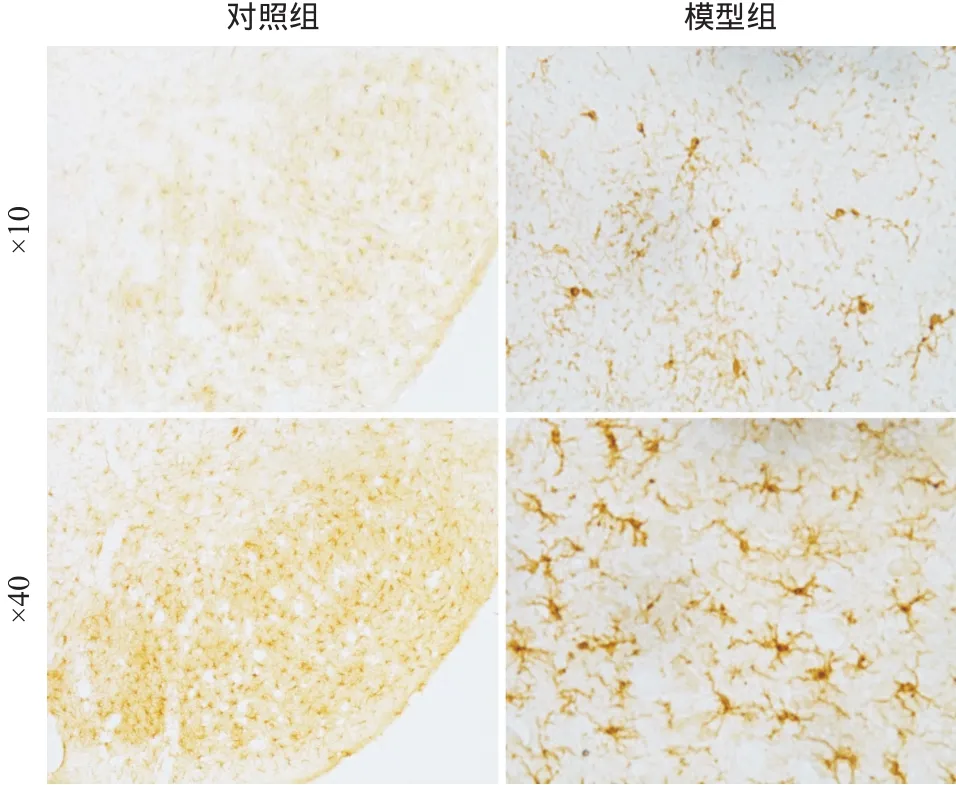
圖3 IBA-1免疫組織化學染色圖
本實驗利用小鼠腦內SNpc定位注射突變型A53T αS原纖維的方法,成功地建立了αS原纖維PD小鼠模型,同時模擬出LBs包涵體、DA能神經元丟失及神經炎癥三大PD病理特征。行為學檢測結果顯示,模型組小鼠表現出顯著的肌力減弱及平衡力下降。LUK等[6]在小鼠的背側紋狀體區注射αS原纖維,造模30 d時通過懸掛實驗就能檢測到實驗組小鼠的肌力及協調能力減弱。本實驗中模型小鼠尚未出現運動及認知功能的顯著下降,這與LUK等[6]的研究結果不一致,推測可能是因為紋狀體DA水平尚未明顯下降(紋狀體腦區TH免疫組織化學結果表明,DA能神經元末梢尚未出現結構異常,數據未顯示),也可能是本實驗中的曠場試驗檢測不夠靈敏,需要加大樣本量。另外,本研究團隊曾在前期報道過在海馬區注射A53T αS原纖維可導致小鼠工作記憶的受損[7],這與本研究結果不一致,原因可能是A53T αS原纖維直接注射到中腦SNpc區3個月時間尚不足以擴散到海馬和皮層等與認知密切相關的腦區,或雖有少量擴散,但不足以影響到其神經網絡功能的完整性。因此,αS原纖維注射到不同的腦區可能出現αS病理的傳播差異,從而導致不同的行為學表型,說明了αS病理和行為學表型之間的密切聯系。
PD患者的LBs中有90%以上為絲氨酸129位磷酸化的αS陽性包涵體,而在正常人的腦內僅有4%的αS有此位點的磷酸化[13],因此,本研究以絲氨酸129位磷酸化的pSyn作為檢測LBs包涵體的病理標記物。本實驗中A53T αS原纖維誘導的LBs包涵體的形態呈多樣性變化,有典型的強免疫活性的球形包涵體形式、紡錘絲樣神經突形式以及大量規則不一的微粒狀形式,這與KUUSISTO等[14]的研究結論一致,反映了A53T αS聚集程度的不同。此外,本研究發現直接在SNpc區注射A53T αS原纖維3個月可導致約30%的DA能神經元丟失,進一步證實了LBs和DA能神經元變性之間的因果聯系。LUK等[6]發現紋狀體區注射αS原纖維3個月和6個月后,αS病理可擴散到SNpc區,并分別導致DA能神經元死亡15%和35%;且發現αS原纖維誘導的LBs包涵體出現在DA能神經元死亡之前,同樣證實了兩者的因果關系。不同之處在于,本實驗采用的是比αS原纖維毒性更強的突變型A53T αS原纖維,且直接注射在SNpc區,因而能夠更快地導致更多的DA能神經元死亡。此外,研究表明PD尸檢腦內有明顯的神經炎癥反應,主要包括小膠質細胞的過度激活及形態功能改變等;和SACINO等[15]的研究結果一致,我們同樣發現A53T αS原纖維導致了以小膠質細胞活化為特征的神經炎癥的過度激活。
總之,本實驗利用SNpc區定位注射的方法建立了基于A53T αS原纖維的PD小鼠模型,證實了該模型可較為全面地模擬PD表型和病理特征,為進一步研究PD的病理機制及靶向αS的藥物篩選提供前期基礎。但是,A53T αS原纖維對DA能神經元毒性的分子機制,以及A53T αS在DA能神經元及膠質細胞內的吸收、分泌和擴散機制尚需深入研究。

