N-(4-丁酸甲酯)-4-羥基-1,8-萘酰亞胺葡萄糖醛酸苷的高效制備
白洪越,孔水仙,王 宇,侯熙彥,呂 俠*
(1.大連民族大學生命科學學院,生物技術與資源利用教育部重點實驗室,遼寧 大連 116600;2.大連醫科大學附屬第二醫院,遼寧 大連 116027)
尿苷二磷酸葡萄糖醛酸轉移酶(UGTs)是人體重要的II相代謝酶,不僅肩負著大量外源物的代謝清除,同時還在維系機體內源性物質代謝平衡中發揮著重要作用[1]。很多藥物、中草藥及天然化合物可抑制或激活UGTs酶的活性,引起臨床上不良的藥物/草藥-藥物相互作用或導致內源性物質的代謝紊亂。熒光探針具有操作簡便,生物樣本需要量少,高通量等優點。N-(4-丁酸甲酯)-4-羥基-1,8-萘酰亞胺(NMHN)能夠同時被多種UGTs亞型快速代謝,生成的代謝產物也具有較好的熒光屬性,能夠作為UGTs廣譜熒光探針底物,同時快速檢測多個UGTs亞型的活性[2]。再者生成的代謝產物也可作為β-葡萄糖醛酸苷酶的熒光探針底物用于β-葡萄糖醛酸苷酶的活性檢測。因此迫切需要構建NMHNG的高效制備方法。與化學合成法相比,生物合成法制備葡萄糖醛酸苷產物具有產率高、副產物少、制備過程簡單等優點[3]。本文利用牛肝微粒體能夠高效催化NMHN發生葡萄糖醛酸化反應生成NMHNG,同時借助固相萃取柱實現了NMHNG的高效分離及純化,獲得了純度大于98%的代謝產物。
1 實驗部分
1.1 試劑與儀器
Bruker ARX 500 MHz 超導核磁共振波譜儀(瑞士Brucker公司);UPLC-UV-ESI-MS 高效液相色譜-串聯質譜儀(日本島津公司); Allegra X-30R高速冷凍離心機(美國克曼庫爾特有限公司);MS-100恒溫混勻儀(杭州奧盛儀器有限公司);Synergy H1 型全功能微孔板檢測酶標儀(美國博騰儀器有限公司)。
三羥甲基氨基甲烷(Tris)、聚氧乙烯十六烷基醚(Brij58)、尿苷二磷酸葡萄糖醛酸鈉鹽(UDPGA)和MgCl2均購自Sigma公司;各種屬肝微粒體均購自瑞德肝臟疾病研究有限公司; UniElut C18AEX陰離子固相萃取小柱購自華譜有限公司。
1.2 實驗過程
1.2.1 NMHN葡萄糖醛酸化的種屬差異
UGTs孵育體系的建立:在1.5 mL離心管中依次加入底物NMHN(終濃度500 μmol/ L)、各個種屬肝微粒體(終濃度為0.5 mg/mL)、MgCl2(50 mmol/L)、Tris-HCl(50 mmol/L),于恒溫混勻儀上預先孵育5 min,再加入UDPGA(40 mmol/ L)起始反應,反應6h后加入乙腈終止反應。4℃ 14770r/min 離心20 min后取上清液于UPLC-UV-ESI-MS分析不同屬肝微粒體對NMHN生物轉化率。
1.2.2 NMHNG的制備與鑒定
UGTs孵育體系的建立同上,使用豬肝微粒體制備NMHNG(轉化率可達94.9%)。SPE柱由甲醇和水順序洗脫活化,將混合上清液上樣于SPE柱,依次用6mL超純水、6mL甲醇和6mL 5%的甲酸甲醇順序洗脫。收集含有代謝產物的餾份,旋轉蒸干后,通過質譜和核磁共振波譜鑒定其結構。
2 結果與討論
2.1 種屬差異實驗結果
NMHN在9種動物肝微粒體催化下均能發生葡萄糖醛酸化反應生成NMHNG,猴肝微粒體,大鼠肝微粒,小鼠肝微粒體,豚鼠肝微粒體,豬肝微粒體,狗肝微粒體,兔肝微粒體,牛肝微粒體和人肝微粒體的轉化率分別為28.1%,73.9%,59.9%,87.7%,94.9%,64.9%,75.9%,90.9%,和43.5% .其中豬肝微粒體催化NMHN發生葡萄糖醛酸化反應的生物轉化率最高,因此選擇豬微粒體為酶源用于NMHNG的制備。
2.2 NMHNG的分離及純化
由圖1a可知,UGTs反應混合液中NMHNG的含量高于90%,但是仍有約10%的NMHN的存在。SPE柱分離純化后,UGTs反應混合液中的NMHNG與NMHN及UGTs反應混合液中的其它雜質實現了快速較好的分離,獲得了4.0 mg NMHNG,其純度高于98%,實際產率高達80%。由圖1b和1c所示,UPLC-UV-ESI-MS給出NMHN的準分子離子峰[M+H]+,m/z: 314.05,NMHNG的準分子離子峰[M+H]+,m/z: 490.10,NMHNG的分子量比NMHN的分子量增加了176,確定其為NMHN的但葡萄糖醛酸化產物。
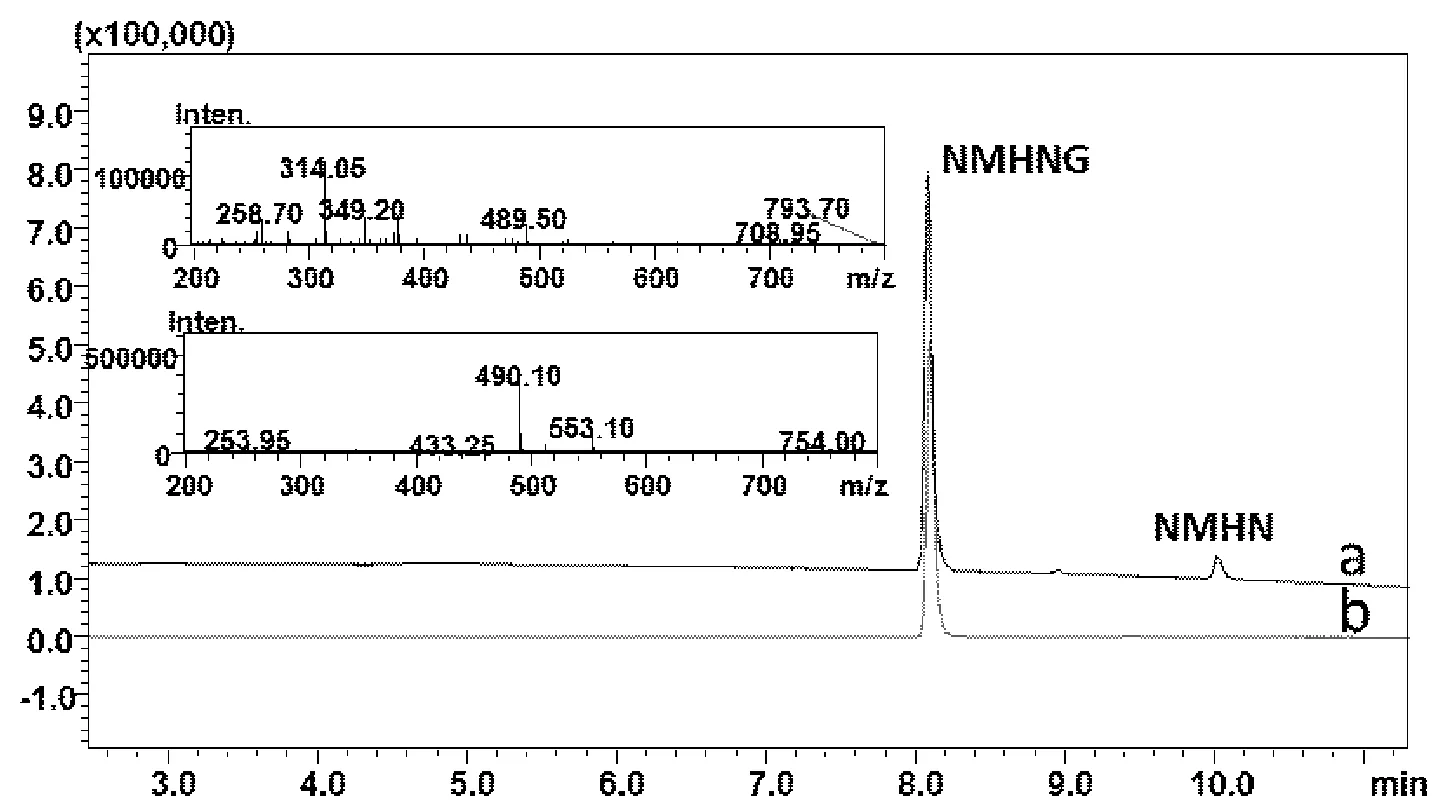
Fig.1 UPLC-UV chromatography of the reaction mixture (a) and the glucuronide of NMHN after isolation and purification by SPE(b) and the MS spectra of NMHN and NMHNG (Inset)
2.3 NMHN葡萄糖醛酸苷的結構表征
NMHNG黃色粉末(乙腈),紫外最大吸收波長為240 nm和360 nm,ESI-MS給出其準離子峰m/z 490.10 [M+H]+,其分子量489比NMHN大176,結合核磁共振氫譜和碳譜推測其分子式為C23H23NO11。與NMHN的13C NMR相比,NMHNG的13C NMR中出現6個新的葡萄糖醛酸的碳信號(δ99.94,72.9,75.57,71.3,75.4,170.0),其它碳信號與NMHN非常相似。從遠程相關譜圖HMBC譜中看到(δ5.44) 的葡萄糖醛酸的端基氫信號與C-4(δ157.7)有相關。1H NMR 中NMHNG的葡萄糖醛酸特征信號端基質子 H(δ5.44,J=7.2Hz)偶合常數大于7,證實其為β構型糖苷鍵。綜合上述信息,可確定NMHN在豬肝微粒體的催化下生成了NMHN-β-D-葡萄糖醛酸苷結合物,氫譜和碳譜核磁共振化學位移歸屬見表1。
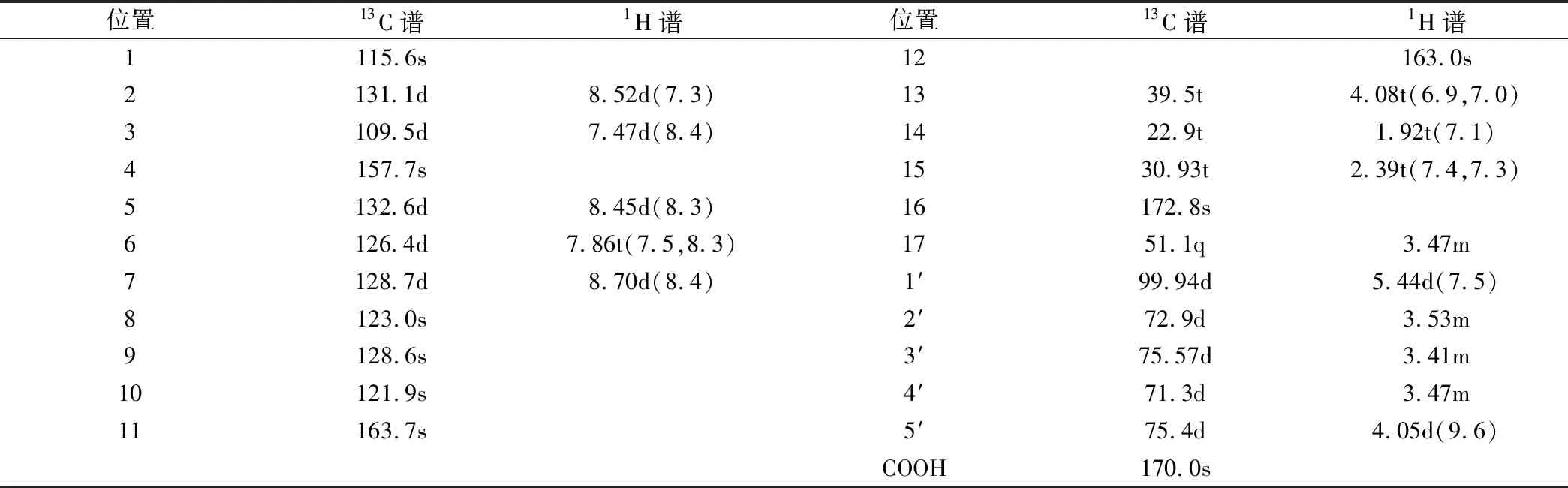
Table 1 Proton and carbon NMR chemical shift assignments for the glucuronide of NMHNG (DMSO-d6,δ in ppm,J in Hz)
3 結論
本文考察了不同種屬肝微粒體對NMHN的生物轉化效率,利用能夠高效轉化NMHN生成NMHNG的豬肝微粒體,使用生物合成的方法制備了NMHNG。同時通過固相萃取小柱實現了反應混合液中NMHNG的富集、分離和純化,借助現代波譜分析手段對NMHNG的結構進行了表征。該生物合成法產率高、制備物純度高、制備過程簡單,為NMHNβ-D-葡萄糖醛酸苷的高效制備提供了方法。

