微量Fe3+對過氧化氫異丙苯熱穩定性影響研究
王 飛, 劉惠平, 劉章蕊, 王 萌, 朱 鵬, 張小良
(上海應用技術大學 城市建設與安全工程學院,上海 201418)
0 引言
過氧化氫異丙苯(Cumene Hydroperoxide,CHP)是生產苯酚和丙酮的重要中間體,廣泛用于乙烯裂解汽油脫砷和丙烯腈丁二烯苯乙烯(Acrylonitrile Butadiene Styrene,ABS)接枝聚合反應。由于CHP分子結構中含有不穩定的過氧基團,因此在其生產、運輸、儲存或使用等過程中極易分解,并放出大量的熱,若不及時移除,則可能造成災難性的后果[1]。1970—2002年期間,美國等地發生過多起由CHP引發的熱爆炸及反應失控事故,造成了人員傷亡和經濟損失[2-4]。
近年來,一些學者采用不同的方法對CHP的穩定性和熱安全性進行了研究,如黃艷軍等[5]利用C80微量量熱儀對CHP的熱穩定性進行了研究,發現不同的升溫速率對CHP的初始分解溫度和最大放熱溫度有影響,升溫速率越快,CHP的初始分解溫度和最大放熱溫度會越高;金滿平等[6]利用C600微量熱儀研究了水和弱酸對CHP熱穩定性的影響,發現水和弱酸能降低CHP分解的活化能、起始分解溫度和最大分解溫度;倪磊等[7]利用差示掃描量熱儀(Differential Scanning Calorimetry,DSC)和絕熱量熱儀研究了CHP及其與不同金屬離子混合后的熱穩定性,為企業儲存、運輸CHP提供了指導。
本文利用絕熱加速量熱儀(Adiabatic Rate Calorimeter,ARC)研究微量Fe3+對CHP絕熱分解的影響,得到了被測樣品校正后的起始分解溫度(To,s)、絕熱溫升(ΔTad,s)、最大溫升速率(mm,s)和最大溫升速率達到時間(θm,s)等參數,并計算了測試樣品分解反應的動力學參數及CHP的分解熱,評估微量Fe3+的存在對CHP熱穩定性的影響,以期為CHP的熱穩定性安全提供一定的參考。
1 實驗
1.1 試劑
實驗采用的試劑為過氧化氫異丙苯(FeCl3·6H2O),純度≥70%。
1.2 儀器與測試條件
測試采用的儀器為德國耐馳公司的ARC244型絕熱加速量熱儀。測試結果用儀器自帶的ARC2000軟件進行分析。
測試樣品:樣品1為市售CHP試劑,CHP含量≥70%;樣品2為含0.4×10-3(w.t.)% Fe3+雜質的CHP溶液;樣品3為含1.2×10-3(w.t.)% Fe3+雜質的CHP溶液;樣品4為含2.0×10-3(w.t.)% Fe3+雜質的CHP溶液;樣品5為含4.0×10-3(w.t.)% Fe3+雜質的CHP溶液。測試所用樣品球為不銹鋼小球,比熱Cvb為0.576 J/(g·℃)。詳細的樣品測試質量及測試條件見表1。
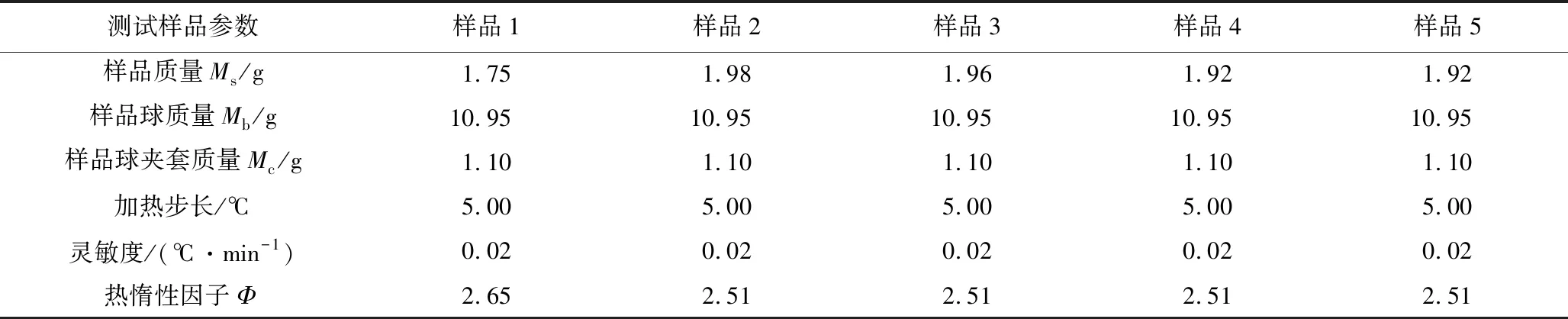
表1 測試樣品參數及測試條件Table 1 Test sample weight and test conditions
2 結果與討論
2.1 測試結果
5個樣品分解過程中的溫度-時間曲線、自放熱速率-溫度曲線、壓力-時間曲線分別見圖1、圖2和圖3,絕熱分解參數見表2。
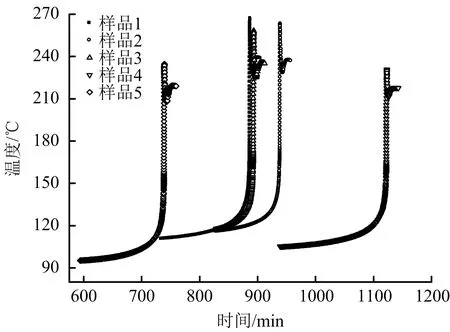
圖1 溫度-時間曲線Fig.1 Temperature-time curves
由圖1可知,樣品1~4的初始分解時間隨著Fe3+含量增加而增加,但當Fe3+達到一定濃度后(樣品5),樣品的起始分解時間會明顯縮短。
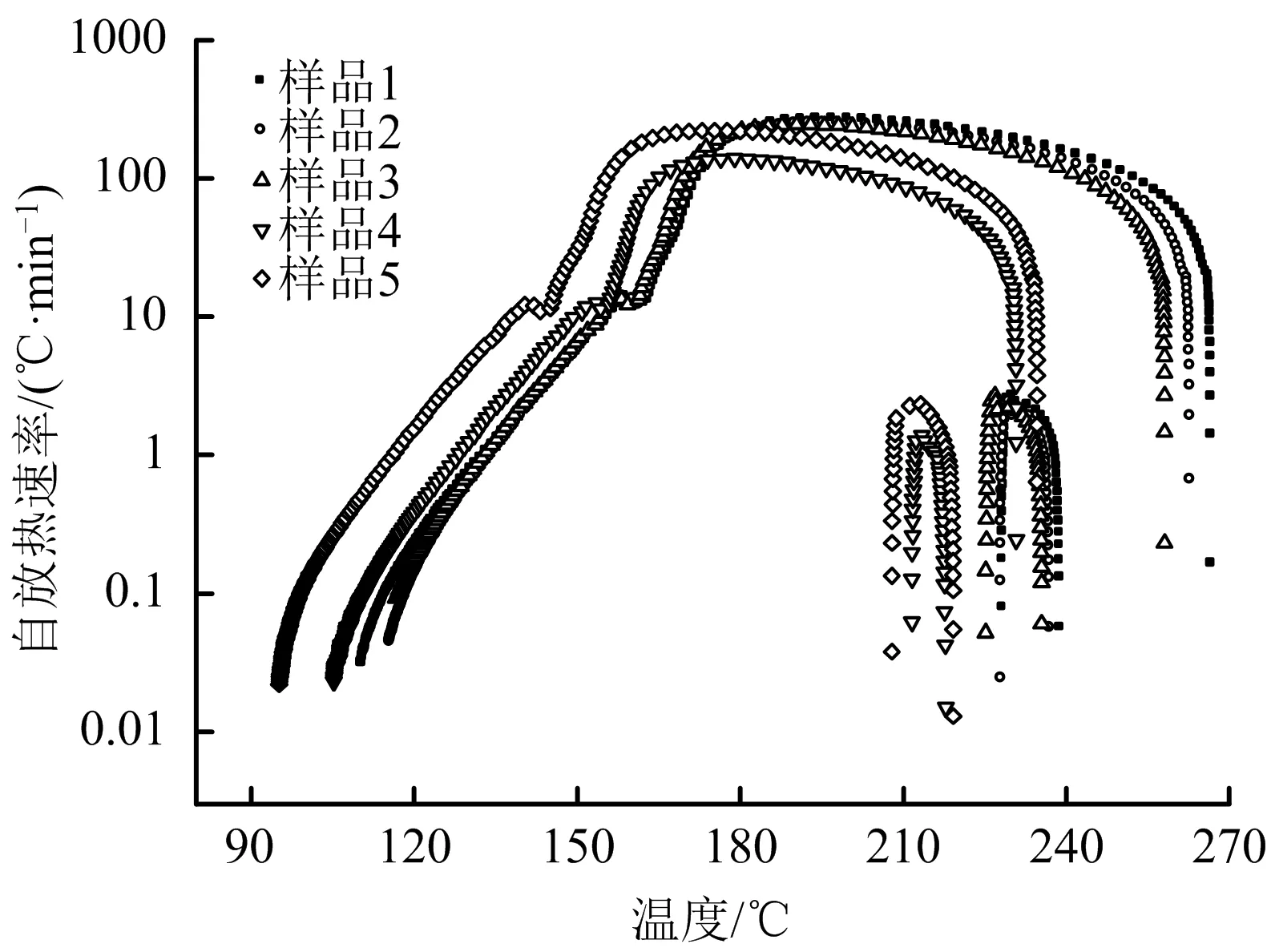
圖2 自放熱速率-溫度曲線Fig.2 Self-heat release rate-temperature curves
圖2表明,5個樣品在分解過程中的自放熱速率-溫度曲線變化規律不盡相同;樣品1,樣品2,樣品3的變化規律基本一致,而樣品4和樣品5的變化趨勢類似。
由圖3可知,5個樣品在分解過程中的壓力-時間曲線與圖1的溫度-時間曲線變化規律基本一致。
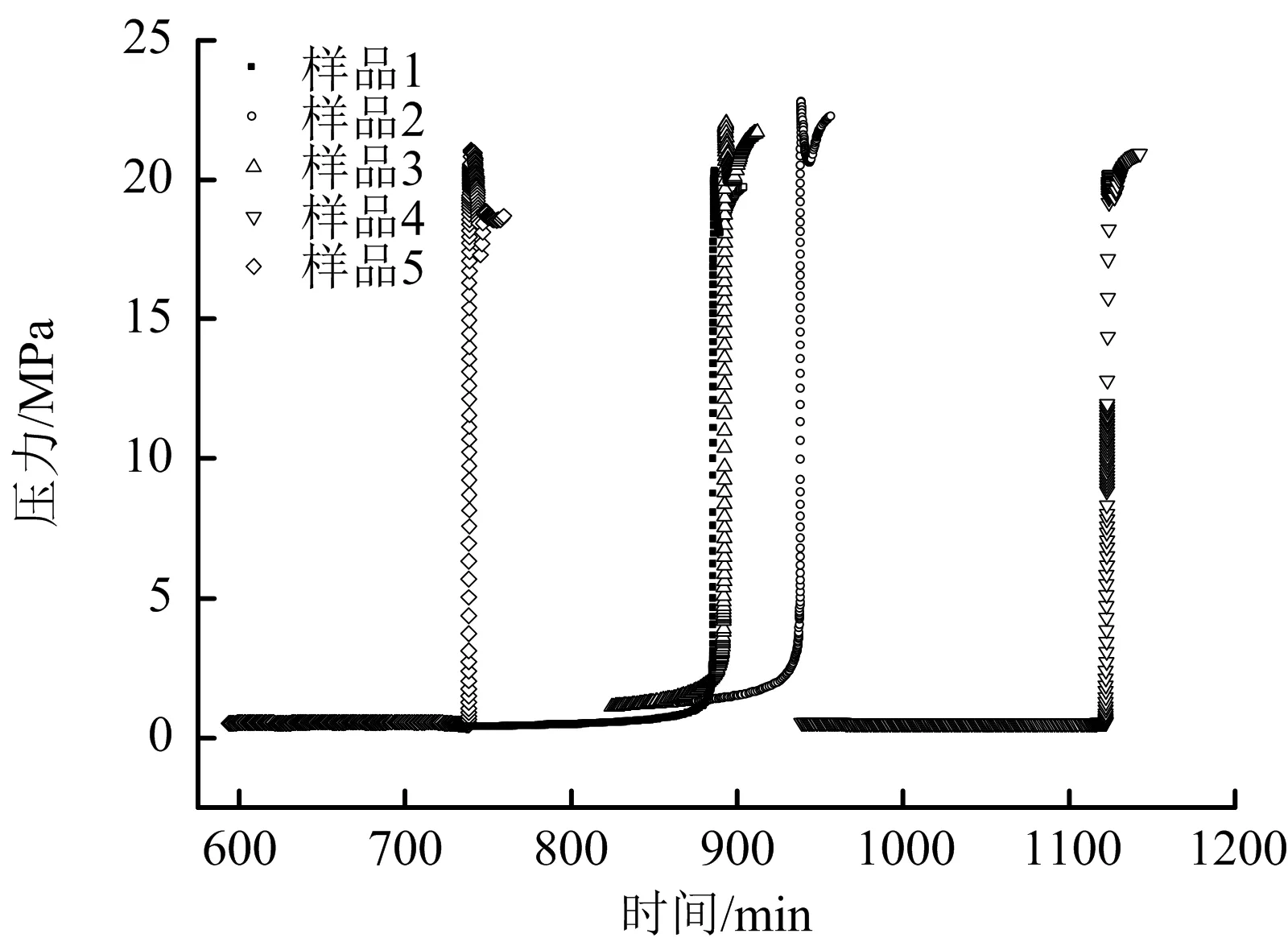
圖3 壓力-時間曲線Fig.3 Pressure-time curves
由圖1-3數據可知,5個樣品的初始分解溫度呈先遞增,后遞減趨勢,按序依次分別為110.51,115.73,116.75,105.25和95.23 ℃。另外,5個樣品分解過程中所達到的最大溫升速率不同,分別為267.73,249.48,243.7,138.91和220.79 ℃/min,特別是分解開始后至到達最大溫升速率的時間差別較大,分別為152.92,110.10,67.81,54.24和45.50 min。
2.2 微量Fe3+對分解反應活化能的影響
圖4為5個樣品絕熱分解過程中反應活化能隨溫度變化的曲線。由圖4可見,5個樣品分解過程中活化能隨溫度的變化趨勢相似。根據測試數據分析可得,5個樣品分解過程中的平均活化能分別為456.29,443.99,382.51,351.21和343.49 kJ/mol。
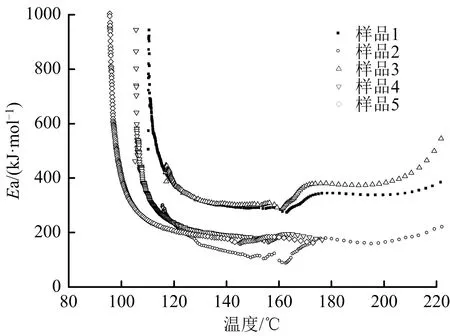
圖4 活化能-溫度曲線Fig.4 Activation energy-temperature curves
另外,由Arrhenius方程(見式(1))求得的動力學參數之一的指前因子A,計算結果見表2。
(1)
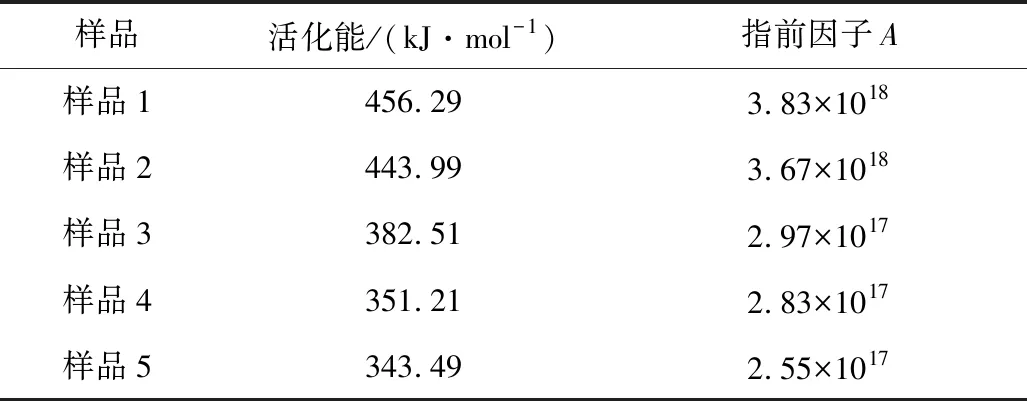
表2 5個樣品的反應活化能及指前因子Table 2 Reaction activation energy and pre-exponential factors of five samples
2.3 測試數據校正
利用ARC測試樣品的過程中,樣品球內物質分解產生的熱量不僅要加熱樣品本身,還要加熱樣品球,所以測試的是樣品和樣品球組成的體系的溫度變化[8]。如果測試樣品自分解放出的熱量只用于加熱樣品本身,而不加熱樣品球,那么實際測得的溫升及溫升速率都會高于測量值[9]。因此,需要引入熱惰性因子Φ對ARC測試的結果進行校正,從而使測試結果更準確、真實[10]。具體校正方法見式(2)~(9)[11-15],校正結果見表3。
Φ=1+[(MbCvb+McCvc)/(MsCvs)]
(2)
(3)
(4)
ΔTad,s=ΦΔTad
(5)
mo,s=Φmo
(6)
mm,s=Φmm
(7)
Tm,s=To,s+Φ(Tm-To)
(8)
(9)
式中:Φ為熱惰性因子,無量綱;Mb為樣品球的質量,g;Mc為樣品球夾套的質量,g;Ms為樣品的質量,g;Cvb為樣品球夾套的比熱容,J/(g·℃);Cvc為樣品球夾套的比熱容,J/(g·℃);Cvs為樣品的比熱容,J/(g·℃);To為初始分解溫度,℃;To,s為校正后的初始分解溫度,℃;R為摩爾氣體常數,R=8.314 J/(mol·K);Ea為活化能,kJ/mol;Tf,s為校正后的最高分解溫度,℃;ΔTad為絕熱溫升,℃;ΔTad,s為校正后的絕熱溫升,℃;mo為初始溫升速率,℃/min;mo,s為校正后的初始溫升速率,℃/min;mm為最大溫升速率,℃/min;mm,s為校正后的最大溫升速率,℃/min;Tm為最大溫升速率對應溫度,℃;Tm,s為校正后的最大溫升速率對應溫度,℃;θm為最大溫升速率對應時間,min;θm,s為校正后的最大溫升速率對應時間,min。
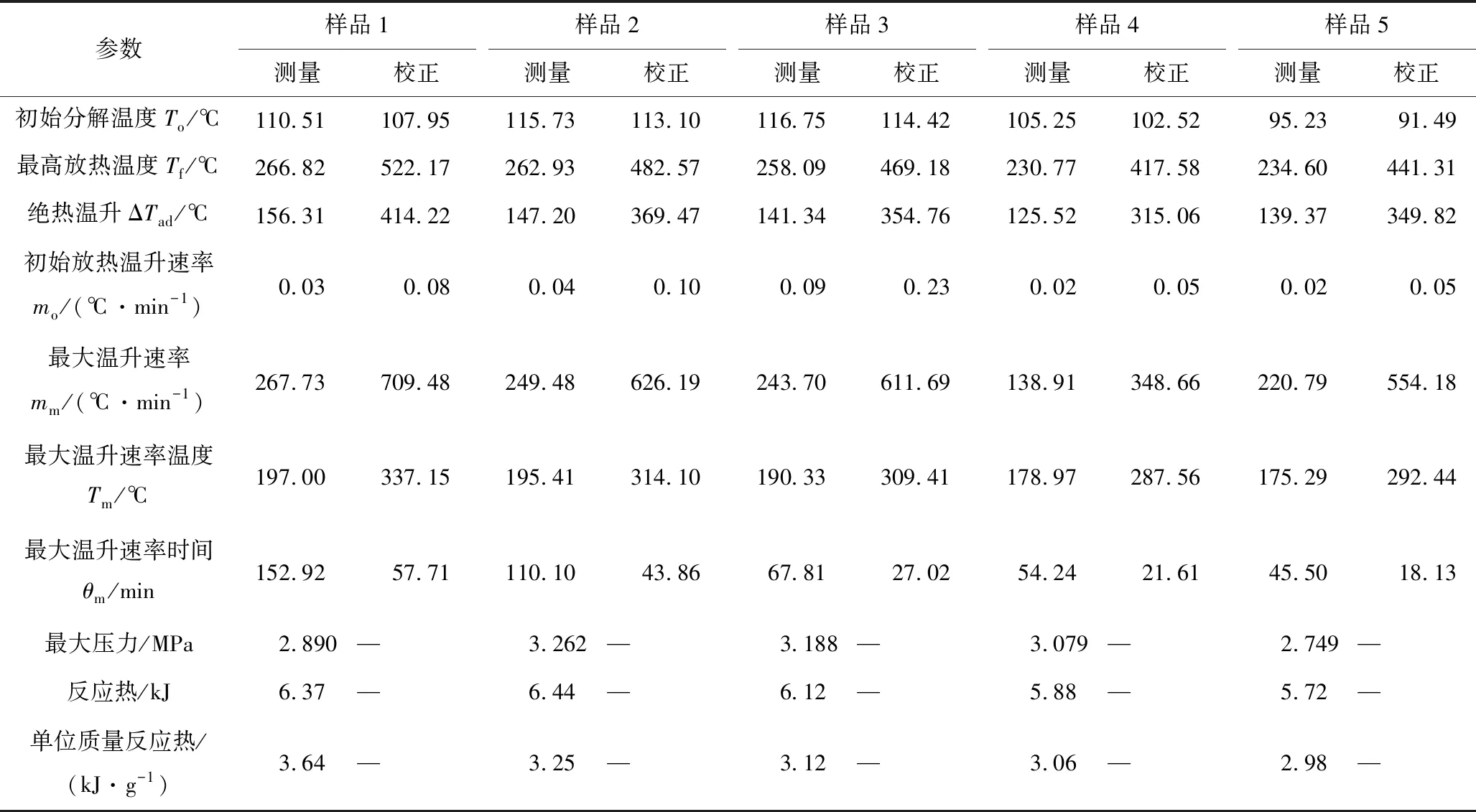
表3 樣品絕熱分解的測試結果及校正值Table 3 Test results and corrected values of sample adiabatic decomposition
2.4 測試結果分析
由圖1樣品的溫度-時間變化曲線可見,當樣品分解使得反應體系溫度達到最大值后,都有1個突然下降,達到某一溫度后又上升直至平穩的過程。這可能是由于測試過程中CHP分解反應達到劇烈狀態時放出熱量很快,使得反應體系的溫度上升過快,即溫升速率很快(見圖2和表3),遠遠超過了ARC儀器維持模擬絕熱過程而加熱的最大額定溫升速率(20 K/min);當反應達到最劇烈狀態后,反應體系內的溫度達到了1個最高點,而此時樣品球外的儀器加熱溫度還沒跟上,因此反應體系的熱量會向樣品球外傳遞,導致體系的溫度降低,直至與儀器加熱溫度一致;之后,由于反應后期的反應速率較小,放出熱量較少,反應體系的溫升速率與儀器的加熱速率一致,測試又回到了正常狀態,直至反應完全結束。
圖1和表3結果表明,樣品1~5的校正初始分解溫度分別為107.95,113.10,114.42,102.52和91.49 ℃,呈現先增加后降低的趨勢;5個樣品的絕熱溫升分別為414.22,369.47,354.76,315.06和349.82 ℃;最大溫升速率分別為709.48,626.19,611.69,348.66和554.18 ℃/min。造成上述現象的原因可能是,當樣品中含有較低含量的Fe3+時(樣品2和樣品3),其對CHP具有緩慢的催化分解作用,由于分解反應較慢,放出的熱量較少,反應體系的溫升速率低于儀器檢測的靈敏度(0.02 ℃/min),因此實驗開始后很長時間內檢測不到溫升信號,但此過程中樣品中的CHP濃度卻會由于長時間緩慢的分解而逐漸降低,從而導致樣品2和樣品3在絕熱受熱過程中的初始分解溫度略高于樣品1的初始分解溫度。當樣品中Fe3+含量增加到一定的量后(樣品4和樣品5),Fe3+對CHP的催化分解作用更明顯,放熱越多,反應體系的溫升速率更容易高于儀器檢測的靈敏度而被儀器檢測,因此,樣品4和樣品5的起始分解溫度低于樣品1的初始分解溫度。另外,不含Fe3+的樣品1在受熱過程中主要發生的是CHP熱分解反應,而含微量Fe3+的樣品在受熱過程中除了發生熱分解反應外,還發生了催化分解反應,且在一定濃度范圍內,Fe3+含量相對越高,發生催化分解反應的CHP也越多。由于不同分解反應機理的放熱效應不一樣,不同樣品對反應體系的最終絕熱溫升及反應過程中的最大溫升速率的影響也不一樣(見圖2和表3)。由表3結果可見,5個樣品單位質量的反應熱呈現依次遞減規律,分別為3.64,3.25,3.12,3.06和2.98 kJ/g。此外,從圖1和表3中還可發現,樣品2~5從分解開始至達到最大溫升速率的時間分別為43.86,27.02,21.61和18.13 min,明顯短于樣品1的相應時間(57.71 min),說明微量Fe3+的存在能夠顯著加快CHP的分解過程,且Fe3+濃度越大,CHP達到劇烈分解的時間越短。
由圖3可見,樣品4和樣品5的壓力-時間變化曲線與樣品1、樣品2和樣品3的相比略有差別。這可能是由于Fe3+濃度的增加,明顯加快了CHP的催化分解,從而使得反應體系的壓升速率顯著增加,但反應體系最后達到的最大壓力卻相差不大(見表3),說明Fe3+的存在對反應體系的最終壓力影響不大。
表2和圖4結果表明,Fe3+的存在對CHP絕熱分解的活化能影響較大,既影響了樣品的初始分解活化能,也影響了其整個分解過程的平均活化能;而且,Fe3+含量越高,樣品分解過程的平均活化能越低,說明Fe3+的存在對CHP起到了明顯的催化分解作用,增加了CHP絕熱分解的危險性。
3 結論
1)測試的5個CHP樣品校正初始分解溫度(To,s)隨著Fe3+濃度的增高而呈現先增加后下降的趨勢,即Fe3+濃度較低時,CHP的初始分解溫度略有上升;隨著Fe3+濃度的進一步增大,CHP初始分解溫度逐漸降低,CHP分解危險性也隨之增大。
2)絕熱分解過程中,隨著Fe3+濃度的增高,5個CHP樣品的最大溫升速率對應時間θm依次減小,Fe3+的加入使得CHP分解變得更加劇烈。
3)絕熱分解過程中,隨著Fe3+濃度的增高,CHP樣品校正最大溫升速率mm,s和校正絕熱溫升ΔTad,s呈現先下降后增加的趨勢,即Fe3+濃度達到一定值后,絕熱溫升會變大,最大溫升速率會增加,CHP分解危險性也會越高。
4)絕熱分解過程中,Fe3+濃度越高,相應CHP樣品的活化能Ea值越小,CHP更易發生分解。因此,在儲存和運輸CHP的過程中,要避免CHP與Fe3+接觸,防止CHP發生分解。

