連作對土壤微生物及平邑甜茶幼苗氮吸收、分配和利用的影響
王功帥,馬子清,潘鳳兵,田長平,陳 杰,王金政,陳學森,尹承苗*,毛志泉*
(1 山東農業大學園藝科學與工程學院/作物生物學國家重點實驗室,山東泰安 271018;2 煙臺市農業科學研究所,山東煙臺 265500;3 臨沂市蘭山區園林辦公室,山東臨沂 276000;4 山東省果樹研究所,山東泰安 271018)
我國傳統優勢栽培地區的蘋果園主要是上個世紀80年代與90年代初發展建立的,大部分已進入衰老期,其中蘋果產區20年齡果園占20%,每年面臨2~3.33萬 hm2的老果園改造[1],蘋果連作障礙是生產中的一大難題,給果農造成巨大的經濟損失,嚴重制約了我國果樹產業的可持續發展[2]。土壤pH失衡、自毒類物質、土壤理化性質惡化、微生物因素是引起蘋果連作障礙的主要因素[3-4]。蘋果連作障礙通常在再植后1~3年內表現,具體表現為地上部發育不良,根系生物量降低,根尖壞死,嚴重的直接導致植株死亡[5-6]。
連作不僅抑制植物根系的生長,還嚴重影響對各種元素的吸收和積累。阮維斌等[7]研究表明,連作降低大豆植株對磷、鉀等礦質元素的吸收,地上部分的養分比例下降。這可能由于連作提高根系超氧自由基和MDA水平,增加了膜滲透[8-9],過多的自由基使線粒體膜流動性降低[10],膜通透性降低,功能喪失[11]。進而破壞根系皮層和表皮層結構[12],影響根系功能。根系活力和根系質膜ATPase活性是影響根系吸收功能的重要因子。質膜H+-ATPase可利用ATP水解產生的能量將細胞質膜內側的H+泵到質膜外側,產生跨膜pH梯度和跨膜電勢梯度[13-15]。此電化學梯度為物質跨膜轉運提供驅動,帶動一系列次級運輸體系對各種營養物質、離子的轉運[15]。
氮素是果樹生長發育過程中所必需的重要營養元素,它影響果樹的營養生長和生殖生長,影響果樹內各種生理生化過程。氮素的吸收直接關系到器官分化、形成以及樹體結構的形成。由于15N標記的特殊性,被廣泛應用于植株體內氮素的分配與積累研究上。然而關于蘋果連作條件下對氮元素的吸收、利用和分配鮮有報道。本試驗以盆栽平邑甜茶為試材,利用15N示蹤原子的方法,研究在連作條件下平邑甜茶對15N的吸收、利用和分配,進一步揭示蘋果連作障礙的發生機制,為今后克服蘋果連作障礙提供理論基礎。
1 材料與方法
1.1 試驗材料與設計
本試驗于2013年1—11月在山東農業大學園藝科學與工程學院國家蘋果中心實驗站和國家蘋果實驗室進行。連作土取自山東省泰安市岱岳區滿莊鎮灘清灣村30年的老蘋果園,臨近老果園周圍的麥田土為正茬。連作土收集距樹干1 m、深5—40 cm范圍內的土壤,多點取樣混勻使用。土壤類型為沙土,有機質含量為5.04 g/kg,土壤硝態氮含量為13.2 mg/kg,銨態氮含量為4.11 mg/kg,速效鉀含量為109 mg/kg,速效磷含量為9.28 mg/kg,土壤pH為5.31。正茬土類型為沙土,有機質含量為13.8 mg/kg,土壤硝態氮含量為15.3 mg/kg,銨態氮含量為9.37 mg/kg,速效鉀含量為122 mg/kg,速效磷含量為20.4 mg/kg,土壤pH為6.83。
試驗材料選用平邑甜茶 (Malus hupehensis Rehd.),2013年1月種子層積,待種子萌動露白后即可在育苗盤中播種育苗。試驗采用盆栽的方法,泥盆高26 cm,直徑28 cm,裝土7 kg,2013年5月選取生長一致的幼苗進行移栽。
本試驗設4個處理:T1為連作土溴甲烷滅菌處理;T2為連作土高溫滅菌處理;T3為老果園臨近麥田土;CK為連作土。每個處理重復20盆共計80盆。待盆栽幼樹長勢穩定后,于2013年6月3日每盆施用0.5 g15N-尿素 (上海化工院生產,豐度為10.22%),溶于水后均勻澆入盆內。
1.2 測定方法
分別于8月5日和9月5日進行破壞性取樣。植株材料用于生物量指標、根系指標和15N的測定;土壤樣品用于土壤微生物的測定。每個處理隨機選取3個重復。
生物量的測定:平邑甜茶幼苗株高和地徑分別用米尺和電子游標卡尺測定,將當天完整取樣的幼苗用去離子水沖洗干凈,晾干,用天平測定鮮重。將幼苗在105℃下高溫殺青30分鐘,80℃烘干至恒重為干重。
根形態測定:將不同處理的幼苗根剪下,用清水沖洗干凈,鋪展在水中,然后用專業版WinRHIZO(2007年版) 根系分析系統對樣品圖像進行分析處理,記錄幼苗根系平均直徑、總體積、總表面積和根尖數等根系構型參數。
根系活力的測定參照文獻[4]的方法。
根系質膜H+-ATPase的測定參照文獻[16]的方法。
土壤微生物的測定:細菌的培養采用牛肉膏蛋白胨培養基,真菌的培養采用馬丁氏培養基。
15N的測定:將樣品在105℃殺青30 min,80℃烘干,用不銹鋼電磨粉碎后過0.25 mm篩,樣品裝袋暫存待測。15N豐度及全15N含量在中國農業科學院原子能研究所用MAT2251質譜儀測定。
1.3 數據計算與分析
肥料氮 (Ndff%) = (植物樣品中15N豐度%-自然豐度%) / (肥料中15N豐度% -自然豐度%) × 100
氮肥利用率 (%) =[Ndff% × 器官全氮量 (g)]/施肥量 (g) × 100
氮肥分配率 (%) = 各器官從氮肥中吸收的氮量(g) / 總吸收氮量 (g) × 100
從氮肥中吸收的氮量 (g) = 器官全氮量 (g) × Ndff%
試驗數據采用Microsoft Excel 2003進行計算和作圖,通過SPSS 19.0軟件進行Duncan顯著性檢測。
2 結果與分析
2.1 連作對平邑甜茶幼苗生物量的影響
由表1可以看出,連作顯著抑制了平邑甜茶幼苗生物量的生長。8月份,連作土溴甲烷熏蒸、高溫滅菌與麥田土處理幼苗的生物量沒有差異,但顯著高于連作土對照處理。連作土對照處理幼苗的鮮重分別為連作土溴甲烷、高溫滅菌處理和麥田土處理的56.15%、53.68%、68.22%,干重為溴甲烷、高溫滅菌處理和麥田土處理的52.17%、53.33%、66.67%。株高為溴甲烷、高溫滅菌處理和麥田土處理的54.77%、59.16%、68.89%。地徑為溴甲烷、高溫滅菌處理和麥田土處理的80.00%、80.00%、82.35%。9月份,除了地徑沒有差異外,連作土溴甲烷熏蒸、高溫滅菌處理和麥田土處理與連作處理相比幼苗株高、鮮重和干重達到顯著性差異。與溴甲烷熏蒸、高溫滅菌處理和麥田土處理相比,連作土對照處理的鮮重分別減少了46.77%、46.50%和27.38%;干重分別減少了50.57%、49.04%、39.56%;株高分別減少了41.97%、41.95%和23.51%。
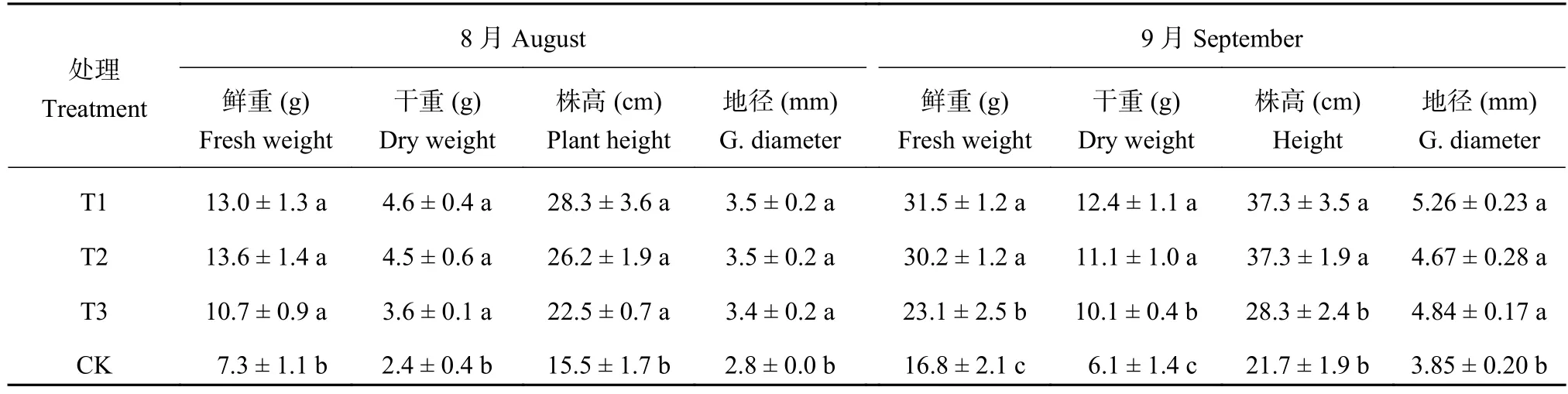
表 1 不同處理平邑甜茶幼苗鮮重、干重及生長狀況Table 1 Effect of different treatments on the biomass of Malus hupehensis Rehd. seedlings
2.2 連作對平邑甜茶幼苗根系構型的影響
由表2可知,與連作土處理相比,連作土溴甲烷熏蒸、高溫滅菌處理和麥田土處理幼苗根系結構具有明顯的差別。連作土對照處理幼苗的根長、根面積、根尖數和分叉數顯著低于連作土溴甲烷熏蒸和高溫滅菌處理。8月份連作土處理的幼苗根長、根面積、根尖數和分叉數與麥田土處理沒有顯著性差異。隨著植株的生長,9月份測定結果表現為連作土處理的幼苗根長、根面積、根尖數和分叉數顯著低于連作土溴甲烷熏蒸、高溫滅菌和麥田土處理。與連作土溴甲烷熏蒸、高溫滅菌和麥田土處理相比,連作土處理的幼苗根長分別減少了60.10%、59.19%和42.35%;根面積分別減少了56.24%、55.75%和48.07;根尖數分別減少了30.29%、25.78%和25.94%;分叉數分別減少了94.13%、93.87%和93.06%。
2.3 連作對平邑甜茶根系活力的影響
圖1顯示,連作土處理的幼苗根系活力最低,顯著低于連作土溴甲烷熏蒸、高溫滅菌和麥田土處理。與連作土溴甲烷熏蒸、高溫滅菌和麥田土處理相比,8月連作土處理的幼苗根系活力分別減少了42.65%、43.09%和33.41%。而連作土溴甲烷熏蒸、高溫滅菌和麥田土處理無顯著差異。9月份麥田土處理幼苗根系活力顯著低于連作土溴甲烷熏蒸和高溫滅菌處理,高于連作土處理,與連作土溴甲烷熏蒸、高溫滅菌和麥田土處理相比,連作土處理的根系活力分別減少了39.71%、40.64%和26.80%。
2.4 連作對平邑甜茶幼苗根系質膜H+-ATP酶的影響
通過測定H+-ATPase,發現連坐土溴甲烷熏蒸和高溫滅菌處理幼苗根系質膜 H+-ATP 酶差異不大,但顯著高于麥田土和連作土,連作土幼苗根系活性最低,顯著低于麥田土。8月和9月趨勢基本一致,與溴甲烷熏蒸、高溫滅菌和麥田土處理相比,9月份連作土處理幼苗根系的H+-ATPase活性分別減少了41.44%、38.24% 和 25.78%(圖2)。
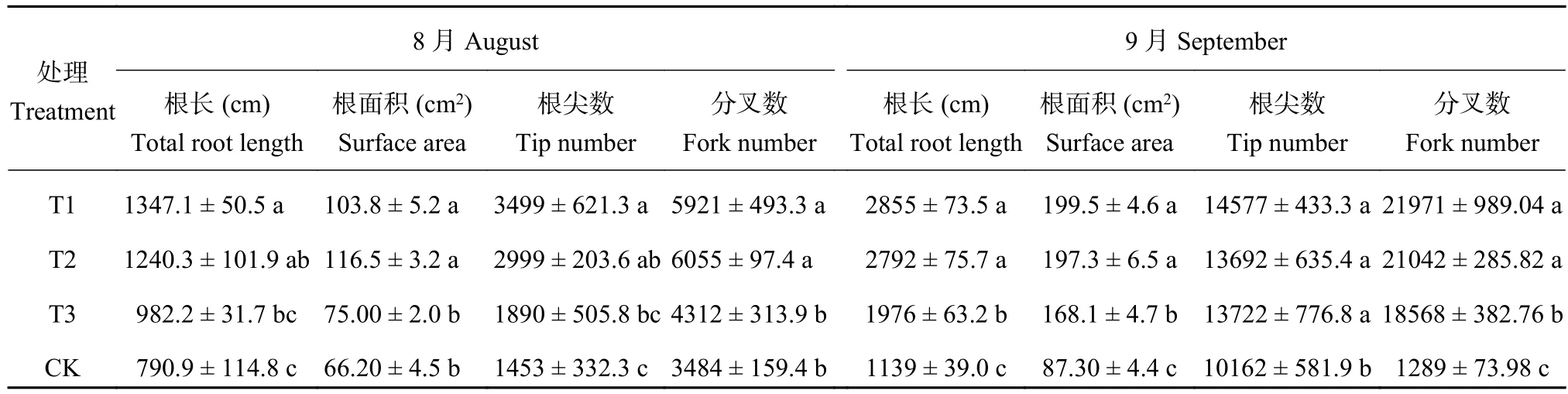
表 2 不同處理對平邑甜茶根系構型的影響Table 2 Effect of different treatments on the root architecture of Malus hupehensis Rehd. seedlings
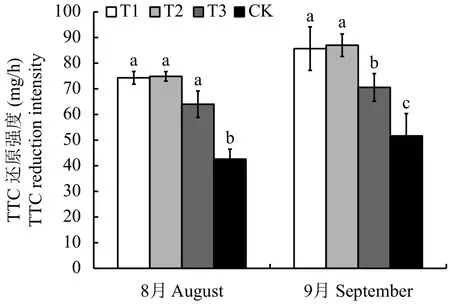
圖 1 不同處理對平邑甜茶幼苗根系活力的影響Fig. 1 Effects of different treatments on root activity ofMalus hupehensis Rehd. seedlings
2.5 連作對土壤微生物的影響
由表3可知,不同處理的土壤微生物數量差異很大。8月份,由于連作土溴甲烷熏蒸和高溫滅菌,土壤微生物總量顯著低于麥田土。連作土中細菌總量最少,顯著低于麥田土,真菌總量最高,與麥田土差異不大。隨著連作時間的延長,連作土壤微生物發生了顯著變化。9月份,連作土細菌總量顯著低于溴甲烷熏蒸、高溫滅菌和麥田土處理,分別占70.25%、37.13%、78.77%。連作土壤的真菌總量顯著高于溴甲烷熏蒸、高溫滅菌和麥田土處理,分別是其他3個處理的6.24倍、2.79倍、1.76倍。同時,細菌/真菌比值顯著低于溴甲烷熏蒸、高溫滅菌和麥田土處理。
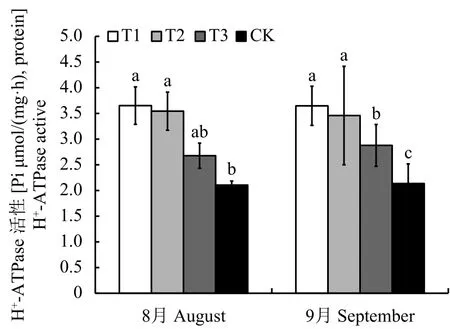
圖 2 不同處理對平邑甜茶幼苗根系H+-ATPase的影響Fig. 2 Effect of different treatments on H+-ATPase activeof Malus hupehensis Rehd. seedlings
2.6 連作對15N-尿素的Ndff、分配率和利用率的影響
2.6.1 不同處理對植株各器官Ndff的影響 圖3可以看出,連作土處理各器官的Ndff最低,顯著低于連作土溴甲烷熏蒸、高溫滅菌和麥田土處理。8月份表現為隨著植株的生長,各器官的Ndff都增加,但是不同器官的Ndff含量發生了明顯變化。連作土溴甲烷熏蒸、高溫滅菌和麥田土處理莖葉的Ndff含量高于根系,而連作土處理幼苗根系的Ndff含量高于葉,莖最少。隨著15N的不斷消耗和植株的生長,在9月份連作土處理根莖葉器官的Ndff與其他3個處理的趨勢一致,莖 > 根系 > 葉。連作土處理根系的Ndff含量最低,與連作土溴甲烷熏蒸、高溫滅菌和麥田土處理相比,分別減少了18.26%、47.99%和46.78%;莖的Ndff含量分別減少了47.57%、46.75%和45.05%;葉片組織的Ndff含量分別減少了61.34%、58.65%和57.36%。
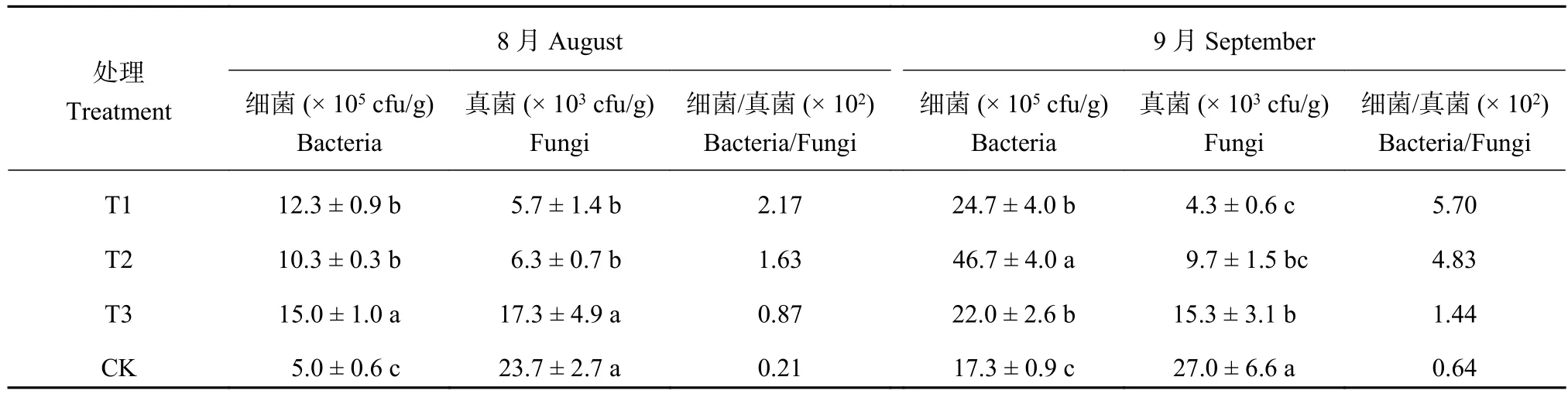
表 3 不同處理對土壤微生物的影響Table 3 Effect of different treatments on soil microbial amount
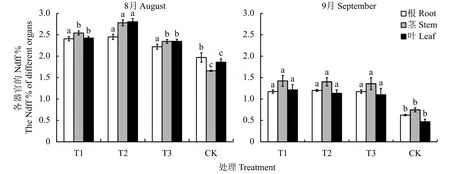
圖 3 不同處理對平邑甜茶各器官Ndff的影響Fig. 3 Effect of different treatments on the Ndff in organs of Malus hupehensis Rehd. seedlings
2.6.2 連作對植株各器官15N分配的影響 由圖4可知,不同處理平邑甜茶對15N營養元素在不同器官組織的分配有顯著的差異。連作土處理的根系和葉組織15N的分配與其他3個處理有顯著性差異。連作土幼苗根系15N分配率顯著高于連作土溴甲烷熏蒸、高溫滅菌和麥田土處理,而葉片15N的分配率顯著降低,而莖組織的15N分配基本無差異。8月份連作土處理根系15N的分配率為39.59%,分別是連作土溴甲烷熏蒸、高溫滅菌和麥田土的1.16、1.14、1.13倍。隨著植株的生長,9月份連作土處理根系15N的分配率有所提高,達到42.11%,是連作土溴甲烷熏蒸、高溫滅菌和麥田土處理的1.18倍。葉片組織的15N分配率顯著降低,由41.04%減少為29.55%。僅占連作土溴甲烷熏蒸、高溫滅菌和麥田土處理的64.78%、73.07%、59.93%。
2.6.3 連作對氮肥利用率的影響 圖5可以看出,連作土處理的氮肥利用率最低,顯著低于連作土溴甲烷熏蒸、高溫滅菌和麥田土處理。8月份連作土處理的氮肥利用率為11.0%,與連作土溴甲烷熏蒸、高溫滅菌和麥田土處理相比,分別減少了的61.75%、61.61%和47.68%。9月份連作土的氮肥利用率為13.33%,與其他3個處理相比,連作土處理分別減少了67.19%、67.68%和60.39%。
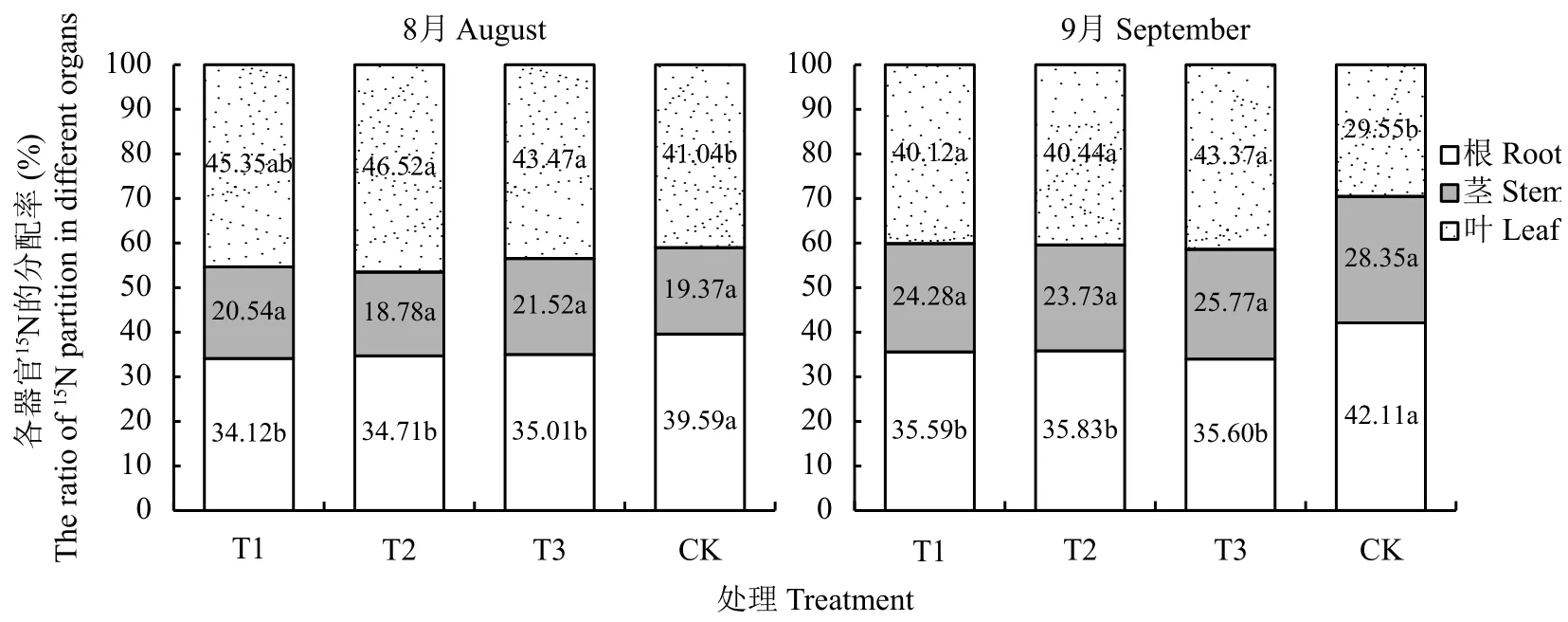
圖 4 不同處理對平邑甜茶15N分配的影響Fig. 4 Effect of different treatments on ratio of 15N partition of Malus hupehensis Rehd. seedlings
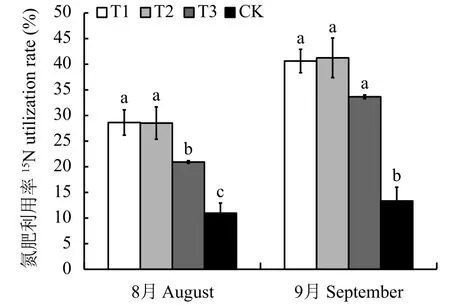
圖 5 不同處理對平邑甜茶氮肥利用率的影響Fig. 5 Effect of different treatments on itrogen fertilizer use efficiency of Malus hupehensis Rehd. seedlings
3 討論
生物因素是引起蘋果連作障礙的主要因素[3,17-18]。本試驗的結果表明,溴甲烷滅菌和高溫滅菌顯著提高了連作蘋果幼苗的生物量。土壤消毒處理克服了連作障礙的問題,進一步表明有害微生物是引起蘋果連作障礙的主要原因,這與Yim等[12]研究結果一致。越來越多的研究表明有害真菌如Phytophthora、Pythium、Cylindrocarpon、Fusarium和Rhizoctonia的增加是引起蘋果連作障礙的重要因素[3,18-20]。Franke-Whittle等[21]采用高通量測序方法表明Acremonium、Cylindrocarpon和Fusarium的含量與蘋果植株生長呈明顯的負相關。病原真菌積累能顯著降低農作物產量,增加病蟲害[22]。土壤微生物對土壤質量有很大的影響,細菌型土壤是土壤肥力提高的生物學標志之一,真菌型土壤是地力衰退的標志[23]。試驗表明,蘋果連作顯著增加了土壤中真菌的數量,并隨著連作時間的延長,土壤真菌數量越多。蘋果連作導致土壤由“細菌型”土壤向“真菌型”土壤轉變[24]。
根系作為植物吸收水分和養分的主要器官,可以通過其形態和分布來適應外部環境的脅迫[25]。Bauerle等[26]研究表明,根系的快速生長與發達分生能力能夠抵御土壤中病原體。本試驗結果表明,蘋果連作顯著抑制了根系的生長,導致根長、根面積、根尖數顯著低于正常水平。根系的生長狀況是影響果樹氮素吸收的關鍵因素。連作不僅抑制蘋果根系生長,還影響根系功能。連作會導致蘋果根系自由基大量產生,破壞了抗氧化酶系統和自由基之間的平衡[10,27],過量的ROS會引起質膜氧化損傷,破壞線粒體膜的完整性[27]。連作顯著降低了平邑甜茶的根系活力,降低了根系呼吸能力。ATPase是細胞質膜重要的酶,H+-ATPase通過細胞膜運輸系統進行跨膜運輸增加質子電化學梯度進而提高植物養分的吸收,連作脅迫顯著降低了質膜H+-ATPase酶的活性,減少了根系功能所需要的能量,進而影響了膜的功能,降低了根系對營養元素的吸收和運輸。
根系吸收的氮素在樹體生長過程中起著重要的作用。隨著氣溫的增加和幼苗的快速生長,幼苗對15N的Ndff也不斷增加。然而,連作抑制了對15N的征調能力,降低各組織器官的Ndff,影響了不同器官的Ndff的含量。生長初期,連作條件下15N對莖的貢獻率最高,葉最低。生長快速期,15N對根系貢獻率最高,莖最少。說明更多的氮貢獻于根系,減少了植株地上組織生長的供應。這與阮維斌等[7]研究結果一致。同時,連作還影響15N在不同組織器官的分配。試驗結果表明根系中的15N分配越來越高,地上部分15N越來越少,并且隨時間的延長,根系對15N分配率有增長的趨勢。連作引起蘋果根系消耗更多的養分,這與Atucha等[28]研究結果一致。蘋果對氮肥利用率較低,一般為25%~35%[29]。本試驗表明,在8月和9月,連作條件下蘋果幼苗的氮肥利用率分別為10.95%和13.33%,顯著低于正常水平,連作顯著抑制了根系對氮肥利用率。
4 結論
連作抑制了平邑甜茶幼苗根系生長和根系功能,降低了對氮肥的吸收,導致根系過多的消耗營養元素,減少了對地上部分的供應,進而影響植株的生長。因此,在防控蘋果連作障礙的措施中,應注重選擇抗性和分生能力強的根系,加強根系防護,地上部分增加葉面施肥,緩解連作引起的地上部營養元素供應不足。

