食品中耐藥細菌風險評估的研究進展
姜竹茂,艾春梅,,王曄茹,董慶利,劉東紅,丁 甜,*
(1.煙臺大學生命科學學院,山東 煙臺 264005;2.浙江大學生物系統工程與食品科學學院,浙江 杭州 310058;3.國家食品安全風險評估中心,北京 100022;4.上海理工大學醫療器械與食品學院,上海 200093)
抗生素的使用是現代醫療衛生的基礎之一,可以有效抑制細菌的增長或者殺死細菌,被廣泛應用于人類疾病治療及農業、畜牧業、水產養殖等領域,但由于抗生素的不合理使用,現已產生嚴重的抗生素耐藥性問題[1]。2014年世界衛生組織發布了全球耐藥性報告——《抗菌素耐藥:全球監測報告》,該報告首次審視了全球抗生素耐藥情況,提出當抗生素藥物治療被感染人群不再有效時,即為抗生素耐藥。2016年9月聯合國193 個成員國簽署了一份歷史性宣言,承諾合作掃除“超級病菌”對人類健康的威脅,這份宣言一旦落實,每年可以避免70萬 人死亡[2]。所謂的“超級細菌”是指那些對多種抗生素具有耐藥性的細菌,即多重耐藥細菌[3]。有專家稱這種“超級細菌”對抗生素有強大的抵抗作用,能避免被滅活[4]。
經研究,細菌先天具有耐藥性和染色體突變性,可以通過多種機制(質粒、轉座子、整合子、基因盒等)來獲得并傳播耐藥基因[5]。當使用抗生素時,由于細胞膜通透性改變、靶標位點突變及鈍化酶等原因而產生耐藥細菌,并通過水平基因轉移(horizontal gene transfer,HGT)機制傳播耐藥細菌和耐藥基因(圖1)[6-8]。食物鏈是一個眾多細菌共存的生態系統,長期在抗生素選擇壓力下,食品在整個食物鏈過程中會發生耐藥細菌污染或耐藥基因的轉移,如動物源耐藥細菌可通過動物的排泄物、環境、空氣及水等途徑,或者在食品加工過程產生的交叉污染等,將耐藥細菌或耐藥基因傳遞給人類,使人類產生人源性耐藥細菌[9]。
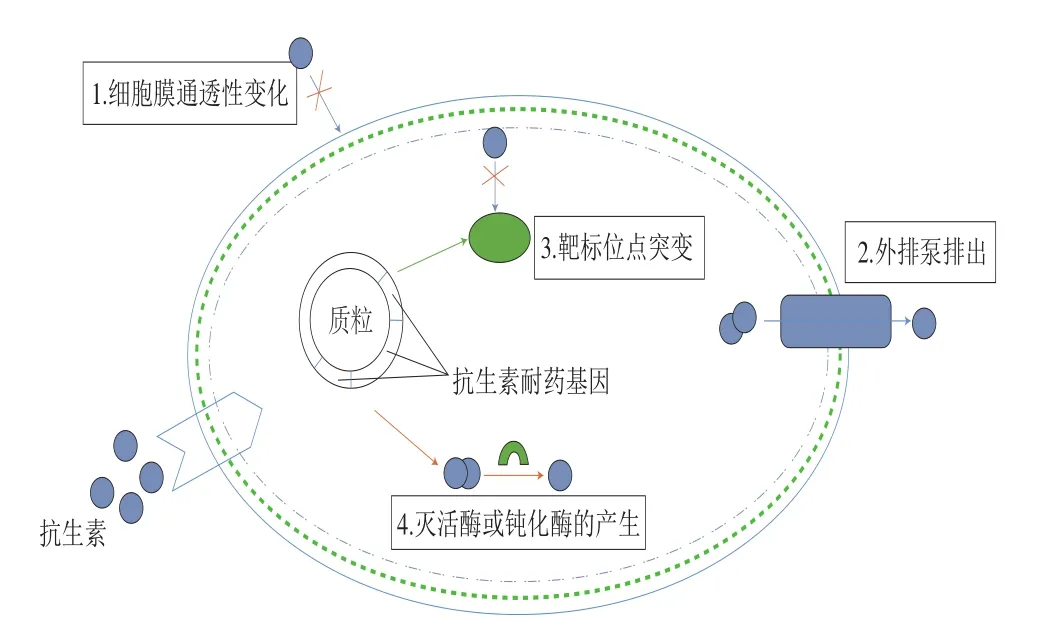
圖 1 細菌主要耐藥機制[7]Fig. 1 Mechanisms of antimicrobial resistance in bacteria[7]
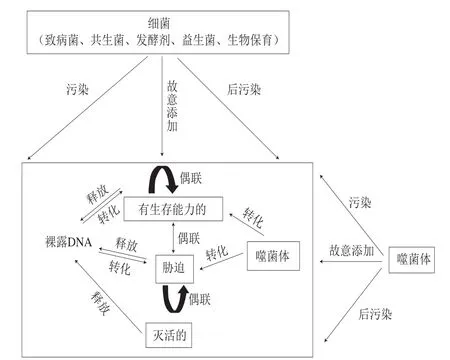
圖 2 食品中的HGT機制[16]Fig. 2 Horizontal gene transfer mechanism in foods[16]
如圖2所示,HGT是不同物種之間通過水平轉移方式進行遺傳物質的傳遞。通過不斷改造和進化[10],提升物種的適應能力,這是生物進化的重要驅動之一[11]。HGT在細菌間的作用機制主要有偶聯、轉化和轉導3 種,這種作用機制可能發生在土壤、水、食物以及人類和動物的消化系統中[12]。有專家提出若HGT和細菌耐藥機制相結合,會大大增強耐藥基因的表達、維持細菌種群以及多重耐藥性的產生[13-15]。
近年來,針對耐藥細菌的傳播及耐藥基因的轉移研究較多,結果都顯示其對人類健康可造成潛在危害。Fang Hua等[17]采用宏基因組學分析方法,探討了耐藥基因(antibiotic resistance genes,ARGs)、人類致病菌(human pathogenic bacteria,HPB)和抗生素耐藥HPB(antibiotic resistant HPB,ARHPB)從養豬場向周圍河流及農業土壤環境的傳播情況,結果發現動物飼養場周圍的河流沉積物、河水以及土壤中都存在有耐藥基因、HPB及ARHPB。在216 株耐藥細菌分離株中有54.4%是潛在的ARHPB,并有4 株多重耐藥基因-HPB分離株。因此,HGT機制已被確定為耐藥基因傳播的主要途徑之一,由于耐藥基因可通過HGT轉移,動物體內微生物組中的耐藥基因向人類體內轉移的情況時常發生。Apata等[18]提出HGT和垂直基因轉移這兩種類型機制的共同作用使得耐藥細菌的數量和傳播風險大幅增加[19]。
因此,開展食品中耐藥細菌風險評估、權衡風險和利益、科學管理和使用抗生素,可以有效地保障食品安全和人類健康[4]。在耐藥細菌風險評估領域,瑞士和丹麥等歐洲國家一直走在前列。早在2004年,Claycamp等[20]基于傳統微生物風險評估理論探討了耐藥細菌的風險評估方法,運用危害識別、釋放評估、暴露評估、劑量-反應關系評估、風險評估5 個步驟,描述了食品生產鏈中耐藥細菌對人類健康造成的不良后果。同時,該報告指出,與傳統微生物風險評估方法相比,由于耐藥細菌風險評估中存在數據缺乏和模型不確定性等問題,將來對可靠模型創建和監測的數據需求依舊保持不變。本文根據食用動物產品生產中抗生素耐藥細菌風險評估的組成部分及路徑(圖3)[21],綜述了食品中耐藥細菌風險評估的最新研究進展及其預防控制措施,以期為未來耐藥細菌風險評估研究提供理論依據。
1 危害識別
由圖3可知,危害識別的目的是識別可能導致人類疾病的耐藥細菌或耐藥基因。在《食用動物中使用抗菌獸藥產品對公眾健康造成耐藥性風險評估指南》中指出,在整個危害識別過程中,需要考慮的幾個因素是:1)物質特定信息(抗菌類別、作用機制等);2)識別治療目標物種中對人類健康造成影響的耐藥細菌;3)產生細菌耐藥性的決定因素和機制;4)交叉阻力因素;5)影響人類健康細菌的敏感性數據分析(最低抑菌濃度)。
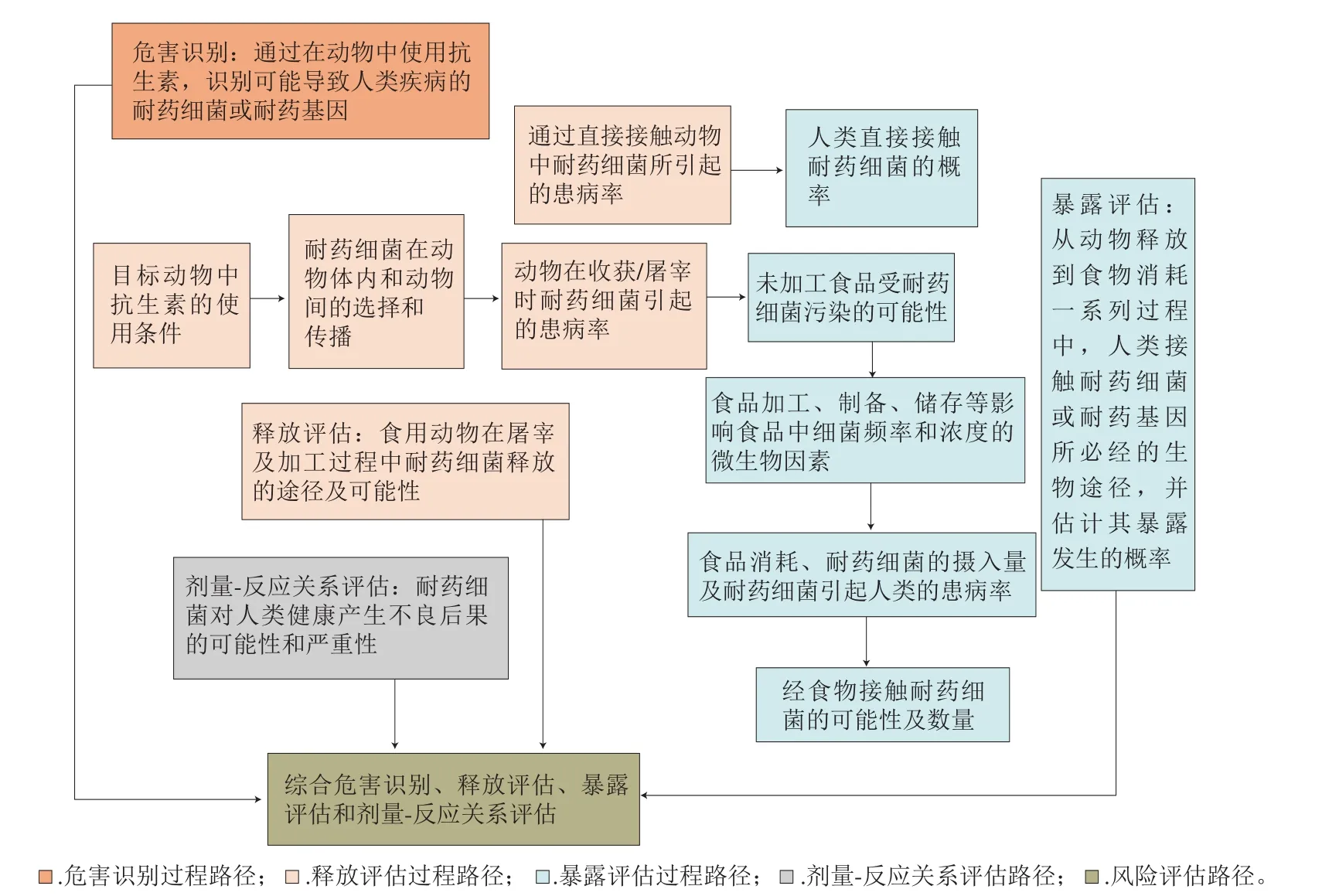
圖 3 食用動物生產中抗生素耐藥性風險評估的組成部分及路徑[21]Fig. 3 Components and pathways for risk assessment of antibiotic resistance in food animal production[21]
Alban等[22]在危害識別中發現丹麥病豬使用截短側耳素會產生可向人類轉移的腸球菌和耐甲氧西林金黃色葡萄球菌CC398(MRSA CC398),這兩種耐藥細菌可能是由轉座子和質粒所介導的染色體或可動遺傳因子經HGT機制在不同菌種之間傳播。然而,在許多分析中由于數據缺乏以及缺少對耐藥機制的監測分析,很多耐藥細菌在危害識別中未被考慮在內。
然而,與傳統的微生物風險評估相比,在危害識別階段很難準確估計耐藥細菌對人類健康的影響程度,只有當抗生素對患者治療不再有效時才能準確估計。在水產養殖、牲畜飼養、作物栽培及食品生產等整個食物鏈中,耐藥細菌/耐藥基因都可能會通過包括抗生素、抗病毒藥物、殺真菌劑等壓力選擇,最終利用HGT機制進入人或動物體內[23-25];其也有可能是人類或動物暴露于消毒劑或生物殺滅劑中,從而導致耐藥細菌的出現[26-27]。因此,在這一系列復雜的過程中,人類可通過直接接觸或者間接接觸的方式使耐藥細菌轉移并蓄積于人體內。由此可見,對抗生素的監測及耐藥細菌患病率的估計是非常重要的。趙勇等[28]總結了食源性致病菌主要的耐藥機制;Florez-Cuadrado等[9]介紹了耐藥細菌的選擇和傳播方法;Founou等[29]總結了發達國家和發展中國家從食用動物和產品中分離的耐藥細菌引起的人類患病率。這些研究為耐藥細菌的風險識別提供了理論依據。
2 釋放評估
釋放評估描述了在目標物種中使用抗生素后向特定環境釋放耐藥細菌或耐藥基因所必經的生物途徑,并定性或定量評估全過程發生的概率,包括目標物種在屠宰、加工以及處理人員對物種的直接接觸等一系列過程中釋放耐藥細菌的可能性(圖3)。Singer等[30]描述了由于使用抗生素治療泌乳奶牛的臨床乳腺炎,產生耐藥細菌并在操作過程中釋放的可能性。運用定量方法在每個節點采用蒙特卡羅(Monte Carlo)模型模擬:第1節點估計患有臨床乳腺炎的哺乳期奶牛接受抗菌治療的病例數,根據其病例情況將患病奶牛分為輕度、中度和重度[31],中度至重度臨床乳腺炎的奶牛給予拭藥(intramammary,IMM)和注射用藥治療,估計用IMM治療病例數占90.25%,利用IMM和注射用藥治療病例數占93.25%;第2節點估計抗生素使用后耐藥細菌出現的可能性,包括奶牛中每種細菌病原體引起的患病率、每種病原體對每種抗生素的敏感性以及在使用抗生素后每種病原體中耐藥細菌產生的可能性;第3節點估計被送往屠宰的奶牛中所攜帶的耐藥細菌離開農場的可能性。
Alban等[22]在釋放評估中運用定性評估對丹麥豬群進行了調查,結果顯示腸球菌在豬腸道微生物群中較多,且環境中也無處不在,因此推測豬體內可能會存在腸球菌。經調查,2015年發現丹麥豬因糞腸球菌患病的概率為24.7%;對水貂養殖場研究發現在39 株MRSA CC398菌株中,79.5%的菌株對泰妙菌素有耐藥性;經丹麥當地搜集的數據發現,MRSA CC398分離株通常對四環素(100%)和克林霉素(87%)具有抗性,對紅霉素具有高水平的抗性(43%)。因此,評估丹麥豬群中MRSA CC398釋放的總體概率高(中度不確定性),而腸球菌釋放的總體概率低(高度不確定性)。
因此,在釋放評估中需要考慮的因素可能有:1)目標物種的品種、生產飼養形式和疾病跡象,以及動物與飼養場間及周圍(植物產品和水產養殖)耐藥細菌傳播的可能性;2)抗生素的使用劑量和使用期限等,以及給藥途徑過程中可能與其他抗生素的協同/交叉耐藥性;3)耐藥基因在目標物體內和體外發生HGT的頻率;4)抗生素在建議條件下使用時,目標物種中的食源性致病細菌及耐藥細菌的致死情況;5)在目標動物群體中人畜共患病菌的攜帶率和產生耐藥細菌的概率等;6)目標物種在屠宰加工過程中人為地直接或間接接觸導致耐藥細菌傳播和轉移的可能性等。過去研究人員試圖量化抗生素治療食用動物耐藥細菌釋放的可能性,其風險管理可能會提高釋放評估的便利性[32]。
3 暴露評估
暴露評估描述了人類暴露于耐藥細菌,或在動物中使用某種抗生素釋放耐藥細菌或耐藥基因所必經的生物途徑,并用定性或定量法估計其暴露發生的概率(圖3)。人類可直接或間接接觸沿食物鏈傳播的耐藥細菌。直接接觸是人類直接接觸動物和生物物質(如血液、尿液、糞便、牛奶、唾液和精液)之后,耐藥細菌在宿主之間迅速傳播(圖4),相關職業人員如獸醫、農民、屠宰工人和食品加工人員以及與他們直接接觸的人都可能被耐藥細菌直接感染,并且感染的可能性會更高[33-34]。另外,人類可能通過接觸或食用受污染的食品(例如肉、蛋、奶和乳制品)而間接接觸到耐藥細菌和耐藥基因。通過食物鏈間接接觸傳播是一種影響深遠且更復雜的途徑,因為在整個食物鏈中無論是在肉類、蔬菜還是糧食生產的不同階段,耐藥細菌或耐藥基因都會在牧場、環境及人類之間傳播[35-37]。
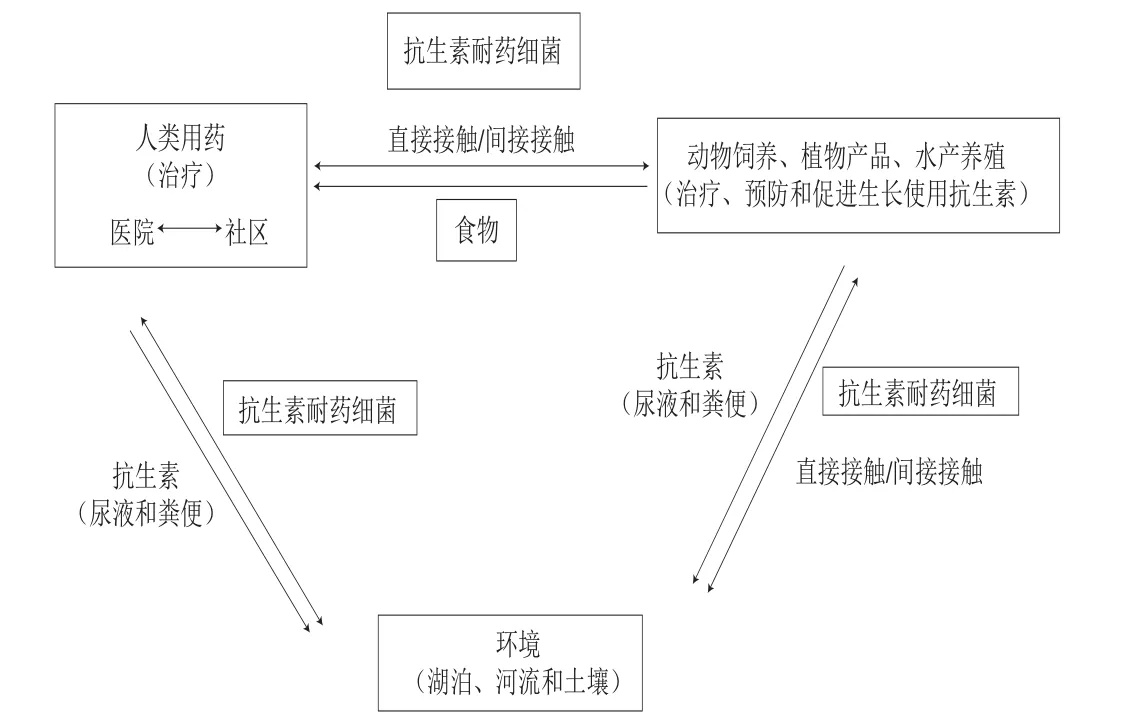
圖 4 食物鏈中耐藥細菌的不同傳播途徑[16]Fig. 4 Different routes of transmission of drug-resistant bacteria in food chains[16]
在暴露評估階段,Singer等[30]采用定量事件樹模型中的3 個節點,利用蒙特卡羅模型模擬評估人類通過屠宰奶牛以及食用受污染牛肉而暴露于耐藥細菌的可能性:首先,評估使用抗生素的奶牛在屠宰前產生耐藥細菌(沙門氏菌、大腸桿菌和彎曲桿菌)的可能性;其次,對使用抗生素治療后攜有耐藥細菌的奶牛屠宰數量進行估計;最后,估量經不同加工切割方式銷售的牛肉產品引起人類受食源性耐藥細菌污染的可能性。
Alban等[22]在此階段定性分析了人類通過肉類接觸到MRSA CC398和腸球菌的可能性,比如職業人員與牲畜直接接觸或通過環境、土壤、人等間接接觸等。獸醫、豬運輸者和與活體動物接觸的屠宰場工作人員與耐藥細菌接觸的可能性更高[38]。2014年,丹麥人口為570萬,雇用的勞動力有270萬,因此估計其中有11 000~15 000 人是MRSA CC398的攜帶者,約占工作人口的0.4%~0.5%和總人口的0.2%~0.3%,而通過與環境、土壤或作物間接接觸污染的概率被評估為低或未知;對于腸球菌,通過食源性途徑傳播的重要性是未知的,屬于高不確定性[22]。
類似地,在暴露評估中需要考慮:1)人類對食物的消費及消耗方式;2)食用受細菌污染食物的情況;3)抗生素耐藥細菌的流行情況;4)人類通過直接或間接接觸動物而獲得耐藥細菌的情況。因此,在暴露評估中人為的驅動可能是暴露途徑的開始,除了釋放評估中的監管風險管理,在食品的生產加工過程中相關數據的搜集也很重要;也可在其中尋找耐藥細菌釋放的途徑,并揭示人類耐藥細菌的來源,如食物制備過程中耐藥細菌的傳播等;另外,公共衛生檢查和數據監測也可用于更新風險評估模型的暴露評估部分,這都為風險評估建模提供了便利性。
4 劑量-反應關系評估
要正確表征抗生素耐藥細菌的致病風險,典型的方法是選擇有劑量-反應健康數據(無論是確定或推測)的危害因素。劑量-反應評估包括被攝入的病原體(劑量)和發生不良后果的可能性之間的關系[39]。也就是說在不同的暴露水平下會有不同的患病結果[40]。一般的耐藥性劑量-反應關系研究方法是建立QMRA模型。如Claycamp等[20]提到平均感染劑量,并表明在動物或人類臨床研究或人類流行病學中獲得的劑量-反應關系是定量風險評估的基礎,用于評估暴露人群感染耐藥細菌的后果及其風險。在定量評估中除了利用QMRA模型之外,早期是根據生態學或病例對照流行病學方法(比率法)實現的。Anderson等[32]的研究中運用生態學方法來構建風險評估的概率模型,對動物中耐氟喹諾酮的空腸彎曲菌進行風險評估。
5 風險評估
風險評估綜合評估了人類暴露于危險中的潛在后果(不良健康影響)以及后果發生的嚴重性和可能性(圖3)。它涉及到特定情況下暴露的耐藥細菌或耐藥基因與這些暴露后果之間的關系,及其可能導致的社會經濟后果。風險評估綜合了釋放評估、暴露評估、劑量-反應關系評估的結果,以全面描述相關風險及其伴隨的不確定性;在此過程中,對任何可能影響最終風險評估的假設和不確定性,或者可能存在的后果,都應予以評估[16],如:1)每年由耐藥細菌感染人類的病例數(未報告的病例數);2)感染疾病的嚴重程度,包括死亡、并發癥的產生、患病時間和住院時間(額外治療)等;3)耐藥細菌與敏感生物的毒性比較;4)抗菌藥物治療的費用;5)亞種人群的易感性等。
在Alban等[22]的研究中,2015年丹麥由MRSA CC398引起的臨床感染患者因產生更多的并發癥,出現住院時間延長、花費增加等現象,估計重度患者每人平均花費高達27 000 歐元。其次,截短側耳素的大量使用會引起公共衛生負擔和患病人數增加等問題,研究結果顯示:人體攜帶MRSA CC398和尿路感染腸球菌(腸球菌菌株)的情況是相當常見的,而MRSA CC398的嚴重感染很少發生,腸球菌的嚴重感染主要與住院時間延長有關。截短側耳素在丹麥不用于人類,供人類使用的利奈唑胺僅在特定的醫院環境和選定的患者組中使用。因此,MRSA CC398的后果評估中,被評估為正常群體的概率非常低,但被評估為弱勢群體的概率較高。
Singer等[30]使用定量風險評估方法估計了由牛肉中所攜帶的耐藥細菌引起人類疾病的病例數,同時評估因食用IMM和拭藥治療的不同治療方法的牛肉產品引起人類感染耐藥細菌的病例數。結果顯示:經頭孢噻呋注射治療牛乳腺炎疾病,由于耐藥細菌的產生,人類平均每年因感染沙門氏菌持續出現癥狀的概率是1/25 369百萬,因感染大腸桿菌持續出現癥狀的概率是1/918 236百萬;經頭孢噻呋注射治療和IMM相結合治療牛乳腺炎疾病,由于耐藥細菌的產生,人類平均每年因感染沙門氏菌持續出現癥狀的概率是1/6 698百萬,因感染大腸桿菌持續出現癥狀的概率是1/243 227百萬;經頭氧四環素藥物注射治療,由于耐藥細菌的產生,人類平均每年因感染彎曲桿菌持續出現癥狀的概率是1/225 903百萬,因感染沙門氏菌持續出現癥狀的概率是1/26 908百萬,因感染大腸桿菌持續出現癥狀的概率是1/14 567 063百萬。
6 發展現狀及前景
近幾年,國內外對食物鏈中耐藥細菌風險評估的研究甚少,但有一些關于耐藥細菌風險評估分析及總結性文章。如Nicholas等[41]提到耐藥細菌的風險評估因數據有限,可以從其他路徑和可能的實驗方法來填補其數據空白,包括:食物鏈農場環境階段最小選擇濃度的確定、劑量-反應數據的確定、篩選新的耐藥決定因子、基于暴露評估模型建立風險排序方法等,都可為食物鏈中抗生素耐藥細菌的風險評估提供指導。Stella等[42]提出,根據“一體健康”方針,歐洲食品安全管理局、歐洲疾病控制中心和歐洲藥品管理局等其他歐盟機構應密切合作,提供科學指導和技術咨詢,收集和分析人類和動物中耐藥細菌監測數據并聯合評估,同時歐洲食品安全管理局還應就食品安全議題進行風險交流,使整個食物鏈中的所有相關部門都參與進來,制定以科學為基礎的戰略來減少抗生素耐藥細菌對人類健康造成的危害。
6.1 風險等級排序
在可用于控制公共衛生危害資源有限的背景下,鑒于耐藥細菌的復雜性和廣泛性,將確定的動物物種、細菌種類和/或抗生素抗菌類別等應用于未來風險管理活動至關重要。Colliineau等[43]利用瑞士耐藥細菌監測計劃的數據,將208 種動物/細菌/抗菌類別組合確定為相關危害,使用多標準決策分析開發并組合暴露評估和危害特征評分,通過敏感性分析探索改變分數權重。由于烹飪方式不同,暴露在家庭路徑交叉污染評分的不確定性可能會對最終的風險排名產生較大影響,因此對模型的完善也帶來巨大的挑戰,但也為未來風險管理的優先排序提供了依據。
6.2 抗生素耐藥細菌風險評估的不確定性因素
在耐藥細菌風險評估中有許多數據和模型不確定性的實例。例如,多重耐藥性的途徑和耐藥細菌在許多間接途徑暴露和釋放通常被認為是導致與抗生素耐藥細菌風險評估相關的不確定性原因。此外,在動物或人類腸道內的耐藥基因轉移的數量和性質在很大程度上也是未知的。如果一種耐藥細菌菌株能夠在很長一段時間內在人體宿主內存活,并持續存在腸道內,那么這種耐藥感染可能會隨著時間的推移而逐漸轉移。在這種情況下,對于人類健康風險評估潛在的危害分析將不夠全面。因此,可靠的風險管理以及關于暴露、后果和不良健康結果信息的搜集可以減少風險評估中的不確定性。
6.3 食品中細菌的抗生素耐藥性
在食品中除了從農場到餐桌過程中耐藥細菌和耐藥基因的交叉污染,耐藥共生菌的產生也引起了廣泛關注。Alban等[22]提到在某些食品生產過程中故意添加含有耐藥基因的微生物(如發酵劑、益生菌和噬菌體等),而一些益生菌具有黏附于人類胃腸道上皮細胞的能力,大量攝入后,其可以長期在胃腸道中寄生,從而增加了耐藥基因轉移的風險。Papadopoulos等[44]評估耐甲氧西林金黃色葡萄球菌在乳制品生產鏈中的流行情況,在367 份檢測樣本(36 份散裝牛奶、19 份乳制品、72 個人、185 只動物、55 個設備)中,212 份(57.8%)金黃色葡萄球菌呈陽性,幾乎所有的分離株(99.6%)對至少一種抗生素有耐藥性,13.3%的分離株對3 種或3 種以上的抗生素具有耐藥性。在Srujana等[45]的研究中發現,從瓦朗格爾不同社區采集的所有生奶和巴氏殺菌奶樣本中都含有耐藥細菌,在所有樣品中均發現大量氨芐西林和紅霉素耐藥細菌,較少的產品中發現呋喃唑胺和卡那霉素耐藥細菌,未檢測到氯霉素、慶大霉素、納地西酸和新霉素耐藥細菌。
6.4 從農場到餐桌耐藥細菌的預防和控制措施
在發展中國家,食物鏈中耐藥細菌的傳播和轉移問題更加嚴重,耐藥細菌感染導致人類的發病率和死亡率顯著增加,治療成本也明顯增加[46]。世界衛生組織全球行動計劃的5 項戰略目標提出:1)提高對抗生素耐藥性的理解和認識;2)通過監測和研究強化知識;3)減少傳染病;4)優化合理使用抗生素;5)可持續投資和開發新藥[47]。即在風險評估中不斷減少不確定因素,提高評估過程中的準確性,降低耐藥細菌的產生概率,減少患病率。
7 結 語
當前食物鏈中的耐藥細菌是一項全球公共衛生挑戰,對人類健康、社會經濟有著重要影響。因此,為了降低風險、加強監管措施,從定量風險評估入手是每個國家長期以來應采取的措施。有大量的研究認為應從食品加工過程入手來減少耐藥細菌的產生以及耐藥基因的轉移。也有不少研究表明,從農場到餐桌的動植物制品只要經良好加工處理,人們食用時其中的耐藥細菌已大量死亡,即通過遵守良好農業規范即可實現對初級植物和動物食品中細菌污染的限制。
其次,存在于共生細菌中的耐藥基因可以在食品加工期間或人類攝入后轉移到人源致病菌中。因此,不僅應監測源自食品生產動物以及食品中共生細菌耐藥基因的存在,還要研究遺傳因子,從而更好地了解它們的流行病學,以便實施最終措施來減少共生細菌在食物中的存在。
食品加工和保鮮技術對細菌的影響是可變的,但一般來說,應用這些技術處理食品后,食品上的細菌數量會減少。如熱處理技術可以有效降低耐藥基因轉移至食物和/或人體消化系統。
對于耐藥細菌風險評估,更直接的需要是描述食物途徑中抗生素耐藥細菌對人類健康造成的不良后果。根據公共衛生監測的大數據以及建立風險評估模型,來減輕耐藥細菌對人類帶來的潛在危害。

