HPLC法測定依達拉奉注射液中的有關物質
王連慧,李俊廣,宋良偉,張娜
(1.山東大學藥學院,山東 濟南 250100;2.山東羅欣藥業集團股份有限公司,山東 臨沂 276017)
依達拉奉注射液是由日本三菱制藥公司開發并于2001年4月獲日本厚生省批準上市,規格為20 mL:30 mg,商品名為Radicut[1],具有清除自由基和抑制脂質過氧化的作用,2003年進入中國,目前已有多家國產依達拉奉注射液上市。注射液有關物質檢查是非常重要的一項質量控制指標,基于雜質譜進行本品有關物質研究目前尚無文獻報道,本文結合本品所用原料藥的雜質概況、制劑處方工藝、降解途徑研究結果和相關文獻資料對本品的雜質譜進行全面分析(見表1),在雜質分析的基礎上,采用相應的雜質對照品對雜質分析方法進行系統的方法學驗證,證明了所用的有關物質檢測方法確實能有效地分離檢出依達拉奉注射液中可能存在的雜質。
1 儀器與試藥
1.1 儀器 XS105電子天平(梅特勒);島津LC-20AT高效液相色譜儀(配置二極管陣列、紫外檢測器)。
1.2 試藥 依達拉奉注射液(山東羅欣藥業集團股份有限公司,批號∶170301、170302、170303,規格20 mL:30 mg);依達拉奉注射液(日本田邊三菱制藥株式會社,A073);依達拉奉對照品(中國食品藥品檢定研究院);二聚體(深圳斯坦德);三聚體(深圳斯坦德);雜質P1(中國食品藥品檢定研究院)、雜質P3(深圳斯坦德);雜質1、雜質2均為自制;甲醇(色譜純,禹王集團);磷酸二氫鉀、磷酸、三乙胺(國藥集團)均為分析純試劑;水為純化水。

表1 依達拉奉雜質譜[2-3]
2 方法與結果
2.1 方法


表2 液相梯度洗脫表
2.1.2 溶液配制 取本品適量,加溶劑[0.05 mol·L-1磷酸二氫鉀溶液(用磷酸調pH值至3.5)-甲醇(50∶50)]稀釋制成每1 mL中約含依達拉奉0.5 mg的溶液,作為供試品溶液;精密量取供試品溶液適量,用溶劑稀釋制成每1 mL中約含依達拉奉0.5 μg的溶液,搖勻,作為對照溶液。
2.2 結果
2.2.1 專屬性
2.2.1.1 空白干擾試驗 精密量取空白溶劑、空白輔料溶液和供試品溶液各20 μL,分別注入液相色譜儀,記錄色譜圖,空白溶劑及空白輔料對本品有關物質檢查無干擾,各雜質峰與其他峰分離度均大于2.0,能完全分離。
2.2.1.2 強降解試驗 取依達拉奉注射液在各苛刻試驗條件(酸、堿、氧化、高溫、光照)下進行破壞、降解,同時做空白輔料作為對照,按照本方法分別進行測定,結果見表3。
試驗結果表明,本品在氧化條件下雜質個數及雜質含量增加明顯,說明本品在氧化條件下有明顯的降解,其他破壞條件下均較穩定;本方法輔料均無干擾,對各雜質分離良好,對測定無干擾,專屬性符合要求,各個破壞條件下峰純度符合要求,適于本品的有關物質檢查。
2.2.2 檢測限與定量限 精密稱取依達拉奉與各雜質對照品適量,分別加甲醇溶解并稀釋至信噪比約為10∶1,作為定量限溶液,連續進樣6針,精密度良好;分別精密量取各定量限溶液3 mL,置10 mL量瓶中,加溶劑稀釋至刻度,信噪比約為3∶1作為檢測限溶液,分別精密量取各20 μL,注入液相色譜儀,記錄色譜圖,結果見表4。

表4 檢測限與定量限試驗結果
2.2.3 線性關系、校正因子的考察 精密稱取依達拉奉和各雜質對照品適量,加甲醇溶解并用稀釋劑制成一系列濃度的溶液,分別精密量取上述溶液各20 μL,注入液相色譜儀,測定峰面積。以濃度為橫坐標,以峰面積為縱坐標進行線性回歸,結果見表5。
結果表明:主成分與各雜質在一定的范圍內,其濃度與峰面積成良好的線性關系,相關系數均大于0.999。雜質P1、雜質P3響應值與依達拉奉差異較大,對雜質P1和雜質P3的控制采用外標法。其他雜質校正因子均在0.9~1.1之間,采用不加校正因子的自身對照法測定其含量。
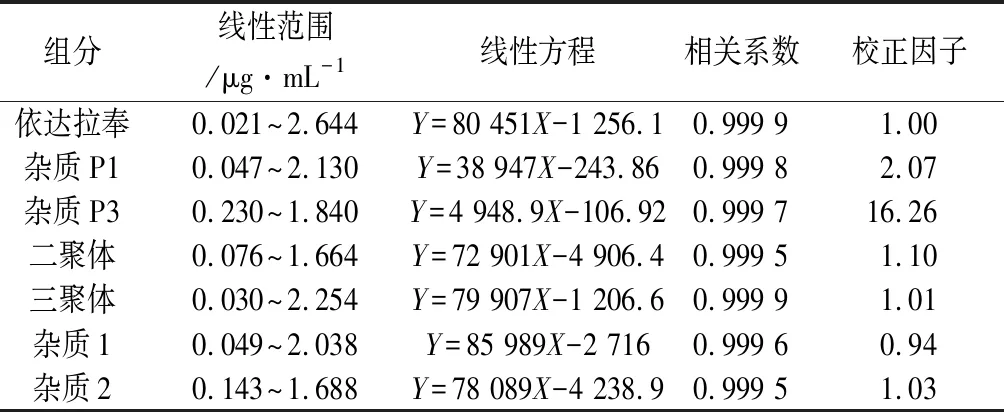
表5 線性試驗結果
2.2.4 進樣精密度試驗 取依達拉奉及各雜質線性關系試驗項下的中間濃度溶液,作為供試品溶液。精密量取20 μL,注入液相色譜儀,連續進樣6次,記錄色譜圖,計算6次峰面積的RSD,結果見表6。

表6 精密度試驗結果
結果表明主成分與各雜質RSD均小于2.0%,精密度符合要求,本法進樣精密度良好。
2.2.5 重復性試驗 取本品,按照“2.1”項下的方法測定,重復本試驗6次,雜質P1、 P3按外標法以峰面積計算,其他雜質采用不加校正因子的自身對照法計算,試驗結果見表7。

表7 重復性試驗結果
由以上數據可得,重復本試驗6次,所檢出雜質個數一致及雜質含量基本一致,即本法重復性良好。
2.2.6 中間精密度試驗 由不同人員在不同時間、不同儀器,分別進行重復性試驗,雜質P1、 P3按外標法以峰面積計算,其他雜質采用不加校正因子的自身對照法計算,由不同人員在不同時間、不同儀器進行檢驗,雜質個數一致,雜質含量基本一致,本法中間精密度良好。
2.2.7 溶液穩定性 取依達拉奉注射液適量,用溶劑稀釋制成每1 mL中約含0.5 mg的溶液,搖勻,作為供試品溶液;供試品溶液室溫下(約25 ℃)放置,于0、2、4、6、8、10、12 h時,精密量取20 μL,分別注入液相色譜儀,記錄色譜圖。按面積歸一化法計算,試驗結果表明,本品室溫放置12 h各雜質個數沒有變化,雜質含量變化均小于0.02%,穩定性良好。
2.2.8 準確度 分別精密稱取依達拉奉各雜質對照品各約5 mg,置同一100 mL量瓶內,加甲醇稀釋至刻度,搖勻,作為混合雜質對照品貯備液,精密量取混合雜質對照品貯備液1.6 mL(80%)、2.0 mL(100%)、2.4 mL(120%)各3份,分別置9個20 mL量瓶內,精密量取注射液5 mL,分別置上述量瓶中,用溶劑稀釋至刻度,搖勻,作為加樣供試品溶液,精密量取混合雜質對照品貯備液2 mL置20 mL量瓶中,加溶劑稀釋至刻度,搖勻,作為混合雜質對照品溶液;精密量取注射液5 mL,置20 mL量瓶中,用溶劑稀釋至刻度,搖勻,作為供試品溶液,分別精密量取混合雜質對照品溶液、供試品溶液、加樣供試品溶液各20 μL注入液相色譜儀,記錄色譜圖。按外標法以峰面積計算各雜質的回收率,結果見表8。

表8 準確度試驗結果
試驗結果表明:各雜質平均回收率均在90%以上,RSD均小于10%,表明本法的準確度可靠。
2.2.9 耐用性試驗 為考察本方法對條件發生微小變化的耐受程度,采用不同廠家儀器、不同品牌色譜柱、不同柱溫(30±5)℃、不同流速(1.0±0.1)mL·min-1、不同波長(243±2)nm、不同pH(7.0±0.2)等因素對方法的耐用性進行考察,分別精密量取供試品溶液、混合溶液20 μL,注入液相色譜儀,記錄色譜圖。試驗結果表明各雜質峰與其他成分峰均達到基線分離;雜質檢出個數和總量基本一致,本方法耐用性良好。
2.2.10 樣品測定及結果 分別取本品3批及原研制劑1批,加溶劑稀釋制成每1 mL中約含0.5 mg的溶液,作為供試品溶液;精密量取供試品溶液適量,用溶劑稀釋制成每1 mL中約含0.5 μg的溶液,搖勻,作為對照溶液。另取雜質P1和雜質P3對照品各適量,分別加少量甲醇溶解后,用溶劑稀釋制成每1 mL中含P1約2 μg、P3約1 μg的溶液,作為對照品溶液。照上述確定的色譜條件進行測定,結果見表9。

表9 樣品測定結果
3 討論
3.1 檢測方法的選擇 已有文獻報道[4-8]采用HPLC法測定依達拉奉有關物質,但沒有針對雜質譜進行依達拉奉注射液有關物質的研究,本文針結合本品所用原料藥的雜質概況、制劑處方工藝、降解途徑研究結果和相關文獻資料對本品的雜質譜進行全面分析,在雜質譜分析的基礎上,采用相應的雜質對照品對雜質分析方法進行系統的方法學驗證,證明了所用的有關物質檢測方法確實能有效地分離檢出依達拉奉注射液中可能存在的雜質。
3.2 與原研制劑雜質譜的比較 采用經過驗證的有關物質檢查方法對自制制劑和原研制劑進行雜質譜比較,由表9試驗結果表明自制制劑的雜質個數少于原研制劑,雜質含量與原研制劑基本一致,說明自制制劑有關物質控制水平與原研制劑相當。

