血清幽門螺桿菌抗體聯合胃蛋白酶原檢測與 OLGA/OLGIM胃炎評價標準在胃癌前病變 風險評估中的相關性研究*
王霄騰 呂 賓 冀子中
嘉興市第一醫院消化內科1(314000) 浙江中醫藥大學附屬第一醫院消化內科2
背景:血清胃蛋白酶原(PGs)作為評估胃黏膜萎縮的指標,可反映胃黏膜功能和形態學狀態。OLGA/OLGIM是一種結合胃黏膜萎縮/腸化生程度和范圍的胃炎分類方法,已逐步被接受并應用于胃癌篩查。目的:分析血清幽門螺桿菌(Hp)抗體聯合PGs檢測(ABC法)與組織學OLGA/OLGIM胃炎評價標準的相關性,評價PGs檢測在胃癌前病變風險評估中的價值。方法:納入2017年1月—2018年1月因上消化道癥狀在嘉興市第一醫院行胃鏡檢查的患者331例,分別采用血清學ABC法和組織學OLGA/OLGIM胃炎評價標準進行分組,比較不同OLGA/OLGIM組間Hp感染率、PGⅠ、PGⅡ水平和PGⅠ/PGⅡ比值(PGR)的差異,分析OLGA/OLGIM胃炎評價標準與ABC法的相關性。結果:OLGA/OLGIM分組中,stage-0組Hp感染率明顯低于其他四組,stage-Ⅳ組則明顯高于其他四組(P<0.05),PGR隨分組等級升高逐漸降低(P<0.05);OLGA分組中,PGⅠ亦隨分組等級的升高呈降低趨勢(P<0.05)。Gamma系數分析顯示OLGA/OLGIM胃炎評價標準與ABC法之間存在較強的相關性(G=0.589, P<0.05; G=0.440, P<0.05)。結論:血清學ABC法與組織學OLGA/OLGIM胃炎評價標準在胃癌前病變風險評估方面存在密切聯系。血清PGs檢測在我國可用于胃癌前病變篩查,為后續是否需作胃鏡精查提供依據。
Risk Assessment
胃癌的預后與分期密切相關,早期胃癌術后5年生存率大于95%,而進展期胃癌則通常小于30%[1]。因此,對高危人群定期進行個體化胃癌風險篩查評估是胃癌預防工作的重點。我國2012年制訂的《中國慢性胃炎共識意見》指出,對于存在慢性萎縮性胃炎,尤其是伴有中重度腸化生或上皮內瘤變的患者,應對病灶進行定期內鏡監測和隨訪[2],即“胃黏膜定標活檢”。國際胃炎萎縮工作小組提出的慢性胃炎分級分期評估系統(operative link on gastritis assessment, OLGA)和慢性胃炎腸化生分級分期評估系統(operative link on gastritis intestinal metaplasia, OLGIM)將胃炎萎縮和腸化生程度與范圍相結合,能較好地預測癌變風險,近年已逐步為人們所認知和接受[3]。
血清胃蛋白酶原(pepsinogens, PGs)的測定簡單、迅速,聯合檢測血清胃泌素17(gastrin 17, G17)與PGⅠ、PGⅡ,并計算PG Ⅰ/PGⅡ比值(pepsinogen ratio, PGR),有助于判斷胃黏膜有無萎縮。血清學“ABC法”最早由日本Miki[4]提出,系通過聯合檢測血清幽門螺桿菌(Helicobacterpylori, Hp)IgG抗體與PGs水平進行大規模胃癌篩查,根據檢測結果將被篩查人群按胃癌發生風險大小逐級分層(A、B、C、D四組),從而提高早期胃癌檢出率。關于PG陽性的定義,國外通常將PGⅠ≤70 μg/L且PGR≤3.0作為萎縮性胃炎的診斷界值和胃癌高危人群篩查標準[5];我國胃癌高發區篩查建議采用PGⅠ≤70 μg/L且PGR≤7.0的標準[6],但目前尚缺乏大樣本隨訪數據佐證。本研究通過分析血清學ABC法與組織學OLGA/OLGIM胃炎評價標準的相關性,評價PGs檢測在胃癌前病變風險評估中的價值。
對象與方法
一、病例來源
連續納入2017年1月—2018年1月因上消化道癥狀在嘉興市第一醫院行胃鏡檢查并自愿加入研究的患者。排除標準:①胃鏡檢查前1個月內服用過H2受體拮抗劑、質子泵抑制劑等抑酸藥,胃鏡檢查前1周內服用過胃黏膜保護劑;②Hp根除史、本次內鏡檢查發現消化性潰瘍、病理檢查確診胃癌;③胃或十二指腸手術史;④一級親屬腫瘤病史、慢性肝病等。研究方案經嘉興市第一醫院倫理委員會審核批準,入組患者均簽署知情同意書。
二、胃鏡檢查和病理診斷
行胃鏡檢查時于固定位置取5塊活組織(胃竇小彎、胃竇大彎、胃角、胃體小彎、胃體大彎各1塊),4%甲醛固定,石蠟包埋、切片,HE染色,由病理科醫師根據新悉尼系統進行診斷[7]。萎縮根據嚴重程度分為輕、中、重度:輕度為固有腺體數減少不超過原有腺體的1/3;中度為固有腺體數減少介于原有腺體的1/3~2/3之間;重度為固有腺體數減少超過2/3,僅殘留少數腺體,甚至完全消失[7]。
三、血清學檢測
受檢者空腹抽取靜脈血5 mL,分離血清,立即檢測或置于-80 ℃保存待測。使用芬蘭Biohit公司的GastroPanel血清胃功能檢測試劑盒,以ELISA法定量檢測血清G17、PGⅠ、PGⅡ水平。血清Hp IgG抗體采用新加坡MP生物醫學亞太私人有限公司的Hp IgG抗體檢測試劑盒進行定性分析。
四、ABC法和OLGA/OLGIM胃炎評價標準分組和比較
入組患者根據血清學檢測結果按ABC法分為四組:A組,Hp和PG均陰性;B組,Hp陽性且PG陰性;C組,Hp和PG均陽性;D組,Hp陰性且PG陽性。PG陽性定義為PGⅠ≤70 μg/L且PGR≤7.0。同時根據組織學萎縮/腸化生部位和程度,按OLGA/OLGIM胃炎評價標準分為五組(stage-0~Ⅳ)。比較不同OLGA/OLGIM分組患者的血清學檢測結果,分析組織學OLGA/OLGIM胃炎評價標準與血清學ABC法在胃癌前病變風險評估中的相關性。
五、統計學分析
結 果
一、一般資料
共331例患者納入研究,其中男性140例,女性191例,平均年齡(53.1±11.8)歲,平均體質指數(BMI)(23.4±4.9) kg/m2;非萎縮性胃炎177例,萎縮性胃炎154例。患者飲酒情況:不飲酒78例(23.6%),目前飲酒111例(33.5%),曾飲酒142例(42.9%);吸煙情況:不吸煙198例(59.8%),目前吸煙45例(13.6%),曾吸煙88例(26.6%)。
血清學ABC法分組:A組214例(64.7%),B組106例(32.0%),C組4例(1.2%),D組7例(2.1%)。
組織學OLGA分組:stage-0組177例,stage-Ⅰ組82例,stage-Ⅱ組49例,stage-Ⅲ組16例,stage-Ⅳ組7例;stage-0組年齡明顯小于其他四組(P=0.000)(表1)。OLGIM分組:stage-0組172例,stage-Ⅰ組81例,stage-Ⅱ組47例,stage-Ⅲ組19例,stage-Ⅳ組12例;stage-0組年齡明顯小于其他四組(P=0.000)(表2)。
二、不同OLGA/OLGIM分組患者Hp感染率比較
OLGA分組中,stage-0、Ⅰ、Ⅱ、Ⅲ、Ⅳ組Hp感染率分別為33.9%、53.7%、51.0%、56.2%和71.4%,各組間總體差異有統計學意義,其中stage-0組明顯低于其他四組,stage-Ⅳ組則明顯高于其他四組(χ2=13.42,P=0.006)(表1)。
OLGIM分組中,stage-0、Ⅰ、Ⅱ、Ⅲ、Ⅳ組Hp感染率分別為33.1%、50.6%、55.3%、57.9%和66.7%,各組間總體差異有統計學意義,其中stage-0組明顯低于其他四組,stage-Ⅳ組則明顯高于其他四組(χ2=16.09,P=0.003)(表2)。
三、不同OLGA/OLGIM分組患者胃分泌功能比較
OLGA分組中,PGⅠ水平和PGR隨分組等級升高呈降低趨勢(F=2.127,P=0.041;F=4.350,P=0.002),stage-Ⅲ、Ⅳ組降低尤為明顯;各組間PGⅡ水平差異無統計學意義(F=1.426,P=0.099)(表1)。
OLGIM分組中,PGR隨分組等級升高逐漸降低(F=3.207,P=0.013),stage-Ⅲ、Ⅳ組降低尤為明顯;各組間PG Ⅰ、PG Ⅱ 水平差異無統計學意義(F=0.689,P=0.782;F=1.715,P=0.074)(表2)。
四、組織學OLGA/OLGIM胃炎評價標準與血清學ABC法的相關性
分析顯示,組織學OLGA/OLGIM胃炎評價標準與血清學ABC法之間存在較強的相關性(G=0.589,P=0.007;G=0.440,P=0.024),ABC法分類C、D組患者更多地集中分布于OLGA/OLGIM胃炎評價標準高等級組中(P<0.05;P<0.05)(表3)。
討 論
胃癌的發生、發展是一個多步驟、漸進的過程,盡管萎縮性胃炎、腸化生等胃癌前病變與胃癌的發生存在密切聯系,但最終進展為胃癌的只是少數患者[4]。因此,有針對性地篩選出胃癌高風險人群進行動態隨訪觀察,成為早期發現胃癌的重要手段。
胃鏡檢查并獲得病理學依據是評估胃癌前病變風險的最佳選擇。近年提出的OLGA/OLGIM胃炎評價標準通過對胃炎萎縮/腸化生程度和范圍進行綜合評估,能起到較好的預測作用,高等級分期(Ⅲ、Ⅳ期)的患者通常意味著更高的胃癌發生風險,需接受內鏡和病理隨訪[8-9]。然而,我國胃癌高風險人群基數大,在如此龐大的人群中開展胃癌長期隨訪有一定難度。同時,胃鏡作為一項侵入性檢查,患者的接受度和耐受性亦普遍不高。因此,建立血清學檢測方法,實現對胃癌前病變風險的無創性評估有著重要的現實意義。
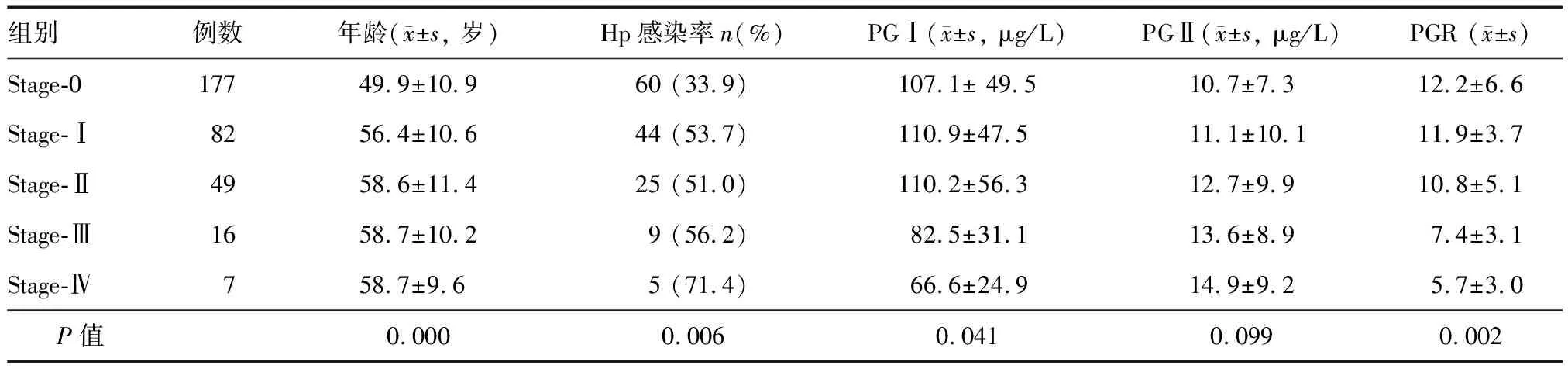
表1 不同OLGA分組Hp感染率和血清PGⅠ、PGⅡ、PGR比較
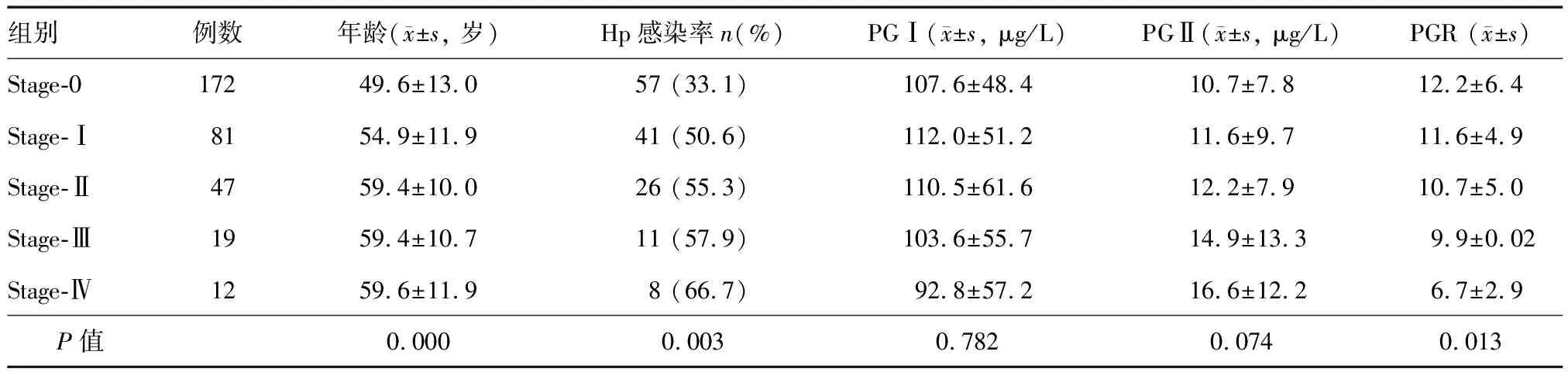
表2 不同OLGIM分組Hp感染率和血清PGⅠ、PGⅡ、PGR比較
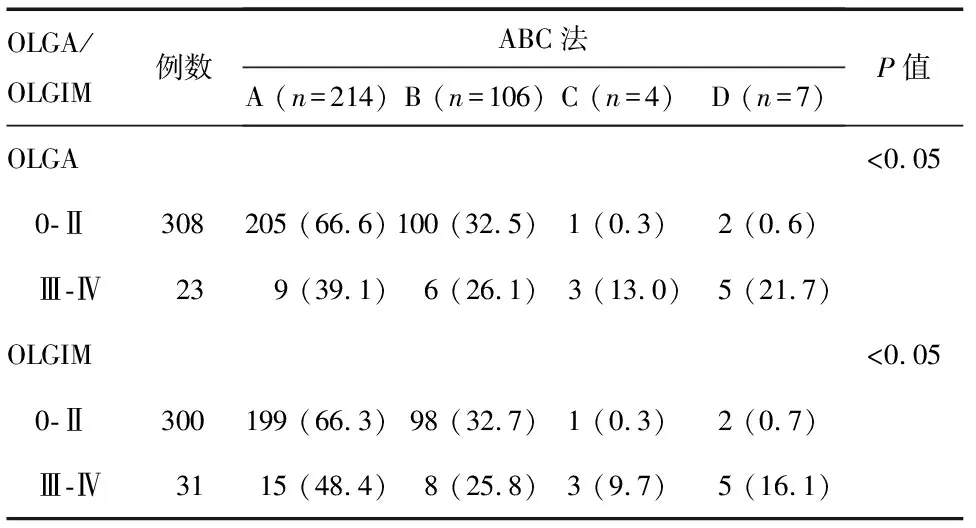
表3 組織學OLGA/OLGIM胃炎評價標準與血清學ABC法的相關性 n(%)
PGs是胃蛋白酶的無活性前體,可分為PGⅠ和PGⅡ兩個不同生化特征和免疫原性的亞群。PGⅠ主要由胃底腺主細胞和頸黏液細胞分泌,PGⅡ除上述細胞外,還能由賁門腺、胃竇幽門腺頸黏液細胞以及十二指腸上段分泌,兩者水平的變化可反映胃黏膜功能和形態學狀態,有胃黏膜“血清學活檢”之稱。將血清PGs與Hp抗體檢測相結合的ABC法,通過對受檢人群進行風險分層,可提高評估準確性,進而評價胃癌發生風險。目前國內對PG陽性用于胃癌初篩的界值設定并不統一[10-11],雖有建議在胃癌高發區采用PGⅠ≤70 μg/L且PGR≤7.0的標準[6],但缺乏大樣本隨訪數據佐證。
本課題組前期研究[12]發現,ABC法在我國臨床胃癌篩查中有一定應用價值,PG陽性患者有更高的胃癌發生風險。在此基礎上,本研究側重于分析血清PGs水平和ABC法與組織學OLGA/OLGIM胃炎評價標準之間的關系,以期明確血清PGs檢測在胃癌前病變風險評估中的價值。
Hp感染作為一個重要的胃癌相關危險因素,已為人們所熟知。持續Hp感染可引起胃黏膜長期慢性炎癥反應,進而發生胃黏膜萎縮、腸化生。本研究分析顯示,隨著OLGA/OLGIM分期等級的升高,胃炎患者Hp感染率呈升高趨勢。事實上,當胃黏膜發生萎縮、腸化生時,由于胃內環境的改變,Hp感染檢出率可能會呈現下降趨勢[8,13]。本研究中stage-Ⅳ組Hp感染率反而最高可能與研究類型不同有關。得出上述結論的研究為前瞻性隊列研究,而本研究為回顧性橫斷面研究,首先著眼于不同萎縮/腸化生程度人群,再分析其Hp感染率,因此無法呈現Hp感染率隨胃黏膜狀態動態變化的趨勢。此外,Hp IgG抗體并不能反映Hp實時感染狀態(Hp IgG于Hp消除后6個月方降低至消失),亦可能影響研究結果。高OLGA/OLGIM等級組樣本量較小所致的統計學誤差也是導致研究結果差異的可能原因之一。該結果也從側面體現了持續Hp感染與胃黏膜萎縮、腸化生之間的密切聯系[13],提示了對高危人群進行Hp根除治療在早期胃癌預防中的必要性。
在胃黏膜萎縮、腸化生進程中,血清PGⅠ水平持續下降,而PGⅡ因可由不同部位腺體和化生的幽門腺分泌,其血清水平通常下降不明顯,因而表現為PGR明顯降低[14]。本研究中血清 PGⅠ水平和PGR隨著OLGA分期等級的升高呈降低趨勢,高等級組(stage-Ⅲ、Ⅳ組)降低尤為明顯。OLGA胃炎評價標準反映的是胃黏膜萎縮程度和范圍的變化,高等級組中的患者通常萎縮程度更重,相應地,PGⅠ水平和PGR下降明顯,與既往研究結果類似。而在反映腸化生程度的OLGIM胃炎評價標準中,隨著分期等級的升高,僅PGR顯著下降。OLGIM分組與OLGA分組在PGs水平上的差異可能主要與分組人群的個體差異有關。此外,PGⅠ水平與胃體萎縮程度密切相關,因此OLGA分組比OLGIM分組更能體現萎縮程度的差異。
鑒于OLGA/OLGIM分組與血清PGs水平之間的聯系,本研究進一步評價了同樣用于評估胃癌發生風險的血清學ABC法與組織學OLGA/OLGIM胃炎評價標準之間的相關性。分析發現兩者間存在較強的相關性,ABC法分類C、D組患者更多地集中分布于OLGA/OLGIM胃炎評價標準高等級組中。這一結果表明,血清學ABC法在胃癌前病變風險評估中,有著與組織學評價標準相似的特異性和準確性。本研究為首次對胃癌前病變篩查工作中血清學分類方法與組織學分類方法間的相關性進行探討。事實上,血清PGs檢測已被廣泛認可和接受,并被納入到多個國家的胃癌和癌前病變篩查工作中。本研究結果有助于理解PGs檢測作為“血清學活檢”在胃癌前病變篩查中的重要作用,并為我國早期胃癌篩查策略的制訂提供依據。本研究的不足之處主要在于樣本量較小,且個體在地域環境、生活習慣、飲食結構等方面的差異可能影響結果的穩定性。本研究納入的均為因上消化道癥狀行胃鏡檢查者,與胃癌普查人群存在差異,研究結果應用于早期胃癌篩查工作前尚需進一步驗證。
綜上所述,本研究探討了血清PGs檢測與組織學OLGA/OLGIM胃炎評價標準之間的聯系,并通過分析血清學ABC法與組織學OLGA/OLGIM胃炎評價標準在胃癌前病變風險評估中的相關性,肯定了血清學檢查的應用價值。由于納入人群特征的差異,本研究結果可能更適用于有上消化道癥狀者的胃癌篩查。可以肯定的是,無論是對于胃癌篩查人群還是需長期隨訪監測的高危人群,血清學檢查都有助于評估胃癌前病變發生風險,為后續是否需作胃鏡精查提供依據。在越來越強調胃癌早期發現、早期診斷的當下,血清學與組織學相互配合,實現對胃癌前病變風險的評估和管理,并制訂符合我國國情和胃癌流行病學特征的早期胃癌篩查流程,將是今后的工作重點。無癥狀人群和存在上消化道癥狀的人群在胃癌篩查方面可能存在的差異,需今后開展更多大樣本、多中心、高質量的臨床研究加以明確。

