宮頸癌容積旋轉調強放療中患者腹圍變化對擺位誤差的影響
王 甜,成肇杰,梁衛學,韋順文,王占宇
(柳州市工人醫院腫瘤科,廣西柳州 545005)
0 引言
宮頸癌是女性常見的惡性腫瘤,早期宮頸癌術后聯合輔助放療可明顯減少復發,提高患者生存率[1]。容積旋轉調強放療(volumetric-modulated arc therapy,VMAT)使照射野形狀與靶區高度適形,對腫瘤高劑量照射的同時提高了治療效率,有效降低了腸道等器官受照體積[2],減少了不良放療反應。然而,調強放療對放療擺位的準確性及重復性要求較高,擺位誤差控制是重要的質控內容[3]。宮頸癌患者放化療過程中不良反應如腹瀉等可使患者體質量下降,從而使腹圍發生變化,影響擺位精度。因此,本研究利用錐形束 CT(cone beam CT,CBCT)分析腹圍變化與擺位誤差的關系,以期了解擺位誤差與腹圍變化的規律,為宮頸癌臨床放射治療提供一定的參考。
1 材料與方法
1.1 一般資料
選取2017年10月至2018年4月柳州市工人醫院腫瘤科宮頸癌術后患者30例,年齡35~64歲(中位年齡52歲),按國際婦產科聯盟(International Federation of Gynecology and Obstetrics,FIGO)分期標準分期在Ⅰb至Ⅲb期之間,患者行宮頸癌根治術后進行輔助放化療,入組患者均簽署放療知情同意書。
1.2 方法
1.2.1 模擬定位
囑患者定位前排空腸道,定位前1h排空小便,喝300 ml溫開水,保證膀胱充盈度。患者仰臥位,雙手上舉抱頭,用熱塑體膜固定。采用西門子Biograph mCT S20 PET-CT機掃描定位,掃描條件為管電壓120 kV、管電流200 mAs,層厚5 mm,掃描范圍為胸椎10至閉孔下緣2~3 cm,所得CT圖像傳輸至RayStation三維治療計劃系統。
1.2.2 靶區勾畫及計劃設計
按照ICRU 50、62號報告勾畫術后宮頸癌臨床靶區(clinical target volume,CTV),將 CTV 在三維方向外擴5 mm得到計劃靶區(planning target volume,PTV),并勾畫小腸、股骨頭、直腸及膀胱等危及器官(organ at risk,OAR)。膀胱為充盈狀態下的整個膀胱,直腸的上界為直腸乙狀結腸交界處、下界至肛門[4]。采用瓦里安Trilogy直線加速器,射線能量均為6 MV,處方劑量為50.4Gy,治療次數為28次,照射的體積≥95%,PTV接受處方劑量110%的體積小于5%,靶區外無劑量熱點,CTV內無劑量冷點;OAR的限量為:直腸V50<50%(V50表示接受50 Gy劑量照射的體積百分比),小腸V50<10%,股骨頭V50<5%,膀胱V50<50%。用RayStation計劃系統設計6 MV X線非均整模式下的VMAT計劃[5]。
1.2.3 治療方法
患者每個分次治療前,放療技師進行腹圍測量:用軟尺在呼氣末、吸氣未開始時經髂嵴點測量腹部水平圍長并記錄,入組患者在同等條件下測量(同一患者同一時間進行測量并治療,囑患者提前排空腸道,空腹,治療前1 h排空小便,喝300 ml水,保證與定位時相同膀胱充盈度。排除患者身體不適、腹部脹氣影響腹圍測量者)。對患者擺位后,行CBCT位置驗證:患者治療前行CBCT圖像驗證,所得圖像與計劃CT圖像配準后,記錄患者治療床上下、前后、左右方向擺位誤差,3個方向誤差≤5 mm時,即行放療;如若某方向擺位誤差>5 mm,則調整治療床位置或重新擺位(調整后再次行CBCT驗證掃描)。按中華醫學會放射治療技術學組制定的圖像引導放療(image guide radiation therapy,IGRT)技術操作指南:第 1 周為5次/周,每次治療前行CBCT驗證;第2~6周為1次/周,治療前行CBCT驗證;當發現腹圍變化大且任一方向擺位誤差>5 mm時,后續每次治療前行CBCT驗證,配準并糾正三維方向位移,使整個療程精確實施。
1.2.4 擺位誤差與劑量學分析
計算3個方向上每位患者擺位誤差,并分析與腹圍變化的關系。統計位移后(標記為產生位移后組)與治療計劃(標記為治療計劃組)靶區及正常組織受量,包括PTV的95%體積劑量(D95)、最大劑量(Dmax)、最小劑量(Dmin)、平均劑量(Dmean);直腸、膀胱接受 45 Gy劑量體積(V45)。
1.2.5 統計學方法
采用SPSS 17.0統計學軟件進行數據分析。計數資料用均數±標準差(±s)表示,采用配對樣本t檢驗分析差異。采用Pearson法分析腹圍變化與擺位誤差的關系,P<0.05為差異有統計學意義。
2 結果
2.1 腹圍變化與擺位誤差
隨著治療周次的深入,其中16例患者第5周腹圍下降>3 cm,結束時平均腹圍下降4.3 cm,在線配準后發現治療床有一個或多個方向擺位誤差>5 mm,記錄上下、前后、左右方向擺位誤差數據及與之相對應的腹圍測量數據,具體見表1。其余14例患者腹圍下降≤2 cm,上下、前后、左右方向擺位誤差均能達到精準性放療要求。16例患者擺位誤差校正前后比較,差異有統計學意義(P<0.05)。詳見表2。
表1 16例宮頸癌患者不同治療周次腹圍下降與3個方向擺位誤差統計(±s)
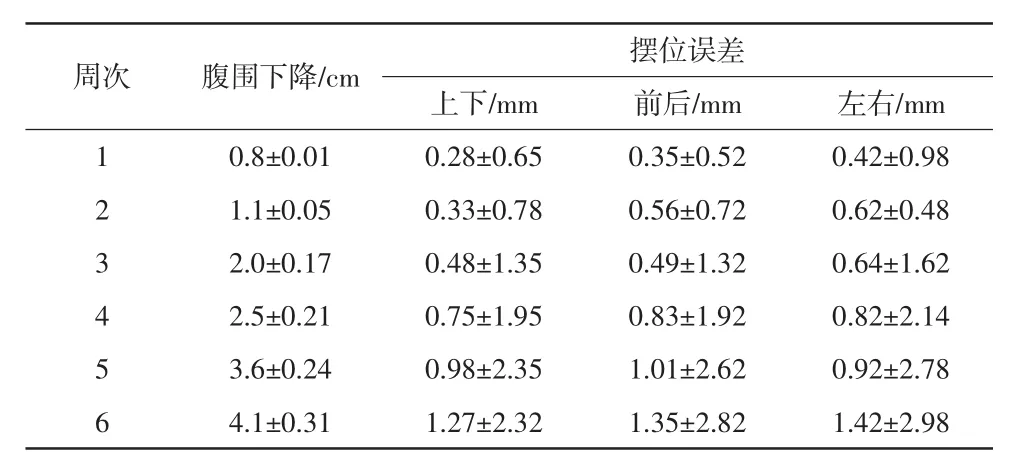
表1 16例宮頸癌患者不同治療周次腹圍下降與3個方向擺位誤差統計(±s)
周次 腹圍下降/cm 擺位誤差上下/mm 前后/mm 左右/mm 1 0.8±0.01 0.28±0.65 0.35±0.52 0.42±0.98 2 1.1±0.05 0.33±0.78 0.56±0.72 0.62±0.48 3 2.0±0.17 0.48±1.35 0.49±1.32 0.64±1.62 4 2.5±0.21 0.75±1.95 0.83±1.92 0.82±2.14 5 3.6±0.24 0.98±2.35 1.01±2.62 0.92±2.78 6 4.1±0.31 1.27±2.32 1.35±2.82 1.42±2.98
表2 16例患者擺位誤差校正前后比較(±s)mm

表2 16例患者擺位誤差校正前后比較(±s)mm
分組 上下 前后 左右校正前 1.52±2.85 1.75±3.12 1.82±2.99校正后 0.37±0.84 0.45±0.62 0.67±0.72 t 3.084 4.014 3.927 P<0.05 <0.05 <0.05
2.2 腹圍下降和擺位誤差絕對值的Pearson相關性分析
16例患者上下、前后、左右方向擺位誤差行絕對值轉換后與腹圍下降進行Pearson相關性分析,r分別為 0.785、0.817、0.851,P分別為 0.048、0.043、0.040,差異均有統計學意義(P<0.05)。說明患者擺位誤差隨著腹圍下降而增大,特別是最后一周放療腹圍下降(4.1±0.31)cm,擺位誤差上下、前后、左右方向分別為(1.27±2.32)、(1.35±2.82)、(1.42±2.98)mm。
2.3 劑量差異
未進行配準并糾正三維方向位移情況下,治療計劃組和產生位移后組劑量差異見表3。產生位移后組PTV 的D95明顯小于治療計劃組(P<0.05);膀胱V45、直腸V45與治療計劃組相比無明顯變化(P>0.05)。
表3 位移誤差引起靶區劑量及正常組織劑量差異比較(±s)
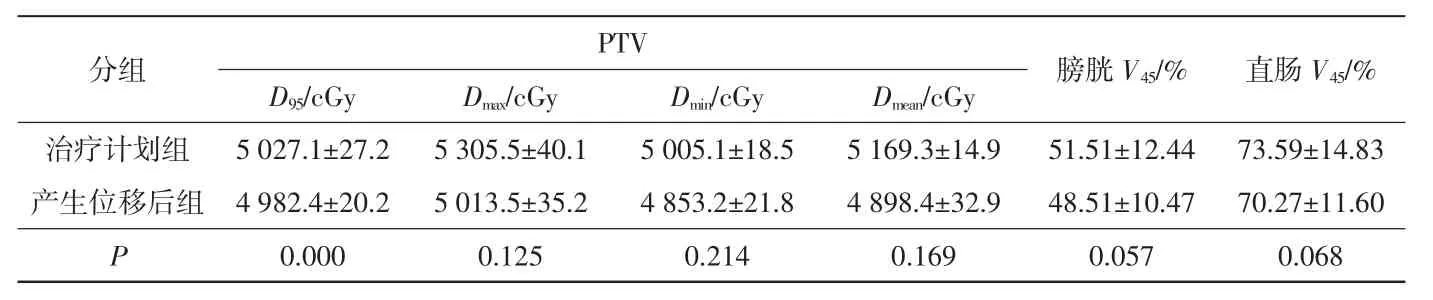
表3 位移誤差引起靶區劑量及正常組織劑量差異比較(±s)
分組 PTV D95/cGy Dmax/cGy Dmin/cGy Dmean/cGy 膀胱V45/% 直腸V45/%治療計劃組 5 027.1±27.2 5 305.5±40.1 5 005.1±18.5 5 169.3±14.9 51.51±12.44 73.59±14.83產生位移后組 4 982.4±20.2 5 013.5±35.2 4 853.2±21.8 4 898.4±32.9 48.51±10.47 70.27±11.60 P 0.000 0.125 0.214 0.169 0.057 0.068
3 討論
VMAT作為一種新型放療技術,能通過單弧或多弧對機架旋轉角度進行改良,動態調整多葉準直器(multi-leaf collimator,MLC),以達到優化輸出劑量率和保證靶區精準照射目的[6]。VMAT方案在具有與調強放療(intensity modulated radiation therapy,IMRT)相近的放射均勻性和周圍組織受量的同時,還可有效縮短放療時間,保護重要器官功能[7]。國外學者報道,VMAT在小腸、直腸及股骨頭照射受量方面均低于IMRT[8],且在重要器官照射劑量分布方面具有明顯優勢[9]。本研究用RayStation計劃系統設計6 MV X線非均整模式下的VMAT計劃[5],在OAR保護以及正常組織低劑量照射上,非均整模式散射線更少。非均整模式下的VMAT計劃相較均整模式下的VMAT計劃更具優勢,出束時間下降,治療效率提高,有利于降低二次癌癥的發生率。
Qin等[10]Meta分析顯示術后同期放化療較術后單純放療有利于提高早期高危宮頸癌總生存期(overall survival,OS)[風險比(hazard ratio,HR)=0.47,P=0.000]和無進展生存期(progression-free survival,PFS)(HR=0.5,P=0.000)。因此,本研究患者均為宮頸癌根治術后行輔助放化療。據報道,早期宮頸癌術后同期放化療胃腸道不良反應發生率為13%[11],如腹瀉、食欲減退等會引起體質量下降。大多數宮頸癌患者皮下脂肪較多,尤其是腹圍脂肪含量較高,當體質量下降時,消瘦部位往往集中在腹部、盆部及大腿,且腹圍測量點在宮頸癌靶區上,故監測腹圍變化較為方便實用。當患者體質量下降明顯時,放療技師與醫師在精確治療與擺位過程中須注意到患者治療中心的誤差,通過CBCT掃描驗證以達到患者治療的重復性及最優性[12]。本研究利用CBCT研究擺位誤差與腹圍變化的關系,發現患者在相同固定條件下,治療重復性能得到較好保證,且在放療實施前行CBCT驗證可準確發現擺位誤差并能予以在線糾正。患者腹圍保持良好或腹圍變化≤2 cm時,CBCT驗證圖像與計劃CT圖像骨性配準后,擺位誤差在上下、前后、左右方向均能達到精準性放療要求。本研究結果顯示,由于不良反應可導致部分患者體質量下降,從而造成腹圍下降,當腹圍降低>3 cm時,患者3個方向上平均擺位誤差均>3 mm,且有一個或多個方向誤差>5 mm,需要進行在線配準并糾正三維方向位移,產生位移后組PTV的D95明顯小于治療計劃組,P<0.05,差異有統計學意義。證明當腹圍下降明顯時,需進行在線校正后方能治療,從而達到治療的精準化。葉志雄等[13]通過研究直腸癌體質量下降與位移誤差相關性中發現,患者體質量下降>3 kg時,擺位誤差在3個方向上均>3 mm,且靶區劑量和周圍正常組織劑量均存在一定差異。本研究與之結果相近,Pearson相關性分析顯示,腹圍下降時患者擺位誤差相應增大,二者高度相關。當腹圍下降過大時,務必進行CBCT圖像引導放療或重新擺位。
CBCT呈現的三維圖像具有橫斷面上觀察解剖結構,了解CTV、PTV外包邊界,與計劃CT圖像高度適配等優勢,在達到靶區內腫瘤組織精準劑量的同時,還保護了周圍正常組織[14]。但是,CBCT在實現精準放療的同時也存在一些問題,如無法測量治療過程中腫瘤及周圍正常組織動態變化的全過程[15]、價格昂貴、操作復雜、消耗時間較多、患者所受輻射劑量增大等。因此,明確CBCT優劣勢,合理安排CBCT引導策略,使患者體位重復性得到最大保證的同時,可有效減少CBCT引導次數。當患者后期腹圍變化明顯時,應隔日或每日行1次CBCT配準以糾正擺位誤差,如相差太大需重新更換體膜并更改治療計劃,保證治療精準性。當然,治療過程中存在隨機性和系統性誤差,如患者自身不可抗拒的皮膚組織松弛、基于CBCT的直腸蠕動引起的位移變化[16]、膀胱充盈程度和呼吸運動等情況引起的誤差。
綜上所述,宮頸癌患者放療過程中,腹圍下降時會影響擺位誤差,從而影響靶區,因此應密切關注患者腹圍變化情況,特別是后8次治療;當腹圍變化過大時,應適當增加CBCT引導次數,或重新更換體膜并更改治療計劃以達到精準放療的目的。

