基質金屬蛋白酶在稽留流產發生中的作用和調控機制研究
施林領 陸秀芳 單海燕 伯樂 李海燕 奚星澍 滕云 茅彩萍
稽留流產(missed abortion)又稱過期流產,指胚胎或胎兒死亡后滯留宮內未及時自然排出[1],是產科常見的一種病理妊娠。近年來,稽留流產發病率逐漸上升,引起稽留流產的原因極其復雜[2-3],主要包括染色體因素、免疫因素、生殖道感染、內分泌紊亂、環境污染、氧化應激、社會因素等。雖然關于稽留流產的文獻報道并不少,但其發病機制仍未完全明了。因此,明確其病因尋找有效的干預措施對遺傳咨詢及再次妊娠有重要的臨床指導意義。本研究擬通過檢測稽留流產與正常人工流產者絨毛組織中核轉錄因子NF-κB(nuclear transcription factor-κB, NF-κB)、轉化生長因子TGF-β1(transforming growth factor-beta 1,TGF-β1)、基質金屬蛋白酶9(matrix metalloproteinase-9,MMP-9)和基質金屬蛋白酶組織抑制因子1(tissueinhibitor of metalloproteinase,TIMP-1)之間的相關性,探討導致稽留流產的可能病因及發病機制,為臨床診療提供科學理論依據。
資料與方法
一、一般資料
選擇2015年11月至2016年5月期間就診于蘇州大學附屬第一醫院計劃生育門診和蘇州市立醫院北區婦產科的30例稽留流產患者作為實驗組,患者既往月經規律,經人絨毛膜促性腺激素及B超動態監測證實為稽留流產,患者平均年齡(28.0±5.1)歲,孕齡(58.4±13.7) d;同時選擇30例自愿要求終止妊娠的有正常生育史的同期早孕健康婦女作為對照組,平均年齡(29.2±4.8)歲,孕齡(60.8±12.4) d。
所有納入對象滿足的入選標準為(1)既往均無高血壓、滋養細胞疾病、惡性腫瘤、內分泌及免疫性疾病等,且所有稽留流產均排除染色體因素所致;(2)婦科檢查均排除陰道炎、宮頸炎;(3)超聲提示無子宮內膜息肉、子宮黏膜下肌瘤、卵巢囊腫等;(4)孕前3個月及孕期均未服用藥物,均未接觸毒物及放射線。本研究經蘇州大學附屬第一醫院和蘇州市立醫院北區的醫學倫理委員會批準,患者及家屬均知情同意并簽訂知情同意書。兩組患者的一般資料比較,差異均無統計學意義,有可比性。
二、方法
于清宮術時獲取兩組患者的絨毛組織,在無菌及滅活RNA酶條件下,采集稽留流產和正常早孕婦女的流產絨毛標本,通過焦磷酸二乙酯處理過的生理鹽水洗凈去除粘液和血液,濾紙去除表面水分,將剔除蛻膜組織后所得的組織置于滅活 RNA 酶的凍存管中,置-80℃冷凍保存。
1.提取組織標本RNA:取凍存的待測絨毛組織約100 mg置于研缽中,加入適量液氮研磨至粉狀,RNA提取操作嚴格按照RNeasy Mini Kit(50)(Qiagen公司,批號:74104,生產時間:2016年4月)說明書要求進行,完成后用Qubit熒光定量(Thermo Fisher公司,型號:Q33226)測定RNA濃度,RNA濃度= A260×稀釋倍數×40÷1000(ug/μl)。
2.RNA的逆轉錄:采用PrimeScript RT reagent反轉錄試劑盒(TaKaRa公司,批號:RR047A,生產時間:2016年6月),將RNA逆轉錄為cDNA,嚴格按照說明書要求,根據不同樣本濃度進行相應換算,然后向體系中加入相應RNA(加入量<500 ng/10 ml),操作均在冰上進行。37℃ 15 min,85℃ 5s,產物置4℃保存。反應結束后進行PCR反應。
3.mRNA表達的檢測:采用RT-PCR檢測兩組患者絨毛組織中NFκB (NFκB p50亞基的調控基因NFκB1和NFκB p65亞基的調控基因RelA)、TGF-β1、TIMP-1、MMP-9等相關基因表達。采用ABI7500(Thermo Fisher公司,型號:4351105)對目的基因進行擴增,且在完成后對相應數據進行分析。進行的PCR反應均采用Premix ExTaq PCR反應液(TaKaRa公司,批號:RR820L,生產時間:2016年6月),反應體系及參數嚴格參照說明書。反應條件為 95℃ 30 s、95℃ 5 s、60℃ 34 s、95℃ 15 s; 60℃ 1min 共40個循環。均用標準品對RT-PCR的產物量進行校正,按比例稀釋標準品后與待測樣本同時上機,且均采用不同批次的標本重復實驗3次。采用相對定量法計算mRNA的表達量,ΔC表示目的基因mRNA的相對表達量,ΔC=C(目的基因)-C(內參基因),ΔC’=ΔC(目的基因)-ΔC(標準值),目的基因的相對總量為2-ΔC’。引物由上海生工生物公司設計及合成,見表1。

表1 RT-PCR引物序列
4.蛋白表達的檢測:采用Western Blot法檢測患者絨毛組織中NFκB(p50亞基和p65亞基)、TGF-β1、TIMP-1、MMP-9的蛋白表達。絨毛組織蛋白質的提取,按照Trizol試劑盒(Gibco BRL公司,批號:15596026,生產時間:2016年7月)要求操作,所獲蛋白質經SDS-PAGE電泳,PVDF轉膜,再用5%小牛血清白蛋白室溫封閉2 h,加一抗(抗體稀釋度為1:1 000,內參抗體稀釋度為1:2 000),于4℃保存過夜,次日取膜棄一抗,加入適量TBST洗滌PVDF膜,重復3次,每次10 min,加二抗(稀釋度為1:2000)室溫下1 h后,棄二抗,再更換TBST洗滌3次,每次10 min,而后行曝光等處理并用imageJ軟件對灰度值進行分析。
5.血清TGF-β1的檢測:囑納入對象術前禁食12 h,采集清晨空腹狀態下外周靜脈血5 ml于EATD管內,靜置后離心并分離血清,于-80℃冰箱保存待測。采用酶聯免疫吸附試驗(ELISA)檢測血清TGF-β1,試劑盒購自R&D Systems公司(批號:DY010,生產時間:2016年8月)。
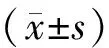
結 果
一、兩組患者一般資料分析
兩組患者的月經周期均規律,均排除因染色體異常導致的流產。兩組患者的年齡、停經時間等比較,差異均無統計學意義,所有患者均無器質性疾病。肉眼辨認所有標本并選出典型的絨毛組織。
二、兩組患者血漿TGF-β1水平檢測
實驗組血液中TGF-β1的平均水平為(119.34±17.81) pg/L,低于對照組的(180.75±26.28) pg/L,兩組間差異有統計學意義。見表2。

表2 血漿TGF-β1檢測結果
Note:Compared with the control group,*P<0.05
三、MMPs通路中關鍵因子mRNA表達情況
實驗組絨毛組織NFκB1、TGF-β1和TIMP-1的mRNA表達量均低于對照組,差異均有統計學意義;而RelA的mRNA表達水平,兩組間差異無統計學意義;實驗組絨毛組織MMP-9的mRNA表達量高于對照組,差異有統計學意義。見圖1。
四、MMPs通路中相關蛋白的表達
實驗組絨毛組織MMP-9蛋白表達水平高于對照組,兩組差異有統計學意義;實驗組絨毛組織TGF-β1和NFκB p50亞基(NFκB1基因調控)、TIMP-1的蛋白表達水平均低于對照組,兩組差異有統計學意義。見圖2、圖3。
討 論
相對于自然流產而言,稽留流產中胚胎停育或死亡后不能及時從機體排出,易使患者發生凝血功能障礙,稽留流產的致病因素至今尚不甚明確,這些未明確的危險因素可能導致稽留流產的再次發生,具有更大的危害性[4]。因此,稽留流產病因和發病機制的探討對其預防和治療具有重要的臨床意義。
基質金屬蛋白酶(matrix metalloproteinases,MMPs)是存在于基質中降解細胞外基質(extracellular matrix,ECM)的重要水解蛋白酶,在絨毛外滋養細胞(extravillous trophoblast cell,EVT)入侵內膜基質中起關鍵作用,其天然的組織型抑制分子基質金屬蛋白酶抑制劑(matrix metalloproteinase inhibitors,TIMPs)是有序降解和重塑ECM的關鍵分子[5]。既往研究報道[6-8],胚胎植入過程中MMPs的作用主要包括:(1)參與子宮內膜生長和血管生成,促進胚胎著床的同時供給著床后所需要的營養物質;(2)參與胚胎著床過程,通過對蛻膜ECM的降解,防止因胚胎滋養層細胞的突然侵襲引發出血,從而使胎囊與蛻膜脫離導致流產。MMPs和TIMPs能由胚胎滋養層細胞與蛻膜分別合成,在正常生理狀態下,兩者互相制衡,但MMPs和TIMPs之間的平衡在某些病理狀態下也會失調,從而影響胚胎著床與生長[9]。此外,蛻膜因為侵襲過度的胚胎滋養細胞可能發生過度降解,從而導致妊娠早期出血甚至流產。其中,MMP-9在形成胎盤與建立子宮胎兒循環方面的作用至關重要。通過RT-PCR檢測到實驗組和對照組的流產絨毛組織中均有MMP-9的表達。本研究中,實驗組MMP-9的mRNA及其蛋白表達水平均高于對照組,而TIMP-1的表達低于對照組,且差異均有統計學意義(P<0.05)。本研究結果提示,稽留流產的發生可能與MMP-9/ TIMP-1的平衡被破壞有關,為了明確導致MMP-9表達升高及TIMP-1表達降低的原因,本研究進一步對其信號通路的調控機制進行了探究。
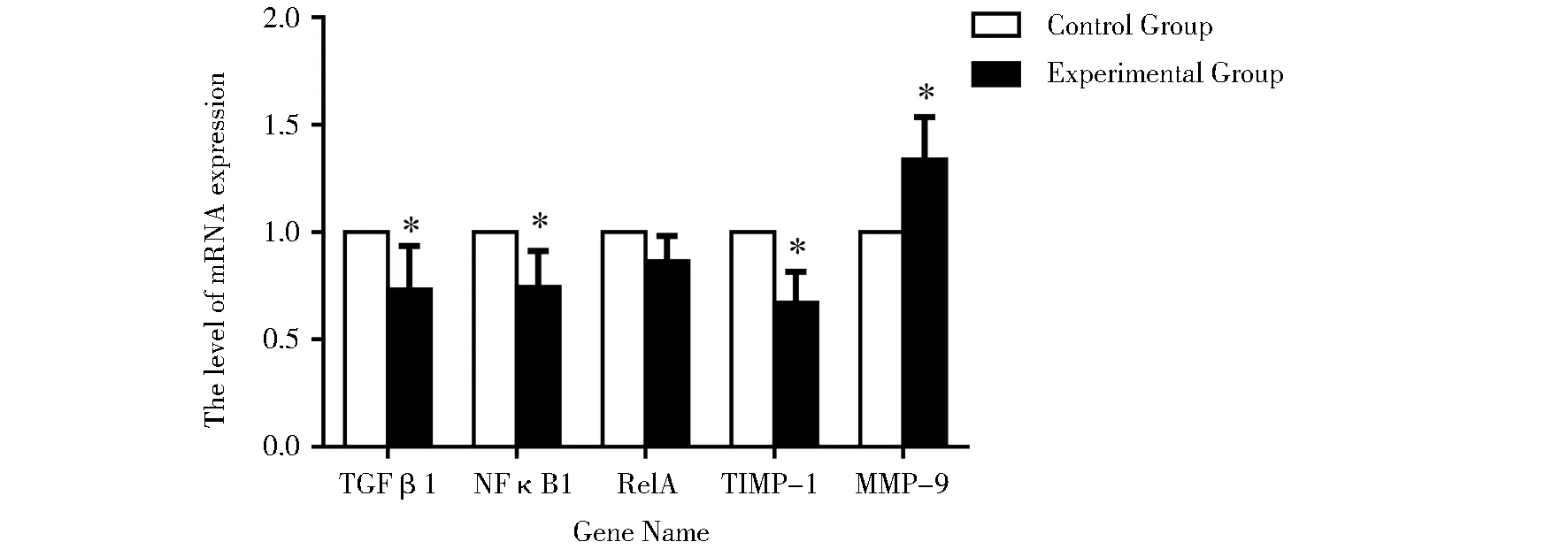
圖1 MMPs通路中相關因子mRNA表達Figure 1 mRNA expression of related genes in MMPs pathway
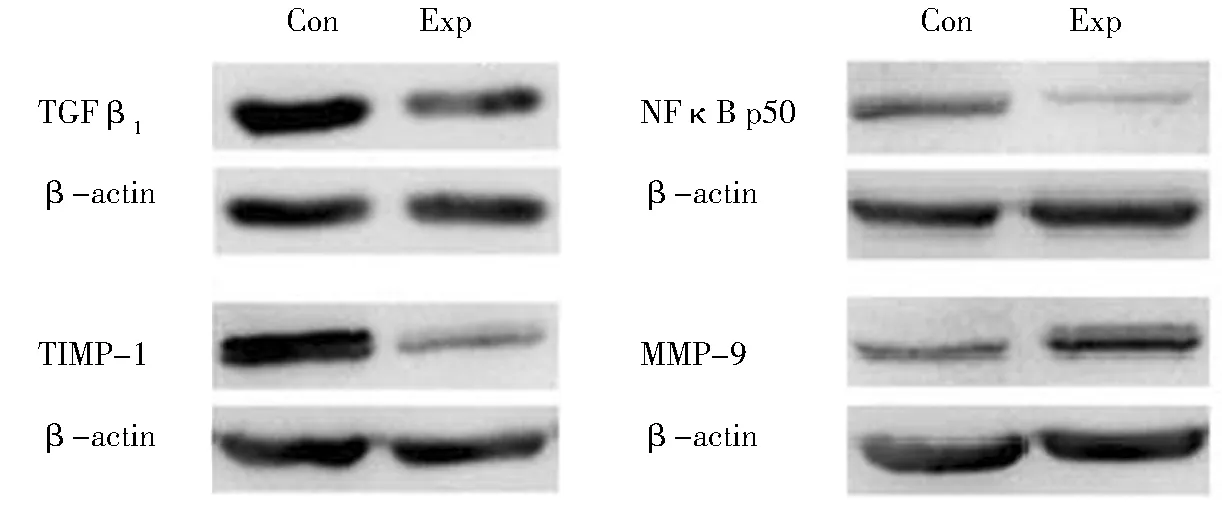
圖2 蛋白印跡條帶原圖Figure 2 Original stripe map from Western blot

圖3 MMPs通路中相關蛋白的表達Figure 3 Expression of related proteins in MMPs pathway
TGF-β1是一種多功能細胞因子,在胚胎著床、ECM產生、血管生成、細胞增殖分化及調節機體免疫系統等方面均起著重要的作用。文獻報道[10-11],TGF-β1不僅可誘導TIMP-1的產生,還能調控MMP-9及其抑制物TIMP-1的侵襲力。研究發現,TGF-β1在妊娠合體滋養層細胞、絨毛及絨毛外滋養細胞以及各期胎盤組織等中均有表達[12]。本研究中,實驗組TGF-β1的mRNA和蛋白表達明顯低于對照組,差異有統計學意義,提示TGF-β1、TIMP-1與MMP-9可能具有一定相關性。妊娠早期,TGF-β1水平的異常降低可能引起TIMP-1的表達降低,從而打破MMP-9/TIMP-1的平衡;MMP-9表達的異常增加,使滋養細胞侵襲過深,蛻膜ECM過度降解,胚胎植入失敗以及胎盤形成不良,最終導致稽留流產的發生。這表明TGF-β1對早期胚胎穩定著床可能有一定的調控作用。
NF-κB可調控TGF-β1的合成并促進其表達。TGF-β1的活化因子為組織轉谷氨酰酶,其啟動子中含有NF-κB的結合位點。NF-κB活化后由胞漿轉移至胞核發生核轉位,參與TGF-β1的合成。NF- κB 的活化由其抑制亞單位IκB的磷酸化所啟動,IκB蛋白的降解激活NF-κB的p50亞單位(NFκB1基因)和p65亞單位(RelA基因),使其得以轉位進入細胞核內調控基因的轉錄和表達。此外,MMP-9也為NF-κB 的靶基因。既往研究證實[13-14],MMP-9基因的啟動子側翼調控區存在NF-κB的結合位點,NF-κB與其結合后,能增強其啟動子的活性,從而上調MMP-9 的表達,加速ECM 的降解。本研究中,實驗組絨毛組織中NFκB1和RelA的mRNA水平,及對應的p50和p65蛋白的表達水平均低于對照組,而MMP-9的mRNA和蛋白的表達水平則高于對照組,差異均有統計學意義。根據以上結果推測,在NF-κB和TGF-β1均低表達時,NF-κB對MMP-9生成的促進作用大于TGF-β1對MMP-9生成的抑制作用,可能是由于過度表達的MMP-9消耗了大部分NF-κB的結合位點,余下小部分NF-κB與TGF-β1啟動子結合,懸殊的作用效果導致MMP-9表達異常升高,打破了ECM合成與降解的平衡,使得滋養細胞侵襲過深引起蛻膜ECM過度降解。
綜上所述,NF-κB表達水平的降低,引起TGF-β1水平的降低,可影響MMP-9 /TIMP-1平衡的調控,且MMP-9水平的異常升高,使蛻膜ECM過度降解,引起胚胎植入失敗和不良胎盤形成,最終導致稽留流產的發生。本研究結果對進一步探討稽留流產的發生發展機制提供了新的思路和診療策略。

