L-肌肽對魚藤素誘導SH-SY5Y細胞神經毒性的保護作用
柳傳毅,陳彥潔,方瓊彤,呂滿霞,吳新榮
(1.廣東藥科大學藥學院,廣東 廣州 510006;2. 廣州軍區廣州總醫院藥劑科,廣州市老年慢病患者合理用藥重點實驗室,廣東 廣州 510010)
肌肽是主要由β-丙氨酸和L-組氨酸組成的內源性二肽,目前的研究證實,肌肽具有清除自由基、抗氧化活性,藥理活性廣泛。因肌肽具有高效的藥理活性和低毒的特征,研究者認為,其可以為阿爾茨海默癥、腦卒中等疾病的治療提供新的方向。Holliday等[6]在MRC-5成纖維細胞和HeLa細胞模型上,研究得出20~50 mmol·L-1的肌肽并不影響正常二倍體人成纖維細胞的生長,但是能促進細胞的生長。目前尚未完全得出PD發病機制,但已被證實的機制有氧化應激、清除自由基等。Boldyrev等[7]報道,肌肽能夠明顯改善PD神經癥狀,并能提高血紅細胞中Cu/Zn-超氧化物歧化酶的活性。研究報道,肌肽對臨床上的多種抗腫瘤藥物誘導的毒副作用具有保護作用。Noori等[8]實驗證實,肌肽能夠有效抑制由順鉑誘導的氧化應激導致的超氧化物歧化酶、過氧化物水平的降低。綜上所述,肌肽主要是通過清除自由基、抗氧化應激等機制發揮作用,由此可得出肌肽是一種極具有潛在治療PD的藥物。本研究以SH-SY5Y細胞作為模型,研究L-肌肽是否通過抗氧化應激作用,來降低由魚藤素誘導的神經毒性,進而探究魚藤素的神經毒性。
1 材料
1.1細胞株人神經瘤細胞株 SH-SY5Y,由廣州軍區廣州總醫院醫學實驗科提供。
1.2試劑魚藤素(deguelin,批號:045M4736V,HPLC級)、L-肌肽(批號:BCBQ8925V)、二甲基亞砜(批號:RNBD6895)、Accutase solution(細胞消化液,批號:SLBN5790V),均購自Sigma公司;Annexin V-FITC細胞凋亡檢測試劑盒(批號:C1065-2)、活性氧檢測試劑盒(批號:S0033-1),均購自碧云天公司;胎牛血清,杭州四季青生物工程材料有限公司,批號:20151225;CCK-8試劑,日本同仁公司,批號:JU739;RPMI 1640培養基,Gibco公司,批號:8116053;吖啶橙/溴化乙錠(AO/EB)雙染試劑盒,索萊寶公司,批號:20160111。
1.3儀器二氧化碳培養箱、Multiscan-GO全波長酶標儀(美國Thermo公司);YSK-319型倒置顯微鏡、IX7型倒置熒光顯微鏡(日本Olympus公司);YSK-239型低溫高速離心機(Sigma公司);流式細胞儀(美國Millipore公司)。
2 方法
2.1藥物的配制
2.1.1魚藤素的配制 1 mmol·L-1魚藤素母液配制:在6.3 mL的DMSO溶液中溶解2.5 g魚藤素,并在-20 ℃條件下避光保存,不同溶度的魚藤素用培養基稀釋,現配現用。
2.1.2L-肌肽的配制 將L-肌肽加入到不同體積的培養基中,配制成實驗所需濃度,并用無菌過濾膜過濾,現配現用。
5.實驗環境。在檢驗過程中環境溫度控制不到位,使得溫度增加變化較大,會影響到檢驗儀器設備、試劑的正常運行和工作,使得儀器的精準度發生變化,繼而影響到食品檢驗結果的準確性。
2.2細胞培養從細胞庫中取出SH-SY5Y細胞,快速解凍并在超凈臺上將細胞轉移到離心管中,加入適量已配好的新鮮培養基,離心,取下沉液,后加入新鮮的培養基,培養于37 ℃、5% CO2的恒溫箱中,取對數生長期細胞用于實驗。
2.3CCK-8法檢測細胞存活率取對數生長期細胞,將細胞接種于96孔板,細胞密度為5×107·L-1,每孔接種細胞100 μL后,放入5% CO2培養箱培養,使細胞貼壁。
2.3.1L-肌肽對SH-SY5Y細胞存活率的影響 次日加藥前,去除舊的培養基,每組設5個復孔,其中實驗組每孔100 μL,加入不同濃度的L-肌肽(1、10、20、40、60、80、100 mmol·L-1),其中空白組無細胞,只有培養基,對照組只加相同培養基。加藥后,96孔板中繼續培養24 h。
2.3.2L-肌肽對魚藤素抑制SH-SY5Y細胞增殖作用的影響 次日加藥前,去除舊的培養基,后加入100 μL不同濃度的藥物,其中實驗組加入情況如下:A組:8 μmol·L-1魚藤素;B組:8 μmol·L-1魚藤素+3 mmol·L-1L-肌肽;C組:8 μmol·L-1魚藤素+30 mmol·L-1L-肌肽;D組:20 μmol·L-1魚藤素;E組:20 μmol·L-1魚藤素+3 mmol·L-1L-肌肽;F組:20 μmol·L-1魚藤素+30 mmol·L-1L-肌肽;G組:50 μmol·L-1魚藤素;H組:50 μmol·L-1魚藤素+3 mmol·L-1L-肌肽;I組:50 μmol·L-1魚藤素+30 mmol·L-1L-肌肽,每組設置5個復孔,對照組只加培養基,空白組無細胞,只加培養基。加藥后,置于培養箱中繼續培養24 h后,除去舊培養基,將培養基與CCK-8試劑按照9 ∶1的比例配制成混合溶液后,每孔加入100 μL混合液,培養板繼續在CO2培養箱培養,避光反應2 h,在450 nm波長處,酶標儀測定吸光度。細胞存活率/%=[(OD實驗組-OD空白組)/(OD對照組-OD空白組)]×100%。實驗平行重復3次。
2.4AO/EB法檢測細胞形態和凋亡情況取對數生長期細胞,接種在6孔板中,每孔接種3 mL密度為5×107·L-1,均勻分布。在恒溫培養箱培養,使細胞貼壁。不同實驗分組如下:A組:對照組,只加培養基;B組:20 μmol·L-1魚藤素;C組:30 mmol·L-1L-肌肽;D組:20 μmol·L-1魚藤素+30 mmol·L-1L-肌肽。作用24 h后,用PBS溶液洗滌2次,每孔加入1 mL的PBS。配制AO溶液 ∶EB溶液=1 ∶1的工作液,每孔加入20 μL工作液,室溫放置5 min。最后在熒光倒置顯微鏡下進行觀察,并拍照。
2.5AnnexinV-FITC/PI雙染流式細胞術檢測細胞凋亡率取對數生長期細胞,接種6孔板,每孔接種3 mL密度為5×107·L-1,均勻分布,在CO2培養箱培養,使細胞貼壁。次日除去舊培養基并加藥,實驗分組情況同“2.3.2”。藥物作用24 h后,收集細胞液,并用PBS液洗滌2次,在顯微鏡下計數,將細胞液重懸于EP管中,除去上清液,加入195 μL結合液和5 μL Annexin V-FITC混勻,混勻后加入10 μL PI,混勻液再次混勻,后用流式細胞儀檢測細胞凋亡率。
2.6流式細胞術檢測細胞ROS水平取對數生長期細胞,接種6孔板,每孔接種3 mL密度為5×107·L-1,均勻分布。在CO2培養箱培養,使細胞貼壁。不同實驗分組同“2.3.2”。24 h后收集細胞液,離心5 min,吸取上清液,用無血清培養基按1 000 ∶1比例稀釋10 mmol·L-1DCFH-DA母液,用1 mL稀釋液懸浮細胞,在37 ℃避光條件下孵育30 min,期間每隔5 min振蕩1次,離心后,PBS洗滌,PBS重懸細胞。用流式細胞儀檢測各組細胞ROS水平。
3 結果
3.1L-肌肽對細胞存活率的影響如Fig 1所示,與對照組相比,藥物作用24 h后, 0~100 mmol·L-1的L-肌肽對SH-SY5Y細胞的存活率并沒有明顯影響,在最高濃度100 mmol·L-1時,其對細胞存活率的影響無統計學意義,結果說明,在0~100 mmol·L-1范圍內,L-肌肽對SH-SY5Y細胞沒有明顯的抑制作用。Holliday等[9]研究證實,20~50 mmol·L-1肌肽不僅不影響正常二倍體成纖維細胞的存活,而且還能促進細胞的生長,故本實驗選取低濃度3 mmol·L-1的L-肌肽與30 mmol·L-1的L-肌肽。
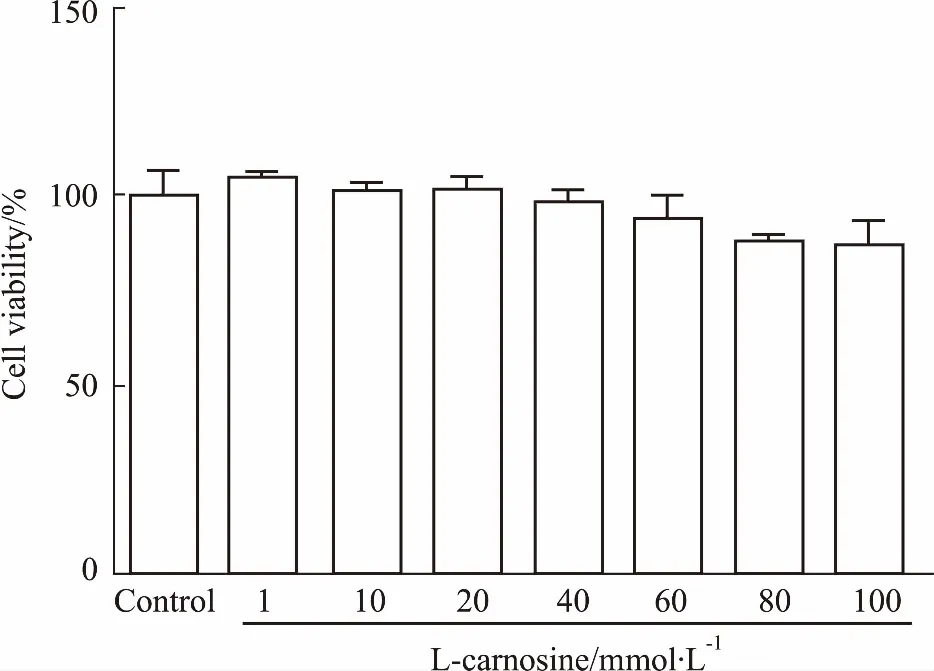
Fig 1 Effect of different concentrations of L-carnosine treated 24 h on viability of SH-SY5Y cells n=3)
如Fig 2 所示,藥物作用24后,3 mmol·L-1與30 mmol·L-1的L-肌肽和魚藤素共作用于SH-SY5Y細胞,能有效降低魚藤素對細胞的抑制作用。與魚藤素單獨作用的細胞的抑制率相比,3 mmol·L-1L-肌肽與20 μmol·L-1魚藤素對細胞的抑制率降低了5.01%(P<0.05),30 mmol·L-1L-肌肽與20、50 μmol·L-1魚藤素對細胞的抑制率分別降低9.07%和6.1%(P<0.05)。結果表明,30 mmol·L-1L-肌肽能夠有效降低魚藤素對SH-SY5Y細胞的增殖抑制作用,保護SH-SY5Y細胞。
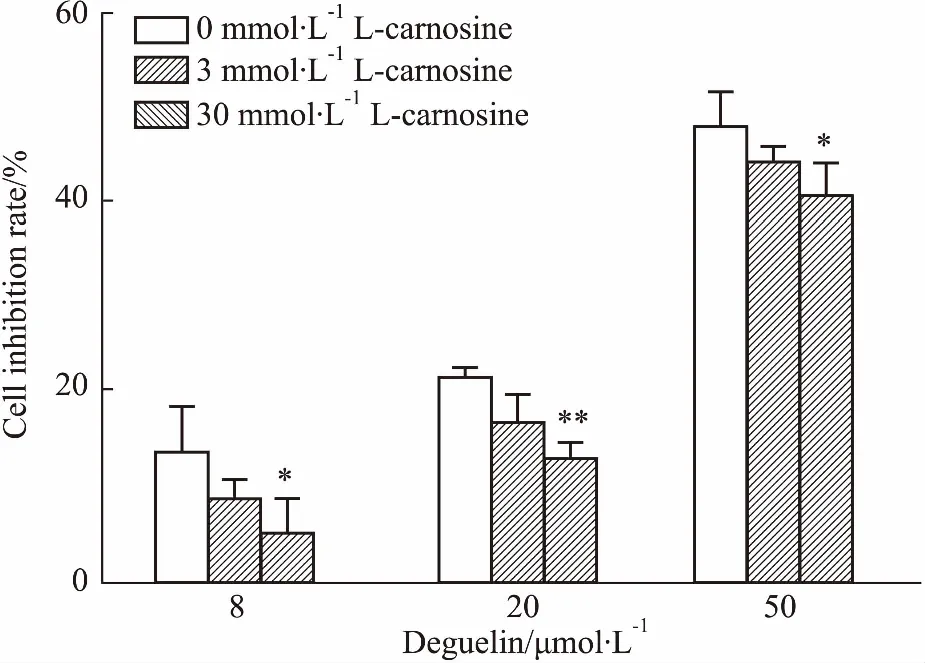
Fig 2 Effect of different concentrations of deguelin and L-carnosine treated 24 h on inhibitory rate of SH-SY5Y cells n=3)
**P<0.05,**P<0.01vs0 mmol·L-1L-carnosine group
3.2L-肌肽對細胞形態和凋亡的影響24 h后,細胞凋亡形態如Fig 3所示,30 mmol·L-1L-肌肽處理組,核內染色質均勻,細胞呈多邊形,少見明顯的凋亡特征。C組20 μmol·L-1魚藤素處理組,部分細胞表現出早期凋亡特征,細胞體積減小,核固縮呈新月狀。D組30 mmol·L-1L-肌肽和20 μmol·L-1魚藤素組,早期凋亡細胞數減少,表明L-肌肽能有效的降低魚藤素對細胞的誘導凋亡作用。
3.3L-肌肽影響細胞凋亡率Tab 1、Fig 4結果顯示,與單獨魚藤素的C組相比,D組的早期凋亡率降低9.35%,總凋亡率降低10.7%,差異有統計學意義(P<0.05),表明L-肌肽可有效保護細胞,抑制細胞凋亡。
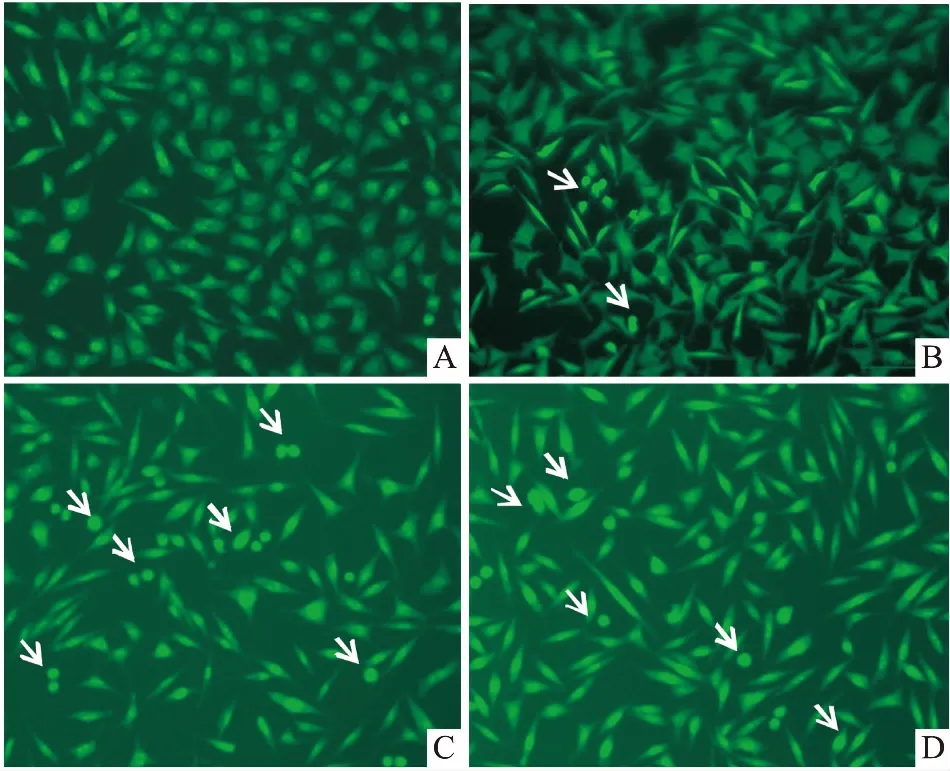
Fig 3 Apoptotic morphology of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h with AO/EB double stained (×200)
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine cotreated group. Arrows: apoptotic cell.
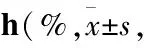
Tab 1 Apoptotic rate of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 n=3)
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine co-treated group.*P<0.05vsgroup A;#P<0.05vsgroup C.
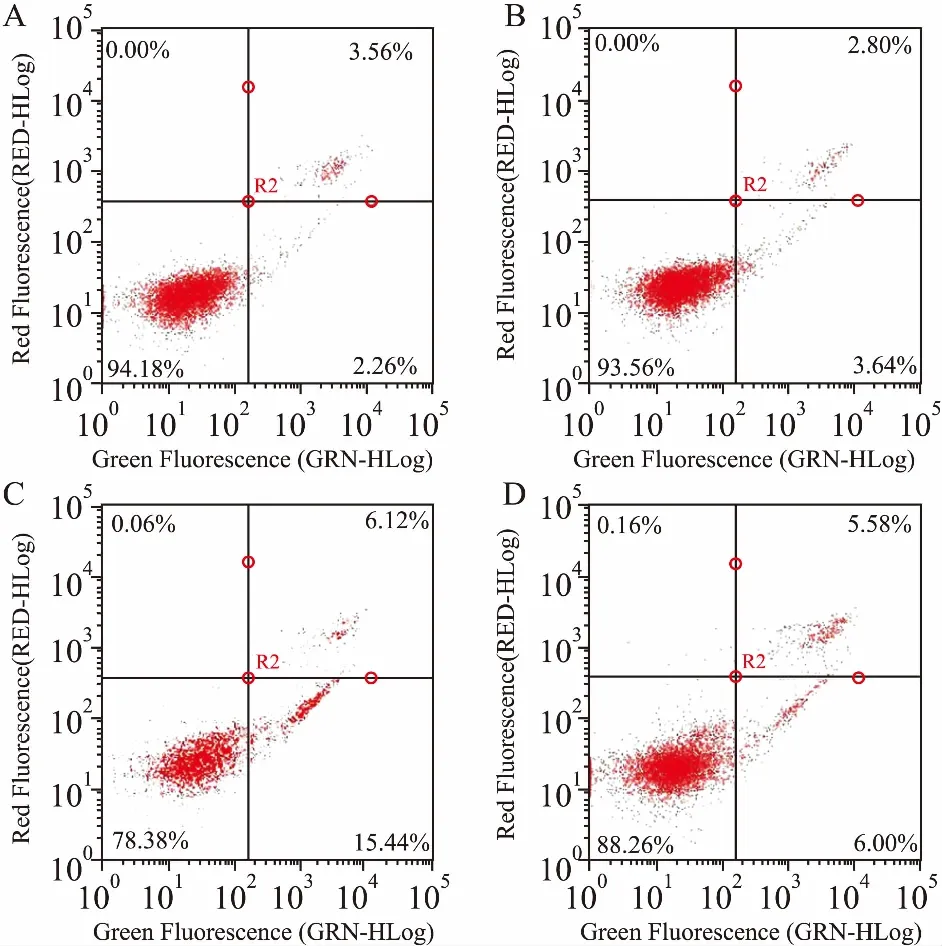
Fig 4 Apoptotic rate of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine co-treated group.
3.4L-肌肽影響細胞的ROS水平如Fig 5所示,與對照組相比,30 mmol·L-1L-肌肽作用后,SH-SY5Y細胞的ROS水平較低,差異有統計學意義(P<0.05)。D組30 mmol·L-1L-肌肽和魚藤素共處理組,ROS水平較魚藤素單獨處理組低,差異有統計學意義(P<0.05)。表明L-肌肽的神經保護作用可能是通過降低細胞內ROS水平實現的。
4 討論
SH-SY5Y細胞是一種分化程度較低的腫瘤細胞,衍生于人的神經母細胞瘤細胞系,其具有酪氨酸羥化酶、多巴胺羥化酶活性和多巴胺轉運體, 因此,該細胞系被廣泛運用于神經系統疾病發病機制的研究,特別是應用于PD發病機制的研究。本研究以SH-SY5Y細胞為模型,用CCK-8法檢測L-肌肽對細胞增殖的影響,結果表明,高濃度100 mmol·L-1的L-肌肽對細胞的增殖并無明顯的抑制作用,3、30 mmol·L-1的L-肌肽在一定程度上能有效降低魚藤素對細胞的增殖抑制作用,尤其是30 mmol·L-1L-肌肽對20 μmol·L-1魚藤素導致的細胞增殖抑制作用的效果最為明顯(細胞抑制率降低近10%),故采用30 mmol·L-1L-肌肽與20 μmol·L-1魚藤素組進行其他相關實驗。通過AO/EB實驗和細胞形態觀察發現,與同濃度的單獨魚藤素組相比,30 mmol·L-1L-肌肽共處理組,細胞的形態得到改善,表現為早期凋亡數減少,說明L-肌肽能夠降低魚藤素對細胞的誘導凋亡作用。
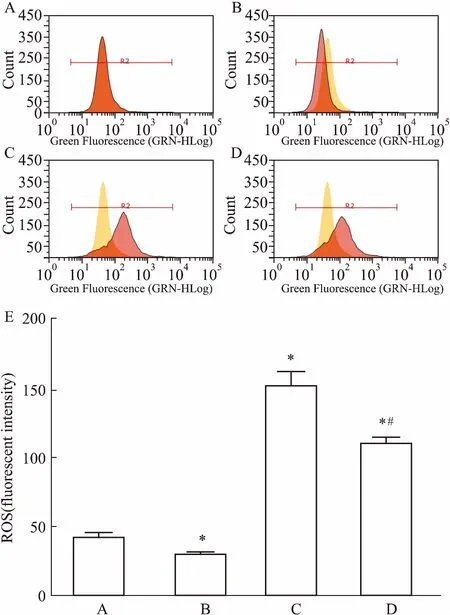
Fig 5 Determination of ROS level of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h
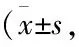
采用Annexin V-FITC/PI雙染流式細胞術定量檢測細胞凋亡率,結果發現,30 mmol·L-1L-肌肽共處理組比20 μmol·L-1魚藤素組細胞的早期凋亡率較小,降低9.35%,同時總凋亡率降低10.7%(P<0.05),故可得知L-肌肽對細胞的保護作用可能是通過抑制細胞的凋亡實現的。
線粒體是氧化應激的主要來源之一,因為它利用氧氣作為能量,產生應激反應。 ROS通常由緊密調節酶產生,如果過度刺激電子傳遞鏈將會導致ROS的過量產生。ROS涉及許多疾病,包括線粒體蛋白質的改變,線粒體脂質和線粒體DNA,這些疾病將導致神經細胞的損傷。氧化應激被認為是許多病因的主要原因,包括PD和阿爾茨海默病。研究者發現幾個與PD有關的基因涉及到線粒體的功能,神經退行性疾病發生的原因可能是線粒體功能障礙[10]。Dexter等[11]認為,氧化應激是導致PD的主要原因之一。之前研究發現,魚藤素存在神經毒性是因為其作用于細胞的同時,抑制了線粒體復合體I,線粒體復合體I被抑制后,電子傳遞鏈將無法進行,導致ROS水平升高[12]。本研究采用DCFH-DA染色,流式細胞術檢測不同組的細胞ROS水平,結果發現,與對照組相比,30 mmol·L-1L-肌肽組作用于SH-SY5Y細胞后的 ROS水平較低(P<0.05),其中,30 mmol·L-1L-肌肽和魚藤素共處理組,ROS水平較魚藤素單獨處理組低(P<0.05),表明L-肌肽保護神經細胞毒性的機制可能是通過抗氧化應激反應。
本研究證實,L-肌肽主要通過抗氧化機制來降低細胞的神經毒性,與魚藤素聯用時,可以降低魚藤素誘導的神經毒性,這為進一步研究魚藤素神經毒性和尋找降低魚藤素毒性的方法提供了依據。