P2W18O626-@Tb3+溶液電致變色/熒光開關性質的可逆調控及對H2O2的光譜檢測
王 斌 鄭金慧 劉哲林 王曉紅 段莉梅 白鎖柱 許 良,2 劉宗瑞*,
(1內蒙古民族大學化學化工學院,通遼 028043)
(2天然產物化學及功能分子合成自治區重點實驗室,通遼 028000)
(3長春理工大學化學與環境工程學院,長春 130022)
0 引 言
熒光開關是指發光分子在外界刺激下熒光信號發生可逆的發光與淬滅過程,在熒光成像、光學信息存儲、生物及化學傳感等領域有潛在的應用價值[1-2]。多金屬氧酸鹽(簡稱多酸)是由前過渡金屬元素W、Mo、V、Nb、Ta的酸式鹽脫水縮合而成的金屬-氧簇合物,具有組成豐富、結構多樣、納米尺度可調控、可逆的氧化還原以及光、電、磁等性質,在催化、能源、材料、生物等領域有重要的應用前景[3-4]。在紫外/可見光照、電化學氧化/還原、化學氧化/還原等作用下,多酸會發生可逆的氧化還原反應并伴隨著可逆的變色性質,還原態多酸在可見區有寬的吸收峰,可以作為能量受體被用于熒光開關的設計[5-7]。
目前,基于稀土多酸熒光開關的研究主要集中在化學響應、光調控、電化學調控熒光開關。在化學響應熒光開關方面,Liu等[8]通過Langmuir-Blodgett(LB)技術構筑了多酸紅光薄膜4-hexadecylaniline/EuW10,在HCl與NH3刺激下實現了紅光薄膜可逆的熒光開關性質,熒光開關的機理歸屬于O→W的激發態電子與H+之間的電子轉移;Song等[9]利用旋涂法構筑了聚丙烯腈(PAN)、EuW10雜化自支持薄膜PAN-EuW10, 在 HCl、H2S、SO2刺激下薄膜的熒光淬滅,在NH3刺激下薄膜的熒光恢復,同時實現了對H2S、SO2等氣體分子的熒光光譜檢測;Wan等[10]利用自組裝技術制備了稀土多酸/嵌段共聚物poly(ethylene oxide-b-N,N-dimethylaminoethyl methacrylate)(PEO-b-PDMAEMA)雜化超分子復合物DyW10/PEO-b-PDMAEMA,在CO2/Ar的刺激下,該稀土多酸復合物呈現出可逆的化學響應熒光開關性能,同時實現了對CO2分子的熒光光譜檢測;Wang等[11]在維生素C/H2O2的作用下,對稀土多酸Eu-PMo12O40可逆的化學響應變色/熒光開關性質進行研究,實現了該稀土多酸對維生素C的紫外可見、熒光雙光譜可逆檢測。在光調控熒光開關方面,Yao等[12]利用Casting技術制備了[Eu(SiW10MoO39)2]13-/Agarose雜化自支持紅光薄膜,在紫外、可見光刺激下,實現了稀土多酸紅光薄膜可逆的熒光開關性質,光調控熒光開關的機理歸屬于分子內熒光共振能量轉移。在電化學調控熒光開關方面,Bi等[13]利用Layer-By-Layer(LBL)技術制備了聚乙烯亞胺(PEI)、稀土多酸雜化紅光薄膜[PEI/EuGeW11]34,在外加氧化還原電位-0.85/0.85 V下實現了多酸紅光薄膜可逆的電致變色/熒光開關性質;隨后,該課題組通過LBL技術構筑了一系列PEI、聚二甲基二烯丙基氯化銨(PDDA)與稀土多酸的發光薄膜[PEI/DyPW11]41、[PDDA/SmPW11]n,在外加氧化還原電位下實現了橙光及白光薄膜多色可調控熒光開關性能[14-15];Dong等[16]基于多酸(Na-POM)/稀土上轉換納米粒子 (UCNPS)復合物UCNPS@Na-POM可逆的電致變色/熒光開關性質,實現了對抗氧化劑谷胱甘肽的熒光光譜檢測;Wu等[17]將電化學還原與化學氧化法相結合實現了稀土多酸[(CH3)4N]2.5H7.5[Eu(GeW11O39(H2O)2]2可逆的變色/熒光開關性質,同時實現了稀土多酸對H2O2的紫外可見、熒光雙光譜檢測。
我們基于分子設計思想及分子間熒光共振能量轉移,以可逆電致變色性質的多酸陰離子P2W18O626-為能量受體(receptor),以優異綠光性質的Tb3+為能量給體(donor),在外加氧化還原電位下對P2W18O626-@Tb3+綠光體系電致變色/熒光開關性能進行調控;考察不同氧化還原電位對混合溶液著色程度及熒光開關能量轉移效率的影響,獲得多酸還原電子數與熒光開關能量轉移效率的內在聯系。在此基礎上,基于還原態多酸與H2O2的氧化還原反應,利用電化學還原態多酸P2W18O6212-@Tb3+溶液對H2O2進行紫外可見、熒光雙光譜檢測。
1 實驗部分
1.1 試劑與儀器
硝酸鋱(Tb(NO3)3·6H2O,99.9%)購買于江西贛州稀土集團有限公司;鎢酸鈉(Na2WO4·2H2O,99.5%)、過氧化氫(H2O2,30%)等試劑購買于國藥集團化學試劑有限公司,均為分析純。實驗過程中使用的二次水由Millipore Milli-Q凈化水系統處理(18.2 MΩ·cm)。
X射線衍射儀 (D8 Focus,德國布魯克有限公司),測試電壓40 kV,電流40 mA,輻射源為Cu Kα(λ=0.154 1 nm)測試范圍 3°~80°;傅立葉紅外光譜儀(Nicolet-5700,美國尼高力公司);電化學工作站(CHI660e,上海辰華儀器有限公司),采用三電極體系 (1 cm×1 cm的鉑片為工作電極和對電極,Ag/AgCl為參比電極),電解液為pH=1的 0.5 mol·L-1H2SO4/Na2SO4緩沖溶液 (用 0.5 mol·L-1H2SO4將 0.5 mol·L-1Na2SO4溶液的pH調節到pH=1);紫外可見光譜儀(UV-670,上海美普達儀器有限公司),紫外可見光譜與動力學曲線分別通過Scan、Kinetics方法測得,比色皿厚度為1 cm;熒光光譜儀(F-4600,日本日立公司),比色皿厚度為1 cm,狹縫大小均為10 nm,激發波長 λEx≈377 nm。
1.2 K6P2W18O62的合成與結構
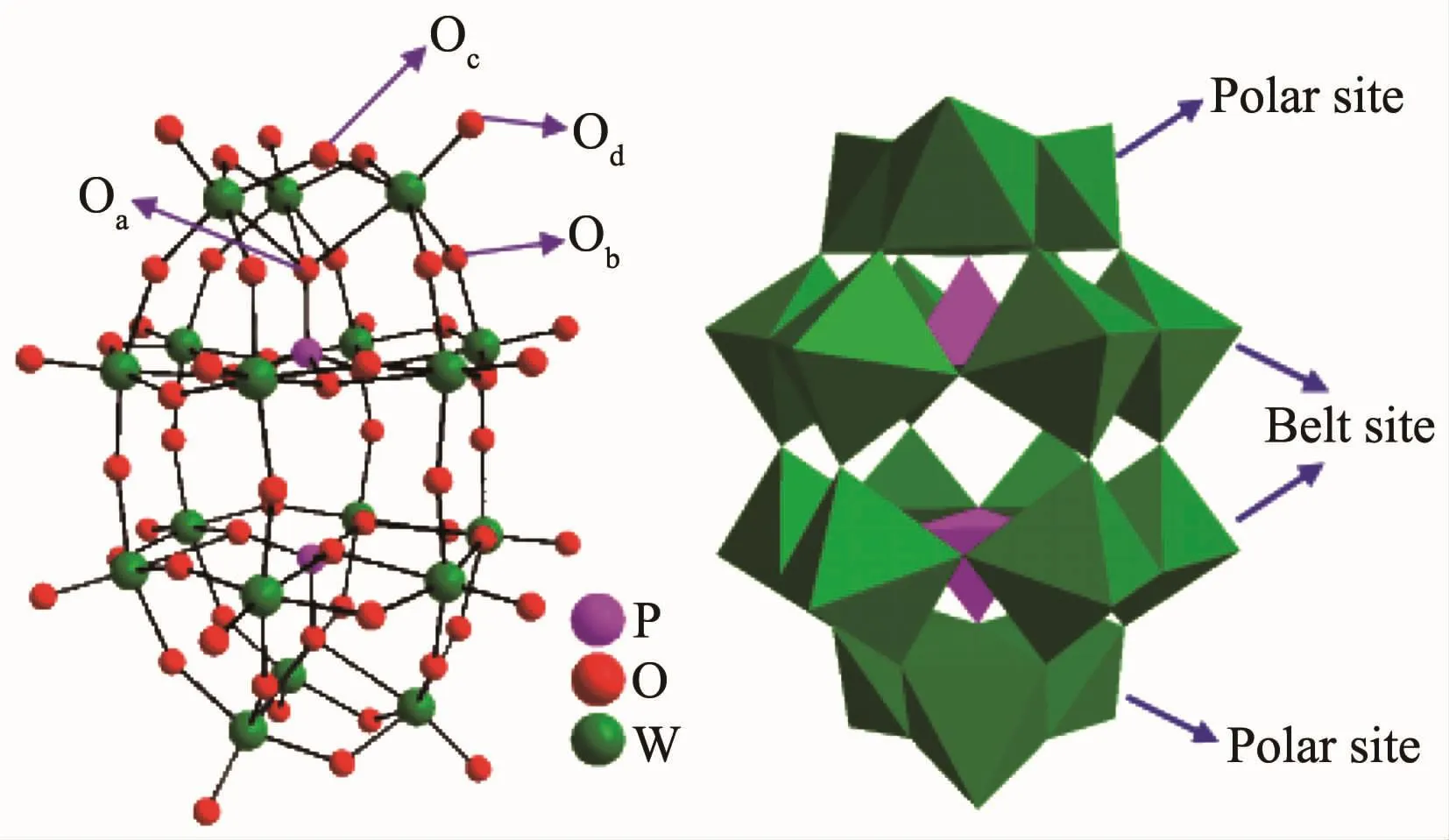
圖1 P2W18O626-多酸陰離子的球棍模型 (左)和多面體結構 (右)Fig.1 Ball-stick representation(left)and polyhedral structure of the polyoxoanion P2W18O626-(right)
根據文獻方法合成了Dawson型多酸K6P2W18O62·14H2O(簡寫為P2W18)[18]。在Dawson型多酸陰離子P2W18O626-中存在4種不同配位氧原子,即中心氧(Oa)、共點相連橋氧(Ob)共邊相連橋氧(Oc)、端氧(Od),其中極位上的3個WO6八面體共邊相連形成三金屬簇W3O10,而赤道位上的6個WO6八面體通過共點、共邊交替連接形成六元環,極位三金屬簇與赤道位六元環通過PO4四面體共點相連形成PW9O349-,上下2個PW9O349-共點相連形成了Dawson型多酸陰離子P2W18O626-(圖1)。
1.3 K6P2W18O62的結構表征
利用粉末X射線衍射與紅外光譜對K6P2W18O62的結構進行表征。在K6P2W18O62的XRD圖中出現了一系列Dawson型多酸的特征衍射峰,與文獻報道基本一致[19](圖2a);在紅外光譜中,波數為1 085、961、910、777 cm-1處出現了 K6P2W18O62的特征吸收峰,分別歸屬于 P-Oa、W-Od、W-Oc、W-Ob的對稱或不對稱伸縮振動[20],結果表明已成功合成了Dawson型多酸 K6P2W18O62(圖 2b)。
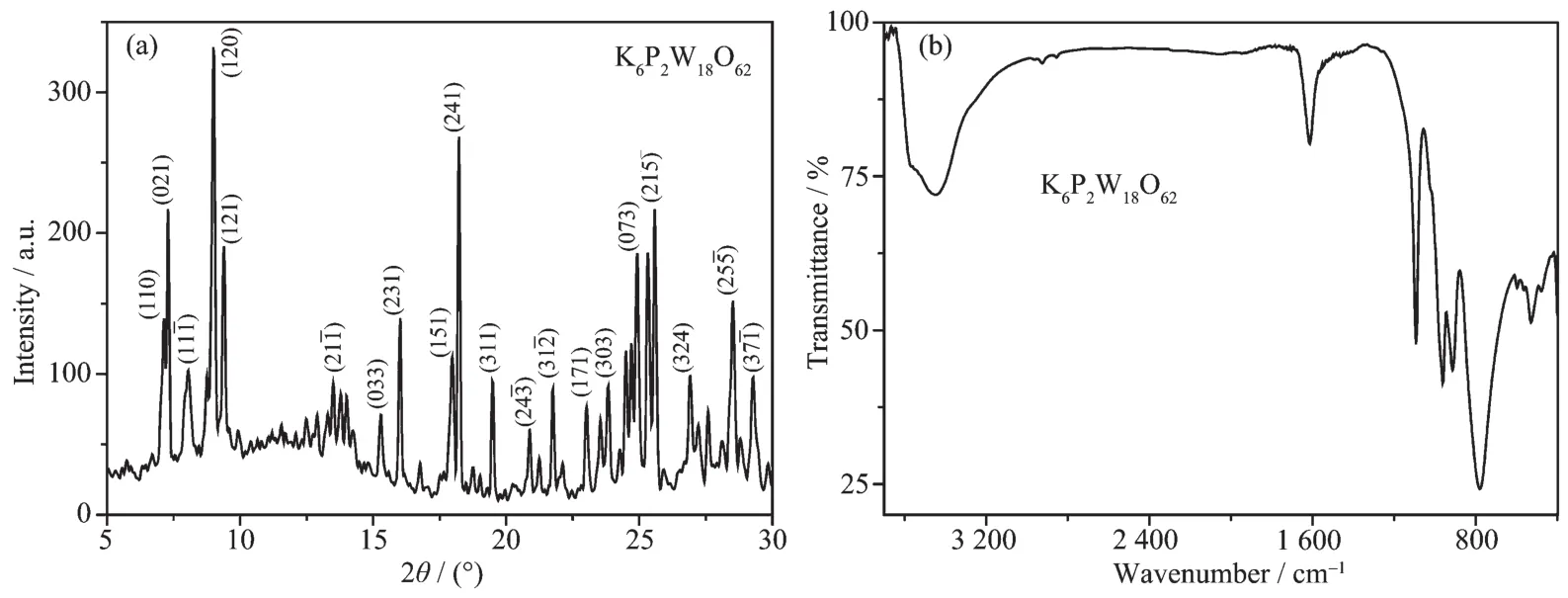
圖2 K6P2W18O62的XRD(a)和紅外光譜圖 (b)Fig.2 XRD patterns(a)and FTIR spectra(b)of K6P2W18O62
1.4 K6P2W18O62溶液的循環伏安曲線
圖3 為 0.6 mmol·L-1的 K6P2W18O62在 pH=1 的0.5 mol·L-1H2SO4/Na2SO4緩沖溶液中的循環伏安曲線,半波電位E1/2=(Ea+Ec)/2(其中Ea為陽極峰電位,Ec為陰極峰電位)在-0.04(Ⅰ-Ⅰ′)、-0.22(Ⅱ-Ⅱ′)、-0.53(Ⅲ-Ⅲ′)、-0.75 V(Ⅳ-Ⅳ′)處出現了 4 對 Dawson型多酸的特征氧化還原峰,分別對應于1e、1e、2e、2e可逆的氧化還原過程[21];通過對不同掃描速度50、100、150、200、250、300 mV·s-1下循環伏安曲線的比較,發現氧化峰Ⅱ、還原峰Ⅱ′的峰電流與掃描速度的平方根成正比,表明多酸在溶液中的電化學行為屬于擴散控制過程[22]。
1.5 K6P2W18O62溶液的紫外可見光譜
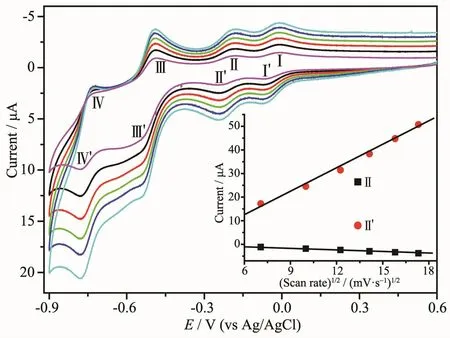
圖3 K6P2W18O62溶液在掃描速度為 50、100、150、200、250和300 mV·s-1下的循環伏安曲線Fig.3 Cyclic voltammetry curves of K6P2W18O62solution with the scan rate 50,100,150,200,250 and 300 mV·s-1
圖4為 10-5mol·L-1K6P2W18O62溶液的紫外可見吸收光譜,在紫外區190~380 nm范圍內出現了Dawson型多酸的特征吸收峰,分別歸屬于Od→W(196 nm)、Ob/Oc→W(250、300 nm)配體到金屬的電荷遷移躍遷(LMCT)[23]。
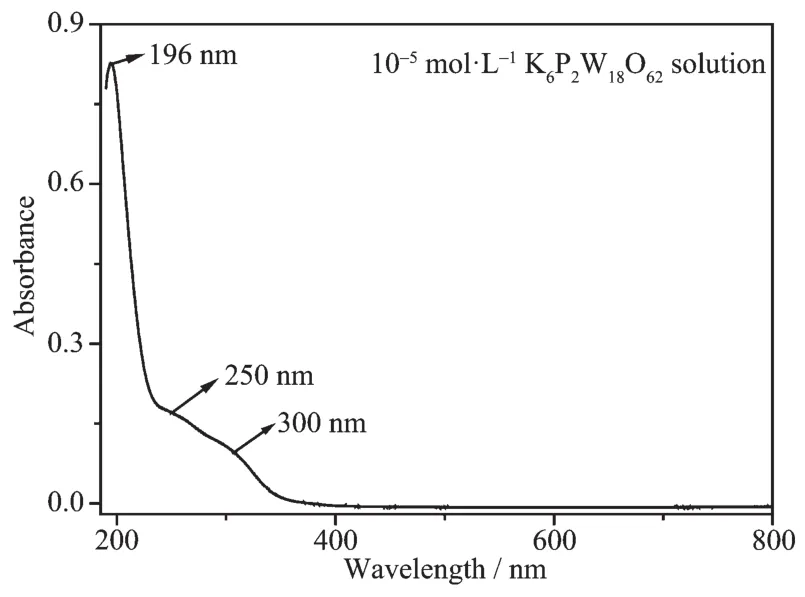
圖4 K6P2W18O62溶液的紫外可見光譜圖Fig.4 UV-Vis spectra of K6P2W18O62aqueous solution
2 結果與討論
2.1 濃度對著色程度及熒光強度的影響
在外加還原電位-0.85 V下,對濃度為0.2、0.4、0.6、0.8 mmol·L-1的 K6P2W18O62溶液進行電解,隨著還原時間的延長,溶液由無色變為深藍色,在700 nm處的吸光度逐漸增大、著色程度逐漸增強,1.5 h后吸光度不再變化,表明K6P2W18O62溶液著色已達到飽和(圖5a);同時,在可見區400~800 nm 的范圍內出現寬的吸收峰,歸屬于W5+/W6+分子內價電子轉移吸收帶(IVCT)[24],隨著多酸溶液濃度的增大,著色平衡時750 nm處吸光度呈線性增加(圖5b)。
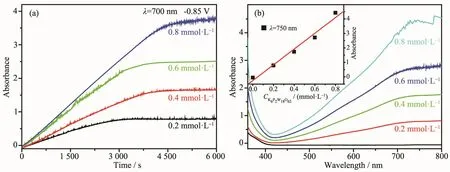
圖5 外加還原電位-0.85 V下,不同濃度K6P2W18O62溶液在700 nm處的吸光度隨時間的變化曲線(a)及著色平衡時的紫外可見光譜(b)Fig.5 Curves of the absorbance at 700 nm versus time(a)and the corresponding absorption spectra at coloring equilibrium(b)of K6P2W18O62solution with different concentrations when applied a reduction potential-0.85 V
圖6a 為 0.6 mmol·L-1的 K6P2W18O62與 10、20、30、40、50、60、70、80、90、100 mmol·L-1的 Tb(NO3)3混合溶液P2W18O626-@Tb3+的熒光光譜,在491、547、588、624 nm處出現了一系列Tb3+的特征發射峰,分別歸屬于5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3的軌道能級躍遷[25];同時隨著Tb3+濃度的增大,547 nm處的熒光發射峰線性增強(圖6b)。
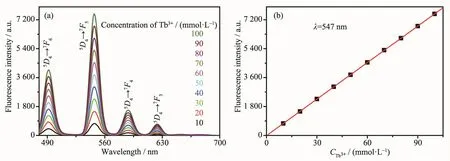
圖6 P2W18O626-@Tb3+混合溶液的熒光光譜 (a)及547 nm處的熒光強度對Tb3+濃度作圖 (b)Fig.6 Fluorescence spectra of the mixed solution P2W18O626-@Tb3+(a)and the fluorescence intensity at 547 nm with different Tb3+concentrations(b)
2.2 P2W18O626-@Tb3+可逆電致變色及熒光開關性能
在外加氧化還原電位-0.85/0.85 V下,對0.6 mmol·L-1K6P2W18O62與 100 mmol·L-1Tb(NO3)3混合溶液的電致變色及電化學調控熒光開關性能進行研究。在外加還原電位-0.85 V下,隨著還原時間的延長,750 nm處的吸光度逐漸增大,在可見區400~800 nm范圍內出現寬的吸收峰;而在外加氧化電位0.85 V下,隨著氧化時間的延長750 nm處的吸光度逐漸降低,在可見區400~800 nm范圍內的吸收峰消失,溶液呈現出可逆的電致變色性質(圖7(a,b))。與此同時,在外加還原電位-0.85 V下,隨著還原時間的延長547 nm處的熒光強度逐漸降低,在460~700 nm范圍內的熒光發射峰減弱,熒光淬滅;而在外加氧化電位0.85 V下,隨著氧化時間的延長547 nm處的熒光強度逐漸增強,在460~700 nm范圍內的熒光發射峰恢復,溶液呈現出可逆的電化學調控熒光開關性質(圖 7(c,d))。
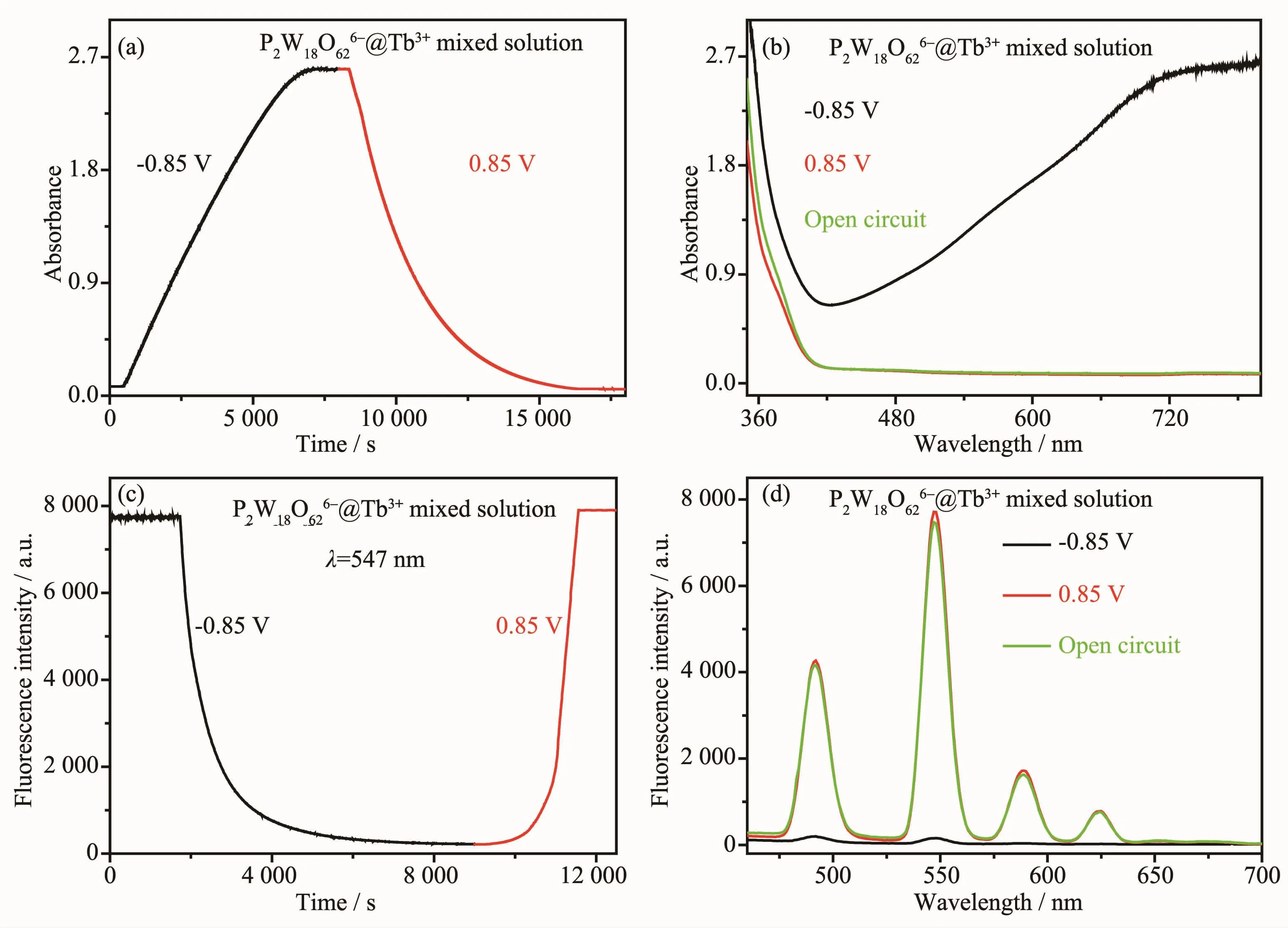
圖7 在-0.85/0.85 V下,混合溶液P2W18O626-@Tb3+的紫外可見動力學曲線 (a)、紫外可見光譜 (b)、熒光動力學曲線 (c)和熒光光譜 (d)Fig.7 UV-Vis kinetic curves(a),UV-Vis absorption spectra(b),fluorescence kinetic curves(c)and fluorescence spectra(d)of the mixed solution P2W18O626-@Tb3+when applied redox potential-0.85/0.85 V
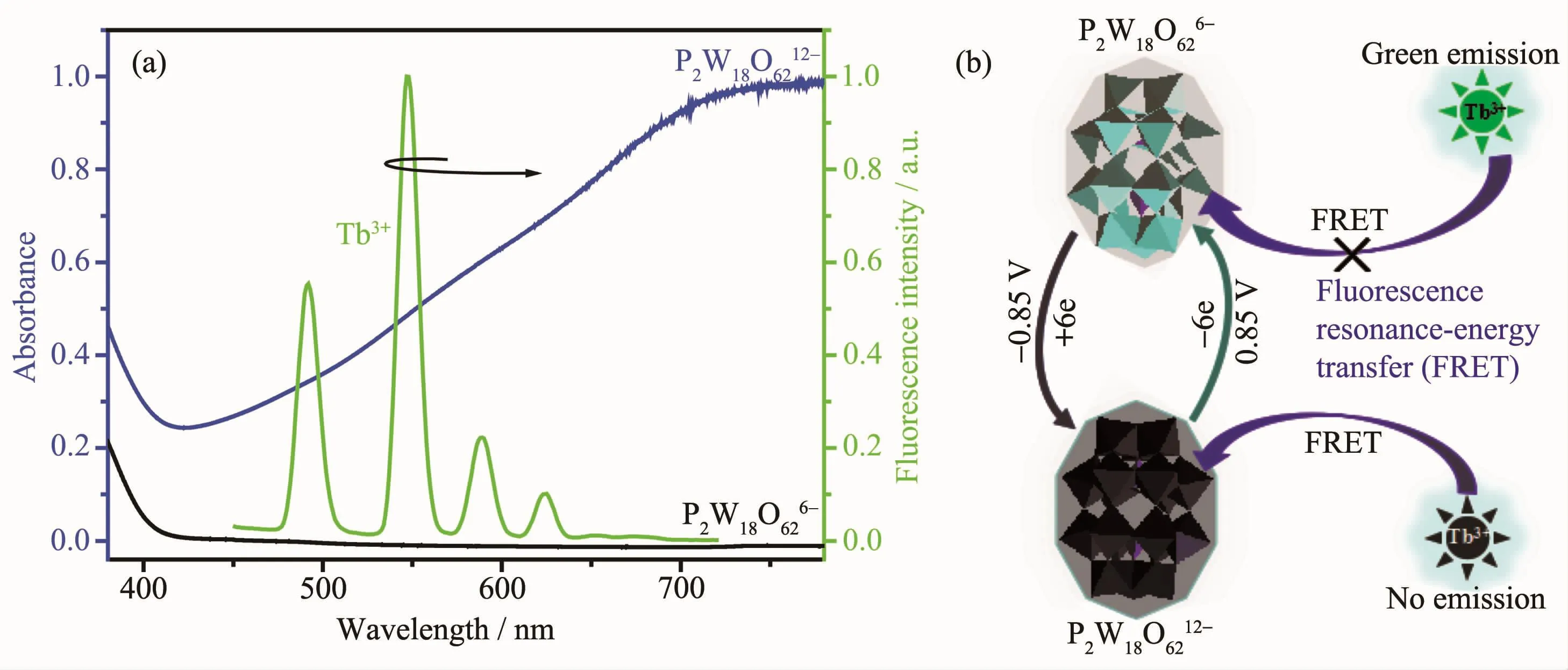
圖8 多酸陰離子P2W18O6212-、P2W18O626-的紫外可見吸收光譜與Tb3+的熒光光譜 (a)及電致變色/熒光開關過程的機理示意圖 (b)Fig.8 UV-Vis spectra,fluorescence spectra of Tb3+(a)and the mechanism of electrochromic and luminescent switching process(b)of the polyanions P2W18O6212-and P2W18O626-
將Tb3+離子的熒光發射光譜與多酸陰離子的可見吸收光譜重疊,在外加還原電位-0.85 V下,多酸陰離子P2W18O626-得到6個電子被還原成P2W18O6212-,同時在可見區出現寬的吸收峰(圖8a,藍線),而Tb3+的熒光發射峰完全被P2W18O6212-的吸收光譜所覆蓋(圖8a,綠線),二者可以發生分子間熒光共振能量轉移(fluorescence resonance energy transfer,FRET)[26],能量給體Tb3+將輻射出的能量轉移給能量受體P2W18O6212-,進而導致Tb3+的熒光淬滅;而在外加氧化電位0.85 V下,電化學還原態多酸陰離子P2W18O6212-失去6個電子重新被氧化成P2W18O626-,可見區的吸收峰消失(圖 8a,黑線),此時 P2W18O626-不能吸收Tb3+所輻射的能量,Tb3+的熒光恢復,溶液P2W18O626-@Tb3+呈現出可逆的電致變色及電化學調控熒光開關效應。圖8b為P2W18O626-@Tb3+混合體系電致變色/熒光開關能量轉移過程示意圖,在外加還原電位-0.85 V下,多酸得到電子被還原成P2W18O6212-,由無色變為藍色,能夠吸收Tb3+發射出來的綠光,導致Tb3+的熒光淬滅;而在外加氧化電位0.85 V下,P2W18O6212-失去電子被氧化成P2W18O626-,由藍色變為無色,此時P2W18O626-與Tb3+之間不發生能量轉移,Tb3+的熒光恢復。
2.3 氧化還原電位對電致變色及熒光開關性能的影響
在外加不同氧化還原電位±0.38、±0.69、±0.85 V下,對P2W18O626-@Tb3+混合溶液的電致變色及電化學調控熒光開關性質進行研究。利用紫外可見動力學方法對溶液的電致變色響應速度進行考察,隨著還原電位的減小(-0.38、-0.69、-0.85 V),多酸陰離子P2W18O626-得電子數增大,分別獲得2e、4e、6e的還原產物,溶液著色平衡所需的時間逐漸縮短 (圖9a),著色平衡時750 nm處的吸光度逐漸增強;隨著氧化電位的增大,溶液褪色過程所需的時間逐漸縮短(圖9b)。同時,隨著還原電位的減小,著色平衡后溶液的藍色逐漸加深,在可見區400~800 nm區間內的吸收峰逐漸增強(圖9c);而隨著還原電位的減小,溶液在460~700 nm區間的熒光發射峰逐漸降低,熒光淬滅程度逐漸增大 (圖9d),在還原電位-0.38、-0.69、-0.85 V下溶液的熒光開關能量轉移效率分別為85.97%、87.53%、93.42%。

圖9 混合溶液P2W18O626-@Tb3+在不同還原電位 (a)、氧化電位 (b)下的紫外可見動力學曲線;混合溶液P2W18O626-@Tb3+在不同還原電位下的紫外可見光譜 (c)、熒光光譜(d)Fig.9 UV-Vis kinetic curves of P2W18O626-@Tb3+mixed solution at different reduction potentials(a)and oxidation potentials(b);Corresponding UV-Vis spectra(c)and fluorescence spectra(d)of P2W18O626-@Tb3+mixed solution at different reduction potentials
2.4 基于P2W18O6212-@Tb3+溶液電致變色-熒光開關性質對H2O2的光譜檢測
將電化學還原與H2O2氧化法相結合,基于P2W18O626-@Tb3+溶液可逆變色-熒光開關性質實現了對H2O2紫外可見、熒光雙光譜檢測(圖10)。在外加還原電位-0.85 V下,P2W18O6212-@Tb3+溶液在可見區400~800 nm范圍內出現寬的吸收峰(圖10a);與此同時溶液在460~700 nm范圍內的熒光發射峰降低,熒光淬滅(圖 10c)。 而在 0.04、0.08、0.12、0.16、0.20、0.24、0.28 mmol·L-1的 H2O2作用下,P2W18O6212-被氧化成P2W18O626-,溶液的藍色逐漸消失,隨著H2O2濃度的增大可見區的吸收峰逐漸降低,以750 nm處的吸光度對H2O2的濃度作圖,得到吸光度(A)對H2O2濃度(C)的線性檢測方程A=-8 956.5C+2.636 8(線性相關系數r=99.4%),該紫外可見光譜法對 H2O2濃度檢測的線性范圍為 1.76×10-5~0.28 mmol·L-1,檢出限 CL=kSN/m=1.76×10-2μmol·L-1(其中m為標準曲線的斜率,值為-8 956.5 L·mol-1;SN為標準偏差,值為 5.42×10-5;k為置信因子,值為 3)(圖10b);與此同時,隨著H2O2濃度的增大溶液在460~700 nm范圍內的熒光發射峰逐漸增強、熒光恢復,以547 nm處熒光強度的對數對H2O2濃度作圖,獲得熒光檢測的線性方程lnI=12 849.9C+4.955 1(線性相關系數r=96.5%),該熒光光譜法對維生素C濃度的線性檢測范圍為 3.04×10-3~0.28 mmol·L-1,檢出限 CL=kSN/m=3.04 μmol·L-1(其中 m=12 849.9 L·mol-1;SN=1.30×10-2;k=3)(圖 10d)。
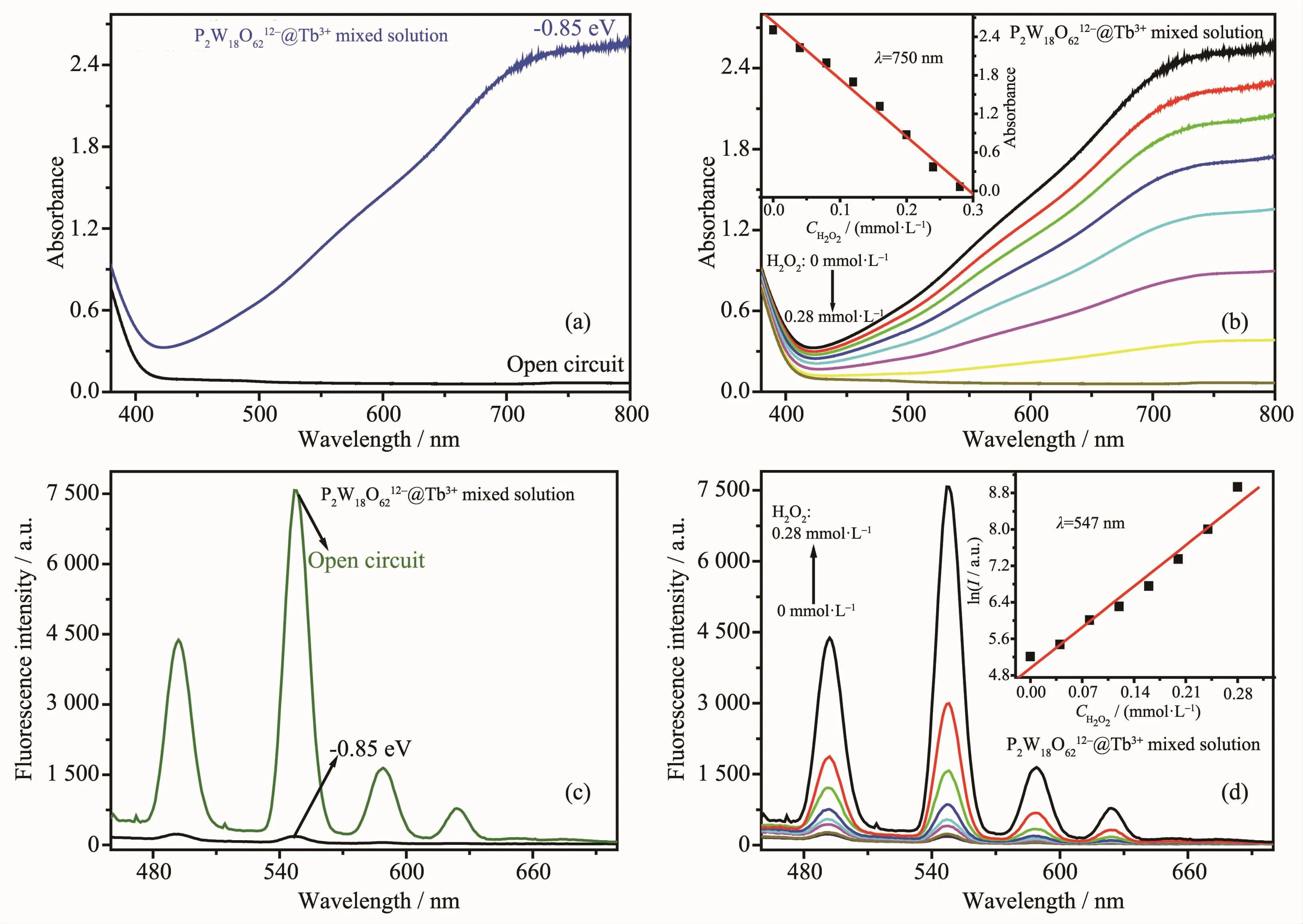
圖10 在-0.85 V下P2W18O6212-@Tb3+溶液的紫外可見光譜 (a)及熒光光譜 (c),在不同濃度H2O2下溶液的紫外可見光譜 (b)及熒光光譜 (d)Fig.10 UV-Vis spectra(a)and fluorescence spectra(b)of P2W18O626-@Tb3+mixed solution when applied a reduction potential-0.85 V;UV-Vis spectra(c)and fluorescence spectra(d)of P2W18O6212-@Tb3+mixed solution with different H2O2concentrations
3 結 論
在外加氧化還原電位±0.85 V下,實現了P2W18O626-@Tb3+混合溶液可逆的電致變色及熒光開關雙功能性質,熒光開關的機理歸屬于變色多酸P2W18O626-與綠光Tb3+分子間熒光共振能量轉移。通過控制還原電位-0.38、-0.69、-0.85 V分別獲得多酸陰離子P2W18O626-的2e、4e、6e還原產物,隨著還原電子數的增加P2W18O626-@Tb3+混合溶液電致變色著色能力增強、響應速率加快;同時,溶液的熒光淬滅程度逐漸增大,熒光開關能量轉移效率分別為85.97%、87.53%、93.42%。最后利用電化學還原態P2W18O6212-@Tb3+溶液對H2O2紫外可見、熒光雙光譜檢測,紫外可見光譜法對H2O2檢測的線性方程為A=-8 956.5C+2.636 8, 線性檢測范圍為 1.76×10-5~0.28 mmol·L-1,檢出限為 1.76×10-2μmol·L-1;熒光光譜法對H2O2檢測的線性方程為lnI=12 849.9C+4.955 1,線性檢測范圍為 3.04×10-3~0.28 mmol·L-1,檢出限為 3.04 μmol·L-1。該研究對多酸基變色/熒光開關體系的設計及其在生化傳感領域的應用具有一定的理論及實際意義。

