嗜水氣單胞菌感染青魚肝臟的蛋白質組學分析
劉 問
(湖州師范學院生命科學學院, 浙江省水生生物資源養護與開發技術研究重點實驗室, 湖州 313000)
青魚(Mylopharyngodon piceus)是我國傳統淡水養殖的“四大家魚”之一, 具有生長快、產量高、肉味鮮美等特點, 深受廣大消費者的喜愛。據統計,2017年我國養殖青魚年產量達6.32×108kg, 主產區為江蘇、安徽、江西、浙江、湖北等省[1]。隨著青魚養殖業的快速發展, 養殖面積不斷擴大, 集約化程度不斷提高, 養殖水質易惡化, 在養殖過程中青魚病害頻發, 其中以嗜水氣單胞菌(Aeromonas hydrophila)感染引起的病害最為嚴重, 造成了較大的經濟損失[2—6]。嗜水氣單胞菌廣泛存在于淡水、污水及土壤中, 是淡水養殖魚類的主要致病菌。在嗜水氣單胞菌侵入魚體后, 先在腸道內增殖, 再經門動脈循環進入肝臟、腎臟及其他組織, 引起肝臟、腎臟等器官以及血液病變, 繼而出現全身癥狀。在我國, 嗜水氣單胞菌是危害養殖魚的種類最多、影響區域最廣、流行季節最長、發病率和死亡率高、造成經濟損失最嚴重的細菌性病原[7—13], 對我國水產養殖業構成了嚴重威脅。
魚類肝臟具有分泌膽汁、排毒、儲存糖元等功能, 是機體維持生理機能最核心的器官之一。在魚體受嗜水氣單胞菌侵染后, 肝臟表現出不同程度的病理變化, 如腫大、充血或失血等, 顯微鏡檢可見血源性色素沉著、肝細胞腫脹、變性、壞死、崩解等癥狀。目前, 鮮見應用蛋白質組學方法研究嗜水氣單胞菌對魚體肝臟的分子致病機制方面的報道。本研究采用iTRAQ蛋白質組學技術, 通過分析嗜水氣單胞菌感染青魚前后青魚肝臟組織蛋白表達的變化, 及差異表達蛋白主要參與的生物過程及信號通路等, 探討嗜水氣單胞菌對青魚的致病機制。
1 材料與方法
1.1 實驗動物
健康青魚購自浙江湖州市某養殖場, 平均體重為186 g, 養殖水溫為(26±1)℃ 。
1.2 主要儀器
Easy nLC色譜系統(Thermo Scientific)、Q Exactive質譜儀(Thermo Scientific)、AKTA Purifier 100純化儀(GE Healthcare)、Multiskcan FC酶標儀(Thermo Scientific)、低溫高速離心機(Eppendorf 5430R)、真空離心濃縮儀(Eppendorf Concentrator Plus)、MP Fastprep-24勻漿儀(MP Biomedicals)、超聲破碎儀(寧波新芝JY92-II)、Votex振蕩器(上海琪特QT-1)。
1.3 青魚感染試驗
采用致病性嗜水氣單胞菌菌株BCK0712(由本實驗室分離自發病青魚), 腹腔注射感染健康青魚,注射劑量為7.60×105cfu/g組織, 每組注射5尾青魚,對照組注射生理鹽水, 實驗水溫為26℃。在注射24h后, 采集感染組和對照組青魚肝臟, 分裝后-80℃凍存。同時對感染組和對照組的青魚進行細菌分離和鑒定, 對其是否感染嗜水氣單胞菌進行確認。
1.4 蛋白質提取及酶解
取50—100 mg肝臟組織加入1 mL SDT裂解液(4%SDS, 100 mmol/L Tris-HCl, 1 mmol/L DTT,pH7.6), 勻漿后超聲破碎, 沸水浴15min, 14000×g離心40min, 取上清。采用BCA法進行蛋白質定量。分裝樣品, -80℃凍存。
取30 μL蛋白質溶液, 分別加入DTT至終濃度為100 mmol/L, 沸水浴5min, 冷卻至室溫。加入200 μL UA緩沖液(8 mmol/L尿素, 150 mmol/L Tris-HCl, pH 8.0)混勻, 14000×g離心15min, 棄上清。加入100 μL IAA緩沖液(100 mmol/L IAA于UA), 振蕩混勻, 室溫避光反應30min, 離心, 棄上清。加入100 μL UA緩沖液, 14000×g離心15min (重復2次)。加入100 μL 25 mmol/L NH4HCO3溶液, 14000×g離心15min (重復2次)。加入40 μL Trypsin溶液(40 μg Trypsin于40 μL 25 mmol/L NH4HCO3溶液), 振蕩1min, 37℃放置 16—18h。離心取上清, 測定OD280。
1.5 iTRAQ試劑標記
各樣品分別取100 μg肽段, 按照AB SCIEX公司iTRAQ標記試劑盒說明書進行標記。
1.6 強陽離子交換色譜分離
將每組標記后的肽段混合, 采用AKTA Purifier 100進行分級(A液: 10 mmol/L KH2PO4, 25% ACN,pH 3.0; B液: 10 mmol/L KH2PO4, 500 mmol/L KCl,25%ACN, pH 3.0)。進柱后以1 mL /min的速率進行梯度洗脫, 梯度洗脫如下: 0—22min, B液線性梯度從0—8%; 22—47min, B液線性梯度從8%—52%;47—50min, B液線性梯度從52%—100%; 50—58min, B液維持在100%; 58min以后, B液重置為0。洗脫過程中監測214 nm的吸光度值, 將每個組分脫鹽并凍干。
1.7 質譜分析
高效液相色譜采用納升流速的HPLC液相系統Easy nLC進行分離(A液: 0.1%甲酸水溶液;B液: 0.1%甲酸乙腈水溶液, 其中乙腈為84%)。色譜柱以95%的A液平衡, 樣品上樣到上樣柱(Thermo Scientific Acclaim PepMap100, 100 μm×2 cm, nano-Viper C18), 經過分析柱(Thermo scientific EASY column, 75 μm×10 cm, 3 μm, C18-A2)分離, 流速為300 nL/min。梯度洗脫如下: 0—50min, B液線性梯度從0—35%; 50—55min, B液線性梯度從35—100%; 55—60min, B液維持在100%。
質譜鑒定樣品經色譜分離后用Q-Exactive質譜儀進行質譜分析。分析時長為60min, 檢測方式為正離子, 母離子掃描范圍是300—1800 m/z。一級質譜分辨率: m/z為200時70000, AGC target為3e6, 一級最大(Maximum) IT為10ms, 掃描范圍數(number of scan ranges)為1, 動態排除(Dynamic exclusion)為40.0s。多肽和多肽碎片的質量電荷比按以下方法采集: 每次全掃描(full scan)后采集10個碎片圖譜, 二級質譜激活類型(MS2 Activation Type)為HCD, 隔離窗(Isolation window)為2 m/z。二級質譜分辨率: m/z為200時17500, 微碎片圖譜數(microscans)為1, 二級Maximum IT為60ms, 規一化碰撞能量(Normalized collision energy)為30eV, 填充率(Underfill ratio)為0.1%。
1.8 數據分析
用軟件Mascot 2.2和Proteome Discoverer 1.4進行查庫鑒定及定量分析。本實驗使用的數據庫為NCBI_Cyprinidae_420850_20161102.fasta (序列總數: 420850)。搜索參數設置如下: 胰蛋白酶消化;胰酶消化最多允許2個漏切點; 一級離子質量容差為0.002%; 二級離子質量容差為0.1 Da; 固定修飾分別為Carbamidomethyl (C)、iTRAQ8plex (K)和TRAQ8plex (N-term); 可變修飾為Oxidation (M)和iTRAQ8plex (Y)。依據蛋白質豐度水平, 當差異倍數≥1.2(上調)或≤0.83(下調), 且經統計檢驗其P<0.05 時, 視為差異表達蛋白質。
1.9 生物信息學分析
采用數據庫中的注釋信息, 分析篩選出來的差異表達蛋白, 通過GO (Gene Ontology)分析數據庫(http//www.geneontology.org/)進行GO分析, 從參與的生物過程(Biological process, BP)、分子功能(Molecular function, MF)及細胞組分(Cellular Component, CC)三個方面進行顯著性分析。通過KEGG(Kyoto Encyclopedia of Genes and Genomes)數據庫(http//www.kegg.jp/kegg/pathway.html)分析差異表達蛋白主要參與的生化代謝途徑和信號轉導途徑。
1.10 感染青魚的組織病理分析
取注射感染嗜水氣單胞菌BCK0712菌株24h后的青魚和對照組青魚, 解剖后取其肝臟組織, 用4% 多聚甲醛固定, 石蠟包埋后進行切片, 以蘇木精-伊紅染色法染色, 中性樹膠包埋, 顯微鏡觀察和拍照。
2 結果
2.1 感染青魚的發病癥狀
健康青魚在注射感染嗜水氣單胞菌24h后, 出現了體色發黑、鰓蓋充血、鰭基充血、內臟充血、肛門紅腫、腸腔內有氣體、腹腔內積有紅色腹水等癥狀(圖 1)。
2.2 差異表達蛋白統計
本實驗共鑒定到肽段14905個, 鑒定到蛋白數量為4475個。通過分析, 篩選到青魚肝臟組織的差異表達蛋白共計188 個, 其中表達上調的差異蛋白70 個(表 1按差異顯著性列出前21個), 表達下調的差異蛋白118個(表 2按差異顯著性列出前55個)。
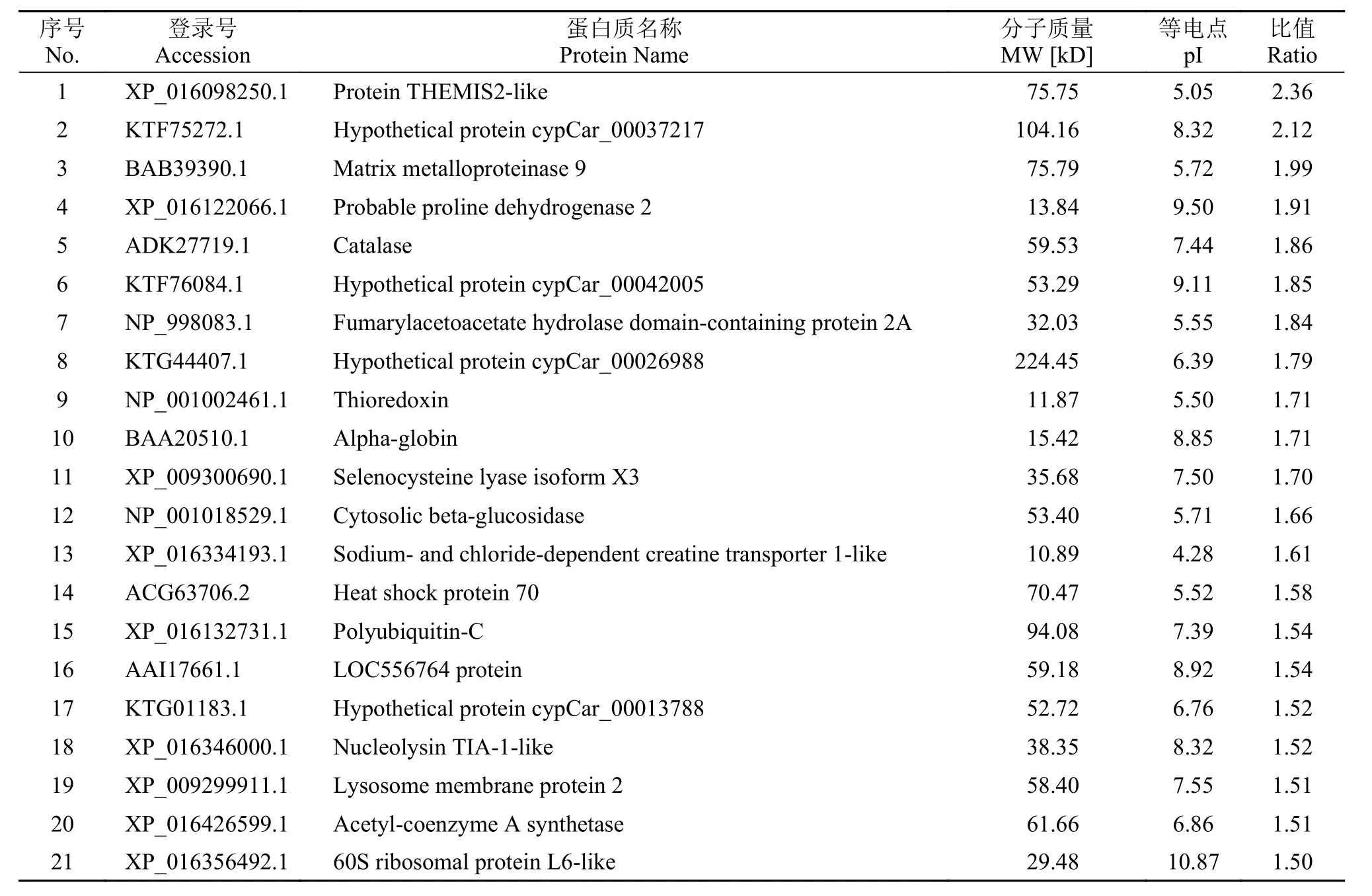
表 1 在嗜水氣單胞菌感染青魚后青魚肝臟組織表達上調的差異蛋白Tab. 1 Up-regulated proteins in liver of A. hydrophila infected black carp
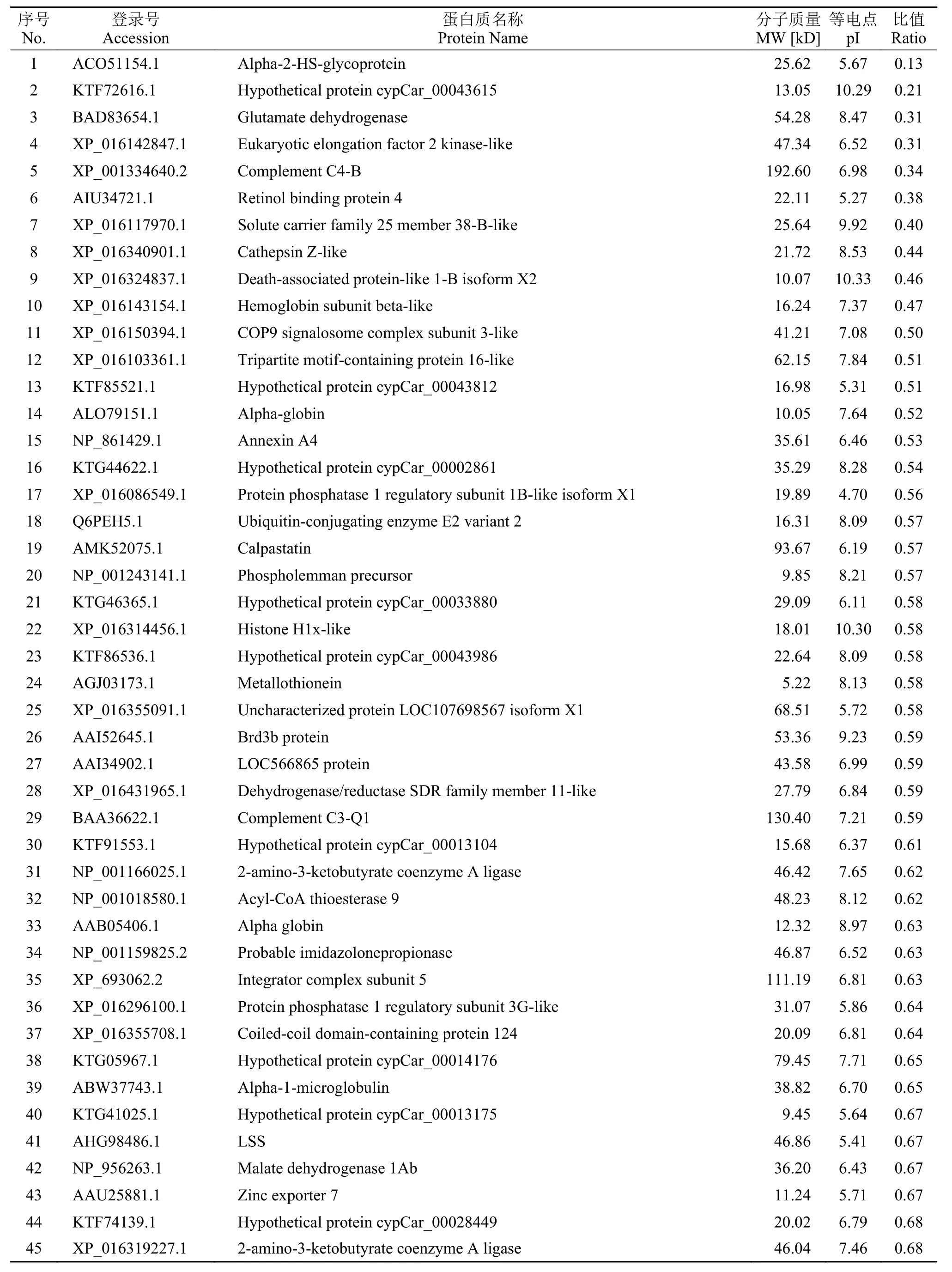
表 2 在嗜水氣單胞菌感染青魚后青魚肝臟組織表達下調的差異蛋白Tab. 2 Down-regulated proteins in liver of A. hydrophila infected black carp

續表 2
上調表達蛋白包括選擇性胸腺細胞相關蛋白2樣蛋白(Protein THEMIS2-like)、基質金屬蛋白酶-9(Matrix metalloproteinase 9)、脯氨酸脫氫酶2(Proline dehydrogenase 2)、過氧化氫酶(Catalase)、延胡索酰乙酰乙酸水解酶(Fumarylacetoacetate hydrolase domain-containing protein 2A)、硫氧還蛋白(Thioredoxin)、α-珠蛋白(Alpha-globin)、硒代半胱氨酸裂解酶X3亞型(Selenocysteine lyase isoform X3)、β-葡萄糖苷酶(Cytosolic beta-glucosidase)、Na+/Cl-依賴性肌酸轉運蛋白樣蛋白1(Sodium- and chloride-dependent creatine transporter 1-like)、熱休克蛋白70(Heat shock protein 70)、多聚泛素C (Polyubiquitin-C)、核溶素樣蛋白TIA-1(Nucleolysin TIA-1-like)、溶酶體相關膜蛋白2(Lysosome membrane protein 2)、乙酰輔酶A合成酶(Acetyl-coenzyme A synthetase)、似60S核糖體蛋白L6(60S ribosomal protein L6-like)等。
下調表達蛋白包括α2熱穩定性糖蛋白(Alpha-2-HS-glycoprotein)、谷氨酸脫氫酶(Glutamate dehydrogenase)、真核生物延長因子2激酶(Eukaryotic elongation factor 2 kinase-like)、補體C4-B (Complement C4-B)、視黃醇結合蛋白4(Retinol binding protein 4)、溶質載體家族25成員38樣蛋白(Solute carrier family 25 member 38-B-like)、組織蛋白酶Z(Cathepsin Z-like)、死亡相關蛋白樣蛋白1-B X2亞型(Death-associated protein-like 1-B isoform X2)、血紅蛋白β亞單位樣蛋白(Hemoglobin subunit betalike)等。
2.3 生物信息學分析
為深入分析嗜水氣單胞菌感染對青魚肝臟組織蛋白表達的影響, 對差異表達蛋白質進行GO功能分析, 差異蛋白參與的“生物過程”主要集中在單組織過程(Single-organism process)、細胞內過程(Cellular process)、代謝過程(Metabolic process)、生物學調控(Biological regulation)等; “分子功能”主要集中在結合活性(Binding)和催化活性(Catalytic activity)等; “細胞組分”主要集中在細胞(Cell)、細胞部分(CEll part)和細胞器(Organelle)等(圖 2)。
KEGG通路分析表明, 青魚肝臟組織的差異表達蛋白主要參與補體和凝血級聯反應(Complement and coagulation cascades)、剪接體(Spliceosome)、細胞內吞作用(Endocytosis)、氧化磷酸化(Oxidative phosphorylation)、碳代謝(Carbon metabolism)、精氨酸和脯氨酸代謝(Arginine and proline metabolism)、色氨酸代謝(Tryptophan metabolism)等通路(圖 3), 其中補體和凝血級聯反應通路富集最為顯著(圖 4)。
2.4 差異表達蛋白的qRT-PCR驗證
選取差異表達蛋白補體C3和熱休克蛋白70(HSP70), 用qRT-PCR檢測其在mRNA水平上的變化。結果顯示, 在嗜水氣單胞菌感染青魚后, 青魚肝臟組織中補體C3基因的mRNA表達水平下調,HSP70基因的mRNA表達水平上調(圖 5), 這與iTRAQ結果變化趨勢一致。
2.5 感染青魚的組織病理變化
感染嗜水氣單胞菌的青魚和健康青魚的肝臟組織切片于顯微鏡下觀察, 可見病魚肝臟組織發生了明顯的病理變化, 主要表現為肝細胞邊界不分明、細胞核固縮、肝板排列紊亂、有出血現象等(圖 6A); 而健康青魚肝臟切片顯示肝細胞多角形、排列緊密、細胞邊界明顯(圖 6B)。
3 討論
iTRAQ聯合液相色譜串聯質譜技術是近年發展起來的功能強大的比較蛋白質組學技術之一, 用于尋找差異表達蛋白, 為生理病理機制研究提供線索, 也可用于分子標志物的篩選研究[14]。本實驗應用iTRAQ蛋白質組學技術, 研究了青魚感染嗜水氣單胞菌前后肝臟組織蛋白質表達的變化, 結果共篩選到188個差異表達蛋白, 其中70個(占37%)差異蛋白表達上調, 118個(占63%)差異蛋白表達下調, 表達下調的蛋白占比較高. 分析與免疫相關的差異蛋白, 上調表達蛋白有選擇性胸腺細胞相關蛋白樣蛋白、基質金屬蛋白酶-9、熱休克蛋白70、過氧化氫酶、硫氧還蛋白等, 下調表達蛋白有補體C1、補體B/C2B、補體C3-Q1和補體C4-B等。

圖 2 青魚肝臟組織差異表達蛋白的GO功能分析Fig. 2 GO analysis of differently expressed proteins in liver of black carp
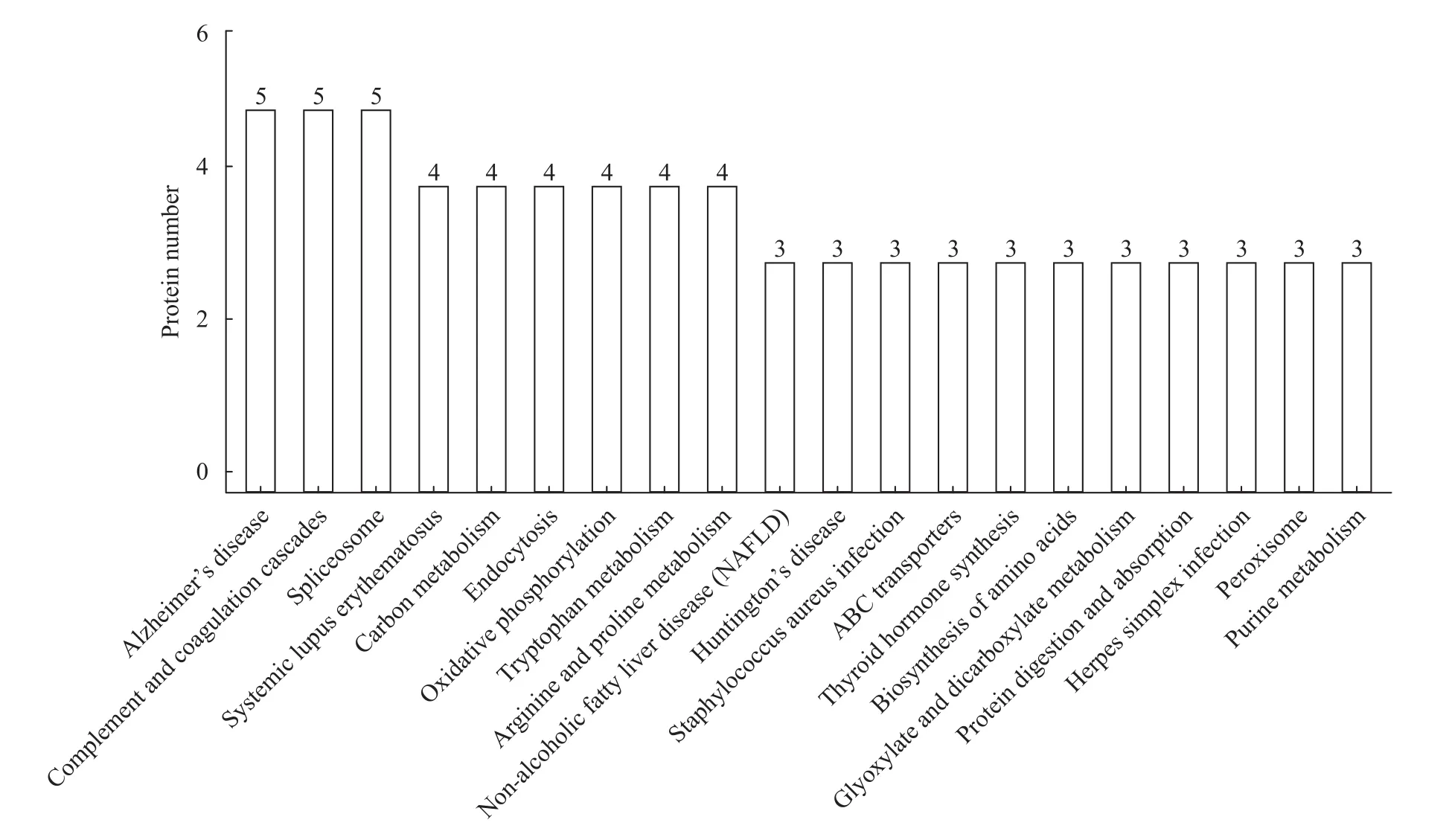
圖 3 青魚肝臟組織差異表達蛋白的KEGG通路分析(前20條)Fig. 3 KEGG pathway analysis of differently expressed proteins in liver of black carp (top 20)

圖 4 補體和凝血級聯反應通路(差異表達蛋白以粗體標注)Fig. 4 Schematic drawing of the pathway of coagulation and complement cascades (the bold fonts indicate differently expressed proteins)
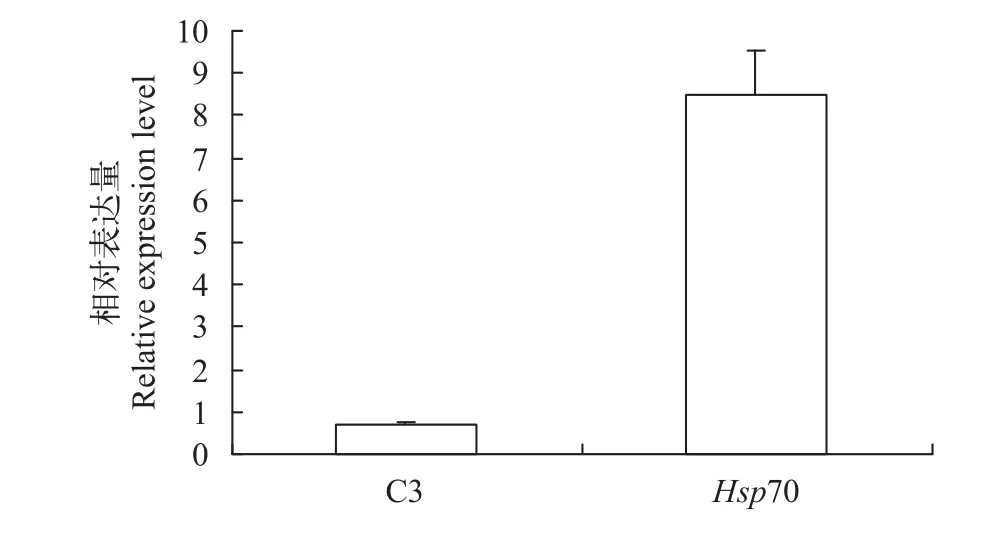
圖 5 嗜水氣單胞菌感染青魚后青魚肝臟補體C3和Hsp70 mRNA的相對表達量Fig. 5 Relative expression of C3 and Hsp70 genes in liver of A.hydrophila infected black carp
選擇性胸腺細胞相關蛋白(THEMIS2)調控著巨噬細胞Toll樣受體信號轉導和細胞因子的產生,在巨噬細胞炎癥反應中發揮著關鍵作用[15]。青魚在受到嗜水氣單胞菌感染后, 肝臟組織THEMIS2的上調表達, 提示THEMIS2可能參與了調控巨噬細胞炎癥反應, 從而增強機體免疫應答, 以應對病原體的感染。
基質金屬蛋白酶-9 (MMP-9)屬于基質金屬蛋白酶家族(MMPs), MMPs是一類蛋白水解酶, 可降解細胞外多種基質成分。近年來, 隨著基礎研究的不斷深入, MMPs在炎癥中的作用越來越受重視.MMPs能通過多種途徑調節炎癥性反應的進程, 通過改變化學因子的功能和重要的促炎癥性細胞因子的生物可利用性, 從而促進炎癥細胞募集[16]。研究表明, MMP-9主要由炎性細胞(如巨噬細胞)分泌[17], 且MMP-9的過表達與炎癥初期釋放的某些炎性介質呈正相關[18]。推測本實驗嗜水氣單胞菌感染導致魚體炎性介質的釋放增加, 肝臟MMP-9表達上調, 細胞外基質和基膜的降解進一步加重, 炎性細胞的浸潤加劇, 從而加重了炎性反應。
熱休克蛋白(HSPs)是一類存在于所有生物體比較保守的蛋白, 在遇到外界刺激時, 能誘導或增強表達, 以保護細胞免受損害[19]。HSP70是HSPs家族中表達最廣泛的蛋白, 具有促進蛋白質的合成、折疊、運輸, 清除變性蛋白, 抗細胞凋亡和介導細胞免疫功能以及信號傳導因子的作用[20]。HSP70在正常細胞中水平較低, 在應激狀態下可明顯升高。吉富羅非魚(Oreochromis niloticus)感染鏈球菌48h內,HSP70 mRNA在脾臟中表達升高, 感染24h后HSP70 mRNA表達量是正常脾臟組織的5.5倍多[21]。萬文菊等[22]用溶藻弧菌(Vibrio alginolyticus)感染劍尾魚(Xiphophorus helleri), 結果在感染瀕死魚脾臟內檢測到HSP70基因強烈表達。研究表明,HSP70還是重要的抗原提呈調節因子, 可促進T細胞介導的免疫反應, 產生細胞因子, 加強NK細胞的殺傷作用, 以及介導NF-κB/IκB/IKK信號通路。青魚在感染嗜水氣單胞菌后, 肝臟HSP70的表達出現上調, 提示青魚處于病原菌感染、肝組織損傷等病理應激狀態, 升高的HSP70可激活機體的免疫應答反應, 調控免疫細胞因子的活性。
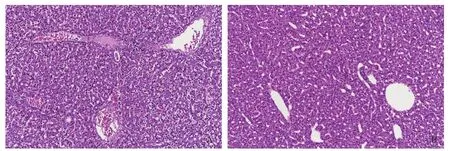
圖 6 感染嗜水氣單胞的青魚肝臟組織切片(200×)Fig. 6 Hispathological characteristic of liver of black carp infected with A. hydrophilia
過氧化氫酶(CAT)存在于所有已知動物的各組織中, 特別在肝臟中以高濃度存在。它能催化過氧化氫分解為分子氧和水, 清除體內的過氧化氫, 從而使細胞免于遭受過氧化氫的毒害, 是生物防御體系的關鍵酶之一。硫氧還蛋白(Trx)是一類氧化還原調節蛋白, 可通過對細胞內被氧化的二硫鍵的還原來修復機體的氧化損傷, 還可與其他氧化還原系統協調配合, 消除體內過多的活性氧[23]。趙靜等[24]分析了齊口裂腹魚(Schizothorax prenanti)感染嗜水氣單胞菌后血清CAT活力變化, 結果顯示在感染初期, CAT活力明顯增強, 48h時達到峰值。嚴林飛等[25]研究表明, 大黃魚(Larimichthys crocea)感染鰻弧菌(Vibrio anguillarum)后肝組織中CAT基因的表達隨著時間的推移而變化明顯, 感染后12h達到最高(7.48倍)。本實驗青魚肝臟CAT和Trx的表達上調,說明嗜水氣單胞菌感染可能引起機體產生大量活性氧自由基和過氧化氫, CAT和Trx的上調表達可清除體內過量的活性氧, 進而防止它們對機體細胞造成損傷。
補體系統是存在于血清、組織液和細胞膜表面的的一組不耐熱的經活化后具有酶活性的蛋白質, 參與了機體的特異性和非特異性免疫, 在抗微生物防御反應、免疫調節及介導免疫病理的損傷性反應中發揮重要作用。補體系統各成分通常以非活性狀態存在, 當其被激活物質活化之后, 才表現出生物學活性。目前已發現3條補體激活途徑:經典途徑、替代途徑和凝集素途徑。 3條途徑起點各異, 但存在相互交叉, 并且有共同的末端通路, 即膜攻擊復合物(MAC)的形成及其溶解細胞效應。由于魚類進化地位的特殊性, 關于其補體系統的研究越來越受到眾多學者的重視。研究表明硬骨魚類存在補體激活的3條途徑, 補體的溶菌活性是硬骨魚類清除細菌的一個重要機制。 Li等[26]的研究表明遲緩愛德華氏菌(Edwardsiella tarda)通過抑制補體替代途徑的活化逃避宿主的攻擊。人類某些疾病可引起總的補體含量或單一成分含量發生變化, 因此對補體水平的測定, 對疾病的診斷具有一定意義。青魚在感染嗜水氣單胞菌后, 肝臟中的補體C1、補體B/C2B、補體C3-Q1和補體C4-B均呈下調表達, 這些補體成分參與了補體活化的3條激活途經。在通路分析中, 與青魚補體和凝血級聯反應通路相關的差異蛋白個數最多, 其中包含補體B/C2B、補體C3-Q1和補體C4-B等。以上結果提示在青魚受細菌感染后, 肝臟中的補體系統的活化受到了抑制, 機體對病原菌的殺滅作用降低, 免疫功能下降。
此外, 方獻平等[27]研究發現三角魴和團頭魴對嗜水氣單胞菌的響應蛋白質多集中在糖類合成代謝、丙酮酸代謝、碳水化合物合成分解、轉錄翻譯和氧化還原等生物過程中, 并且這些應答蛋白質參與了結構分子活性、核糖體結構組成、維生素連接、輔酶連接、血紅素連接、氧氣轉運相關蛋白活性等分子功能. 本實驗篩選到的差異表達蛋白,除與免疫相關的蛋白外, 其他蛋白種類與三角魴和團頭魴的響應蛋白相似。
綜上所述, 本研究應用iTRAQ蛋白質組學技術,定量分析了青魚感染嗜水氣單胞菌前后肝臟蛋白質組的表達變化, 并對差異表達蛋白在參與的生物學過程、分子功能、細胞定位以及參與的通路等進行歸納整理, 研究結果為深入揭示嗜水氣單胞菌的分子致病機制奠定了理論基礎。

