諾麗莖段愈傷組織誘導優化及細胞懸浮系的建立
鄒瑞,藍增全,吳田,賈丹丹,楊自云
?
諾麗莖段愈傷組織誘導優化及細胞懸浮系的建立
鄒瑞1,藍增全2,吳田1,賈丹丹1,楊自云1
1 西南林業大學 園林學院 國家林業局西南風景園林工程技術研究中心,云南 昆明 650224 2 西南綠色發展研究院,云南 昆明 650224

鄒瑞, 藍增全, 吳田, 等. 諾麗莖段愈傷組織誘導優化及細胞懸浮系的建立.生物工程學報, 2019, 35(2): 298–306.Zou R, Lan ZQ, Wu T, et al. Optimization of noni callus induction and establishment of callus suspension system. Chin J Biotech, 2019, 35(2): 298–306.
為獲取諾麗莖段中的次生代謝物并為建立遺傳轉化體系奠定基礎,以諾麗莖段(無腋芽)為外植體誘導愈傷組織,并建立細胞懸浮系,對影響愈傷組織的誘導及細胞懸浮系的因子進行了研究。結果表明:愈傷組織誘導的最優培養基是MS+1.0 mg/L 6-BA+0.1 mg/L 2,4-D;懸浮培養的最佳培養基為MS+1.0 mg/L 6-BA+0.1 mg/L 2,4-D+3%蔗糖,pH為5.85,當初始接種量為37.5 g/L、搖床轉速為110 r/min且(25±2)℃ 暗培養時,懸浮細胞生長良好,生長速率最大;諾麗莖段懸浮細胞生長曲線呈“S”型,最適繼代周期為12–20 d;培養過程中,培養基的pH呈先下降后緩慢升高的變化趨勢,諾麗莖段愈傷組織懸浮細胞培養的最適pH在4.5–5.0之間。文中成功建立了以諾麗莖段為外植體的穩定的細胞懸浮系。
諾麗,莖段,愈傷組織,細胞懸浮系,生長曲線
諾麗 (Linn.) 又稱海巴戟、諾尼、蘿梨、印桑椹、四季果等[1],是一種常綠多年生闊葉小喬木、灌木,茜草科 (Rubiales)巴戟天屬 () 植物[2],它的樹皮可提取黃色染料,皮中含有袖木醒二酚 (Soranjidiol)、巴戟醌 (Morindone),印度尼西亞民間作藥用[3]。樹皮的提取物用于治療風濕、發熱、創傷、潰瘍、腫瘤[4]。然而諾麗在全球分布都十分稀少,國外主要分布在南太平洋諸島,在夏威夷、印度、印度尼西亞、馬來西亞及中南美洲等國家地區都有生長[5-6],在我國僅分布于少數幾個地方如海南省、西沙群島及臺灣地區,近年來在云南省進行引種栽培,并在云南熱帶地區引種成功[7]。諾麗陸續在植物組織培養方面取得一些研究進展,如黃騏以諾麗種子為試料進行誘導不定芽生根研究[8];吳田用諾麗莖尖及帶芽莖段作為外植體進行離體培養,成功建立了諾麗離體再生體系[9];潘曉晴以不含腋芽的諾麗莖段薄片為外植體進行離體培養研究[10]。
諾麗莖段中富含袖木醒二酚、巴戟醌等次生代謝物,這些次生代謝物有治療風濕、發熱、創傷、潰瘍、腫瘤等作用。提取植物有效成分,同時不對植株本身造成損害,可以在建立諾麗莖段細胞懸浮培養體系的基礎上進行誘導。另外,植物懸浮細胞是遺傳轉化理想的受體之一,建立穩定的細胞懸浮系對遺傳轉化起到巨大促進作用。植物細胞培養將常規植物育種技術與細胞培養技術相結合,可以獲得常規技術無法得到的種質材料,縮短育種周期,提高育種效率,同時植物細胞的全能性使得懸浮細胞培養再生植株具有母本優良性狀,采用細胞培養技術保存植物種質節省人力物力的同時避免不可預測因素對種質資源造成的損失。本研究擬在諾麗莖段愈傷組織誘導的基礎上,進行細胞懸浮系的建立,為后續次生代謝物的誘導和遺傳轉化體系的建立奠定基礎。
1 材料與方法
1.1 材料
實驗所用外植體為西南林業大學園林學院組培室的諾麗無菌組培苗,組培苗每90 d左右繼代一次,繼代培養基為MS+0.2 mg/L NAA。
1.2 方法
1.2.1 愈傷組織的誘導
無菌苗剪去葉片,去除莖段兩端腋芽,取莖段中間部分切成2 mm的薄片,平放于愈傷組織誘導培養基上 (表1),30 d后將誘導出的愈傷組織轉接至原培養基中繼續增殖培養。培養過程中每5 d觀察1次,30 d后統計培養物的形態、顏色、生長情況、愈傷組織誘導率。愈傷組織誘導率=(產生愈傷組織外植體數∕接種外植體數)×100%。數據用SPSS 19.0統計軟件進行計算和單因素方差分析及獨立樣本檢驗,顯著水平<0.05。
1.2.2 愈傷組織的增殖
挑取黃綠色、松散性好、活性高的愈傷組織接種于原培養基上繼代增殖培養。

表1 諾麗莖段愈傷組織誘導培養基中激素的種類與濃度配比
6-BA: 6-benzylaminopurine; 2,4-D: 2,4-dichlorophenoxyacetic acid;NAA:1-naphthalene acetic acid.
1.2.3 諾麗懸浮系的建立
選取黃綠色、分散性好且質地疏松的繼代愈傷組織,用鑷子輕輕夾碎后接種在液體培養基中,每250 mL的培養瓶中加入液體培養基50?100 mL,pH為5.85,搖床轉速為110 r/min,溫度 (25±2) ℃,暗培養。懸浮初期,除去大細胞團,保留分散程度良好的小細胞團和單細胞,每隔10 d繼代1次按1∶2的體積轉入新鮮培養液,連續繼代5?8次逐漸形成穩定的懸浮細胞系。
1) 不同起始接種量對諾麗懸浮細胞生長的影響。將不同重量 (12.5、25、37.5、62.5 g/L) 諾麗莖段誘導出的愈傷組織接種到液體培養基中,每種處理接種5瓶液體培養基,20 d后計算細胞生長速度,接種量和收獲量以濕細胞鮮重計,取2 mL培養液,4 ℃、5 000 r/min離心5 min,棄去上清液,稱量底部沉淀細胞鮮重,細胞生長速度以比生長速率計。
2) 細胞形態觀察。培養液搖勻,取一滴培養液于倒置光學顯微鏡下觀測細胞生長情況。
3) 培養液pH值的測定。采用pH儀測定懸浮培養液pH值,使用前經標準試劑液校準,每2 d測定一次培養液pH值,繪制pH曲線。
4) 細胞生長曲線的測定。用血球計數板法檢測細胞數。培養過程中,每2 d取懸浮培養細胞,先用5%鉻酸對細胞培養液進行處理,使其分散均勻,持續檢測,取平均值繪制細胞懸浮生長曲線。
1.2.4 TTC法測定細胞活力
1) TTC染色所需藥品配置
磷酸鹽緩沖液 (pH 7.0,0.1 mmol/L):稱取磷酸氫二鈉3.12 g溶于無菌蒸餾水,定容至100 mL;稱取磷酸二氫鈉7.17 g溶于無菌蒸餾水,定容至100 mL;取30.5 mL磷酸氫二鈉溶液與19.5 mL磷酸二氫鈉溶液充分混合。
0.4% TTC溶液:0.4 g紅四氮唑溶于少量乙醇,加入磷酸鹽緩沖液,定容至100 mL。
2) TTC染色
用TTC法測定細胞活力。每3 d取諾麗莖段懸浮細胞液,抽濾去除培養液并用蒸餾水沖洗以去除培養基。用濾紙吸取細胞上的水分,稱取200 mg (鮮重) 細胞置于10 mL離心管中,向離心管中加入2.5 mL 0.4% TTC溶液,并加入2.5 mL pH 7.0的磷酸緩沖液混勻,靜止25 ℃暗處理13–16 h,細胞會變成紅色,棄上清,加入蒸餾水洗滌3?5次,加入5 mL 95%的乙醇,置60 ℃水浴30 min,其間輕搖試管1?2次,靜止于室溫下至細胞完全無色,取上清在分光光度計上于485 nm處測吸光值 (Abs),初始培養基按以上程序操作為空白對照。
1.2.5 細胞存活率的測定
懸浮細胞培養結束后,取少量懸浮細胞,先用5%鉻酸對細胞懸液進行處理,使其分散均勻,再用0.1%的酚藏花紅染色液染色,活細胞無色或僅有液泡呈淡淡的紅色,死細胞核和細胞碎片被染成紅色。顯微鏡下計數500個懸浮細胞,計算活細胞所占的比例。懸浮細胞存活率(%)=(活細胞總數/懸浮細胞總數)×100%。
1.2.6 平板培養及懸浮細胞植株再生
將滅菌后的培養基倒入培養皿1/2處,待培養基凝固后,將穩定的懸浮培養液接種于培養基上,再將40 ℃的培養基覆蓋一層在接種的細胞上。將諾麗莖段細胞懸浮培養液接種于MS+2.0 mg/L 2,4-D+0.1 mg/L 6-BA培養基上誘導分化愈傷組織,再將分化出的愈傷組織轉接至MS+1.0 mg/L 6-BA+0.05 mg/L NAA培養基誘導分化不定根不定芽。
2 結果與分析
2.1 不同激素組合對莖愈傷組織誘導影響及增殖
采用6種培養基對諾麗莖段愈傷組織進行誘導 (表2),在6-BA和NAA配合使用的培養基上,可誘導出綠色愈傷組織 (圖1A),質地堅硬緊實,誘導的同時伴隨植株分化;在6-BA和2,4-D配合使用的培養基上,可誘導出疏松愈傷組織 (圖1B、C、E),當6-BA濃度一定時,愈傷組織長勢隨2,4-D的增加而逐漸變差。綜合誘導率、愈傷組織長勢和分化能力的因素,諾麗莖段誘導愈傷組織最佳培養基為MS+2.0 mg/L 2,4-D+0.1 mg/L 6-BA,將愈傷組織代入原培養基可繼代增殖 (圖2)。

表2 不同培養基配方對諾麗莖段愈傷組織誘導的影響
+ Callus growth is poor; ++ Callus growth is general; +++ Callus growth is well; ++++ Callus growth is best. There were significant differences between different lower-case letters in the same column (<0.05), but no significant differences between the same letters (>0.05).

圖1 諾麗莖段愈傷組織誘導

圖2 諾麗莖段愈傷組織繼代
2.2 諾麗莖段懸浮細胞培養的研究
2.2.1 不同初始接種量對諾麗根、莖、葉懸浮細胞生長影響
諾麗莖段懸浮細胞接種量低于25 g/L時,懸浮細胞生長速度較低,接種量37.5 g/L時懸浮細胞生長速度高 (圖3),當懸浮細胞接種量高達62.5 g/L,細胞生長速率較低。因此諾麗莖段懸浮細胞在液體培養基中接種量以37.5 g/L為宜。
2.2.2 莖段懸浮細胞形態觀察
諾麗莖段為外植體的懸浮細胞,初代多為規則型桿狀細胞 (圖4),隨著繼代次數的增加,在第6代后為20個左右小細胞團居多,形態穩定。
2.2.3 懸浮細胞培養液pH的變化曲線
諾麗莖段懸浮細胞培養過程中pH變化近似“V”形曲線 (圖5)。整個實驗過程中培養液的pH值在小范圍內呈先下降后緩慢升高的變化趨勢。在接種后1?12 d的范圍內pH不斷下降,從5.85降到最低點4,此時細胞增殖緩慢;隨后進入對數生長期,pH值逐漸回升;pH在4.5?5.0范圍內細胞增殖最快,而后培養液的pH仍在緩慢增加。有可能是諾麗莖段懸浮細胞產生的大量代謝物使培養液的pH值升高。
2.2.4 諾麗莖段細胞懸浮生長曲線
諾麗莖段細胞懸浮系,在0?6 d細胞數目增長不明顯 (圖6),生長緩慢,此時為停滯期;在6?12 d進入對數生長期,懸浮細胞狀態良好,具有較高的活力,細胞數目急劇增加;在6?20 d進入直線生長期,細胞數量達到峰值22.6×104個/mL,后增長減緩,直至下降。
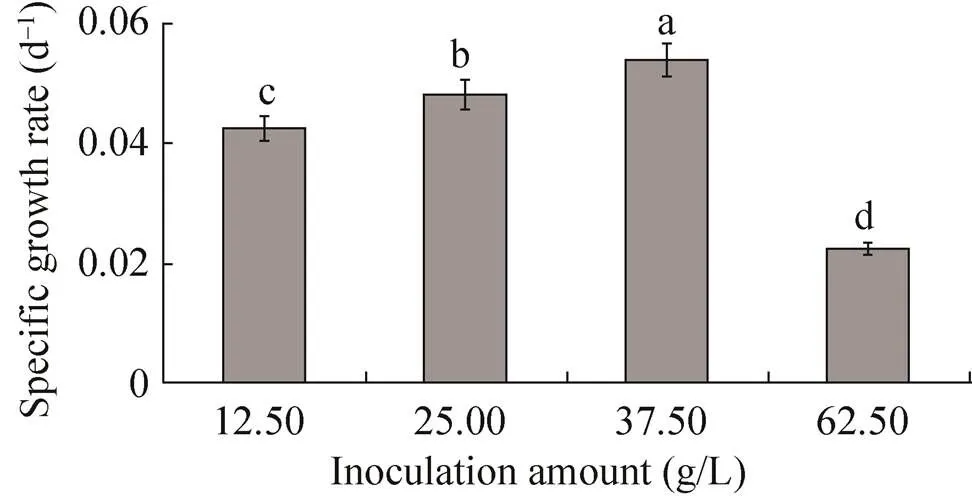
圖3 諾麗莖段不同初始接種量對細胞懸浮培養影響
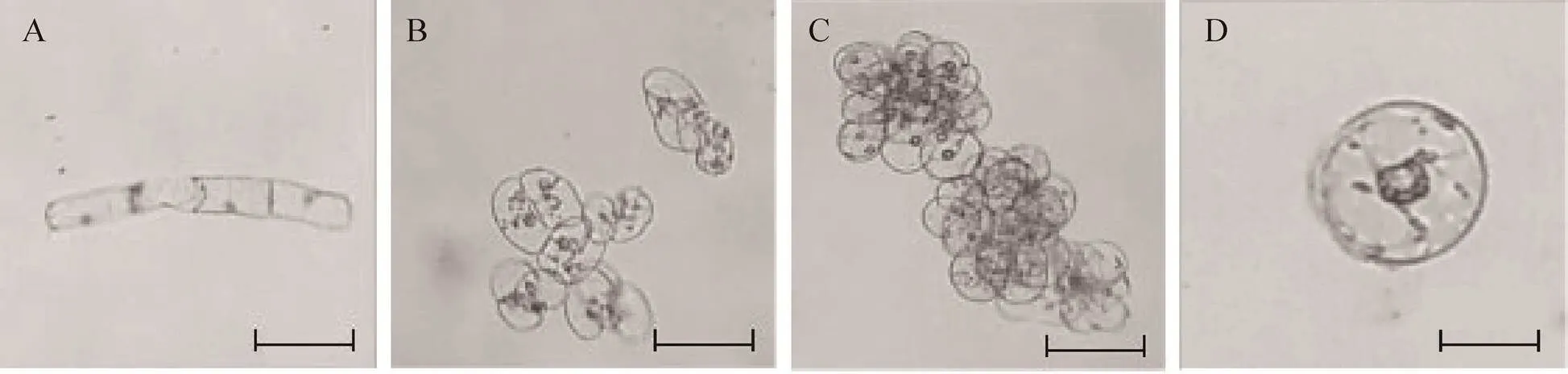
圖4 諾麗莖段懸浮細胞不同培養時期倒置顯微鏡觀察圖(×100)
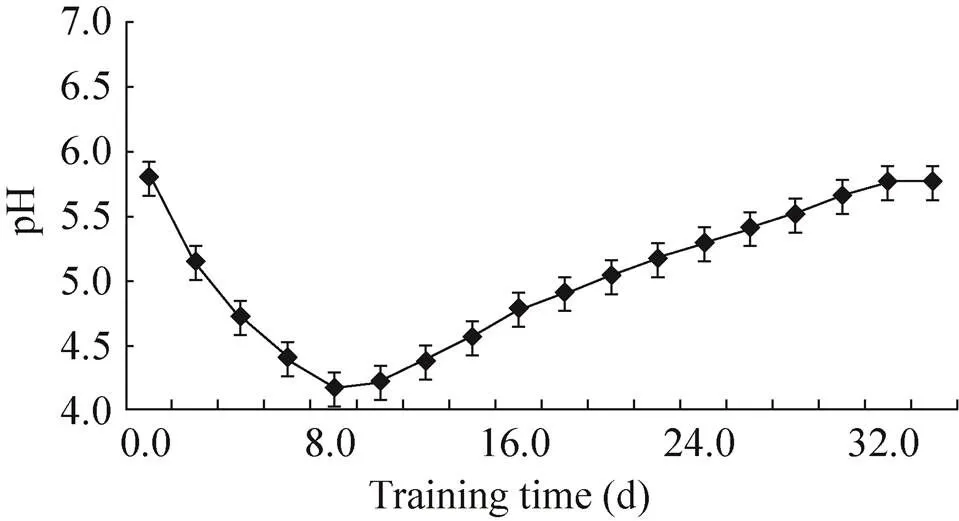
圖5 諾麗莖段懸浮細胞培養液pH值變化

圖6 諾麗莖段細胞懸浮生長曲線
2.2.5 細胞活力測定
對諾麗懸浮細胞活力曲線進行測定,細胞新陳代謝越旺盛其485值越高 (圖7A),且細胞呈深紅色 (圖7B)。以莖段為外植體的懸浮細胞,值隨培養時間的增加而增加,在第18天達到最大1.9,隨后緩慢下降。
綜上,細胞懸浮生長曲線、懸浮液pH值、細胞活力曲線之間存在一定對應關系。諾麗莖段細胞懸浮培養液細胞生長曲線在18 d達到峰值,數量為18.97×104個/mL,而此時懸浮液的pH值下降后回升至pH值5.52,用細胞存活力在第18天細胞活力值最大485=1.9,對應了細胞生長曲線與pH,此時期細胞懸浮液生長狀態較好。
2.2.6 細胞存活力測定
細胞懸浮培養在繼代5?8次以后,形成穩定的懸浮培養液,將培養結束的穩定懸浮培養液進行細胞存活力測定,染色后活細胞無色 (圖8),死細胞呈紅色,以莖段為外植體的細胞懸浮培養細胞存活力達到78.8%。說明培養懸浮細胞的培養基和繼代周期可行。
2.2.7 懸浮細胞平板培養
將諾麗莖段細胞懸浮培養液,接種于MS+ 2.0 mg/L 2,4-D+0.1 mg/L 6-BA培養基上,25 d誘導分化出嫩黃色泥狀愈傷組織 (圖9)。
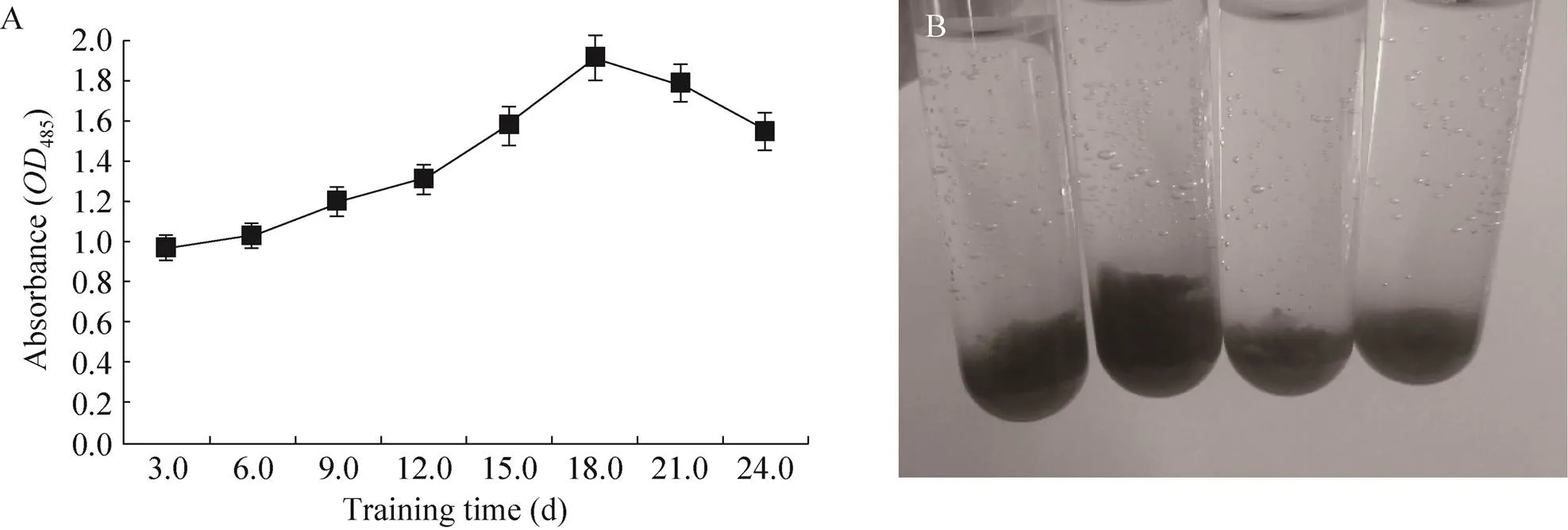
圖7 諾麗莖段懸浮細胞活力測定

圖8 諾麗懸浮細胞染色后活細胞和死細胞
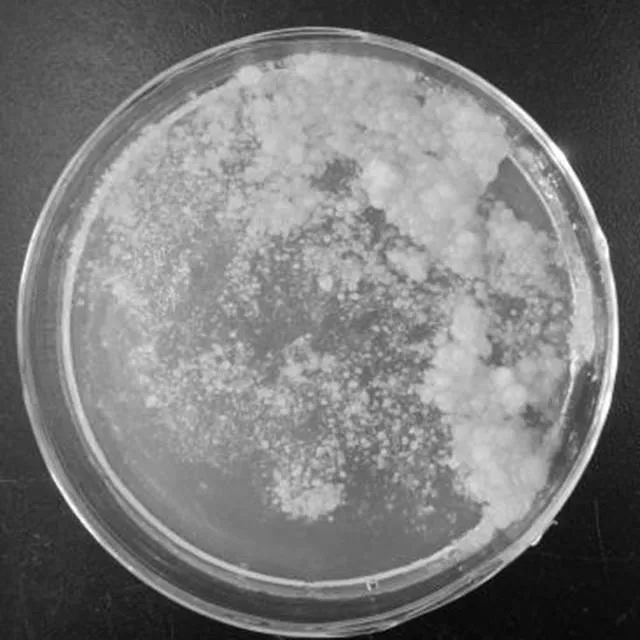
圖9 諾麗莖段細胞懸浮液的平板培養
3 結論與討論
不同植物激素及濃度對愈傷組織的誘導的影響差別較大,其中2,4-D和6-BA對愈傷組織的誘導必不可少,這與張志強等[11]誘導諾麗愈傷組織最適激素組合一致,但培養基的種類不同,他們采用的是B5培養基而在本實驗中采用的是MS培養基,這與實驗目的不同有關,用B5培養基更利于次生代謝產物的積累[12],而我們更關注穩定的細胞懸浮系的產生,以利于后續用細胞懸浮系進行遺傳轉化。此外,張志強等用的外植體是田間諾麗苗頂芽的葉脈,不僅需要消毒步驟,而且可取材范圍較窄,而本課題組有大批量可用的諾麗無菌試管苗,幾乎所有的莖段都可以作為本實驗外植體,取材范圍廣。當6-BA的濃度為1 mg/L時,隨著2,4-D濃度的增大,會對愈傷組織誘導及生長產生抑制作用,愈傷組織生長緩慢且易老化,與呂冬霞等[13]的研究結果一致。同時,當2,4-D濃度為0.1 mg/L時,隨著6-BA濃度的增大,愈傷組織的生長速度不會減慢,愈傷組織的老化程度加快。因此,0.1 mg/L 2,4-D+1.0 mg/L 6-BA為誘導諾麗莖段愈傷組織的最佳濃度組合。
采用適宜的接種量對建立穩定的懸浮培養體系起關鍵性作用[14-18]。懸浮培養體系的增殖速率與初始接種量密切相關,接種量過低或過高均不利于懸浮細胞的生長和增殖。初始接種量過低,限制了增長量;反之,過高,則可能由于細胞團過多而造成培養基養分不足或過多有害分泌物積累而限制了細胞的快速分裂與生長[19-20]。本試驗研究發現,諾麗莖段懸浮細胞培養的最適宜接種量為37.5 g/L,當接種量達到62.5 g/L時,細胞生長量顯著降低。
本研究對諾麗莖段進行細胞懸浮培養研究,獲得了諾麗莖段穩定的細胞懸浮培養液,后續可對諾麗細胞懸浮系進行次生代謝物的誘導,同時與諾麗植株本身的功能性物質相對比,以及建立諾麗細胞懸浮培養動力學模型。穩定的諾麗細胞懸浮培養液可再生愈傷組織及外植體,從單細胞直接進行轉化,這將成為諾麗遺傳轉化的優良受體材料,為諾麗遺傳轉化高頻轉化體系奠定了基礎。后續實驗擬采用真菌[21-22]、寡糖類物質[23]及重金屬離子[24]等誘導因子在諾麗莖段愈傷組織建立的細胞懸浮系中,以誘導袖木醒二酚、巴戟醌等物質。最新研究發現,采用復合誘導子誘導處理其他植物細胞時可以合成更高含量的生物活性物質,這可能得益于復合誘導子具有協同增效的作用,起到增強誘導能力的效果[25-26]。此外,后續擬將穩定生長的諾麗細胞懸浮系,經短暫離心后直接用于遺傳轉化,后接種于篩選培養基上。具體的方法、結論有待進一步研究。
[1] Yang Y, Yang PL, Xu R, et al. The analysis and evaluation of appearance character and nutritive content in differentL. germplasms. China J Trop Crops, 2017, 38(1): 53–58 (in Chinese).楊焱, 楊樸麗, 徐榮, 等. 不同諾麗種質外觀性狀與營養成分的分析及評價. 熱帶作物學報, 2017, 38(1): 53–58.
[2] Yang XB. Hainan Plants Directory. Beijing: Science Press, 2013: 340–341 (in Chinese).楊小波.海南植物名錄. 北京: 科學出版社, 2013: 340–341.
[3] Chen XQ, Cui HB, Dai LK, et al. Flora of China:19. Beijing: Science Press, 2011: 180–187 (in Chinese).陳心啟, 崔鴻賓, 戴倫凱, 等. 中國植物志: 19卷. 北京: 科學出版社, 2011: 180–187.
[4] Jiang JW. Dictionary of Medicinal Plants. Tianjin: Science and Technology Press, 2005: 875–972 (in Chinese).江紀武. 藥用植物辭典. 天津: 科學技術出版社, 2005: 875–972.
[5] Dixon AR, Mcmillen H, Etkin NL. Ferment this: the transformation of noni, a traditional polynesian medicine (, Rubiaceae). Econom Bot, 1999, 53(1): 51–68.
[6] Hirazumi A, Furusawa E. An immunomodulatory polysaccharide-rich substance from the fruit juice of(noni) with antitumour activity. Phytother Res, 1999, 13(5): 380–387.
[7] Wu T, Lan ZQ. Genetic relationship ofgermplasms by ISSR. J Tropl Subtrop Bot, 2014, 22(6): 617–623 (in Chinese).吳田, 藍增全. 基于ISSR技術研究諾麗種質資源的親緣關系. 熱帶亞熱帶植物學報, 2014, 22(6): 617–623.
[8] Huang Q, He WJ, Ye BY, et al. Studies on the micropropagation of noni (L.). J Fujian Norm Univ: Nat Sci Ed, 2007, 23(1): 87–90 (in Chinese).黃騏, 何文錦, 葉冰瑩, 等. 諾麗(L.)離體快速繁殖研究. 福建師范大學學報: 自然科學版, 2007, 23(1): 87–90.
[9] Wu T, Lan ZQ. Study on cultureof noni (Linn.). J Shandong Agric Univ: Nat Sci, 2011, 42(2): 179–182 (in Chinese). 吳田, 藍增全. 諾麗離體培養研究. 山東農業大學學報: 自然科學版, 2011, 42(2): 179–182.
[10] Pan XQ, Wu T, Lan ZQ, et al. Regeneration of stem segments of noni (Linn.). J Northeast For Univ, 2014, 42(8): 20–24 (in Chinese).潘曉晴, 吳田, 藍增全, 等. 諾麗莖段的離體再生. 東北林業大學學報, 2014, 42(8): 20–24.
[11] Zhang ZQ, Li YC. Study on callus induction and cell suspension culture of.Guangdong Agric Sci, 2014, 41(4): 108–112 (in Chinese).張志強, 李永成. 海巴戟天愈傷組織誘導及細胞懸浮培養試驗. 廣東農業科學, 2014, 41(4): 108–112.
[12] Wang GL, Shi RF, Fang HJ. Effects of medium and culture conditions on polysaccharide synthesis by suspension cell culture ofEills. Chin J Biotech, 2001, 17(6): 688–692 (in Chinese).王關林, 石若夫, 方宏筠. 培養基和培養條件對梔子懸浮細胞合成多糖的影響. 生物工程學報, 2001, 17(6): 688–692.
[13] Lv DX, Qu CF. The effects that the regulating agenr for she plants growth takes to callus culfuring. Northern Horticult, 2004(5): 68–69 (in Chinese).呂冬霞, 曲長福. 植物生長調節劑對愈傷組織培養的影響. 北方園藝, 2004(5): 68–69.
[14] Zhao JP, Yang SS. Establishment of cell suspension culture system for.J Northwest A&F Univ: Nat Sci Ed, 2014, 42(1): 189–195 (in Chinese).趙繼鵬, 楊淑慎. 曼地亞紅豆杉細胞懸浮培養體系的建立. 西北農林科技大學學報: 自然科學版, 2014, 42(1): 189–195.
[15] Gao Y, Sun MD, Xu QZ, et al. Establishment of callus induction and cell suspension culture system ofJiangsu Agricl Sci, 2017, 45(14): 27–31 (in Chinese).高媛, 孫牧笛, 徐全智, 等. 苦豆子愈傷組織誘導及細胞懸浮培養體系的建立. 江蘇農業科學, 2017, 45(14): 27–31.
[16] Yang JL, Gui YL, Guo ZC. Studies on kinetics of somatic embryo suspension culture inRehd.et Wils. Chin J Biotech, 2000, 16(2): 218–220 (in Chinese).楊金玲, 桂耀林, 郭仲琛. 白杄體細胞胚懸浮培養的動力學研究. 生物工程學報, 2000, 16(2): 218–220.
[17] Yang YG, Gui YL, Tang W, et al. Observation on differentiation potential and chromosome stability of callus in subcultures of. Acta Botan Sin, 1994, 36(12): 934–939 (in Chinese).楊映根, 桂耀林, 唐巍, 等. 青杄愈傷組織在繼代培養中的分化能力及染色體穩定性研究. 植物學報, 1994, 36(12): 934–939.
[18] Salaj T, Blehová A, Salaj J. Embryogenic suspension cultures ofArn: Growth parameters and maturation ability. Acta Physiol Plant, 2007, 29(3): 225–231.
[19] Yu B, Liu JM, Liu XR, et al. An efficient system of embryogenic cell suspension cultures and plant regeneration in. Acta Horticultu Sin, 2015, 42(4): 721–738 (in Chinese).于波, 劉金梅, 劉曉榮, 等. 白鶴芋胚性細胞懸浮培養和高效植株再生體系的建立. 園藝學報, 2015, 42(4): 721–738.
[20] Mukherjee S, Ghosh B, Jha S. Establishment of forskolin yielding transfomed cell suspension cultures ofas controlledby different factors. J Biotechnol, 2000, 76(1): 73–81.
[21] Chen YQ, Zhu WH, Wu YQ, et al. Effects of fungal elicitor on taxol prodction in suspension cells of. Chin J Biotech, 1999, 15(4): 522–524 (in Chinese).陳永勤, 朱蔚華, 吳蘊祺, 等. 幾種真菌誘導子對云南紅豆杉細胞產生紫杉醇的影響. 生物工程學報, 1999, 15(4): 522–524.
[22] Zhang CP, Li C, Yuan YJ. Effects of fungal elicitor on secondary metabolism of cell suspension culture ofvar.. J Chem Ind Eng (China), 2002, 53(5): 498–502 (in Chinese).張長平, 李春, 元英進. 真菌誘導子對懸浮培養南方紅豆杉細胞次生代謝的影響. 化工學報, 2002, 53(5): 498–502.
[23] Sun Z, Yuan LH, Wu PM. Effects of elicitors on saffron pigment production in cell suspension cultures ofL.. Chin J Bioprs Eng, 2013, 11(3): 18–23 (in Chinese).孫鎮, 袁麗紅, 吳頻梅. 誘導子對藏紅花懸浮培養細胞生產藏紅花色素的影響. 生物加工過程, 2013, 11(3): 18–23.
[24] Dong YL, Pan XW. Effects of copper ion induction elicitation on camptothecin biosynthesis in cell suspension culture of campototheca acuminata decaisne. J Anhui Agric Sci, 2010, 38(23): 12457–12459 (in Chinese).董妍玲, 潘學武. Cu2+誘導刺激對喜樹懸浮培養細胞喜樹堿生物合成的影響. 安徽農業科學, 2010, 38(23): 12457–12459.
[25] Almagro L, García-Pérez P, Belchí-Navarro S, et al. New strategies for the use ofcell factories for the production of bioactive compounds. Plant Physiol Biochem, 2015, 99: 73–78.
[26] Zhao J, Zhu W H, Hu Q. Enhanced catharanthine production incell cultures by combined elicitor treatment in shake flasks and bioreactors. Enzyme Microb Technol, 2001, 28(7/8): 673–681.
Optimization of noni callus induction and establishment of callus suspension system
Rui Zou1, Zengquan Lan2, Tian Wu1, Dandan Jia1, and Ziyun Yang1
1 Southwest Landscape Architecture Engineering Research Center of State Forestry Administration, College of Horticulture and Gardening, Southwest Forestry University, Kunming 650224, Yunnan, China 2 Southwest Institute of Green Development, Kunming 650224, Yunnan, China
The aim of the study was to obtain the secondary metabolites in the stem segment of noni and to establish genetic transformation system. The stem segments (no axillary buds) of noni were used as explants to induce the callus, and then to establish the cell suspension system. The factors affecting callus induction and cell suspension were studied. The results showed that the optimal culture medium for induction was MS with 1.0 mg/L 6-Benzylaminopurine (6-BA) and 0.1 mg/L 2,4-dichlorophenoxyacetic acid (2,4-D), and the optimum culture medium for suspension was MS with 1.0 mg/L 6-BA and 0.1 mg/L 2,4-D, 3% sucrose and the pH of 5.85, with the initial inoculation amount of 37.5 g/L, and the speed of 110 r/min and 25±2 °C applying darkness culture. The suspension cells grew well and showed the maximum growth rate. The growth curve of the suspension cells from the stem segment of noni was in “S-typed” trend, and it should be transformed to the fresh medium between 12 and 20 d. During the culture, the pH of the culture medium decreased and then slowly increased, and the optimum pH for the suspension cells culture of callus from noni’s stem segments was 4.5–5.0. In this study, the stable cell suspension system of the stem segment of noni was successfully established.
Linn., stem, callus, suspension culture, growth curve
April 15, 2018;
June 26, 2018
Yunnan Applied Basic Research Project (No. 2016FB049), Science and Technology Innovation Fund Project of Southwest Forestry University in 2017–2018 (No. C17071), State Forestry Bureau Promotion Project (No. [2015]27), National Spark Program (No. 2014GA830017).
Tian Wu. Tel: +86-871-63862056; E-mail: 2351417655@qq.com
10.13345/j.cjb.180141
云南省應用基礎研究計劃項目 (No. 2016FB049),2017–2018年度西南林業大學科技創新基金項目 (No. C17071),國家林業局推廣項目 (No. [2015]27號),國家星火計劃 (No. 2014GA830017) 資助。
(本文責編 陳宏宇)

